2. 重庆市农业资源与环境研究重点实验室, 重庆 400716
2. Chongqing Key Laboratory of Agricultural Resources and Environment Research, Chongqing 400716
汞(Hg)是一种全球性的污染物, 其在环境中具有长距离的迁移性和持久性(Clarkson et al., 2006).自然环境中, 无机汞(IHg)在微生物作用下, 能转化为具有高神经毒性的甲基汞(MeHg), 并可沿食物链进行生物富集与放大(Meng et al., 2014).土壤环境中, 微生物群落的多样性、温度、pH、有机质、氧化还原电位等是影响Hg甲基化的关键因素(Li et al., 2013).而植物根际土壤, 由于受根系分泌物、根际微生物及植物自身生长活动的影响, 具有与非根际土不一样的物理、化学和生物性质(徐卫红等, 2006).根际土壤中根系分泌物和根际微生物的活动, 能够显著影响重金属的迁移转化、形态特征及生物有效性(Aiken et al., 2011; 陈有鑑等, 2003).相关研究指出, 在湿地生态系统中, 根际土壤中的根系分泌物能增强土壤Hg的迁移能力和生物有效性, 特别是一些低分子量有机酸(如柠檬酸、草酸、酒石酸)能够促进土壤中Hg的甲基化(游蕊等, 2016).然而, 也有研究指出土壤中的一些微生物同时也具有去甲基化的作用(谷春豪等, 2013).事实上, 土壤中MeHg的产生量是由IHg的甲基化过程和MeHg的去甲基化过程共同决定的(Hintelmann et al., 2000), 因而分别探究Hg的甲基化与MeHg的去甲基化过程, 能较为全面地了解根际土壤中MeHg的赋存量与环境因子的关系.
消落带是一个经历周期性淹水的特殊区域, 而研究表明季节性淹水的土壤比永久性受淹土壤更有利于MeHg的产生(Eckley et al., 2017), 因此, 消落带能够加速Hg的地球化学循环(孙涛等, 2018).由于雨热同季, 三峡库区消落带在每年4—9月出露期都会生长出大片茂密的植被, 狗牙根由于具有较强的生长力而成为了三峡库区消落带的优势植物(杨文航等, 2018).消落带生长的大量植物对三峡库区Hg的甲基化具有潜在的生态风险.
然而, 目前对Hg在植物根际环境中的甲基化与MeHg的去甲基化作用机制还有待进一步研究.鉴于此, 本研究的科学假设是:植物的生长, 特别是根系分泌物和根际微生物等因素的作用, 会显著影响消落带根际土壤中Hg的甲基化与MeHg的去甲基化过程.为此, 本研究通过分析根际土与非根际土主要物理化学性质的差异性及其与MeHg含量的相关性, 并利用双同位素示踪法(199Hg2+和Me201Hg), 通过室内模拟培养实验, 分别测定不同培养条件下(有菌、无菌)根际土IHg的甲基化速率与MeHg的去甲基化速率, 探索根际土壤中Hg的甲基化与MeHg去甲基化作用及其影响因素.
2 材料与方法(Materials and methods) 2.1 样品采集与处理实验选取地处长江干流边的三峡库区腹心地带——重庆忠县石宝寨(30°25′75″N, 108°10′55″E)消落带植被覆盖区为研究地点, 选择生长有狗牙根的地块6处, 于2018年8月采集狗牙根根际土, 同时选取消落带裸露区地块6处, 采集非根际土作为对照土.其中, 根际土采用抖根法采集(轻轻抖动1 min, 取附着在植物根系表面的土壤为根际土)(Courchesne et al., 1997), 在选取的每块样地中, 分别设置3个样方(2 m×2 m), 每个样方采集10株狗牙根根际土, 等量混合为一个样品装入无菌袋中, 并注明采集地点、日期、土样号, 放入液氮冷冻保藏, 随后带回实验室储存于-80 ℃超低温冰箱(中科美菱DW-HW328, 安徽)避光保存待用.将各类土壤样品分为两部分, 一部分用于理化性质分析及MeHg、THg含量的测定, 另一部分用于培养实验.
2.2 实验方法与设计分别称取5 g根际土和非根际土于60 mL硼硅玻璃培养瓶中, 一部分采用高压蒸汽灭菌锅对土壤进行灭菌处理, 一部分不灭菌.再分别加入1 mL预前配制好的稳定汞同位素199HgCl2(10.36 pg·μL-1)和Me201HgCl(0.73 pg·μL-1), 其含量分别为土壤本底THg和MeHg含量的10%和100%(Hintelmann et al., 1995), 使其均匀浸透土壤, 并用聚四氟乙烯瓶塞密封培养.于培养0 h和48 h时分别取样, 其中, 初始培养时间(0 h)控制为加入199HgCl2和Me201HgCl后立即将样品置于-80 ℃冰箱中避光保存, 其余样品放入恒温培养箱中(25 ℃), 在黑暗条件下培养48 h, 之后同样立即将样品置于-80 ℃冰箱避光保存, 终止其反应.每个处理设置3个平行.
2.3 样品分析与质量控制 2.3.1 理化性质分析土壤pH在水土质量比为2.5:1的条件下用pH计(Sartorius PT-10, German)测定;Fe2+、Fe3+、Mn2+测定采用邻菲罗啉比色法(鲁如坤, 2000), 用可见光分光光度计测定;土壤SO42-含量采用去离子水浸提, 离子色谱仪(IC6000, 安徽皖仪)分析(贾亮亮等, 2016);有机质含量采用重铬酸钾氧化滴定法测定(Walkley et al., 1934);过氧化氢酶活性采用紫外分光光度法(UV-9100, 北京瑞利分析仪器公司)测定(杨兰芳等, 2011);可培养细菌、真菌数采用稀释涂布平板法进行测定, 并采用自动菌落计数仪(G6, 杭州迅数科技有限公司)计数.样品测定采用方法空白、加标回收、平行样和标准物质进行质量控制.方法空白均低于检出限, 平行样分析的相对标准偏差为2.1%~15%, 加标回收率为93%~108%.
2.3.2 Hg含量分析将用于MeHg含量测定的土壤样品取出后用冻干机(LGJ-10C)避光冻干, 再用玛瑙研钵磨细过100目筛待用.土壤MeHg含量的测定参照美国EPA 1630标准方法, 采用硝酸和硫酸铜溶液浸提, 二氯甲烷萃取并结合水相乙基化等温气相色谱-冷原子荧光法(GC-CVAFS)测定(Feng et al., 2011).土壤THg含量用DMA-80固体进样自动测汞仪(意大利Milestone公司)直接测定, 最低检测限0.5 ng.
培养实验中土壤MeHg同位素含量利用气相色谱-电感耦合等离子体质谱仪连用技术测定(GC-ICP-MS, 7900, 安捷伦), 其前处理与土壤MeHg含量测定方法一致, 不同的是将CVAFS替换为ICP-MS进行测定(Liang et al., 2004), ICP-MS检测器最低检出限 < 10 pg.
MeHg测定方法检出限(MDL, 即3倍空白的标准偏差)为0.02 ng·L-1, 方法空白均低于仪器检出限.土壤THg的测定使用四川盆地标准土(GSS-14, GBW07428, THg为(89±4) ng·g-1)作为标准物质, 标准物质测定的平均回收率为97%~111%, 平行样测定相对标准偏差 < 8.7%.土壤MeHg含量测定中使用样品加标回收进行质量控制, 加标回收率为86%~103%, 平行样测定的相对标准偏差 < 7.8%.
2.4 数据分析本文以甲基化速率常数(km)与去甲基化速率常数(kd)来衡量根际土与非根际土的Hg甲基化与去甲基化速率, 通过测定培养期间Me199Hg的产生量和Me201Hg的减少量来计算, 其具体的计算公式如下(Korthals et al., 1987):
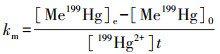
|
(1) |
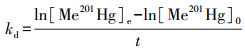
|
(2) |
式中, t为培养时间;[Me199Hg]0为培养初始时Me199Hg同位素的含量;[Me199Hg]e为培养结束时Me199Hg同位素的含量;[Me201Hg]0为培养初始时Me201Hg同位素的含量;[Me201Hg]e为培养结束时Me201Hg同位素的含量;[199Hg2+]为加入土壤中199Hg2+的含量.
以甲基化速率常数和对应的去甲基化速率常数的比值来表示根际土和非根际土的净甲基化潜力(P)(Cesario et al., 2017):
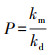
|
(3) |
根据测定的土壤Hg甲基化与去甲基化速率常数, 并结合土壤中本底的THg含量, 来估算在稳态条件下预期的土壤MeHg含量(ng·g-1), 其计算公式如下(Cesario et al., 2017):
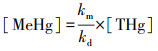
|
(4) |
数据采用SPSS 17.0和Excel进行数理统计分析, 利用单因子方差分析(ANOVA)在显著水平α=0.05下进行均值差异的显著性检验.
3 结果与讨论(Results and discussion) 3.1 根际土与非根际土甲基汞与总汞含量通过对三峡库区消落带狗牙根根际土与非根际土的THg含量与MeHg含量测定发现(图 1), 根际土中THg的平均含量为(88.6±15.3) ng·g-1, 非根际土中THg的平均含量为(84.2±6.7) ng·g-1.根际土中的THg含量略大于非根际土, 且不存在显著性差异(p>0.05, n=36).根际土中MeHg的平均含量为(0.85±0.20) ng·g-1, 非根际土中MeHg的平均含量为(0.47±0.12) ng·g-1.根际土中MeHg含量显著大于非根际土(p < 0.01, n=36), 说明根际微域是IHg甲基化的一个活跃区.已有的相关研究发现, 根际环境能够促进IHg的甲基化, 且距离根系越近, IHg的甲基化率越高(Sun et al., 2011).此外, 也有研究表明, 生长植物的湿地沉积物中MeHg含量显著高于无植物生长的沉积物, 且移除植物后沉积物中MeHg的含量明显减少.植物根系分泌的根系分泌物能够提高根系微域微生物的活性, 而根系微域Hg的甲基化则主要归因于微生物的作用(Windham-Myers et al., 2009).
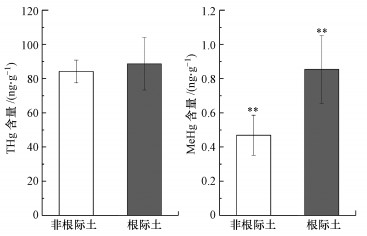 |
| 图 1 根际土与非根际土中总汞和甲基汞含量 (*表示在0.05水平具有显著性差异, **表示在0.01水平具有极显著性差异, 下同) Fig. 1 Total mercury and Methylmercury content in rhizosphere and bulk soil (* indicates a significant difference at the 0.05 level, ** indicates an extremely significant difference at the 0.01 level, the same as below) |
对根际土与非根际土主要理化性质进一步测定分析发现(表 1), 根际土中Fe2+、Mn2+、有机质含量、细菌、真菌数、过氧化氢酶活性均显著大于非根际土(p < 0.05, n=36), 而pH值、Fe3+、SO42-含量小于非根际土.相关性分析发现(表 2), 根际土壤中MeHg含量与Mn2+、SO42-、有机质含量存在显著正相关性(p < 0.05, n=36), 与过氧化氢酶活性、细菌、真菌数存在显著正相关性(p < 0.01, n=36).非根际土中MeHg含量与Fe2+、Mn2+、SO42-、有机质含量、过氧化氢酶活性、细菌数存在显著正相关性(p < 0.05, n=36).
| 表 1 根际土与非根际土主要的理化性质 Table 1 Critical physical and chemical properties of rhizosphere and bulk soil |
根际土壤与非根际土壤的理化性质差异表明, 根际效应对Hg的生物地球化学过程具有重要的影响作用.一方面, 植物根系会分泌出大量的可被微生物利用的有机质, 提高根际环境微生物的活性, 使得根际土壤中微生物的数量和种类都远高于非根际土(朱丽霞等, 2003), 同时也会提高根际土壤中Hg甲基化微生物(如硫酸盐还原菌、铁还原菌)的活性, 从而促进Hg的甲基化, 尤其是根系分泌物中的一些低分子量有机酸对Hg的甲基化具有关键性的促进作用(Yin et al., 2018).另一方面, 根系分泌物还能还原土壤中的重金属, 而使得根际土壤表现出还原态的金属离子浓度(如Fe2+、Mn2+)高于非根际土, 且根系分泌的有机酸、氨基酸等有机物被根际微生物所利用(徐卫红等, 2006), 从而形成一个更利于Hg甲基化的环境.本实验结果表明, 过氧化氢酶与Hg的甲基化具有显著正相关性, 说明植物分泌的过氧化氢酶催化氧化土壤中Hg0转变为可被微生物利用的Hg2+, 从而促进Hg甲基化的发生(谷春豪等, 2013).大量研究已证明, SO42-能作为电子供体与促进硫酸盐还原菌对IHg的甲基化作用(Acha et al., 2011), 根际土壤中大量的SO42-被还原而以S2-的形式存在, 因而表现出根际土壤中SO42-含量略小于非根际土.土壤中的锰是一种微量营养素, 可作为许多植物酶的关键结构的组成成分和辅助因子, 并以Mn2+的形式被植物吸收利用(Burnell, 1988).有研究发现, 根际土壤中的Mn2+对Hg2+具有一定的截留作用, 可降低植物对Hg的吸收(Sierra et al., 2012), 使得更多的Hg2+保留在土壤中, 从而利于土壤Hg的甲基化.另外, 代表土壤微生物活性的指标(细菌、真菌数、过氧化氢酶活性)表现出与根际土壤MeHg含量呈显著(p < 0.01, n=36)正相关性, 表明在根际环境中微生物对Hg的甲基化起着主要作用.
| 表 2 根际土与非根际土主要理化性质与MeHg含量相关性 Table 2 Correlation between critical physical and chemical properties of rhizosphere and bulk soil and methylmercury content |
为进一步验证根际土壤对Hg甲基化与去甲基化的作用, 本研究测定了不同培养条件下(有菌、无菌)根际土中IHg的甲基化速率与MeHg的去甲基化速率, 并与非根际土对照.其中, 根际土与非根际土中IHg的甲基化速率结果如图 2所示.在有菌的培养条件下, 根际土与非根际土甲基化速率常数分别为(0.13±0.08)×10-2、(0.02±0.005)×10-2 d-1;无菌培养条件下, 根际土与非根际土甲基化速率常数分别为(0.06±0.036)×10-2、(0.01±0.007)×10-2 d-1.其中, 有菌培养条件下根际土的甲基化速率对应的变化范围为0.05×10-2~0.21×10-2 d-1, 非根际土甲基化速率对应的变化范围为0.015×10-2~0.025×10-2 d-1.本研究测定的根际土壤的甲基化速率略低于其他研究测定的湿地生态系统中植被根际土甲基化速率(0.02×10-2~0.024 d-1)(Drott et al., 2008), 而高于稻田土壤Hg甲基化速率(0.034×10-3~1.1×10-3 d-1)(赵蕾, 2016).在有菌培养条件下, 根际土中的甲基化速率显著大于非根际土(p < 0.05, n=12);无菌培养条件下, 根际土中的甲基化速率也显著大于非根际土(p < 0.05, n=12).进一步对比有菌和无菌根际土的甲基化速率, 表现为有菌根际土显著大于无菌根际土(p < 0.05, n=12).由此可以看出, 植物的生长可以促进土壤Hg的甲基化速率, 且土壤中的微生物对Hg甲基化起主要作用.Windham-Myers等(2009)对一系列的多样性的生态湿地环境研究发现, 移除植被后土壤Hg的甲基化速率降低了38%, 且土壤的Hg甲基化潜力也减小了36%.这主要是因为移除植被后, 降低了土壤中Hg甲基化微生物的活性.Cesario等(2017)对植被覆盖区和非植被覆盖区盐沼沉积物的Hg甲基化速率的测定也发现, 植被覆盖区沉积物的甲基化速率高于非植被覆盖区.植物的根系会分泌大量可供微生物利用的营养物质, 从而影响根际微生物的群落结构和活性, 进而影响Hg的生物可利用性(Aiken et al., 2011; Cosio et al., 2014).通过微生物计数的测定也可看出, 根际土壤含有较高的微生物量, 其丰富的碳源环境及较低的氧化还原环境也更适宜Hg甲基化微生物的生长, 因此表现出较高的甲基化速率.另外, 本研究发现在无菌的培养条件下, 根际土也具有一定的Hg甲基化能力, 此时的甲基化可能为非生物甲基化.有研究表明, 在富含有机酸、羧酸等有机质和有机配合物的土壤环境中, 汞能通过非生物的甲基化作用转化为甲基汞, 一些有机小分子(如乙酸)和有机大分子(如腐殖酸)能作为非生物甲基化的甲基供体(黄潇, 2014;谷春豪等, 2013).
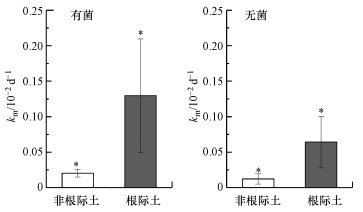 |
| 图 2 不同培养条件下根际土与非根际土汞甲基化速率常数 Fig. 2 Rate constant of mercury methylation in rhizosphere and bulk soil in different culture conditions |
根际土与非根际土中MeHg的去甲基化速率常数如图 3所示.在有菌培养条件下, 根际土与非根际土MeHg去甲基化速率常数分别为(0.10±0.07)、(0.04±0.03) d-1;无菌培养条件下, 根际土与非根际土MeHg去甲基化速率常数分别为(0.004±0.002)、(0.003±0.003) d-1.有菌培养条件下根际土去甲基化速率对应的变化范围为0.03~0.17 d-1, 非根际土去甲基化速率对应的变化范围为0.01~0.07 d-1, 与Drott等(2008)研究测定的值(0.01~0.1 d-1)相当, 而低于稻田土壤中去甲基化速率的变化范围(0.02~0.92 d-1)(赵蕾, 2016).在有菌培养条件下, 根际土中Hg的去甲基化速率显著大于非根际土(p < 0.05, n=12);无菌培养条件下, 根际土与非根际土去甲基化速率不存在显著性差异(p>0.05, n=12).进一步对比有菌和无菌根际土的去甲基化速率, 表现为有菌根际土极显著大于无菌根际土(p < 0.01, n=12).在MeHg的去甲基化过程中, 微生物同样也扮演着重要的角色.然而根际土的去甲基化速率同样也表现为大于非根际土, 考虑到一个可能的重要因素是根际土与非根际土微生物的群落结构不同.有无植物的生长会影响到土壤环境中局部的微生物群落的组成(Cosio et al., 2014).非根际土缺少根系分泌物和植物残体等有机物质的输入, 微生物丰度和活性下降;而根际因其含有丰富的有机质, 微生物丰度和活性也较高, 同时其具有汞去甲基化能力的微生物的活性也高于非根际土.
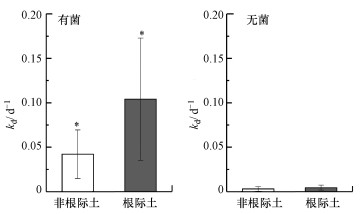 |
| 图 3 不同培养条件下根际土与非根际土汞去甲基化速率常数 Fig. 3 Rate constant of mercury demethylation in rhizosphere and bulk soil in different culture conditions |
土壤中IHg的甲基化过程和MeHg的去甲基化过程会同时发生, 甲基化作用和去甲基化作用之间的平衡过程决定了土壤中MeHg的积累量(Hintelmann et al., 2000).考虑到土壤中Hg2+量远远高于MeHg量, 可假定汞的甲基化不会显著影响Hg2+浓度, 当IHg的甲基化和MeHg的去甲基化达到一个相对平衡态时, MeHg含量将接近一个恒定的稳态浓度.本实验测定的根际土中的去甲基化速率常数约为甲基化速率常数的100倍, 但土壤中IHg和MeHg的本底值相差很大, 土壤中MeHg/THg的比值为1%左右, 发生去甲基化的MeHg量远小于发生甲基化的Hg2+量, 因此土壤表现为净积累.根据测定的土壤IHg甲基化速率常数与MeHg去甲基化速率常数, 并结合土壤中本底的THg含量, 来估算在稳态条件下预期的土壤MeHg含量(Cesario et al., 2017), 结果如图 4所示.根际土的净甲基化潜力平均值为(1.26±0.35)×10-2, 非根际土的净甲基化潜力平均值为(0.57±0.16)×10-2, 根际土的净甲基化潜力显著大于非根际土(p < 0.05, n=12).对土壤中MeHg含量与净甲基化潜力进行相关性分析, 发现土壤中MeHg含量与净甲基化潜力具有显著相关性(r=0.616, p < 0.05, n=12), 这也说明土壤中的净甲基化潜力可以反映出土壤中MeHg的含量.进一步估算稳态条件下根际土与非根际土中的MeHg含量, 其估算值分别为(1.12±0.38)、(0.48±0.09) ng·g-1.在稳态条件下, 根际土中MeHg含量也显著大于非根际土(p < 0.01, n=12).与实际测定的根际土((0.85±0.20) ng·g-1)和非根际土((0.47±0.1) ng·g-1)中的MeHg含量对比, 发现估算值略大于实际测定的土壤MeHg含量.这主要是由于在实验条件下, “新”加入的Hg2+与土壤中原始的Hg2+相比更易发生甲基化(Cesario et al., 2017), 从而可能使得实验测定的甲基化速率常数(km)略高于实际环境, 但稳态条件下的估算值也从侧面反映出了根际土与非根际土MeHg的含量水平, 进一步证明了根际土中较高的MeHg积累量与其具有较高的甲基化潜力有关.
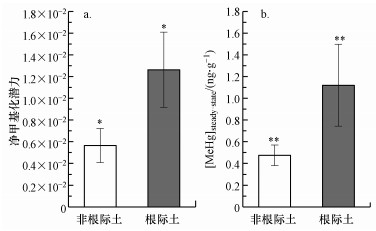 |
| 图 4 根际土与非根际土净甲基化潜力(a)和稳态条件下MeHg含量(b) Fig. 4 Net methylation potential (a) and methylmercury content (b) in steady-state of rhizosphere and bulk soil |
1) 根际土中MeHg的含量显著大于非根际土, 根际微域是IHg发生甲基化的一个活跃区.
2) 根际土中IHg的甲基化和MeHg的去甲基化均受到微生物和非微生物的影响, 其中微生物表现出主要的作用.
3) 根际土壤较高的MeHg积累量与其具有较高的IHg甲基化潜力有关.
Acha D, Hintelmann H, Yee J. 2011. Importance of sulfate reducing bacteria in mercury methylation and demethylation in periphyton from Bolivian Amazon region[J]. Chemosphere, 82(6): 911-916. DOI:10.1016/j.chemosphere.2010.10.050 |
Aiken G R, Hsu-Kim H, Ryan J N. 2011. Influence of dissolved organic matter on the environmental fate of metals, nanoparticles, and colloids[J]. Environmental Science & Technology, 45(8): 3196-3201. DOI:10.1021/es103992s |
Burnell J N.1988.The Biochemistry of Manganese in Plants//Manganese in Soils and Plants[M].Springer. 125-137
|
Cesario R, Hintelmann H, Mendes R, et al. 2017. Evaluation of mercury methylation and methylmercury demethylation rates in vegetated and non-vegetated saltmarsh sediments from two Portuguese estuaries[J]. Environmental Pollution, 226: 297-307. DOI:10.1016/j.envpol.2017.03.075 |
陈有鑑, 黄艺, 曹军, 等. 2003. 玉米根际土壤中不同重金属的形态变化[J]. 土壤学报, 40(3): 367-373. DOI:10.3321/j.issn:0564-3929.2003.03.007 |
Clarkson T W, Magos L. 2006. The toxicology of mercury and its chemical compounds[J]. Critical Reviews in Toxicology, 36(8): 609-662. DOI:10.1080/10408440600845619 |
Cosio C, Fluck R, Regier N, et al. 2014. Effects of macrophytes on the fate of mercury in aquatic systems[J]. Environ Toxicol Chem, 33(6): 1225-1237. DOI:10.1002/etc.2499 |
Courchesne F, Gobran G R. 1997. Mineralogical variations of bulk and rhizosphere soils from a Norway spruce stand[J]. Soil Science Society of America Journal, 61(4): 1245-1249. DOI:10.2136/sssaj1997.03615995006100040034x |
Drott A, Lambertsson L, Bjorn E, et al. 2008. Do potential methylation rates reflect accumulated methyl mercury in contaminated sediments?[J]. Environmental Science & Technology, 42(1): 153-158. DOI:10.1021/es0715851 |
Eckley C S, Luxton T P, Goetz J, et al. 2017. Water-level fluctuations influence sediment porewater chemistry and methylmercury production in a flood-control reservoir[J]. Environmental Pollution, 222: 32-41. DOI:10.1016/j.envpol.2017.01.010 |
Feng X B, Bai W Y, Shang L H, et al. 2011. Mercury speciation and distribution in Aha Reservoir which was contaminated by coal mining activities in Guiyang, Guizhou, China[J]. Applied Geochemistry, 26(2): 213-221. DOI:10.1016/j.apgeochem.2010.11.021 |
谷春豪, 许怀凤, 仇广乐. 2013. 汞的微生物甲基化与去甲基化机理研究进展[J]. 环境化学, 32(6): 926-936. |
Hintelmann H, Evans R D, Villeneuve J Y. 1995. Measurement of mercury methylation in sediments by using enriched stable mercury isotopes combined with methylmercury determination by gas-chromatography inductively-coupled plasma-mass spectrometry[J]. Journal of Analytical Atomic Spectrometry, 10(9): 619-624. DOI:10.1039/JA9951000619 |
Hintelmann H, Keppel-Jones K, Evans R D. 2000. Constants of mercury methylation and demethylation rates in sediments and comparison of tracer and ambient mercury availability[J]. Environ Toxicol Chem, 19(9): 2204-2211. DOI:10.1002/etc.5620190909 |
黄潇.2014.有机配合物对汞的非生物甲基化及其影响因素研究[D].合肥: 安徽农业大学.14-16
|
贾亮亮, 段媛媛. 2016. 土壤易溶盐浸提液中硫酸根和硝酸根的测定[J]. 分析测试技术与仪器, 22(4): 265-268. |
Korthals E T, Winfrey M R. 1987. Seasonal and spatial variations in mercury methylation and demethylation in an Oligotrophic Lake[J]. Applied and Environmental Microbiology, 53(10): 2397-2404. DOI:10.1128/AEM.53.10.2397-2404.1987 |
Li Y B, Cai Y. 2013. Progress in the study of mercury methylation and demethylation in aquatic environments[J]. Chinese Science Bulletin, 58(2): 177-185. DOI:10.1007/s11434-012-5416-4 |
Liang L, Horvat M, Feng X B, et al. 2004. Re-evaluation of distillation and comparison with HNO3 leaching/solvent extraction for isolation of methylmercury compounds from sediment/soil samples[J]. Appl Organomet Chem, 18(6): 264-270. DOI:10.1002/aoc.617 |
鲁如坤.2000.土壤农业化学分析方法[M].北京: 中国农业科学技术出版社.147-161
|
Meng M, Li B, Shao J J, et al. 2014. Accumulation of total mercury and methylmercury in rice plants collected from different mining areas in China[J]. Environmental Pollution, 184: 179-186. DOI:10.1016/j.envpol.2013.08.030 |
Sierra M J, Rodriguez-Alonso J, Millan R. 2012. Impact of the lavender rhizosphere on the mercury uptake in field conditions[J]. Chemosphere, 89(11): 1457-1466. DOI:10.1016/j.chemosphere.2012.06.017 |
孙涛, 马明, 王永敏, 等. 2018. 西南地区典型森林水库土壤和沉积物汞的迁移转化特征[J]. 环境科学, 39(4): 1880-1887. |
Sun X J, Wang Q C, Ma H Y, et al. 2011. Effects of plant rhizosphere on mercury methylation in sediments[J]. Journal of Soils and Sediments, 11(6): 1062-1069. DOI:10.1007/s11368-011-0403-y |
Walkley A, Black I A. 1934. An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method[J]. Soil Science, 37(1): 29-38. DOI:10.1097/00010694-193401000-00003 |
Windham-Myers L, Marvin-Dipasquale M, Krabbenhoft D P, et al. 2009. Experimental removal of wetland emergent vegetation leads to decreased methylmercury production in surface sediment[J]. J Geophys Res-Biogeo. DOI:10.1029/2008JG000815 |
徐卫红, 黄河, 王爱华, 等. 2006. 根系分泌物对土壤重金属活化及其机理研究进展[J]. 生态环境, 15(1): 184-189. DOI:10.3969/j.issn.1674-5906.2006.01.039 |
杨兰芳, 曾巧, 李海波, 等. 2011. 紫外分光光度法测定土壤过氧化氢酶活性[J]. 土壤通报, 42(1): 207-210. |
杨文航, 任庆水, 秦红, 等. 2018. 三峡库区消落带不同海拔狗牙根草地土壤微生物生物量碳氮磷含量特征[J]. 草业学报, 27(2): 57-68. |
Yin D L, Wang Y M, Jiang T, et al. 2018. Methylmercury production in soil in the water-level-fluctuating zone of the Three Gorges Reservoir, China:The key role of low-molecular-weight organic acids[J]. Environmental Pollution, 235: 186-196. DOI:10.1016/j.envpol.2017.12.072 |
游蕊, 梁丽, 覃蔡清, 等. 2016. 低分子量有机酸对三峡水库消落区土壤中汞赋存形态及其活性的影响[J]. 环境科学, 37(1): 173-179. DOI:10.3969/j.issn.1673-1212.2016.01.048 |
赵蕾.2016.汞矿区稻田土壤中汞的分布特征及甲基化/去甲基化速率研究[D].重庆: 西南大学.26-28
|
 2020, Vol. 40
2020, Vol. 40


