2. 同济大学环境科学与工程学院, 上海 200092
2. School of Environmental Science and Engineering, Tongji University, Shanghai 200092
近年来, 水环境中各种药物的流入及其最终转化产物引起了人们的普遍关注, 尤其是抗生素(Luo et al., 2014; Chen et al., 2018; Qian et al., 2018).随着抗生素的广泛应用, 其在水环境中慢慢积聚, 这会增加水体中细菌的耐药性, 并对人类的健康造成威胁, 而现行的传统污水处理厂并无针对性的处理工艺.碳青霉烯类是现阶段一类广泛应用于人类的β-内酰胺抗生素, 主要通过抑制细胞壁合成发挥作用, 对革兰氏阴性感染治疗最有效(Scholar, 2007).同时, 当患者患有严重疾病或者怀疑感染耐药细菌时, 新型碳青霉烯类抗生素通常被用作“最后的抗生素”.其结构与青霉素类的青霉环相似, 不同之处在于噻唑环上的硫原子被碳替代, 且C2与C3之间存在不饱和双键;此外, 其6位羟乙基侧链为反式构象.碳青霉烯类抗生素的代表性物质是亚胺培南、美罗培南、多利培南和厄他培南.已有研究发现(Kumarasamy et al., 2010; Peri et al., 2019; Zhang et al., 2019), 一些革兰氏阴性菌已对碳青霉烯类抗生素产生了抗性基因, 从而严重威胁到碳青霉烯类作用的发挥, 同时在污水厂进出水中检测出美罗培南(Tran et al., 2016; Tran et al., 2016).很多研究表明(Liu et al., 2012; Zhou et al., 2018; Li et al., 2019), 在水环境中已经检测到各种类型的抗生素, 并研究了去除各种抗生素的方法, 却鲜有关于碳青霉烯类抗生素去除方法及基于高级氧化技术去除碳青霉烯类抗生素效果的研究.因此, 寻求一种能够去除新型碳青霉烯类抗生素并且有效地降低其抗菌性能的方法尤为重要.
高级氧化技术(AOPs)主要通过产生具有高氧化还原电位的自由基, 将大分子难降解有机物氧化成低毒或无毒的小分子物质或直接氧化成CO2、H2O和无机盐等, 从而达到去除污染物的效果.羟基自由基(·OH)具有较强的氧化性, 其氧化还原电位为1.8~2.7 V, 对污染物的选择性低, 但高反应性的·OH通过诱导连续氧化反应可以攻击有机物(Tian et al., 2019).UV/H2O2技术是一种基于高级氧化技术, 利用紫外线直接照射活化H2O2产生具有强氧化能力的羟基自由基的环保、低能耗方法.该技术特点明显:无需高温高压、光化学稳定、紫外光获取成本低、不会对体系引入新的污染物.目前, 已有较多研究采用UV/H2O2工艺去除水环境中的抗生素(Nihemaiti et al., 2018; Terracciano et al., 2018; Qiu et al., 2019).
基于此, 本文选取美罗培南(MPN)作为新型碳青霉烯类抗生素的代表性物质, 采用UV/H2O2工艺对MPN进行降解, 考察H2O2投加量、初始pH值、水中共存阴离子浓度、NOM浓度、实际水体等因素对MPN降解的影响, 并对各个因素下的降解结果进行探讨.同时, 根据大肠杆菌的急性毒性试验, 评估MPN降解过程中中间转化产物的抗菌性能变化.
2 材料与方法(Materials and methods) 2.1 材料试剂紫外灯(254 nm, 4 W, Philips)购于上海慎光照明有限公司;石英杯(外径60 mm, 壁厚2 mm, 高90 mm)购于苏州东都实验室设备有限公司.甲醇(CH3OH)、乙腈(CH3CN)购于Sigma-Aldrich公司;黄腐殖酸(HA)、酵母提取物粉末和过氧化氢(H2O2, 质量分数30%)购于阿拉丁生化试剂有限公司;美罗培南三水合物(Meropenem, MPN)购于上海安谱实验科技股份有限公司;实验所用硫代硫酸钠(Na2S2O3)、溴化钾(KBr)、碘化钾(KI)、氯化钠(NaCl)、碳酸氢钠(NaHCO3)、硝酸钠(NaNO3)、溴酸钾(KBrO3)、盐酸(HCl)、氢氧化钠(NaOH)、硫酸(H2SO4)、十二水合磷酸氢二钠(Na2HPO4·12H2O)、二水合磷酸二氢钠(NaH2PO4·2H2O)、蛋白胨均为分析纯, 购于国药集团化学试剂有限公司.实验用水为超纯水.
2.2 降解实验UV/H2O2降解MPN的实验均在自制的不透光的密闭反应器中进行, 反应器长200 mm, 宽200 mm, 高300 mm.室温下, 提前20 min开启紫外灯进行预热, 将一定量的超纯水注入容积为200 mL的石英杯, 同时加入10 mL浓度为0.2 mol·L-1的磷酸缓冲液(PB), 用NaOH或稀H2SO4调节溶液的初始pH值.将石英杯置于反应器中, 然后快速加入一定体积的MPN储备液和H2O2储备液开启实验, 使得溶液总体积为200 mL, 并计时取样, 迅速向样品中加入过量Na2S2O3, 猝灭氧化剂, 最后水样经0.22 μm微孔滤膜过滤收集在液相进样瓶, 于4 ℃保存待测.
2.3 转化产物的毒性分析实验采用大肠杆菌(E.coli)测试MPN及其降解转化产物的抗菌性(Suarez et al., 2007; Sun et al., 2013).由于转化产物的多样性和复杂性, 难以单独评估其特定产物的毒性, 因此, 按照一定的时间间隔, 从反应体系中取出一定样品, 加入过量Na2S2O3.将样品注入体积为40 mL冷却的经高温灭菌的LB培养基中, 同时加入0.05 mL的OD600(即在600 nm波长处测量的光密度)约为0.1的E.coli悬浊液.同时, 通过在每个时间点配置与剩余MPN浓度相同的标准MPN溶液替换光解样品来进行对照.以PBS溶液替代光解样品进行对照实验, 并配置单独Na2S2O3和H2O2溶液, 探究其对受试菌种生长的影响.对于各样品, 一式三份进行实验.将培养基在有氧条件下于37 ℃水浴摇床中连续振荡8 h.
2.4 分析方法高效液相色谱仪(HPLC, Agilent 1260)用于测定样品中MPN的剩余浓度, 色谱柱为Agilent SBC-18柱(4.6 mm×150 mm, 5 μm);流动相由0.66‰的磷酸和乙腈(87:13)组成, 流速为1.0 mL·min-1;进样量为40 μL, 柱温为25 ℃, 波长为298 nm.H2O2使用前, 质量分数采用碘量法(李新, 1987)进行滴定.总有机碳分析仪(TOC-LCPH, 岛津)用于测定MPN的矿化率.
使用紫外可见分光光度计(Mapada UV-1600(PC))于600 nm处测量培养基中的E.coli光密度, 以此作为细菌生长的指示.
3 结果与讨论(Results and discussion) 3.1 不同反应条件的影响在紫外光功率为4 W, pH为7.0, H2O2浓度为0.8 mmol·L-1, MPN浓度为0.04 mmol·L-1的条件下, 考察单独H2O2、单独UV和UV/H2O2对MPN的降解效果, 结果如图 1所示.由图可知, 在没有UV的照射下, 单独H2O2体系中, MPN在20 min内没有被降解, 说明H2O2不能单独氧化降解MPN.单独UV照射, 20 min内MPN的降解率为29.9%, 有文献(Beltran et al., 1995; Fang et al., 2013)表明物质的摩尔吸光系数在特定波长下的数值越大, 对光的吸收越强.MPN在254 nm波长处的摩尔吸收系数为3.36×103 mol-1·cm-1, 光量子产率经测定大于1, 能够被发射波长为254 nm的紫外光降解.在UV/H2O2体系中, 在反应时间为20 min时, MPN的降解率达到97.9%, 这主要由于UV活化H2O2产生强氧化性的羟基自由基(·OH), 从而加速了MPN的降解.通过单独UV和UV/H2O2体系对MPN的降解效果对比可知, MPN的去除主要是通过UV的直接光解和·OH的间接氧化.
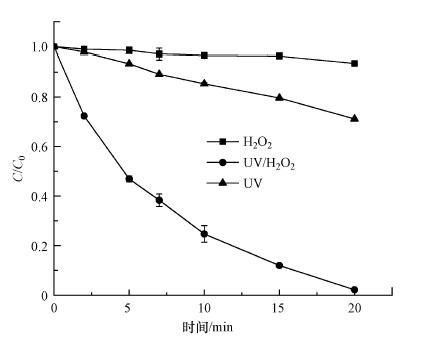 |
| 图 1 不同反应条件对MPN降解的影响 (pH=7.0, T=25 ℃, [H2O2]= 0.8 mmol·L-1, [MPN]=0.04 mmol·L-1, [PB]=10 mmol·L-1, 紫外灯功率4 W) Fig. 1 Effect of different reaction conditions on the degradation of MPN |
在紫外光功率为4 W, pH为7.0, MPN浓度为0.04 mmol·L-1的条件下, 考察不同H2O2投加量对MPN降解率的影响, 结果如图 2a所示.由图 2a可知, 直接光解时, MPN的降解率为29.9%;当体系中投加的H2O2与MPN浓度比为1:1时, 反应20 min时MPN的降解率达到36.4%;当增大H2O2的投加量至20:1, MPN在20 min时降解率达到97.9%;继续增大H2O2的投加量, MPN达到完全降解的时间明显缩短.这一结果表明H2O2投加量的增加导致UV活化H2O2产生更多数量的·OH, 从而促进与MPN的反应, 加速了MPN的降解, 甚至缩短相应的反应时间.这与玺苟莹等(2017)报道的UV/H2O2工艺降解磺胺嘧啶的现象一致.
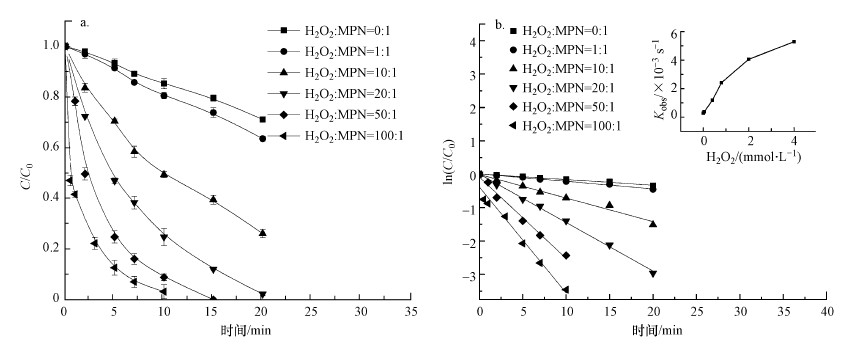 |
| 图 2 H2O2投加量对MPN降解的影响 (pH=7.0, T=25 ℃, [MPN]=0.04 mmol·L-1, [PB]=10 mmol·L-1, 紫外灯功率4 W) Fig. 2 Effect of dosage of H2O2 on the degradation of MPN |
不同H2O2投加量的体系中, 一级降解动力学拟合如图 2b所示.当H2O2与MPN浓度比分别为0:1、1:1、10:1、20:1、50:1、100:1时, MPN的表观速率常数分别为2.81×10-4、3.73×10-4、1.18×10-3、2.42×10-3、4.06×10-3、5.29×10-3 s-1.显然, 随着H2O2投加量的增大, MPN的降解速率也随之加快.由图 2b可以看出, 反应速率常数与低浓度的H2O2具有良好的线性关系, 高投加量的H2O2反应体系中对应的反应速率常数向下偏离了上述线性关系, 这可能与·OH在体系中的稳态浓度和过量的·OH会消耗体系中产生的·OH有关(式(1))(Shah et al., 2013).因此, 综合考虑效率和经济效益, 选择n(H2O2)/n(MPN)=20:1作为主体实验的研究比例.

|
(1) |
在紫外光功率为4 W, H2O2浓度为0.8 mmol·L-1, MPN浓度为0.04 mmol·L-1的条件下, 考察不同初始pH值对UV/H2O2体系降解MPN的影响, 结果如图 3所示.由图 3可知, 当溶液初始pH分别为5.0、6.0、7.0、8.0、9.0时, 反应20 min后MPN的降解率分别为95.2%、94.7%、97.1%、97.7%、97.4%, 说明初始pH对MPN的降解无明显影响.然而, 在UV/H2O2降解MPN过程中, 发现碱性条件较中性条件促进了MPN的降解速率.有研究表明(Christensen et al., 1982), 碱性条件下H2O2发生自分解产生的HO2-能够与·OH反生反应, 从而抑制反应, 降低反应速率, 这与本研究结果不一致(式(2)~(3)).如图 4所示, 在考察不同pH条件对MPN水解的影响时发现, 碱性条件下MPN更易发生水解, 且在pH=9.0下水解的一级速率常数为0.2×10-4 s-1.因此, 可能是这个因素导致了UV/H2O2体系中MPN降解速率的差异.
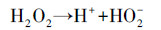
|
(2) |
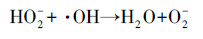
|
(3) |
 |
| 图 3 初始pH对MPN降解的影响 (T=25 ℃, [H2O2]= 0.8 mmol·L-1, [MPN]=0.04 mmol·L-1, [PB]=10 mmol·L-1, 紫外灯功率4 W) Fig. 3 Effect of initial pH on the degradation of MPN |
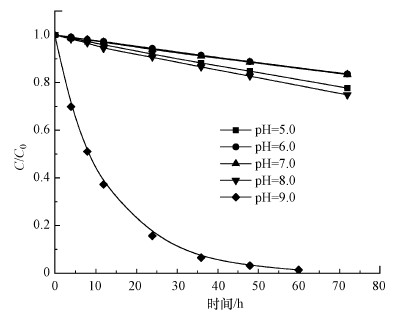 |
| 图 4 MPN在不同pH条件下的水解率 (T=25 ℃, [MPN]=0.04 mmol·L-1, [PB]=10 mmol·L-1) Fig. 4 Hydrolysis rate of MPN under different pH conditions |
Cl-、HCO3-、NO3-等无机阴离子在自然水体中广泛存在.因此, 为了评估UV/H2O2工艺在实际水体中去除MPN的作用, 有必要研究水中共存阴离子对MPN降解的影响.在紫外光功率为4 W, pH为7.0, H2O2浓度为0.8 mmol·L-1, MPN浓度为0.04 mmol·L-1的条件下, 考察了Cl-浓度对MPN去除效果的影响, 结果如图 5a所示.Liao等(2001)在研究中发现, Cl-对UV/H2O2过程产生的·OH具有清除作用, 从而抑制了污染物的降解.但本研究中Cl-的加入对MPN降解的促进作用不明显.Cl-浓度从1 mmol·L-1增加至300 mmol·L-1, MPN的降解速率不会进一步加快.不同HCO3-浓度对MPN降解的影响如图 5b所示.尽管HCO3-能够淬灭部分体系中产生的·OH(He et al., 2012), 但从图 5b可以看出, HCO3-浓度对MPN的降解速率没有影响, 主要原因可能是MPN与·OH的高反应性.NO3-浓度对MPN去除效果的影响如图 5c所示.当加入的NO3-浓度分别为0、0.0119、0.119、0.595、1.190、3.595 mmol·L-1时, MPN的降解率分别为97.8%、100.0%、96.1%、92.5%、76.0%.由此可见, NO3-的投加浓度为0.0119 mmol·L-1时, MPN的降解速率受到了促进;NO3-的投加浓度大于0.119 mmol·L-1时, MPN的降解速率明显受到了抑制.主要原因是当NO3-浓度较低时, UV能够激发NO3-产生·OH(Mark et al., 1996), 从而促进MPN的降解;而当NO3-浓度较高时, NO3-会与MPN竞争·OH发生还原反应, 从而降低MPN的降解速率.
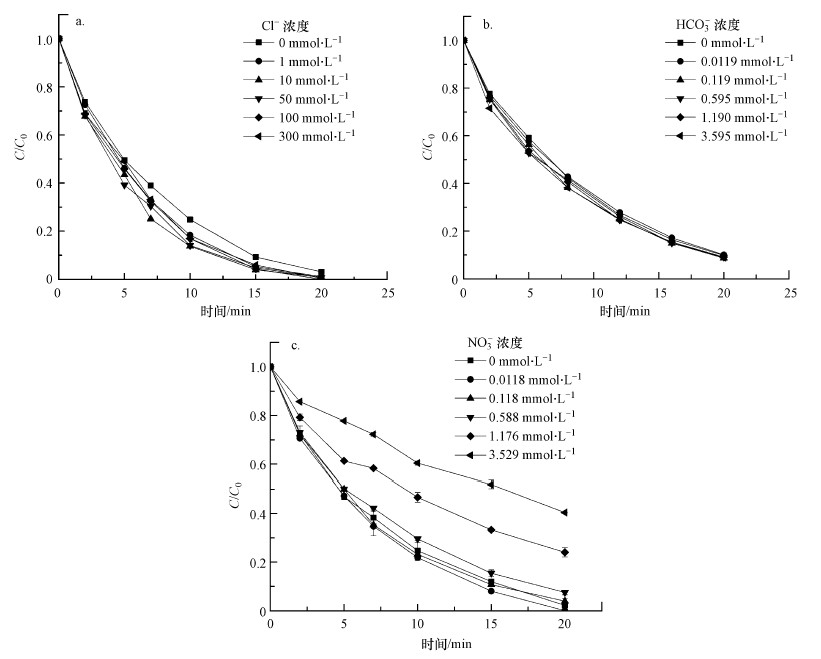 |
| 图 5 Cl-(a)、HCO3-(b)和NO3-(c)浓度对MPN降解的影响 (pH=7.0, T=25 ℃, [H2O2]= 0.8 mmol·L-1, [MPN]=0.04 mmol·L-1, [PB]=10 mmol·L-1, 紫外灯功率4 W) Fig. 5 Effect of Cl-(a), HCO3-(b) and NO3-(c) concentration on the degradation of MPN |
天然有机化合物(NOM)广泛存在于自然水环境中, 已有很多研究表明(Ji et al., 2016; Liu et al., 2019)其对AOPs有显著的影响.选取HA作为NOM的代表物质, 研究了不同HA浓度对MPN降解的影响, 结果如图 6所示.当加入的HA浓度分别为0、1、5、10、20 mg·L-1时, 反应20 min时MPN的降解率分别为97.8%、94.0%、92.2%、90.1%、78.6%.结果表明, 在UV/H2O2工艺中, HA对MPN的降解有抑制作用, 且随着HA浓度的增加, 抑制作用越明显.主要原因是HA与MPN之间的竞争作用, 一方面HA与MPN、H2O2竞争紫外光, 从而影响MPN的直接光解速率和·OH的生成速率;另一方面, HA可以与·OH发生反应, 与MPN竞争·OH, 从而降低了MPN的间接氧化速率.该结果与冯欣欣等(2015)在研究腐殖酸对UV/H2O2降解羟苯甲酮的结论类似.
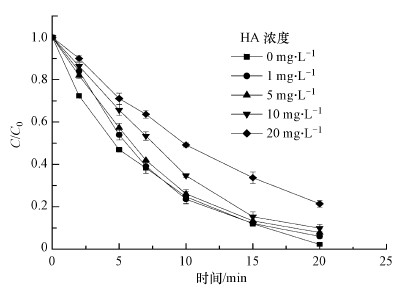 |
| 图 6 HA浓度对MPN降解的影响 (pH=7.0, T=25 ℃, [H2O2]= 0.8 mmol·L-1, [MPN]=0.04 mmol·L-1, [PB]=10 mmol·L-1, 紫外灯功率4 W) Fig. 6 Effect of HA concentration on the degradation of MPN |
TOC是用来衡量体系中有机污染物矿化程度的一项常规指标.UV/H2O2体系中MPN的矿化程度如图 7所示.由图可知, 在0、5、10、15、20 min时, 对应的TOC降解率分别为0、42.0%、43.9%、55.8%、64.8%.结果表明, UV/H2O2工艺对MPN不仅有良好的降解率, 而且具有较好的矿化率.此外, 反应在5~20 min内的矿化速率较为缓慢, 主要原因是反应过程中可能产生了难于矿化的中间产物, 同时随着反应的进行, 体系中的·OH不断被消耗, 浓度不断降低, MPN的降解速率也随之变缓.
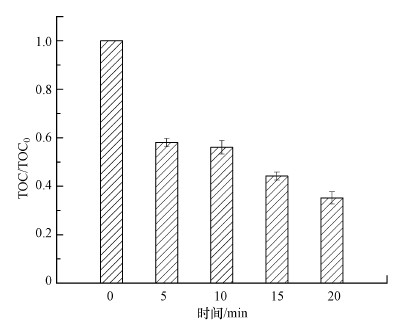 |
| 图 7 UV/H2O2体系中TOC的降解趋势 (pH=7.0, T=25 ℃, [H2O2]= 0.8 mmol·L-1, [MPN]=0.04 mmol·L-1, [PB]=10 mmol·L-1, 紫外灯功率4 W) Fig. 7 TOC variations with time in the UV/H2O2 system |
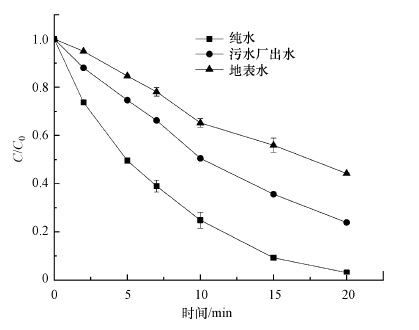
为了考察UV/H2O2降解MPN在实际水体中的应用, 采用两种实际水样代替纯水进行实验.污水厂出水和地表水分别取自苏州市福星污水处理厂和京杭大运河支流.实际水体对MPN去除效果的影响如图 8所示, 污水厂出水和地表水的水质指标如表 1所示.反应20 min时, 纯水、污水厂出水及地表水中MPN的降解率分别为97.9%、76.1%、55.8%.与纯水相比, MPN在实际水样中的降解速率都受到一定程度的抑制, 地表水的抑制作用较污水厂出水明显, 据此推断是实际水体中NOM和NO3-的影响所致, 正如3.4节和3.5节中的讨论.化学需氧量(COD)的测定表明实际水体其他有机污染物能够与目标污染物竞争自由基, 从而导致降解率的下降.
 |
| 图 8 实际水体对MPN降解的影响 (pH=7.0, T=25 ℃, [H2O2]= 0.8 mmol·L-1, [MPN]=0.04 mmol·L-1, [PB]=10 mmol·L-1, 紫外灯功率4 W) Fig. 8 Effect of actual water matrix on the degradation of MPN |
| 表 1 实际水体的水质指标 Table 1 Water quality indicators of actual water bodies |
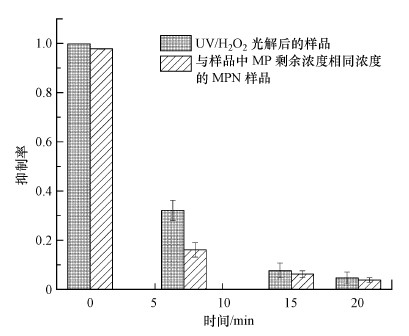
在降解过程中, MPN的转化产物可能仍然保留一些抗菌性, 因此, 有必要评估一下MPN光解转化产物的毒性.E.coli是典型的革兰氏阴性短杆菌, 而MPN对革兰阴性菌的敏感性极高, 因此, 选取E.coli作为评估MPN样品急性毒性的受试菌种.MPN光解样品及与光解过程中MPN剩余浓度相同浓度的对照样品对E.coli的生长抑制情况如图 9所示.E.coli生长抑制率I采用公式(4)进行计算.

|
(4) |
 |
| 图 9 MPN光解样品和对照样品的生长抑制 (pH=7.0, T=25 ℃, [H2O2]= 0.8 mmol·L-1, [MPN]=0.04 mmol·L-1, [PB]=10 mmol·L-1, 紫外灯功率4 W) Fig. 9 Growth inhibition of MPN photolysis and control samples |
式中, OD600(样品)为E.coli在样品中于600 nm处的光密度, OD600(空白)为E.coli在PBS中于600 nm处的光密度.
由图 9可知, 随着反应的进行, MPN光解样品对E.coli的生长抑制显著降低, 并且光解样品的抑制作用大于对照样品的抑制作用.淬灭剂Na2S2O3和单独H2O2的对照实验结果未显示出对E.coli生长的明显抑制.结果表明, 光解过程中的转化产物可能部分还保留了一些抗菌性.在20 min时, MPN光解样品的抑制率为95.4%, 对照样品的抑制率为97.2%, 说明随着反应的进行, MPN的最终转化产物会趋于无抗菌性.MPN的抗菌性能主要基于母体结构上C1连接的1-β-甲基和C2连接的吡咯烷-3-硫基, 由此说明在光解过程中MPN母体结构遭到了破坏, 生成毒性较低的物质.因此, UV/H2O2体系能够快速地去除MPN, 并且能够有效地降低MPN的抗菌性能, 对环境中抗生素的治理具有重要意义.
4 结论(Conclusions)1) UV/H2O2对MPN的降解反应符合假一级反应动力学模型, 且该工艺对MPN具有一定的矿化能力, MPN的降解主要是通过UV的直接光解和·OH的间接氧化.
2) 随着H2O2投加量的增加, MPN的降解速率随之加快;初始pH值和HCO3-的加入对MPN的去除效果影响较小;Cl-的加入促进了MPN的降解, 而促进程度与Cl-的浓度无关;极少量的NO3-存在时, 对MPN的降解表现为促进作用, 当体系中的NO3-浓度≥10 mg·L-1时, MPN的降解受到抑制, 且抑制作用随着浓度的上升而增大.
3) HA的加入会抑制MPN的降解, 浓度越大, 抑制作用越明显;在实际水体中MPN的降解均受到抑制.
4) 随着反应的进行, 中间转化产物仍然保留了一些抗菌性能, 最终产物都会趋于无毒性.
Beltran F J, Ovejero G, Garcia-Araya J F, et al. 1995. Oxidation of polynuclear aromatic hydrocarbons in water.2.UV radiation and ozonation in the presence of UV radiation[J]. Industrial & Engineering Chemistry Research, 34(5): 1607-1615. |
Chen J, Fang C, Xia W, et al. 2018. Selective Transformation of β-Lactam antibiotics by peroxymonosulfate:Reaction kinetics and nonradical mechanism[J]. Environmental Science & Technology, 52(3): 1461-1470. |
Christensen H, Sehested K, Corfitzen H. 1982. Reactions of hydroxyl radicals with hydrogen peroxide at ambient and elevated temperatures[J]. The Journal of Physical Chemistry, 86(9): 1588-1590. DOI:10.1021/j100206a023 |
Fang J, Ling L, Shang C. 2013. Kinetics and mechanisms of pH-dependent degradation of halonitromethanes by UV photolysis[J]. Water Research, 47(3): 1257-1266. DOI:10.1016/j.watres.2012.11.050 |
冯欣欣, 杜尔登, 郭迎庆, 等. 2015. UV/H2O2降解羟苯甲酮反应动力学及影响因素[J]. 环境科学, 36(6): 2129-2137. |
苟玺莹, 张盼月, 钱锋, 等. 2017. UV/ H2O2降解水中磺胺嘧啶影响因素及机理[J]. 环境工程学报, 11(11): 5810-5819. DOI:10.12030/j.cjee.201704031 |
He X, Pelaez M, Westrick J A, et al. 2012. Efficient removal of microcystin-LR by UV-C/H2O2 in synthetic and natural water samples[J]. Water Research, 46(5): 1501-1510. DOI:10.1016/j.watres.2011.11.009 |
Ji Y, Kong D, Lu J, et al. 2016. Cobalt catalyzed peroxymonosulfate oxidation of tetrabromobisphenol A:Kinetics, reaction pathways, and formation of brominated by-products[J]. Journal of Hazardous Materials, 313: 229-237. DOI:10.1016/j.jhazmat.2016.04.033 |
Kumarasamy K K, Toleman M A, Walsh T R, et al. 2010. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK:a molecular, biological, and epidemiological study[J]. The Lancet Infectious Diseases, 10(9): 597-602. DOI:10.1016/S1473-3099(10)70143-2 |
李新. 1987. 用碘量法分析过氧化氢的含量[J]. 电讯技术, (5): 74-77. |
Li J, Pan L, Yu G, et al. 2019. The synthesis of heterogeneous Fenton-like catalyst using sewage sludge biochar and its application for ciprofloxacin degradation[J]. Science of the Total Environment, 654: 1284-1292. DOI:10.1016/j.scitotenv.2018.11.013 |
Liao C, Kang S, Wu F. 2001. Hydroxyl radical scavenging role of chloride and bicarbonate ions in the H2O2/UV process[J]. Chemosphere, 44(5): 1193-1200. DOI:10.1016/S0045-6535(00)00278-2 |
Liu X, Garoma T, Chen Z, et al. 2012. SMX degradation by ozonation and UV radiation:A kinetic study[J]. Chemosphere, 87(10): 1134-1140. DOI:10.1016/j.chemosphere.2012.02.007 |
Liu Y, Guo H, Zhang Y, et al. 2019. Highly efficient removal of trimethoprim based on peroxymonosulfate activation by carbonized resin with Co doping:Performance, mechanism and degradation pathway[J]. Chemical Engineering Journal, 356: 717-726. |
Luo Y, Guo W, Ngo H H, et al. 2014. A review on the occurrence of micropollutants in the aquatic environment and their fate and removal during wastewater treatment[J]. Science of the Total Environment, 473-474: 619-641. DOI:10.1016/j.scitotenv.2013.12.065 |
Mark G, Korth H G, Schuchmann H P, et al. 1996. The photochemistry of aqueous nitrate ion revisited[J]. Journal of Photochemistry & Photobiology A Chemistry, 101(2/3): 89-103. |
Nihemaiti M, Miklos D B, Hübner U, et al. 2018. Removal of trace organic chemicals in wastewater effluent by UV/H2O2 and UV/PDS[J]. Water Research, 145: 487-497. DOI:10.1016/j.watres.2018.08.052 |
Peri A M, Doi Y, Potoski B A, et al. 2019. Antimicrobial treatment challenges in the era of carbapenem resistance[J]. Diagnostic Microbiology and Infectious Disease. |
Qian Y, Xue G, Chen J, et al. 2018. Oxidation of cefalexin by thermally activated persulfate:Kinetics, products, and antibacterial activity change[J]. Journal of Hazardous Materials, 354: 153-160. DOI:10.1016/j.jhazmat.2018.05.004 |
Qiu W, Zheng M, Sun J, et al. 2019. Photolysis of enrofloxacin, pefloxacin and sulfaquinoxaline in aqueous solution by UV/H2O2, UV/Fe(Ⅱ), and UV/H2O2/Fe(Ⅱ) and the toxicity of the final reaction solutions on zebrafish embryos[J]. Science of the Total Environment, 651: 1457-1468. DOI:10.1016/j.scitotenv.2018.09.315 |
Scholar E.2007.Meropenem//Enna S J, Bylund D B.xPharm: The Comprehensive Pharmacology Reference[M].New York: Elsevier.1-5
|
Shah N S, He X, Khan H M, et al. 2013. Efficient removal of endosulfan from aqueous solution by UV-C/peroxides:A comparative study[J]. Journal of Hazardous Materials, 263: 584-592. DOI:10.1016/j.jhazmat.2013.10.019 |
Suarez S, Dodd M C, Omil F, et al. 2007. Kinetics of triclosan oxidation by aqueous ozone and consequent loss of antibacterial activity:Relevance to municipal wastewater ozonation[J]. Water Research, 41(12): 2481-2490. DOI:10.1016/j.watres.2007.02.049 |
Sun P, Yao H, Minakata D, et al. 2013. Acid-catalyzed transformation of ionophore veterinary antibiotics:reaction mechanism and product implications[J]. Environmental Science & Technology, 47(13): 6781-6789. |
Terracciano A, Christodoulatos C, Koutsospyros A, et al. 2018. Degradation of 3-nitro-1, 2, 4-trizole-5-one (NTO) in wastewater with UV/H2O2 oxidation[J]. Chemical Engineering Journal, 354: 481-491. DOI:10.1016/j.cej.2018.07.216 |
Tian F, Ma S, Xu B, et al. 2019. Photochemical degradation of iodate by UV/H2O2 process:Kinetics, parameters and enhanced formation of iodo-trihalomethanes during chloramination[J]. Chemosphere, 221: 292-300. DOI:10.1016/j.chemosphere.2019.01.014 |
Tran N H, Chen H, Do T V, et al. 2016. Simultaneous analysis of multiple classes of antimicrobials in environmental water samples using SPE coupled with UHPLC-ESI-MS/MS and isotope dilution[J]. Talanta, 159: 163-173. DOI:10.1016/j.talanta.2016.06.006 |
Tran N H, Chen H, Reinhard M, et al. 2016. Occurrence and removal of multiple classes of antibiotics and antimicrobial agents in biological wastewater treatment processes[J]. Water Research, 104: 461-472. DOI:10.1016/j.watres.2016.08.040 |
Zhang D, Hu S, Sun J, et al. 2019. Antibiotic consumption versus the prevalence of carbapenem-resistant Gram-negative bacteria at a tertiary hospital in China from 2011 to 2017[J]. Journal of Infection and Public Health, 12(2): 195-199. DOI:10.1016/j.jiph.2018.10.003 |
Zhou X, Liu D, Zhang Y, et al. 2018. Degradation mechanism and kinetic modeling for UV/peroxydisulfate treatment of penicillin antibiotics[J]. Chemical Engineering Journal, 341: 93-101. DOI:10.1016/j.cej.2018.01.137 |
 2019, Vol. 39
2019, Vol. 39


