2. 固体废物处理与资源化教育部重点实验室, 绵阳 621010;
3. 四川省非金属矿粉体改性与高质化利用技术工程实验室, 绵阳 621010
2. Key Laboratory of Solid Waste Treatment and Recycling, Ministry of Education, Mianyang 621010;
3. Sichuan Engineering Lab of Non-metallic Mineral Powder Modification and High-value Utilization(Southwest University of Science and Technology), Mianyang 621010
锑(Sb)目前已被广泛用于工业生产, 如阻燃剂、塑料中的催化剂、涂料中的颜料、玻璃器皿和陶瓷中的添加剂, 以及弹药和电池生产设备中的合金.锑的毒性与砷相似, 在淡水及土壤表层中主要以五价的形态存在, 对动植物和人体存在潜在的危害, 已被美国环保总局和欧盟巴塞尔公约定为优先考虑的污染物(王小明等, 2011).因此, 全面认识锑的环境地球化学行为十分必要.但与其同族元素砷比较而言, 人们对锑的环境迁移转化行为研究依然比较薄弱.目前的研究表明, 铁锰(氢)氧化物对锑的吸附作用可能是限制其地球化学循环的重要形式.其中, 水铁矿具有等电点高、比表面积大的特点, 在自然界中广泛存在, 是制约重金属等污染物在土壤和水环境中迁移和转化的重要物质(管宇立, 2018).朱惠文等(2018)通过静态批式试验研究表明, 水铁矿对钒的最大吸附量可达23.09 mg·g-1, 水铁矿中Fe—O位点是钒的主要吸附位点, 对钒离子具有较好的吸附效果.此外, 水铁矿也是环境中其他晶质铁(氨)氧化物形成的前驱体, 锑在其表面吸附后可能进入稳定的铁氧化物晶格, 从而使锑的迁移性降低.
实际在自然界中水铁矿常与有机质通过一定的作用力相结合形成水铁矿-有机物复合体, 并以此作为基本结构单元而影响着污染物质的迁移和转化.腐殖酸是自然界中广泛存在的大分子有机物质, 具有丰富的表面官能团, 可以和污染物形成络合物并抑制其迁移转化(王亚军等, 2012).前人研究证明, 水铁矿或有机质单纯体系对污染物的吸附能力与水铁矿-有机物复合体存在显著差异.例如, 闫金龙等(2016)研究表明, 单一水铁矿对磷的吸附能力与水铁矿-腐殖酸复合物相比更强.这是由于铁氧化物-腐殖酸复合物对磷的吸附中, 起决定性作用的依然是铁氧化物, 而非腐殖酸组分.腐殖酸通过占据铁氧化物表面的FeOH1/2-基团点位及静电排斥作用抑制磷酸盐的吸附.罗畅(2015)研究发现, 水铁矿、针铁矿、赤铁矿和腐殖酸的复合物与单一铁氧化物相比提高了对Hg2+的吸附速率.Hg2+可以通过腐殖酸逐渐进入水铁矿内部与官能团结合形成内层配合物, 与腐殖酸竞争吸附水铁矿的活性位点.尽管人们对水铁矿对锑的吸附行为已有部分研究, 但与有机质复合后的水铁矿对锑的滞留能力尚未见报道.基于此, 本文重点研究水铁矿和水铁矿-腐殖酸复合物对五价锑吸附性能差异, 主要考察不同时间、初始pH值、不同浓度、不同干扰离子等因素对吸附行为的影响, 并结合吸附动力学模型、吸附等温式模型及Zeta电位和红外光谱分析吸附机理.
2 材料与方法(Materials and methods) 2.1 试剂及仪器氢氧化钠、硝酸、六水氯化铁、氯化钾、焦锑酸钾、盐酸等均为分析纯;腐殖酸中黄腐酸含量大于90%, 有机碳含量为42.27%;实验用水为自制超纯水, 电阻率大于18.25 MΩ·cm.
样品物相由日本理学株式会社D/MAX-ⅢB型X射线衍射仪分析, 仪器参数和检测条件为:Cu靶, 衍射角10°~80°, 速度10°·min-1, 波长λ=1.5418 Å, 石墨弯晶单色器, 发散狭缝DS 1°, 接收狭缝RS 0.6 mm, 管电压40 kV, 管电流30 mA, 步进扫描(0.02°·步-1).样品的红外光谱由美国珀金埃尔默仪器有限公司Frontier型傅里叶变换中/远红外光谱仪经KBr压片法测试获得.Zeta电位通过英国马尔文公司Zetasizer Nano ZS90型电位仪分析.通过美国PE公司8300型电感耦合等离子体质谱仪测定吸附反应后锑的浓度.比表面积采用美国康塔Autosorb-1MP型分析仪测试获得.腐殖酸碳含量通过德国Elementar anal-ysensysteme GmbH公司vario Macro cube型元素分析仪测试获得.
2.2 样品制备准确称取2.5 g腐殖酸于烧杯中溶解完毕后, 用聚四氟乙烯容量瓶定容为250 mL, 配成10 g·L-1的腐殖酸溶液.
水铁矿由六水氯化铁原位水解制备.具体步骤为:在剧烈搅拌下用1 mol·L-1 NaOH调节200 mL 0.1 mol·L-1 FeCl3·6H2O溶液直至pH=7, 并在4000 r·min-1下离心1 min后倒掉上清液, 同样条件下用去离子水洗涤5次, 最后用真空冷冻干燥机将样品干燥, 磨细冷藏备用.
水铁矿与腐殖酸复合物制备:本实验设计了100、500、1500 mg·L-13个浓度, 分别代表低、中、高3种不同腐殖酸浓度的自然界环境.准确称取3份1 g水铁矿粉末加入到250 mL样品瓶中, 分别向其中加入2.5、12.5、37.5 g浓度为10 g·L-1的腐殖酸, 最后用去离子水使3种混合悬浮液定容到250 mL.为有利于水铁矿与腐殖酸稳定吸附复合(李光林, 2002), 用0.1 mol·L-1的HCl将混合悬浮液pH调节为4, 于20 ℃、150 r·min-1恒温摇床中振荡1 d, 最后将混合液离心、干燥.水铁矿和水铁矿与腐殖酸复合物在下文统称为FH、FH-HA复合物.
2.3 吸附方法本文通过批量试验研究了吸附时间、初始pH值、初始浓度、不同干扰离子等因素对水铁矿和腐殖酸复合物吸附Sb(Ⅴ)的影响, 具体实验方法如下:使用焦锑酸钾分别配制不同浓度、不同pH的Sb(Ⅴ)溶液, pH由HNO3或NaOH调整.称取0.01 g吸附剂于50 mL锥形瓶中, 并加入25 mL的锑溶液, 在20 ℃下以150 r·min-1的速率振荡一定时间后, 离心, 过0.45 μm的聚乙烯滤膜并稀释, 采用ICP-OES测定稀释后溶液中的Sb(Ⅴ)浓度, 计算不同条件下的吸附量.在干扰离子实验中, 分别加入(NH4)3PO4、(NH4)2CO3、(NH4)2SO4、NH4NO3、NH4Cl来提供阴离子PO43-、CO32-、SO42-、NO3-、Cl-作为干扰离子, 配制含有不同干扰离子且浓度为50 mg·L-1的Sb(Ⅴ)溶液, 采用离子浓度为0.1 mol·L-1的混合溶液.
3 FH及FH-HA复合物的表征(Characterization of FH and FH-HA complexes) 3.1 FH及FH-HA复合物的XRD分析为探究腐殖酸负载于水铁矿后其矿物结构是否发生变化, 首先对FH和FH-HA复合物进行了XRD分析, 结果见图 1.从图 1中可以发现, 所制得的FH及FH-HA复合物的XRD图谱相似, 均没有明显的尖锐峰, 仅在35°和62°处有两个d值分别为0.25 nm和0.15 nm的宽峰(王慧, 2015), 说明水铁矿吸附腐殖酸后未发生结晶转化, 并且对比JCPDS水铁矿标准卡片及衍射条数可以确定试验合成的矿物为典型的二线水铁矿.
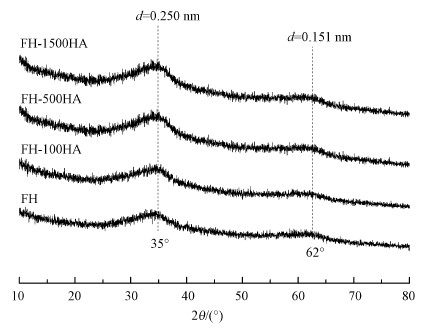 |
| 图 1 FH及FH-HA复合物的XRD分析 Fig. 1 XRD analysis of FH and FH-HA |
为进一步分析矿物表面特征官能团及结构的变化情况, 对FH和FH-HA复合物进行了红外光谱测定.FH及FH-HA复合物的FTIR分析结果见图 2.从图中可以发现, FH及FH-HA复合物在3200、1619 cm-1左右出现的吸收峰是—OH基团伸缩振动引起的(Shimizu et al., 2013), —OH是水铁矿最基本的官能团;在1488和1351 cm-1左右出现的吸收峰分别对应Fe—O和Fe—OH弯曲振动(徐轶群等, 2013), 结合已有文献可知, 在晶体结构中Fe—O键的断裂使羟基具有配位能力;FH-HA复合物在1615 cm-1左右为C=O与H键的结合、COO-中的C=O不对称伸缩振动;与此同时, FH-HA复合物和FH在466、572、1055 cm-1处均出现了水铁矿的特征吸收峰(王琦, 2012), 与文献报道一致.FH-HA复合物与FH相比, 其在1488 cm-1处的峰强度减弱, 峰型变宽, 这可能是水铁矿与腐殖酸结合造成的.魏世勇等(2009)研究指出, 水铁矿能与带负电的腐殖酸中的酸性官能团发生配位反应, 将腐殖酸吸附在水铁矿表面, 此时脱水的铁氧化物更易于和其他矿物发生反应.通过XRD和红外光谱分析可知, 腐殖酸参与水铁矿的合成, 其实质是腐殖酸负载在水铁矿表面, 有机质与水铁矿结合后并没有改变水铁矿的晶型结构.
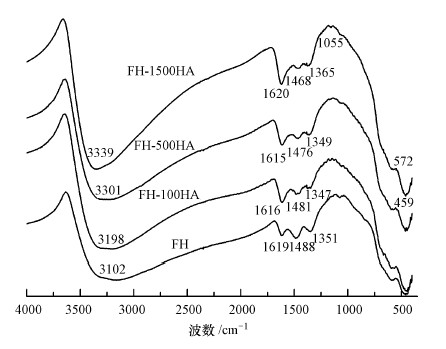 |
| 图 2 FH及FH-HA复合物的FTIR分析 Fig. 2 FTIR analysis of FH and FH-HA |
本文以0.1 mol·L-1的KCl为电解质, 采用硝酸和氢氧化钠调节悬浮液的pH, 在固液比为2.5 g·L-1的条件下测定FH或FH-HA复合物在pH=2~11范围内的表面电性, 结果如图 3所示.从图 3中可以看出, 水铁矿负载腐殖酸后, 其Zeta电位显著减小, 水铁矿的零电点(PZC)从7.2前移到3.0附近.随着腐殖酸负载量增大零电点降低越明显, 这是由包覆在水铁矿表面的腐殖酸酸性官能团电离引起的, 这与Liu等(2018)在多羟基富勒烯与水铁矿吸附和聚集的相互作用中所描述的相一致.
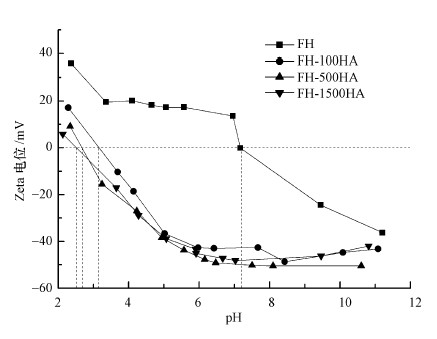 |
| 图 3 FH及FH-HA复合物的Zeta电位分析 Fig. 3 Zeta potential analysis of FH and FH-HA |
由于吸附剂的比表面积大小是影响吸附的重要因素, 故对FH和FH-HA复合物进行了比表面积的测定, 结果见图 4.由图 4可知, 水铁矿的比表面积高达275.97 m2·g-1, 但其吸附腐殖酸后的比表面积有所减小, 且随着腐殖酸吸附量增加比表面积逐渐降低.复合物比表面积减小的原因可能有以下两个方面:①水铁矿表面存在孔隙, 在吸附腐殖酸的过程中将水铁矿的孔隙填充, 从而降低了比表面积;②水铁矿在吸附腐殖酸达到饱和时, 腐殖酸会在水铁矿表面产生沉淀, 影响对氮气的吸附(Eusterhues et al., 2008).
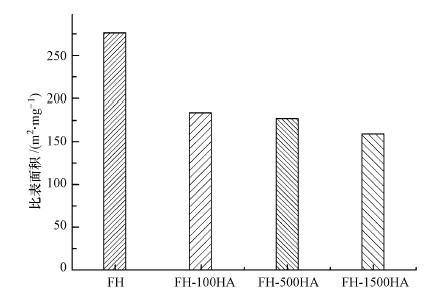 |
| 图 4 FH及FH-HA复合物的比表面积分析 Fig. 4 The specific surface area analysis of FH and FH-HA |
在pH=7, 锑初始浓度为50 mg·L-1, 温度为20 ℃, 吸附时间分别为0.25、0.5、1、2、3、8、24、36、48 h条件下研究吸附时间对FH和FH-HA复合物吸附Sb(Ⅴ)的影响, 结果如图 5所示.从图中可以看出, 在0~3 h范围内, FH及FH-HA复合物对Sb(Ⅴ)的吸附量迅速增加, 这是因为此时高能吸附位点丰富且优先与Sb(Ⅴ)反应.此后, FH及FH-HA复合物对Sb(Ⅴ)的吸附主要依靠低能量吸附位点(Li et al., 2012), 故吸附量增加缓慢.在24 h左右, FH及FH-HA复合物对Sb(Ⅴ)的吸附基本达到平衡.为了揭示吸附过程的基本机制, 分别采用Elovich模型(式(1))、伪一级动力学模型(式(2))和伪二级动力学模型(式(3))对吸附平衡曲线进行拟合.Elovich方程用于描述溶质在溶剂中的非均匀扩散过程, 适用于反应过程中活化能较大的过程(孙小莉等, 2009);伪一级动力学方程用于描述吸附外部液膜扩散过程;伪二级动力学方程表明吸附过程为化学吸附, 并且吸附过程中涉及吸附剂与吸附质之间的电子共用或者电子转移(冯素萍等, 2009).拟合结果如表 1所示.
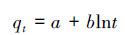
|
(1) |
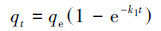
|
(2) |
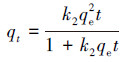
|
(3) |
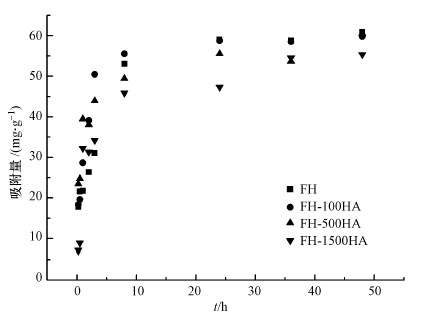 |
| 图 5 吸附时间对FH及FH-HA复合物吸附Sb(Ⅴ)的影响 Fig. 5 Effect of adsorption time on Sb(Ⅴ) adsorption by FH and FH-HA |
| 表 1 FH及FH-HA复合物吸附Sb(Ⅴ)的动力学模型拟合 Table 1 Kinetic model fitting for Sb(Ⅴ) adsorption by FH and FH-HA |
式中, qe为平衡状态下的吸附量(mg·g-1);qt为t时刻的吸附量(mg·g-1);k1、k2为吸附速率平衡常数;a和b为常数.
从表 1可以看出, 3种吸附动力模型相比较, Elovich模型的可决系数较好, 表明FH和FH-HA复合物对Sb(Ⅴ)的吸附为非均相扩散过程.伪二级动力学的拟合度最高, 表明FH和FH-HA复合物对Sb(Ⅴ)的吸附是以化学吸附为主, 吸附过程中有化学键的形成, 这是由于水铁矿和腐殖酸具有吸附性能、配位能力相对较高的表面活性, 因此, FH和FH-HA复合物对Sb(Ⅴ)的吸附更符合伪二级吸附动力学模型.吴志坚等(2010)研究发现, 当吸附质与吸附剂反应形成化学键或者配位共价键时, 吸附质与吸附剂的功能基团一般形成了内层表面络合物.由此可以推断FH和FH-HA复合物与Sb(Ⅴ)反应形成内层表面络合物.此外, 根据伪二级动力学计算得出的平衡吸附量可知, 负载在水铁矿表面的腐殖酸浓度越大, 水铁矿对Sb(Ⅴ)的吸附能力越弱.
4.2 pH对FH及FH-HA复合物吸附Sb(Ⅴ)的影响在温度20 ℃, Sb(Ⅴ)浓度为50 mg·L-1, pH分别为2、4、6、8、10、12的条件下研究不同pH对FH和FH-HA复合物吸附Sb(Ⅴ)的影响, 结果如图 6所示.随着pH的增大, FH与FH-HA复合物对Sb(Ⅴ)的吸附量不断减小, 这与Qi等(2017)的报道结果一致.当腐殖酸负载在水铁矿表面后, 使得复合物的零电点降低, 复合物表面负电荷增多.在pH较低时, FH及FH-HA复合物表面带正电, 此时对Sb(Ⅴ)的静电吸附能力强, FH及FH-HA复合物与Sb(Ⅴ)发生较强的配位交换吸附和静电吸附.随着pH增大, FH及FH-HA复合物表面去质子化作用增强, 表面负电荷增加, 此时吸附同为带负电荷的Sb(Ⅴ)时, 其静电排斥能增加, 对Sb(Ⅴ)的吸附逐渐减弱.
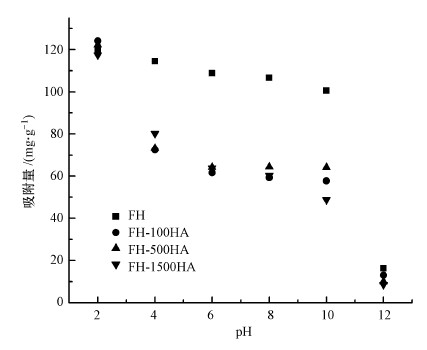 |
| 图 6 pH对FH及FH-HA复合物吸附效果的影响s Fig. 6 Effect of pH on Sb(Ⅴ) adsorption by FH and FH-HA |
在pH=7, 温度为20 ℃, Sb(Ⅴ)初始浓度分别为1、5、10、20、50、80、100 mg·L-1的条件下研究了FH及FH-HA复合物吸附Sb(Ⅴ)的影响, 结果如图 7所示.FH对Sb(Ⅴ)的吸附量高于FH-HA复合物, 说明水铁矿对吸附的贡献更大.当初始浓度为1~100 mg·L-1时, Sb(Ⅴ)的吸附量随Sb(Ⅴ)浓度的升高而逐渐平稳.这种现象是由于Sb(Ⅴ)浓度较低时, 此时吸附位点比较充足, 因此, Sb(Ⅴ)的吸附速率较高, 而当Sb(Ⅴ)初始浓度过高时, FH-HA复合物吸附量虽然不断上升, 但速度比较缓慢, 可能是吸附位点逐渐达到饱和, 或者FH-HA复合物与Sb(Ⅴ)形成了稳定的配合物.
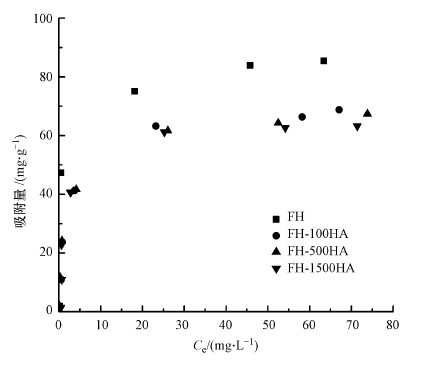 |
| 图 7 不同Sb(Ⅴ)浓度对FH及FH-HA复合物吸附效果影响 Fig. 7 Effect of the initial concentration of Sb(Ⅴ) on Sb(Ⅴ) adsorption by FH and FH-HA |
吸附模型是用来描述吸附过程的重要工具, 通过吸附模型可知吸附剂对吸附质的最大吸附量.在描述固相和液相中的浓度关系时常用的吸附等温式有以下两种, 即Langmuir模型(式(4))和Freundlich模型(式(5)).Langmuir模型用作描述单分子层吸附, 即每个吸附位点只吸附一个分子.Freundlich模型则用于多分子层非均一表面吸附, 它是一个经验公式.FH及FH-HA复合物对Sb(Ⅴ)的等温吸附拟合结果见图 8和表 2.
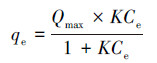
|
(4) |
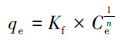
|
(5) |
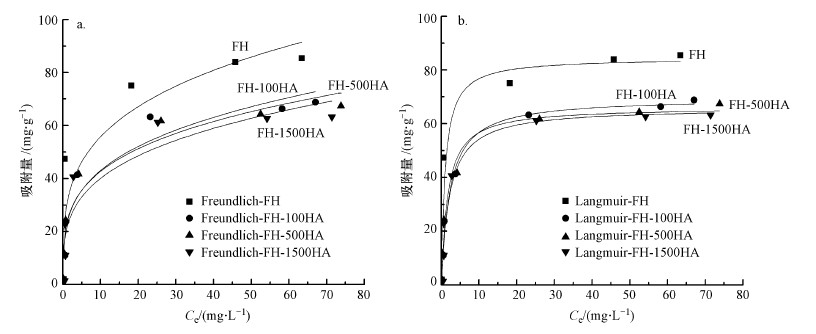 |
| 图 8 FH及FH-HA复合物吸附Sb(Ⅴ)的Freundlich(a)和Langmuir(b)吸附等温线 Fig. 8 FH and FH-HA adsorbed Sb(Ⅴ) Freundlich (a) and Langmuir (b) adsorption isotherms |
| 表 2 FH及FH-HA复合物吸附Sb(Ⅴ)的Langmuir和Freundlich模型拟合结果 Table 2 Langmuir and Freundlich model fitting results of Sb(Ⅴ) adsorption by FH and FH-HA |
式中, qe为Sb(Ⅴ)在吸附剂的吸附量(mg·g-1);Qmax为Sb(Ⅴ)在吸附剂的饱和吸附量(mg·g-1);K为Languir平衡常数;Kf为Freundlich平衡常数;Ce为平衡溶液中Sb(Ⅴ)浓度(mg·g-1);n为经验系数.
由图 8和表 2可知, FH及FH-HA复合物对Sb(Ⅴ)的吸附更符合Langmuir模型, 拟合系数均大于同温下Freundlich模型的拟合系数, 且复合物的拟合系数大于水铁矿, 说明FH-HA复合物对Sb(Ⅴ)的吸附属于单分子层吸附.此外, FH对Sb(Ⅴ)的吸附能力大于FH-HA复合物, 且复合物对Sb(Ⅴ)的吸附量随腐殖酸浓度的增大而减小.
4.4 溶液中共存离子对FH和FH-HA复合物吸附Sb(Ⅴ)的影响在自然环境中, 通常会含PO43-、CO32-、NO3-、Cl-等共存阴离子, 这些阴离子的存在可能会影响FH及FH-HA复合物对Sb(Ⅴ)的滞留能力.因此, 本实验在溶液体积为25 mL, Sb(Ⅴ)初始浓度为50 mg·L-1, 反应温度为20 ℃, 振荡速度为150 r·min-1的条件下考察了PO43-、CO32-、NO3-、Cl-等阴离子与Sb(Ⅴ)共存时, 对FH和FH-HA复合物吸附Sb(Ⅴ)的影响, 结果如图 9所示.
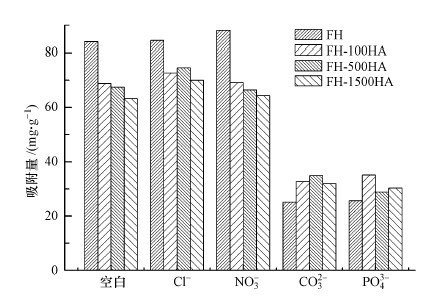 |
| 图 9 共存阴离子对FH及FH-HA复合物吸附Sb(Ⅴ)的影响 Fig. 9 Effect of coexisting anions on Sb(Ⅴ) adsorption by FH and FH-HA |
由图 9可知, 不同阴离子对FH和FH-HA复合物吸附Sb(Ⅴ)的影响不同, 其中, NO3-、Cl-对FH和FH-HA复合物吸附Sb(Ⅴ)的影响较小, 而PO43-、CO32-对FH和FH-HA复合物吸附Sb(Ⅴ)有较强的抑制作用.这可能是由于高价阴离子PO43-、CO32-更能有效阻止Sb(Ⅴ)与水铁矿表面的接触.阴离子带电荷数越大, 吸附到水铁矿及复合物表面时, 会增强表面的负电性, 从而对同为负电的Sb(Ⅴ)的排斥力增强, 吸附量减小.而CO32-虽然电荷数为2, 但其半径较Sb(Ⅴ)小, 与Sb(Ⅴ)相比更容易进入表面孔隙中, 从而对Sb(Ⅴ)产生排斥.此外, 也可能是由于PO43-能够以稳定的双齿络合物吸附在水铁矿表面, 从而抑制了Sb(Ⅴ)在FH和FH-HA复合物上的吸附, 这与Mustafa等(2004)对水铁矿吸附磷酸盐的研究相似.
5 结论(Conclusions)1) 腐殖酸的加入未改变水铁矿的晶型结构.由于腐殖酸包覆在水铁矿的表面, 使复合物带有羧基、羰基等官能团, 从而降低了FH-HA复合物的零电点, 并显著降低了复合物的比表面积.由此可知, 自然环境下的FH和FH-HA复合物性质差异显著.
2) 水铁矿及其与腐殖酸复合体对Sb(Ⅴ)的吸附试验表明, 随着pH的上升, 吸附剂的去质子化能力增强, 对Sb(Ⅴ)的吸附量减小;动力学模型拟合中, 伪二级动力模型对吸附的拟合效果最好, 表明FH和FH-HA复合物与Sb(Ⅴ)的吸附过程中以化学吸附为主, 形成了化学键, 且FH和FH-HA复合物与Sb(Ⅴ)反应形成内层表面络合物.在吸附等温线中FH和FH-HA复合物对于Sb(Ⅴ)的吸附可用单分子层吸附的Langmuir模型进行描述.溶液共存阴离子PO43-、CO32-会抑制FH和FH-HA复合物对Sb(Ⅴ)的吸附.
3) 腐殖酸负载在水铁矿表面对Sb(Ⅴ)的吸附影响表现为:腐殖酸因占据水铁矿的活性位点及腐殖酸的静电排斥作用, 从而抑制水铁矿对Sb(Ⅴ)的吸附, 并且随着腐殖酸含量的增加, 抑制作用增强.
Eusterhues K, Wagner F E, Hausler W, et al. 2008. Characterization of ferrihydrite-soil organic matter coprecipitates by X-ray diffraction and mossbauer spectroscopy[J]. Environmental Science & Technology, 42(21): 7891-7897. |
冯素萍, 沈永, 裘娜. 2009. 腐殖酸对束的吸附特征及动力学研究[J]. 离子交换与吸附, 25(2): 121-129. |
管宇立.2018.水铁矿及其与腐植酸共沉物对水溶液中镉的吸附作用研究[D].兰州: 兰州大学 http://cdmd.cnki.com.cn/Article/CDMD-10730-1018979968.htm
|
李光林.2002.腐殖酸与几种金属离子的相互作用及影响因素研究[D].重庆: 西南农业大学 http://cdmd.cnki.com.cn/article/cdmd-10625-2003071235.htm
|
Liu J, Zhu R L, Xu T Y, et al. 2018. Interaction of polyhydroxy fullerenes with ferrihydrite:adsor-ption and aggregation[J]. Journal of Environmental Sciences, 64(2): 1-9. |
Li X M, Liu T X, Li F B, et al. 2012. Reduction of structural Fe(Ⅲ) in oxyhydroxides by Shewanella decolorationis S12 and characterization of the surface properties of iron minerals[J]. Journal of Soils and Sediments, 12(2): 217-227. DOI:10.1007/s11368-011-0433-5 |
罗畅.2015.铁氧化物吸持腐殖酸对AsO43-、Hg2+次级吸附行为的影响研究[D].重庆: 西南大学 http://cdmd.cnki.com.cn/Article/CDMD-10635-1016703189.htm
|
Mustafa S, Nawab G, Nahem A, et al. 2004. Temperature effect on phosphate sorption by iron hydroxide[J]. Environmental Technology, 25(1): 1-6. DOI:10.1080/09593330409355432b |
Qi P, Pichler T. 2017. Competitive adsorption of As(Ⅲ), As(Ⅴ), Sb(Ⅲ) and Sb(Ⅴ) onto ferrihydrite in multi-component systems:Implications for mobility and distribution[J]. Journal of Hazardous Materials, 330: 142-147. DOI:10.1016/j.jhazmat.2017.02.016 |
Shimizu M, Zhou J D, SchrÄoder C, et al. 2013. Dissimilatory reduction and transfor-mation of ferrihydrite-humic acid coprecipitates[J]. Environmental Science& Technology, 47: 13375-13384. |
孙小莉, 曾庆轩, 冯长根, 等. 2009. 多胺型阴离子交换纤维吸附Cr(Ⅵ)的热力学[J]. 功能材料, 40(10): 1734-1737. DOI:10.3321/j.issn:1001-9731.2009.10.042 |
王慧.2015.铁氧化物及其胡敏酸复合体对磷酸盐的吸附研究[D].武汉: 华中农业大学 http://cdmd.cnki.com.cn/Article/CDMD-10504-1015387493.htm
|
王琦.2012.土壤腐殖酸对氧化铁形成转化的影响[D].武汉: 华中农业大学 http://cdmd.cnki.com.cn/Article/CDMD-10504-1012457990.htm
|
王小明, 杨凯光, 孙世发, 等. 2011. 水铁矿的结构、组成及环境地球化学行为[J]. 地学前缘, 18(2): 339-347. |
王亚军, 马军. 2012. 水体环境中天然有机质腐殖酸研究进展[J]. 生态环境学报, 21(6): 1155-1165. |
魏世勇, 谭文峰, 刘凡. 2009. 土壤腐殖质—矿物质交互作用的机制及研究进展[J]. 中国土壤与料, (1): 6. |
吴志坚, 刘海宁, 张慧芳. 2010. 离子强度对吸附影响机理的研究进展[J]. 环境化学, 29(6): 997-1003. |
徐轶群, 杨明, 何成达, 等. 2013. 铁的氢氧化合物稳定相α, β-FeOOH的表征及光谱分析[J]. 光谱学与光谱分析, 33(12): 3330-3333. DOI:10.3964/j.issn.1000-0593(2013)12-3330-04 |
闫金龙.2016.铁氧化物-有机质复合物对磷的吸附与形态调控效应研究[D].重庆: 西南大学 http://cdmd.cnki.com.cn/Article/CDMD-10635-1016909013.htm
|
朱惠文, 肖细元, 李万超, 等. 2018. 人工合成水铁矿对钒(Ⅴ)的吸附特征[J]. 矿冶工程, 38(6): 97-101. DOI:10.3969/j.issn.0253-6099.2018.06.022 |
 2019, Vol. 39
2019, Vol. 39


