2. 广州大学环境科学与工程学院, 广州 510006;
3. 广州大学珠江三角洲水质安全与保护教育部重点实验室, 广州 510006
2. School of Environmental Science and Engineering, Guangzhou University, Guangzhou 510006;
3. Key Laboratory for Water Quality and Conservation of the Pearl River Delta, Ministry of Education, Guangzhou University, Guangzhou 510006
垃圾渗滤液被公认为是一种严重的污染物(Øygard et al., 2004;Mjk et al., 2010), 其水质成分复杂, 含有大量氨氮、有机物和重金属等污染物质, 其中氨氮浓度较高, 晚期垃圾渗滤液中的氨氮浓度甚至高达4000~6000 mg·L-1.重金属污染物具有难降解、易积累、毒性大的特点, 且有极强的生物毒性, 一直是环境保护和科学研究的重点(Ikem et al., 2003).Øygard等(2004)对挪威西部4个卫生填埋场沉积物和渗滤液中重金属进行评估时发现, 在其研究的金属中, Fe的浸出量最大, 最高达到(180±53) mg·L-1.Kjeldsen等(2013)对垃圾渗滤液中的成分进行归纳得出, Fe含量在3~5500 mg·L-1之间.李丹等(2013)在对堆肥过程渗滤液回流的环境风险进行评估时发现, 渗滤液中浓度最高的金属为Fe, 其在渗滤液中的浓度可达到5.12~207.8 mg·L-1.综上可知, 垃圾渗滤液中含有高浓度的氨和铁, 如果能够利用Fe3+将垃圾渗滤液中的氨氮氧化去除到一定浓度将具有十分重要的意义.
研究厌氧条件下Fe3+通过微生物作用将氨氮氧化, 同时将Fe3+还原为Fe2+的微生物过程称为铁还原氨氧化反应(Feammox)(Sawayama et al., 2006).近年来, 在森林湿地、水稻土、潮间带湿地土壤和河岸带等很多系统中证实了Feammox现象的存在(Ding et al., 2014;Huang et al., 2015;Li et al., 2015;Ding et al., 2017).这一理论的发现给生物脱氮带来了新思路, 同时也为人们深入理解铁循环及其环境效应提供了新的方向.李祥等(2014;2016;2018)在ANAMMOX体系中投加Fe3+, 使得体系中过量的氨被转化(NO2--N:NH4+-N=1.17), 同时在活性污泥和ANAMMOX体系中证实了Feammox的可行性.Gilson等(2015)的研究结果显示, Acidimicrobiaceae A6能将U(Ⅵ)还原的同时将NH4+氧化, 当进水U(Ⅵ)的浓度达到100 μmol·L-1时, 该菌株才完全受抑制.吴胤等(2017)发现, 在含有多种高浓度重金属的大宝山矿区土壤中存在Feammox菌落, 推测Feammox菌落应该具有较高的重金属耐受性.铁还原菌主要有地杆菌(Geobacter spp.)(Holmes et al., 2010)、希瓦氏菌(Shewanella spp.)(Wang et al., 2008), 这些菌种具有多种胞外呼吸能力, 在重金属和有机污染物迁移转化过程中发挥着重要作用, 可将高价有毒的重金属还原为低价无毒或低毒状态, 同时将部分有机污染物降解(马晨等, 2011).厌氧氨氧化启动周期漫长, 且菌种对控制条件要求苛刻.研究发现, 垃圾渗滤液水质营养比例失调, 亚硝态氮含量极低且含有大量重金属, 对厌氧氨氧化这一生化过程有着极大的限制(Wang et al., 2017).而渗滤液的水质情况及氨氮和铁含量符合厌氧铁氨氧化菌的代谢特性, 同时该反应可以将氨氮氧化为亚硝态氮(Clément et al., 2005;Sawayama et al., 2006;Huang et al., 2015)并为厌氧氨氧化提供所需的基质, Fe3+还原为Fe2+, Fe2+可以还原高价态的重金属使其稳定化(Kumiene et al., 2008;王旌等, 2010)或在氧气作用下被氧化为Fe3+, Fe3+以循环的方式再次作为厌氧铁氨氧化的电子受体.到目前为止, 以垃圾渗滤液为处理对象的Feammox的研究尚未见报道.
为此, 本文通过接种长期处理垃圾渗滤液的ANAMMOX污泥启动Feammox系统, 同时以不同进水氨氮和铁浓度来模拟垃圾渗滤液实际情况并探究不同氨氮和铁浓度对Feammox反应的影响, 并对铁还原氨氧化的机理进行初步探讨.
2 材料与方法(Materials and methods) 2.1 Feammox菌种富集试验装置采用ASBR反应器, 具体如图 1所示.ASBR反应器由有机玻璃制成, 有效容积3 L, 反应器侧壁每个单位高程有一取样口, 以方便水样采集.反应器设置有自动进出水和搅拌系统及实时在线监测pH和溶解氧系统, 同时配备氮气以保证反应器中处于无溶解氧状态.装置运行条件:温度维持在15~30 ℃, 转速为150 r·min-1, 水力停留时间为1 d, 进水pH控制在7.4~7.6之间, 通过0.3 mol·L-1盐酸调节.一个周期出水体积为1 L, 进水用高纯氮曝气30 min去除溶解氧.
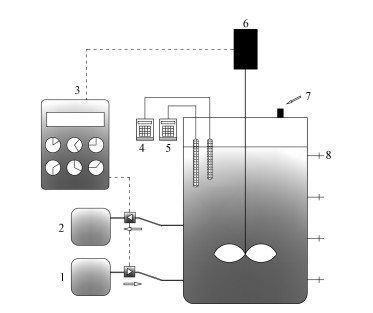 |
| 图 1 ASBR反应器示意图 (1.进水蠕动泵;2.出水蠕动泵;3.自控系统;4.pH计;5.溶解氧仪;6.搅拌电机;7.排气孔;8.取样口) Fig. 1 Schematic diagram of ASBR reactor |
富集培养接种污泥为处理老龄垃圾渗滤液的厌氧氨氧化污泥, 污泥浓度为5260 mg·L-1.试验废水采用低浓度模拟废水, 模拟废水主要成分为:NH4Cl(NH4+-N 50 mg·L-1)、FeCl3(0~34 d进水Fe3+浓度为12 mg·L-1, 35~88 d进水Fe3+浓度提升为24 mg·L-1)、NaHCO3 500 mg·L-1, KH2PO4 43 mg·L-1, CaCl2·2H2O 175 mg·L-1, MgSO4·7H2O.微量元素(Star et al., 2007)浓缩液成分为:EDTA 7500 mg·L-1, ZnSO4·7H2O 640 mg·L-1, CoCl2·6H2O 360 mg·L-1, MnCl2·4H2O 490 mg·L-1, CuSO4·5H2O 125 mg·L-1, Na2MoO4·2H2O 330 mg·L-1, NiCl2·6H2O 280 mg·L-1, NaSeO4·10H2O 310 mg·L-1, H3BO4 14 mg·L-1, 微量元素投加量为0.5 mL·L-1.
2.3 NH4+-N浓度及Fe3+浓度对Feammox的影响通过设置不同浓度氨氮和铁离子浓度来模拟垃圾渗滤液实际情况, 老龄垃圾渗滤液水质(渗滤液来自深圳市某垃圾填埋场)如表 1所示.
| 表 1 老龄垃圾渗滤液水质 Table 1 Old garbage leachate water quality |
试验装置采用经高温灭菌的500 mL西林瓶, 硅胶塞与螺旋盖密封瓶口.参考表 1的老龄垃圾渗滤液水质, 试验分别设置了100、200、400 mg·L-1 NH4+-N和50、200、500 mg·L-1 Fe3+的模拟废水, 模拟水质组成如表 2所示.接种污泥为驯化后的Feammox污泥, MLVSS/MLSS为0.62.模拟废水加入到西林瓶至500 mL, 经高纯氮气曝气30 min以除去溶解氧.每组试验都设置空白对照组, 分别放入恒温气浴箱中, 温度控制为30 ℃, 转速为150 r·min-1.
| 表 2 封闭条件下模拟实际渗滤液水质组成 Table 2 Simulating the actual leachate water quality composition under closed conditions |
各项指标测定方法均参照《水和废水监测分析方法》(第9版)(国家环保总局, 2002), 具体分析项目及方法见表 3.
| 表 3 分析项目和方法 Table 3 Analytical items and methods |
为了得到污泥微观表面的情况, 采用扫描电镜(SEM)进行拍照.首先将污泥样品低速离心, 弃上清液, 污泥样品用PBS缓冲液清洗3次.在样品沉淀中加入5 mL戊二醛, 置于4 ℃冰箱中固定4 h, 并用0.1 mol·L-1 (pH=8.0)的磷酸缓冲液清洗3次, 每次10 min.然后分别用浓度为30%、50%、70%、90%的乙醇进行脱水, 每次10~15 min, 再用100%的乙醇脱水3次, 每次10~15 min.之后加入100%乙醇:乙酸异戊酯=1:1及纯乙酸异戊酯各一次, 每次15 min.最后用冷冻真空干燥机对样品进行干燥, 并使用扫描电镜观察其微观结构.
3 结果与讨论(Results and discussion) 3.1 Feammox系统的长期驯化 3.1.1 Feammox驯化过程中的氮素变化Feammox驯化试验保持进水NH4+-N浓度50 mg·L-1不变, 在常温无溶解氧状态下, pH控制在7.4~7.6之间, 长期运行结果如图 2a所示.以进水NH4+-N浓度变化将整个运行时间分为2个阶段:驯化阶段(0~54 d)和富集培养阶段(55~86 d).驯化阶段初期(0~8 d)出水NH4+-N浓度远低于进水, 这是由于反应器中接种的是厌氧氨氧化菌种, 产生的NO2--N可立即被消耗掉(Li et al., 2018), 同时产生少量NO3--N.随着运行时间的增加, NH4+-N浓度逐渐上升, 主要是因为该阶段以NH4+-N和Fe3+为营养物质富集培养Feammox菌种, 接种污泥中部分厌氧氨氧化菌因缺少营养物质而使菌体自溶, 导致体系中出水NH4+-N浓度升高(李祥等, 2016).第9~54 d时, 出水NH4+-N浓度在40 mg·L-1上下波动, 出水NO3--N浓度从第26 d开始逐渐升高.此时体系中存在Feammox反应, 由于每周期都对反应器进行除氧, 体系中处于无溶解状态, 因此, 可以排除硝化反应生成NO3--N.
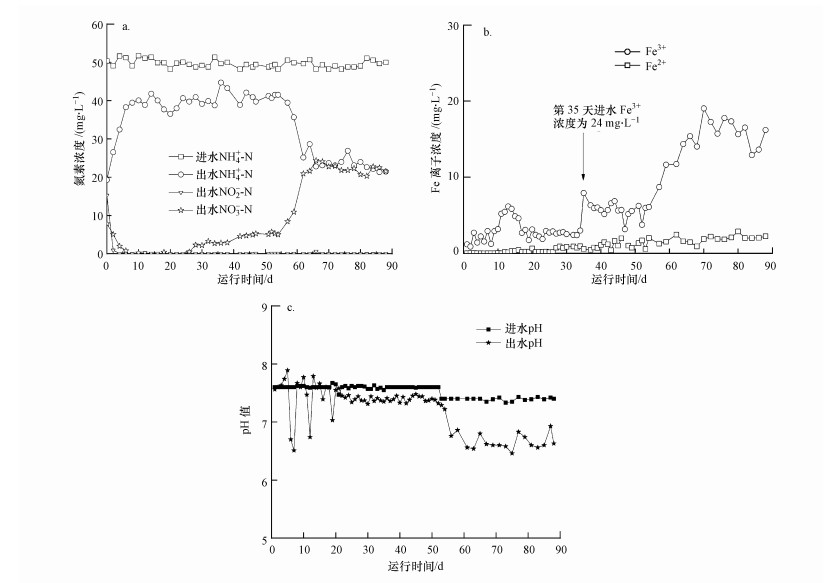 |
| 图 2 反应器长期运行出水氮素转化(a)、铁元素(b)和pH变化(c) Fig. 2 Long-term operation of the reactor water nitrogen conversion(a), conversion of iron(b) and pH change(c) |
第55~66 d时, 出水NH4+-N浓度下降至22 mg·L-1, NH4+-N转化率达到52.73%.在66 d时, 出水NO3--N浓度达到最高浓度24.35 mg·L-1.第67~86 d时, 出水NO3--N浓度有小幅下降趋势.随着反应器运行时间的增加, 反应器去除NH4+-N的能力逐渐提高.反应器运行的整个过程出水NO2--N浓度一直处于很低状态, 低于1.2 mg·L-1.试验在厌氧条件下, NH4+-N的主要转化产物为NO3--N.该部分结果与Li等(2018)和吴胤等(2017)的研究结论一致.
反应器运行0、32、61和88 d时分别提取一定量污泥并提取DNA, 进行定量PCR实验和高通量测序, 实验结果见附录中的附图 S1和S2.由图可知, 经过88 d的驯化厌氧氨氧化菌的基因拷贝数没有太大变化, AOB、NOB和反硝化菌的基因拷贝数出现小幅下降趋势, 说明系统中生成的硝酸盐氮既不是硝化过程也不是厌氧氨氧化过程产生.文献报道, 厌氧铁氨氧化过程与放线菌门(Actinobacteria)有直接关系, 附图 S2数据表明, 厌氧铁氨氧化系统中0~88 d放线菌门得到了富集, 第61 d和88 d的占比明显高于未驯化时放线菌门的占比.吴胤等(2017)在研究Feammox过程中发现, 反应器运行到第90 d时放线菌门由30 d时的2个克隆子(2个OUT)增加到5个克隆子(2个OTU).Huang等(2015)利用454焦磷酸测序证实, 培养180 d后放线菌门、酸杆菌门和β-变形菌门明显增长, 其中, 放线菌数量增加最多.通过以上分子生物学分析进一步说明厌氧铁氨氧化驯化成功.
 |
| 图 附图 1 不同时段菌种DNA基因拷贝数(以DNA计)比较 Fig. 附图 1 Comparison of DNA gene copy numbers of strains in different time periods |
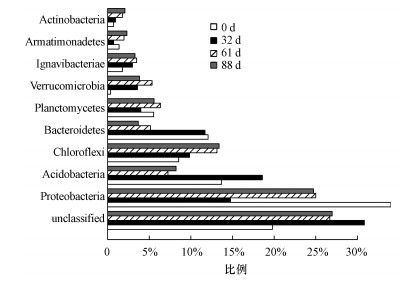 |
| 图 附图 2 分类水平为门时微生物群落结构 Fig. 附图 2 Microbial community structure at the level of phylum |
从能量角度分析得出, Fe3+和NH4+在微生物作用下更容易生成N2.Yang等(2012)研究表明, Feammox在热带高地土壤可以产生N2、NO2--N或NO3--N, 直接产生N2是Feammox主要的途径, 其脱氮速率与硝化反硝化相当.Clément等(2005)认为是Feammox驱动森林河岸沉积物中NH4+-N氧化为NO2--N并产生Fe2+.试验接种污泥为厌氧氨氧化污泥, 因此, 产生的NO2--N立即被厌氧氨氧化菌利用并部分转化为NO3--N, 同时产生少量N2(Park et al., 2009;Li et al., 2018).Yang等(2012)指出, 在不同的控制条件下所生成的产物亦不相同.本试验厌氧铁氨氧化驯化阶段的产物为NO3--N, 与文献结论相符.
3.1.2 Feammox驯化过程中的铁浓度及pH变化反应器在0~34 d时进水Fe3+浓度为12 mg·L-1, 第35~88 d时进水Fe3+浓度提升为24 mg·L-1.出水Fe3+和Fe2+浓度变化如图 2b所示, 初始阶段Fe2+在水相中的浓度很低, 基本检测不到, 第12 d以后出水Fe2+浓度呈递增趋势, 最高浓度达到2.87 mg·L-1, 说明此时反应器中发生了Feammox反应.出水Fe3+浓度一直低于进水浓度, 0~13 d时出水Fe3+浓度从1.17 mg·L-1上升到6.15 mg·L-1;第20~34 d, 出水Fe3+浓度处于平稳状态;第35 d, 将反应器进水Fe3+浓度提升至24 mg·L-1, 此时出水Fe3+浓度随着运行周期的增加略有下降;52 d以后出水Fe3+浓度逐渐升高, 此时对应出水pH大幅下降, 低pH条件下Fe3+溶出更多, 出水Fe3+浓度逐渐升高.
铁是微生物生长的微量元素之一, 参与了很多微生物代谢过程(Burgess et al., 1999).铁在天然环境中多以不溶态Fe3+氧化物的形式存在, 但在厌氧环境中微生物驱动的Fe3+还原是可以发生的(Ding et al., 2015).试验出水中Fe3+浓度远低于进水, 推测在中性条件下有大量的Fe3+沉淀或者被吸附在污泥中.Fe(OH)3溶度积(Ksp)为2.64×10-39, 在中性条件下(pH=6.5~7.6)Fe3+会产生部分沉淀.而当出水pH降低时, 出水Fe3+浓度也随之上升, 这是由于沉淀或者吸附的Fe3+溶出的原因.对比此时氮素的转化, 氨氮的去除负荷有所上升, 推测氨氮的氧化是以游离态Fe3+为电子受体在微生物作用下被氧化为NO2--N或者直接氧化为NO3--N.
反应器出水pH值变化如图 2c所示.由图可知, 0~52 d时反应器进水pH在7.60左右, 第53~88 d进水pH调整为7.40左右.整体出水pH比进水低, 且随着NH4+-N转化量的增大, pH下降得越多.这同李祥等(2016)和Park等(2009)探究活性污泥铁还原氨氧化现象时的结果一致.
3.1.3 污泥表面形态表征图 3所示为污泥在第0 d和88 d时的微观形态特征.从接种ANAMMOX污泥的初始状态(0 d)可以看到, 污泥表面镶嵌着球状菌簇, 同时还存在少量丝状菌, 起到骨架作用, 将厌氧氨氧化菌连接在一起, 形成紧凑的簇(Tao et al., 2011), 污泥表面未见到针状及块状沉积物(图 3a).从第88 d污泥样品的扫描电镜可以看出, 有珊瑚状沉积物附着在污泥表面(图 3b).由于Fe3+在中性pH环境中很容易立即与水反应生成低溶解态的矿物并覆盖在细胞表面.表面的无定型氧化物过量时会阻碍微生物的传质, 进而阻碍细胞的营养吸收和代谢(陈鹏程, 2016;苏润华等, 2018).污泥表面有部分凹陷破碎的菌体细胞, 这可能与沉积物过量有关, 挤压剪切会导致细胞破碎.这些沉积物可能是纳米级的Fe氧化物, 其在细菌表面的吸附可能堵塞细胞膜运输通道, 破坏细胞膜通透性, 磨损细胞壁成分(李梅, 2012).
 |
| 图 3 不同进水基质浓度条件下的污泥扫描电镜照片 (a.0 d, b.88 d) Fig. 3 Scanning electron micrograph of sludge under different influent substrate concentrations (a.0 d, b.88 d) |
Oshiki等(2013)和Gao等(2014)通过SEM观察试验过程中的污泥絮体也发现被一些不规则的粒子覆盖, 他们推测可能是含有被氧化的Fe的矿物质, 阻碍了细胞的营养吸收和代谢.
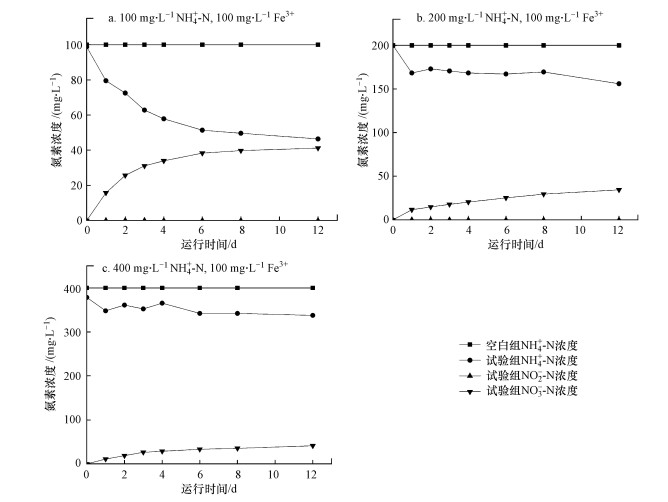
3.2 Feammox处理模拟垃圾渗滤液的影响因素 3.2.1 不同NH4+-N浓度对Feammox系统的影响为模拟实际垃圾渗滤液中的NH4+-N浓度, 试验设置了3组不同进水NH4+-N浓度, 以探究Feammox系统是否合适处理垃圾渗滤液.在不同进水氨氮浓度(100、200、400 mg·L-1)下运行12 d, 结果如图 4、图 5所示.
 |
| 图 4 不同NH4+-N浓度对Feammox影响过程中氮素变化 Fig. 4 Nitrogen changes in different processes of different NH4+-N concentrations on Feammox |
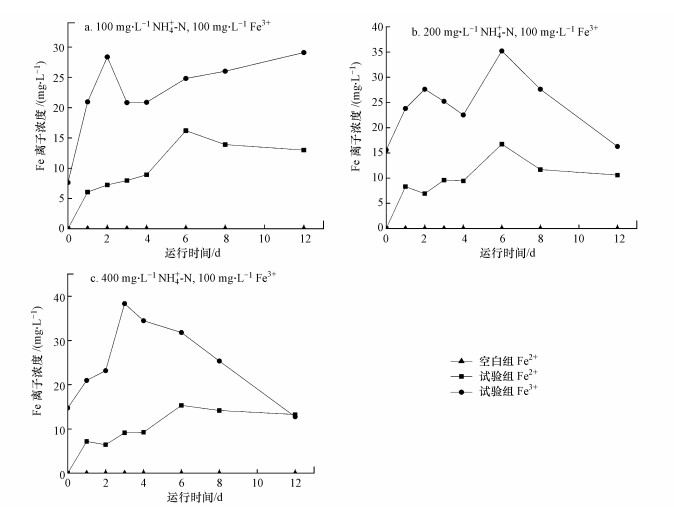 |
| 图 5 不同NH4+-N浓度对Feammox影响过程中铁浓度变化 Fig. 5 Variation of iron content in different processes of different concentrations of NH4+-N on Feammox |
如图 4a所示, 当进水NH4+-N浓度为100 mg·L-1时, 出水NH4+-N浓度在0~12 d时呈大幅下降趋势, 第12 d下降至46.41 mg·L-1, 同时NO3--N浓度上升至41.18 mg·L-1.如图 4b、图 4c所示, 当进水NH4+-N浓度分别为200 mg·L-1和400 mg·L-1时, 经过12 d运行, 出水NH4+-N转化量分别为43.85 mg·L-1和40.69 mg·L-1, NO3--N生成量分别为34.42 mg·L-1和41.12 mg·L-1.由此可知, 经驯化后的Feammox菌种在高NH4+-N浓度条件下仍然具有活性.
如图 5所示, 3组出水Fe2+浓度均呈先升高后降低的趋势.Huang等(2015)和吴胤等(2017)在富集培养Feammox菌种时也发现了Fe2+下降的现象, 分析原因为:Fe(OH)2在25 ℃下的溶度积Ksp=8.0×10-16, Fe2+在中性条件下(pH=6.5~7.6)很快转化为沉淀并沉积在污泥表面, 导致水相中溶出量减少;另外, 磁铁矿的产生会消耗Fe2+ (2Fe(OH)3+Fe2+→FeⅡFe2ⅢO4+2H++2H2O(Benner et al., 2002)).联系富集培养阶段后期出水NO3--N有所下降, 推测体系中可能存在NO3--N依赖型Fe(Ⅱ)氧化反应(王亚娥等, 2014;刘志文等, 2018).同时生成的亚铁则对胞外呼吸具有自我抑制作用, 赤铁矿异化还原研究表明, 随着二价铁生成的积累, 铁还原过程开始受到亚铁传质的限制, 并且受到热力学驱动力变化的影响, 还原效率降低(Royer et al., 2004).
3.2.2 不同Fe3+浓度对Feammox系统的影响试验设置不同进水Fe3+浓度(50、200、500 mg·L-1)来模拟实际垃圾渗滤液, 试验结果如图 6、图 7所示.
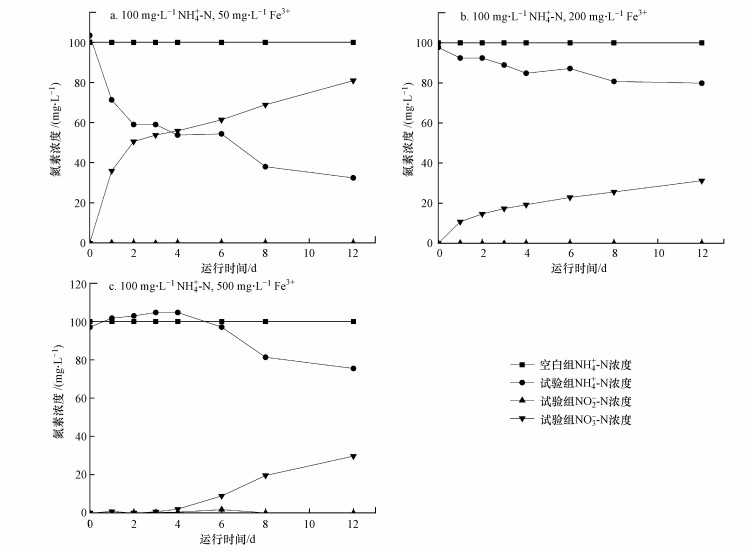 |
| 图 6 不同Fe3+浓度对Feammox影响过程中氮素变化 Fig. 6 Nitrogen changes in different processes of Fe3+ concentration on Feammox |
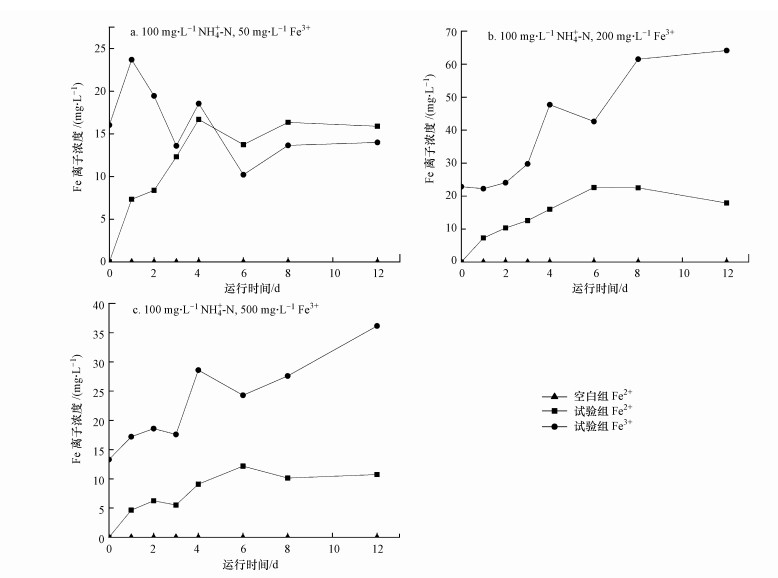 |
| 图 7 不同Fe3+浓度对Feammox影响过程铁浓度变化 Fig. 7 Variation of iron content in different processes of Fe3+ concentration on Feammox |
如图 6a所示, 当进水Fe3+浓度为50 mg·L-1时, 进水NH4+-N浓度在第12 d下降至32.44 mg·L-1, NO3--N浓度上升至80.93 mg·L-1.对比图 4a和图 6b可知, 当进水NH4+-N浓度相同而Fe3+浓度不同时, 进水Fe3+浓度低的试验组NH4+-N转化量和转化速率都高于进水Fe3+浓度高的试验组.由于Fe3+在中性条件下会迅速水解并沉淀在微生物表面阻碍传质, 从而降低微生物的代谢(Klueglein et al., 2013).
如图 6c所示, 当进水Fe3+浓度为500 mg·L-1时, 在0~4 d时出水NH4+-N浓度明显高于进水, 最高达到了104.70 mg·L-1.当进水Fe3+浓度很高, 达到一定浓度时会对微生物产生一定的毒性(Carlson et al., 2013), 部分菌体自溶导致出水NH4+-N浓度明显高于进水.第4~12 d时微生物逐渐适应环境, 出水NH4+-N逐渐降低至75.47 mg·L-1, 去除量达到29.23 mg·L-1, NO3--N浓度上升至29.66 mg·L-1.0~8 d时, NO2--N浓度处于上升状态, 在第8 d时达到最高值1.71 mg·L-1.相比进水Fe3+浓度为50 mg·L-1和200 mg·L-1时, 出水NO2--N浓度一直处于很低的状态.如图 7所示, 3组出水Fe2+浓度都呈现先上升后下降的趋势, 与不同进水NH4+-N浓度试验结果一致.
3组试验中NH4+-N均有去除.在高浓度铁条件下微生物前期不适应环境, 后期仍然具有活性, 说明在高铁浓度条件下Feammox污泥仍然具有代谢活性.
3.2.3 NH4+-N转化量与Fe2+生成量的关系分析将6组试验组NH4+-N转化量与Fe2+生成量(水相中溶出的Fe2+)进行线性拟合, 结果如图 8所示.由图 8a可知, 不同进水氨氮浓度的拟合曲线斜率(出水Fe2+浓度与NH4+-N去除量之比)相近, 均在0.3左右.进水NH4+-N浓度为100 mg·L-1时, 曲线的拟合度最高, R2=0.86544.不同进水Fe3+浓度的拟合曲线中, 出水Fe2+浓度与NH4+-N去除量之比则分别为0.24633、1.09902、0.11079, 进水Fe3+浓度为50 mg·L-1时, 拟合度最高, R2=0.86034(图 8b), 且与图 8a试验组斜率和R2相近.低进水基质浓度条件下, 微生物生长环境适宜、代谢稳定.高进水基质条件下, 微生物代谢受到一定程度的抑制, 曲线拟合度差.高进水Fe3+浓度条件下, NH4+-N转化率下降.这也进一步说明高进水Fe3+浓度条件下, Fe3+迅速水解, 沉积在污泥表面并阻碍传质.
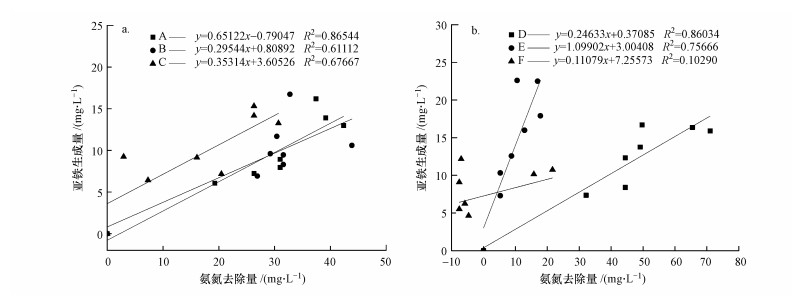 |
| 图 8 NH4+-N转化量与Fe2+生成量的拟合分析 (A~F见表 2) Fig. 8 Fitting analysis between NH4+-N conversion and Fe2+ production |
1) 在ASBR反应器中, 经过88 d的厌氧富集培养, NH4+-N最大转化率达到52.73%, 最大转化量为28.37 mg·L-1, 出水NO3--N浓度最高为24.35 mg·L-1.出水Fe2+浓度随着运行时间的增加而逐渐增加, 最高浓度为2.87 mg·L-1.
2) 通过SEM分析可知, 微生物表面附着有不规则矿物, 这些矿物会沉积在微生物细胞表面并阻碍传质, 从而降低微生物代谢效率.
3) 高浓度NH4+-N(400 mg·L-1)和Fe3+(500 mg·L-1)条件下, NH4+-N转化量分别达到40.69 mg·L-1和29.23 mg·L-1, Feammox仍具有生物活性.低浓度NH4+-N(100 mg·L-1)和Fe3+(50 mg·L-1)条件下, NH4+-N转化量与Fe2+生成量的线性关系较强, R2分别为0.86544和0.86034, 曲线拟合度高, 说明Feammox污泥可以适应模拟垃圾渗滤液水质.但高浓度Fe3+在中性条件下会形成沉淀, 阻碍传质, 从而降低氨氮转化率.
附录(Appendix): 一 DNA的提取与聚合酶链反应(PCR)反应器运行0、32、61和88 d时分别提取0.25 g干污泥, 利用土壤DNA快速提取试剂盒(E.Z.N.ATM Mag-Bind Soil DNA Kit)提取DNA.所有PCR反应采用相同的起始温度和反应设置, 进行温度梯度PCR以基于引物的推荐温度确定最佳退火温度.简而言之, 使用12.5 μL TaqPCR Master Mix(2×, Blue Dye) (Sangon Biotech, Shanghai.Co., Ltd.), 1 μL反向和正向引物, 对每个样品进行25 μL的一式三份PCR反应, 9.5 μL DEPC处理水和1 μL DNA样品, S1000TM热循环仪, 具有附表 1中所述的热条件.所有PCR产物均通过使用1%琼脂糖凝胶的琼脂糖凝胶电泳确认(Ellatif et al., 2018).
| 附表 1 不同目的基因引物表 TableS1 Primers form of different target genes |
使用16S rRNA高通量测序分析富集过程中微生物群体结构的变化, 以了解微生物的富集过程.使用E.Z.N.A.TM Soil DNA Kit(Omega Bio-tek, Inc.USA)提取DNA样品.使用Qubit 3.0 DNA测定试剂盒精确定量基因组DNA, 以确定应添加到PCR反应中的DNA量.PCR的引物为(338F(5′-ACT CCT ACG GGA GGC AGC AG -3′)和806R(5′- GGA CTA CHV GGG TWT CTA AT -3′))(Claesson et al., 2010).对细菌的V3~V4高变区进行定向扩增.根据Illumina方案中16S Metagenomics测序文库的制备中描述的方案, 进行两轮DNA扩增.对于由细菌和古细菌和正常扩增片段扩增的PCR产物, 用0.6倍磁珠(Agencourt AMPure XP)处理400 bp或更长的PCR产物.使用Qubit 3.0 DNA测定试剂盒精确定量回收的DNA, 以便以1 : 1的等量进行测序.当以等量混合时, 每个样品的DNA量为10 ng, 最终测序浓度为20 pmol.以上工作由生物生工(上海)公司完成.
致谢: 感谢珠江三角洲水质安全与保护教育部重点实验室对本研究的支持, 感谢魏春海教授在论文修改方面提供的帮助!
Benner S G, Hansel C M, Wielinga B W, et al. 2002. Reductive dissolution and biomineralization of iron hydroxide under dynamic flow conditions[J]. Environmental Science & Technology, 36(8): 1705–1711.
|
Burgess J E, Quarmby J, Stephenson T. 1999. Role of micronutrients in activated sludge-based biotreatment of industrial effluents[J]. Biotechnology Advances, 17(1): 49–70.
DOI:10.1016/S0734-9750(98)00016-0
|
Carlson H K, Clark I C, Blazewicz S J, et al. 2013. Fe(Ⅱ) oxidation is an innate capability of nitrate-reducing bacteria that involves abiotic and biotic reactions[J]. Journal of Bacteriology, 195(14): 3260–3268.
DOI:10.1128/JB.00058-13
|
Clément J C, Shrestha J, Ehrenfeld J G, et al. 2005. Ammonium oxidation coupled to dissimilatory reduction of iron under anaerobic conditions in wetland soils[J]. Soil Biology & Biochemistry, 37(12): 2323–2328.
|
陈鹏程.2016.水稻土亚铁氧化耦合硝酸盐还原的过程与机制[D].广州: 中国科学院广州地球化学研究所
http://cdmd.cnki.com.cn/Article/CDMD-80165-1016188324.htm |
Ding B, Li Z, Qin Y. 2017. Nitrogen loss from anaerobic ammonium oxidation coupled to iron(Ⅲ) reduction in a riparian zone[J]. Environmental Pollution, 231: 379–386.
DOI:10.1016/j.envpol.2017.08.027
|
Ding L J, Su J Q, Xu H J, et al. 2015. Long-term nitrogen fertilization of paddy soil shifts iron-reducing microbial community revealed by RNA-(13)C-acetate probing coupled with pyrosequencing[J]. Isme Journal, 9(3): 721–734.
DOI:10.1038/ismej.2014.159
|
Ding L J, An X L, Li S, et al. 2014. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence[J]. Environmental Science & Technology, 48(18): 10641–10647.
|
Gao F, Zhang H, Yang F, et al. 2014. The effects of zero-valent iron (ZVI) and ferroferric oxide (Fe3O4) on anammox activity and granulation in anaerobic continuously stirred tank reactors (CSTR)[J]. Process Biochemistry, 49(11): 1970–1978.
DOI:10.1016/j.procbio.2014.07.019
|
Gilson E R, Huang S, Jaffé P R. 2015. Biological reduction of uranium coupled with oxidation of ammonium by Acidimicrobiaceae bacterium A6 under iron reducing conditions[J]. Biodegradation, 26(6): 475–482.
DOI:10.1007/s10532-015-9749-y
|
Huang S, Jaffé P R. 2015. Characterization of incubation experiments and development of an enrichment culture capable of ammonium oxidation under iron-reducing conditions[J]. Biogeosciences, 12(3): 769–779.
DOI:10.5194/bg-12-769-2015
|
Holmes D E, Chaudhuri S K, Nevin K P, et al. 2010. Microarray and genetic analysis of electron transfer to electrodes in Geobacter sulfurreducens[J]. Environmental Microbiology, 8(10): 1805–1815.
|
Ikem A, Egiebor N O, Nyavor K, et al. 2003. Trace elements in water, fish and sediment from Ttuskegee Lake, southeastern USA[J]. Water Air & Soil Pollution, 149(1/4): 51–75.
|
Klueglein N, Kappler A. 2013. Abiotic oxidation of Fe(Ⅱ) by reactive nitrogen species in cultures of the nitrate-reducing Fe(Ⅱ) oxidizer Acidovorax sp. BoFeN1-questioning the existence of enzymatic Fe(Ⅱ) oxidation[J]. Geobiology, 11(2): 180–190.
DOI:10.1111/gbi.12019
|
Kumpiene J, Lagerkvist A, Maurice C. 2008. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments-A review[J]. Waste Management, 28(1): 215–225.
DOI:10.1016/j.wasman.2006.12.012
|
Li X, Huang Y, Liu H W, et al. 2018. Simultaneous Fe(Ⅲ) reduction and ammonia oxidation process in Anammox sludge[J]. Journal of Environmental Sciences, 64(2): 42–50.
|
Li X F, Hou L J, Liu M, et al. 2015. Evidence of nitrogen loss from anaerobic ammonium oxidation coupled with ferric iron reduction in an intertidal wetland[J]. Environmental Science & Technology, 49(19): 11560–11568.
|
李丹, 何小松, 席北斗, 等. 2013. 生活垃圾堆肥渗滤液污染物组成与演化规律研究[J]. 环境科学, 2013, 34(7): 2918–2924.
|
李梅.2012.水环境中ZnO纳米颗粒对大肠杆菌的毒性及影响因素[D].杭州: 浙江大学
http://cdmd.cnki.com.cn/Article/CDMD-10335-1012318146.htm |
李祥, 林兴, 杨朋兵, 等. 2016. 活性污泥厌氧Fe(Ⅲ)还原氨氧化现象初探[J]. 环境科学, 2016, 37(8): 3114–3119.
|
李祥, 黄勇, 巫川, 等. 2014. Fe2+和Fe2+对厌氧氨氧化污泥活性的影响[J]. 环境科学, 2014, 35(11): 4224–4229.
|
刘志文, 陈琛, 彭晓春, 等. 2018. 磁性壳聚糖凝胶球固定厌氧铁氨氧化菌对废水氨氮去除的影响[J]. 环境科学, 2018, 39(10): 4601–4611.
|
Mjk B, Aziz H A, Yusoff M S, et al. 2010. Application of response surface methodology (RSM) for optimization of ammoniacal nitrogen removal from semi-aerobic landfill leachate using ion exchange resin[J]. Desalination, 254(1): 154–161.
|
马晨, 周顺桂, 庄莉, 等. 2011. 微生物胞外呼吸电子传递机制研究进展[J]. 生态学报, 2011, 31(7): 2008–2018.
|
Oshiki M, Ishii S, Yoshida K, et al. 2013. Nitrate-dependent ferrous iron oxidation by anaerobic ammonium oxidation (anammox) bacteria[J]. Appl Environ Microbiol, 79(13): 4087–4093.
DOI:10.1128/AEM.00743-13
|
Øygard J K, Måge A, Gjengedal E. 2004. Estimation of the mass-balance of selected metals in four sanitary landfills in Western Norway, with emphasis on the heavy metal content of the deposited waste and the leachate[J]. Water Research, 38(12): 2851–2858.
DOI:10.1016/j.watres.2004.03.036
|
Park W, Nam Y K, Lee M J, et al. 2009. Anaerobic ammonia-oxidation coupled with Fe3+ reduction by an anaerobic culture from a piggery wastewater acclimated to NH4+/Fe3+ medium[J]. Biotechnology and Bioprocess Engineering, 14(5): 680–685.
DOI:10.1007/s12257-009-0026-y
|
Royer R A, Dempsey B A, Jeon B H, et al. 2004. Inhibition of biological reductive dissolution of hematite by ferrous iron[J]. Environmental Science & Technology, 38(1): 187–193.
|
Sawayama S. 2006. Possibility of anoxic ferric ammonium oxidation[J]. Journal of Bioscience & Bioengineering, 101(1): 70–72.
|
Star W R L V D, Abma W R, Blommers D, et al. 2007. Startup of reactors for anoxic ammonium oxidation:Experiences from the first full-scale anammox reactor in Rotterdam[J]. Water Research, 41(18): 4149–4163.
DOI:10.1016/j.watres.2007.03.044
|
苏润华, 丁丽丽, 任洪强. 2018. 纳米零价铁(NZVI)对厌氧产甲烷活性、污泥特性和微生物群落结构的影响[J]. 环境科学, 2018, 39(7): 3286–3296.
|
Tao W, Zhang H, Gao D, et al. 2011. Enrichment of anammox bacteria in seed sludges from different wastewater treating processes and start-up of anammox process[J]. Desalination, 271(1/3): 193–198.
|
吴胤, 陈琛, 毛小云, 等. 2017. 基于Feammox的生物膜反应器性能研究[J]. 中国环境科学, 2017, 37(9): 3353–3362.
DOI:10.3969/j.issn.1000-6923.2017.09.019 |
王旌, 付融冰, 罗启仕, 等. 2010. 亚铁盐对城市污泥中重金属的稳定化作用研究[J]. 环境科学, 2010, 31(4): 1036–1040.
|
王亚娥, 冯娟娟, 李杰, 等. 2014. 不同Fe(Ⅲ)对活性污泥异化铁还原耦合脱氮的影响及机理初探[J]. 环境科学学报, 2014, 34(2): 377–384.
|
Wang X, Jia M, Zhang C, et al. 2017. Leachate treatment in landfills is a significant N2O source[J]. Science of the Total Environment, s596-597: 18–25.
|
Wang F, Wang J, Jian H, et al. 2008. Environmental adaptation:Genomic analysis of the piezotolerant and psychrotolerant deep-sea iron reducing bacterium Shewanella piezotolerans WP3[J]. Journal of Biotechnology, 136(4): S542–S543.
|
Yang W H, Weber K A, Silver W L. 2012. Nitrogen loss from soil via anaerobic ammonium oxidation coupled to iron reduction[J]. Nature Geoscience, 5(8): 538–541.
DOI:10.1038/ngeo1530
|
Claesson M J, Wang Q, O′Sullivan O, et al. 2010. Comparison of two next -generation sequencing technologies for resolving highly complex microbiota composition using tandem variable 16S rRNA gene regions[J]. Nucleic Acids Research, 38(22): 189–200.
|
Ellatif A H, Gupta V K, Singh B P. 2018. Use of PCR-denaturing gradient gel electrophoresis for the discrimination of Candida species isolated from natural habitats[J]. Microb Pathog, 120: 19–22.
DOI:10.1016/j.micpath.2018.04.027
|
Jin T, Zhang T, Ye L, et al. 2011. Diversity and quantity of ammonia-oxidizing Archaea and Bacteriain sediment of the Pearl River Estuary, China[J]. Applied Microbiology & Biotechnology, 90(3): 1137–1145.
|
Penton C R, Johnson T A, Quensen J F, et al. 2013. Functional genes to assess nitrogen cycling and aromatic hydrocarbon degradation:primers and processing matter[J]. Frontiers in Microbiology, 4(8): 1–17.
|
Wertz S, Valérie Degrange, Prosser J I, et al. 2006. Maintenance of soil functioning following erosion of microbial diversity[J]. Environmental microbiology, 8(12): 2162–2169.
DOI:10.1111/j.1462-2920.2006.01098.x
|
 2019, Vol. 39
2019, Vol. 39


