2. 中国科学院大学资源与环境学院, 北京 100049;
3. 中国科学技术大学生命科学学院, 合肥 230026
2. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049;
3. School of Life Sciences, University of Science and Technology of China, Hefei 230026
铬在合金、电镀、染料、催化剂、木材防腐剂和耐火制品等产品的工业生产中被广泛应用(Baruthio, 1992).伴随着这些产品的大量生产, 含铬化合物随未经处理的废水、废渣大量进入自然界, 从而造成了严重的铬污染(Robins et al., 2013).含铬化合物中最常见的为Cr(Ⅵ)和Cr(Ⅲ)形成的化合物(Megharaj et al., 2003), 其中, Cr(Ⅲ)通常以氧化物、氢氧化物或硫酸盐的形式存在, 主要与土壤和水环境中的有机物结合, 相对不溶于水, 几乎或没有毒性(Cervantes et al., 2001;Okeke, 2008).在哺乳动物中, Cr(Ⅲ)还有促进葡萄糖、蛋白质和脂质代谢的作用(Arıca et al., 2005).然而, Cr(Ⅵ)常见的化合物为铬酸盐(CrO42-)或重铬酸盐(Cr2O72-), 在水中具有高的可溶性和可移动性, 并且对生物系统具有毒性、诱变性和致癌性(Cervantes et al., 2001;Okeke, 2008).Cr(Ⅵ)被认为是最具毒性的Cr形式, 其毒性比Cr(Ⅲ)高100倍, 诱变性比Cr(Ⅲ)高1000倍(Flora et al., 1990).因此, 铬污染治理的根本是Cr(Ⅵ)的去除(林永华, 2018).
Cr(Ⅵ)去除的主要方法包括沉淀法、电解法、膜技术、吸附法及离子交换法等传统的物理化学方法(Miretzky et al., 2010)和生物去除方法(Ullah et al., 2015).由于传统物理化学法存在成本高、效率低和产生有毒污泥及其他废物等缺点, 因此, 近年来具有成本低、二次污染小等优势的生物去除法受到越来越广泛的重视, 其中, 最主要的两种为植物去除法和微生物去除法(Ullah et al., 2015).植物去除法主要依靠植物从土壤和水体中吸收Cr(Ⅵ)并将其转化为Cr(Ⅲ)储存在可收获组分中(Ma et al., 2011;Kamran et al., 2014), 之后通过收割超富集植物的方式回收金属Cr(Ha et al., 2011).研究发现的Cr(Ⅵ)超富集植物有Dicoma niccolifera Wild和Sutera fodina Wild(高玉梅等, 2014)及李氏禾(Leersia hexandra Swartz)(张学洪等, 2006)和多种水生植物(Rakhshaee et al., 2009)等.但由于这些植物生物量较小、生长缓慢, 所以对Cr(Ⅵ)去除较为缓慢(邵明国等, 2014).微生物去除法包括吸附、沉淀及微生物还原Cr(Ⅵ)等方法(Cervantes et al., 2001).其中, 最常见的机制为微生物还原Cr(Ⅵ)至Cr(Ⅲ), 研究人员已经分离发现多种Cr(Ⅵ)还原菌, 如Lysinibacillus fusiformis ZC1(He et al., 2011)、Exiguobacterium sp. GS1(Okeke, 2008)、Shewanella oneidensis(Mugerfeld et al., 2009)等都有较好的Cr(Ⅵ)还原效果.尽管如此, Cr(Ⅵ)仍旧对微生物具有一定的毒害作用, 从而影响微生物在Cr(Ⅵ)去除中的长期应用效果(Poopal et al., 2008).植物-微生物联合去除Cr(Ⅵ), 因其能通过相互作用达到相互促进的效果而在原位Cr(Ⅵ)污染修复中越来越受到研究者的关注(Ullah et al., 2015).寻求一株既能促进植物生长, 又能高效还原Cr(Ⅵ)的菌株是该修复方法的关键.
因此, 本文以一株已知的植物根际促生菌—嗜根寡养单胞菌DSM 14405T为研究对象, 验证其对不同浓度Cr(Ⅵ)的还原能力及Cr(Ⅵ)对菌生长的影响; 探讨温度、pH、转速及连续投加Cr(Ⅵ)对菌株生长和Cr(Ⅵ)还原的影响; 同时, 对在含Cr(Ⅵ)培养基中短时暴露条件下和长时暴露条件下的菌株转录组与对照组进行比较, 分析其中的差异表达基因.以期为Cr(Ⅵ)污染的原位植物-微生物联合治理提供可选菌株和理论依据.
2 材料与方法(Materials and methods) 2.1 菌株来源本研究中选取的菌株为嗜根寡养单胞菌DSM 14405T, 是一株植物根际促生菌(Egamberdieva et al., 2010).嗜根寡养单胞菌DSM 14405T购于美国典型微生物菌种保藏中心, 保藏编号为ATCC BAA-473T(Wolf, 2002).
2.2 培养基胰蛋白胨大豆肉汤培养基(TSB):胰蛋白胨17 g·L-1, 大豆蛋白胨3 g·L-1, 葡萄糖2.5 g·L-1, 氯化钠5.0 g·L-1, 磷酸氢二钾2.5 g·L-1, pH=7.3±0.2.
胰蛋白胨大豆琼脂培养基(TSA):胰蛋白胨17 g·L-1, 大豆蛋白胨3 g·L-1, 葡萄糖2.5 g·L-1, 氯化钠5.0 g·L-1, 磷酸氢二钾2.5 g·L-1, 琼脂15 g·L-1, pH=7.3±0.2.
含不同浓度Cr(Ⅵ)的培养基:以经过0.22 μm滤膜过滤的、Cr(Ⅵ)浓度为5000 mg·L-1的重铬酸钾溶液为母液, 在TSB培养基中加入相应量的母液配置成不同终浓度的含Cr(Ⅵ)培养基.
2.3 嗜根寡养单胞菌DSM 14405T的Cr(Ⅵ)还原能力验证用接种环挑取菌液至TSA培养基中进行划线分离, 于30 ℃下恒温培养.待48 h后, 平板长出合适大小的菌落, 挑取一个菌落接种到TSB培养液中, 于180 r·min-1、30 ℃下培养24 h, 作为种子液, 并于4 ℃下保存短期备用.
向配置的Cr(Ⅵ)浓度分别为0、10、50、200和500 mg·L-1的TSB培养基中加入1%(体积分数)的种子液, 置于180 r·min-1、30 ℃的摇床中培养, 每隔24 h测一次菌生长情况(OD600)和Cr(Ⅵ)浓度, 到培养72 h为止.本研究中涉及的所有实验, 如未说明, 均设置5个平行.
2.4 嗜根寡养单胞菌DSM 14405T还原Cr(Ⅵ)的培养条件优化在含50 mg·L-1 Cr(Ⅵ)的TSB培养基中, 分别于不同培养温度(24、27、30和33 ℃)、不同pH(6.0、6.5、7.0、7.5和8.0)、不同摇床转速(120、150、180和210 r·min-1)条件下, 加入1%的种子液培养, 定期(0、12、24和36 h)测定菌生长情况(OD600)和剩余Cr(Ⅵ)浓度(赵娜娜等, 2019).
2.5 嗜根寡养单胞菌DSM 14405T对于连续投加Cr(Ⅵ)的还原能力在最适培养条件下, 向起始Cr(Ⅵ)浓度为50 mg·L-1的TSB培养基中加入1%种子液, 每隔12 h测定菌生长情况(OD600)和剩余Cr(Ⅵ)浓度.当培养基中的Cr(Ⅵ)还原率超过90%后, 再次向培养基中添加Cr(Ⅵ)母液, 使培养基中Cr(Ⅵ)浓度达到50 mg·L-1左右.此过程循环进行, 直到测定的剩余Cr(Ⅵ)浓度不再降低为止(Zhu et al., 2007;Yang et al., 2009;He et al., 2011).
2.6 嗜根寡养单胞菌DSM 14405T的RNA提取及转录组测定首先在灭菌的500 mL锥形瓶中加入250 mL TSB培养基和1%种子液, 在最适条件下培养12 h; 之后向12个50 mL锥形瓶中各加入19.2 mL培养12 h的菌液; 然后向对照组的锥形瓶中加入0.8 mL无菌水, 实验组锥形瓶中加入0.8 mL Cr(Ⅵ)母液, 使Cr(Ⅵ)的终浓度为200 mg·L-1.对照组和实验组各做6个重复, 并继续放入摇床培养.30 min后, 每组各取出3瓶, 每瓶取3 mL菌液, 作为嗜根寡养单胞菌DSM 14405T在Cr(Ⅵ)中短时暴露条件下的RNA提取样本(对照组命名为C30, 含200 mg·L-1 Cr(Ⅵ)组命名为H30).培养180 min后, 处理方法同上, 作为嗜根寡养单胞菌DSM 14405T在Cr(Ⅵ)中长时暴露条件下的RNA提取样本(对照组命名为C180, 含200 mg·L-1 Cr(Ⅵ)组命名为H180)(Chourey et al., 2008).之后按照RNeasy Protect Bacteria Mini Kit (Qiagen, Cat No.74524)试剂盒的步骤提取RNA.获得的总RNA样品通过琼脂糖凝胶电泳检测是否有污染; 通过Nanodrop检测RNA纯度; 使用Qubit对RNA浓度进行定量; 并用Agilent2100检测RNA的完整性.检测合格后, 富集mRNA, 反转录合成双链cDNA, 纯化双链cDNA并进行末端修复、加A尾及连接测序接头, 最后进行PCR扩增, 构建cDNA文库.文库构建完成后, 先使用Qubit2.0进行初步定量, 稀释文库至1 ng·μL-1, 随后使用Agilent 2100对文库的插入片段长度(insert size)进行检测, insert size符合预期后, 使用Q-PCR方法对文库的有效浓度进行准确定量(文库有效浓度>2 nmol·L-1), 以保证文库质量.在文库质量检测合格后, 使用Illumina高通量测序平台(Hiseq 2500)进行上机测序.获得的原始测序数据, 首先对错误率、A/T/G/C含量分布情况等进行评估, 并进行测序数据过滤.之后用Bowtie2将其与参考序列进行比对分析, 再进行基因表达水平分析、差异表达基因分析和GO注释富集分析.
2.7 Cr(Ⅵ)测定方法及数据分析方法本研究中Cr(Ⅵ)浓度测定时使用哈希六价铬测试试剂包(Hach, Cat No.1271099, 量程为0.010~0.700 mg·L-1)与待测溶液混合, 在哈希DR6000分光光度计(Hach DR6000)上进行测定, 其原理与二苯碳酰二肼分光光度法(刘雪梅等, 2018)相同.另外, 由于铬元素稳定存在的价态为Cr(Ⅲ)和Cr(Ⅵ), 所以Cr(Ⅵ)还原产物即Cr(Ⅲ), 故Cr(Ⅲ)数据未在文中给出.本研究中的统计学分析均采用IBM SPSS Statistics(version 22)软件进行, 图像使用Origin(version 8.0)绘制.采用单因素方差分析(One-way analysis of variance, ANOVA)和LSD检验确定组间的差异显著性(p < 0.05).
3 结果与讨论(Results and discussion) 3.1 菌株的Cr(Ⅵ)还原特性嗜根寡养单胞菌DSM 14405T对Cr(Ⅵ)的还原能力及Cr(Ⅵ)存在时的生长情况(OD600)如图 1所示.在培养的72 h内, 每隔24 h测定菌生长情况(OD600)和Cr(Ⅵ)还原率.其中, 图 1a为4种不同浓度Cr(Ⅵ)培养基与不含Cr(Ⅵ)的对照组在培养时间内的还原率变化对比情况.培养24 h时, Cr(Ⅵ)浓度为10、50、200和500 mg·L-1组的Cr(Ⅵ)还原率分别为100%、92.4%、26.2%和16.5%, 4个不同处理组之间的Cr(Ⅵ)还原率均存在显著差异(p < 0.05).培养48 h时, 4个处理组的Cr(Ⅵ)还原率分别达到100%、100%、41.9%和30%, Cr(Ⅵ)浓度为10和50 mg·L-1的处理组均完全还原, 与另两组之间具有显著差异.培养72 h时, Cr(Ⅵ)浓度为200和500 mg·L-1的处理组的还原率分别达到78.6%和36.6%, 与其他组均存在显著差异.
 |
| 图 1 嗜根寡养单胞菌DSM 14405T在不同Cr(Ⅵ)浓度下的Cr(Ⅵ)还原率(a)及生长情况(OD600)(b)(误差线代表标准差(n=5), 不同字母表示同一时间组间有显著性差异(p < 0.05)) Fig. 1 Cr(Ⅵ) reduction(a) by and growth(b) of Stenotrophomonas rhizophila DSM 14405T under different Cr(Ⅵ) concentrations |
图 1b为对应的5种不同处理组中菌的生长情况(OD600).在培养的72 h内, Cr(Ⅵ)浓度10 mg·L-1组的菌生长情况(OD600)与对照组之间均无显著差异, 且在24 h内就达到了菌生长的稳定期.Cr(Ⅵ)浓度50 mg·L-1组的菌生长情况(OD600)在培养时间内均显著低于前两组, 但从OD600值分析, 该浓度对菌生长的抑制作用较小, 培养24 h时OD600可达5.0左右, 且到达稳定期.而Cr(Ⅵ)浓度200 mg·L-1和500 mg·L-1组的菌生长情况(OD600)在整个培养过程中明显受到抑制, 且这两组之间的菌生长情况(OD600)也存在较大差异.Cr(Ⅵ)浓度200 mg·L-1组的菌生长情况(OD600)虽然受到较大抑制, 但随着Cr(Ⅵ)的还原, 其菌密度上升明显.说明该浓度对菌生长有抑制作用, 但对于菌细胞的毒害作用较小, 随着还原过程的进行Cr(Ⅵ)浓度降低, 菌受到的抑制变小, 生长速度加快.而Cr(Ⅵ)浓度500 mg·L-1组的菌生长情况(OD600)在整个培养过程中都维持在较低水平, 且72 h时的OD600值低于48 h时.这一结果与48~72 h内Cr(Ⅵ)还原率小于24~48 h内还原率的结果吻合.说明Cr(Ⅵ)浓度为500 mg·L-1时除了对菌生长存在抑制作用, 还对菌细胞存在明显毒害作用, 导致Cr(Ⅵ)浓度降低后菌的生长活力仍无法恢复(Cervantes et al., 2001).
目前, 研究人员已经发现多种Cr(Ⅵ)还原菌, 其中包括假单胞菌、微杆菌、脱硫弧菌、肠杆菌、大肠杆菌等(Thacker et al., 2007), 且不同的还原菌对Cr(Ⅵ)的还原能力有所不同.Pseudomonas mandelii CH1可在72 h内完全还原50 mg·L-1的Cr(Ⅵ)(林永华, 2018);Brucella sp.可在54 h内完全还原50 mg·L-1的Cr(Ⅵ)(Thacker et al., 2007);Lysinibacillus fusiformis ZC1则可在12 h内完全还原1 mmol·L-1的Cr(Ⅵ)(He et al., 2011);而嗜根寡养单胞菌DSM 14405T可在24 h内还原92.4%的50 mg·L-1的Cr(Ⅵ).由此可见, 嗜根寡养单胞菌DSM 14405T虽然不是Cr(Ⅵ)还原速度最快的菌, 但其Cr(Ⅵ)还原速率在Cr(Ⅵ)还原菌中较快.且嗜根寡养单胞菌DSM 14405T属于植物根际促生菌, 因此, 对于嗜根寡养单胞菌DSM 14405T还原Cr(Ⅵ)的研究, 在Cr(Ⅵ)污染的原位植物-微生物联合修复方面有较大意义.
通常情况下, Cr(Ⅵ)废水的浓度为几十mg·L-1(马亚梦, 2015).所以, 本研究后续设置Cr(Ⅵ)浓度为50 mg·L-1, 研究嗜根寡养单胞菌DSM 14405T还原Cr(Ⅵ)的最适培养条件及在连续投加Cr(Ⅵ)情况下的还原能力.而在Cr(Ⅵ)存在和不存在情况下分析菌转录组差异实验中, 由于Cr(Ⅵ)浓度为50 mg·L-1时, 菌生长基本不受抑制, 大量与Cr(Ⅵ)抗性及还原相关的基因的表达可能与对照组差异不明显, 所以, 选取200 mg·L-1 Cr(Ⅵ)进行比较转录组分析.
3.2 菌株还原Cr(Ⅵ)的最适培养条件图 2为不同温度、pH和摇床转速下的嗜根寡养单胞菌DSM 14405T生长情况(OD600)和Cr(Ⅵ)还原率随培养时间的变化情况.如图 2a和2b所示, 嗜根寡养单胞菌DSM 14405T在培养的36 h内, 对Cr(Ⅵ)的还原率及生长情况(OD600)在温度为30和33 ℃时均没有显著差异, 而与24和27 ℃培养条件下有显著差异(p < 0.05).由于培养温度较低时消耗的电能较少, 因此认为30 ℃是嗜根寡养单胞菌DSM 14405T还原Cr(Ⅵ)的最适温度.图 2c的结果表明, 培养基初始pH为7.5和8.0时, 菌的Cr(Ⅵ)还原速率没有明显差异, 且均明显快于其他组(p < 0.05).同时结合图 2d中不同pH下菌的生长情况(OD600)可知, pH=8.0时菌的生长速率明显高于pH=7.5时.在两处理组还原速率无明显差异的情况下, 菌密度小的处理组营养消耗少, 更节约成本, 故可以认为最适的Cr(Ⅵ)还原pH为7.5.结合图 2e和2f分析可知, 还原速率快且耗能少的摇床转速最适选择为180 r·min-1.综上, 嗜根寡养单胞菌DSM 14405T还原Cr(Ⅵ)的最高效经济的培养条件为温度30 ℃、pH=7.5、摇床转速180 r·min-1.
 |
| 图 2 嗜根寡养单胞菌DSM 14405T在不同温度、pH和摇床转速下的生长情况(OD600)(a、c、e)及Cr(Ⅵ)还原率(b、d、f)(误差线代表标准差(n=5), 不同字母表示显著性差异, p < 0.05, 下同) Fig. 2 Cr(Ⅵ) reduction by and growth of Stenotrophomonas rhizophila DSM 14405T under different culturing conditions |
初步探讨嗜根寡养单胞菌DSM 14405T对连续投加Cr(Ⅵ)的还原能力, 结果如图 3所示.初始加入50 mg·L-1的Cr(Ⅵ)后, 菌在24 h内对Cr(Ⅵ)的还原率可达90.4%, 还原速率为1.88 mg·L-1·h-1; 第2次加入Cr(Ⅵ)母液使其浓度达到50 mg·L-1后, 在48 h(总培养时间72 h)内可还原89.6%的Cr(Ⅵ) (还原速率为0.93 mg·L-1·h-1); 第3次加入Cr(Ⅵ)母液使其浓度达到50 mg·L-1后, 24 h(总培养时间96 h)内Cr(Ⅵ)的还原率可达55.2%.之后, 分别在108 h和120 h测定Cr(Ⅵ)浓度, 还原率基本保持不变.另外, 从菌生长情况可知, 培养的前24 h, OD600可到达3.5左右.第2次加入Cr(Ⅵ)母液后, 菌细胞光密度值仍旧维持增长, 但增长速度减慢.因为再次加入的Cr(Ⅵ)对细胞增长造成了轻微抑制, 同时也对Cr(Ⅵ)还原速率产生了相应的抑制, 使得第2次加入Cr(Ⅵ)后的还原速率明显低于第1次投加时.从培养第60 h和第72 h的OD600测定结果可知, 这段时间内细菌光密度值维持在5.3左右, 细胞生长进入稳定期.在第3次加入Cr(Ⅵ)母液后, 菌光密度值开始出现下降, 培养至120 h时OD600约为1.5.菌细胞光密度值快速下降应该与培养过程中营养物质消耗未得到补充及Cr(Ⅵ)多次加入对菌造成毒害(Poopal et al., 2008)等相关.菌细胞光密度值快速下降, 也与第3次投加Cr(Ⅵ)后, 菌株无法将其完全还原相一致.
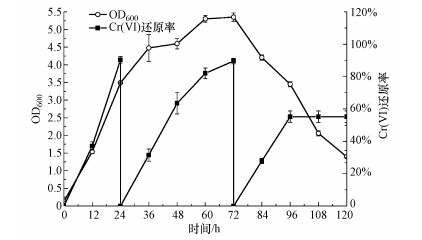 |
| 图 3 连续投加50 mg·L-1 Cr(Ⅵ)时嗜根寡养单胞菌DSM 14405T的Cr(Ⅵ)还原率及生长情况(OD600) Fig. 3 Cr(Ⅵ) reduction by and growth of Stenotrophomonas rhizophila DSM 14405T under repeated spiking of 50 mg·L-1 Cr(Ⅵ) |
本研究同时将嗜根寡养单胞菌DSM 14405T与已报道的其他菌株进行了比较, 其中, Lysinibacillus fusiformis ZC1可在50 h内4次完全还原添加的1 mmol·L-1左右的Cr(Ⅵ)(He et al., 2011);Intrasporangium sp. Q5-1在培养的136 h内可完全还原3次添加的1 mmol·L-1左右的Cr(Ⅵ)(Yang et al., 2009).嗜根寡养单胞菌DSM 14405T在不外加营养素的情况下, 还原连续投加Cr(Ⅵ)的能力是其中最弱的, 这与嗜根寡养单胞菌DSM 14405T生长速率快, 在培养时间内细胞密度明显高于另外两种菌(Yang et al., 2009;He et al., 2011), 从而对营养物质的消耗快有关.
3.4 Cr(Ⅵ)作用下菌株的比较转录组学分析转录组数据已上传至National Center for Biotechnology Information-Sequence Read Archive (NCBI SRA)数据库, 项目编号为PRJNA497242.对RNA-Seq数据中差异表达基因进行分析, 结果如表 1所示. H30组与C30组相比有1112个基因发生上调, 1196个基因发生下调; H180组与C180组相比有128个基因发生上调, 239个基因发生下调.其中, 长时暴露与短时暴露条件下相同的差异表达基因有346个, 仅在长时暴露中存在的差异表达基因有21个, 而短时暴露中单独存在的差异表达基因有1962个.可能是因为长时暴露条件下的细胞适应于Cr(Ⅵ)的存在, 所以在短时暴露条件下表达的一些细胞保护相关基因再次沉默, 特别是编码DNA修复相关蛋白的基因(Hu et al., 2005).
| 表 1 不同处理的差异表达基因统计 Table 1 Statistics of differentially expressed genes under different treatments |
根据短时暴露和长时暴露条件下差异表达基因的GO富集结果可知, 短时暴露中被显著富集的差异表达通路有43条, 其中, 生物过程、细胞组分和分子功能分别占72%、23%和5%;而长时暴露中被显著富集的通路有24条, 三大类分别占33%、38%及29%(于红艳等, 2018).故长时暴露与短时暴露相比, 总的差异表达通路减少, 生物过程所含通路差异表达比例明显下降, 分子功能所含通路比例明显上升.图 4所示分别为短时及长时暴露中显著富集的前15条GO通路, 其中, 短时暴露中富集率最高的通路为localization(GO:0051179), 而长时暴露中差异基因在cellular_component(GO:0005575)中富集率最高.
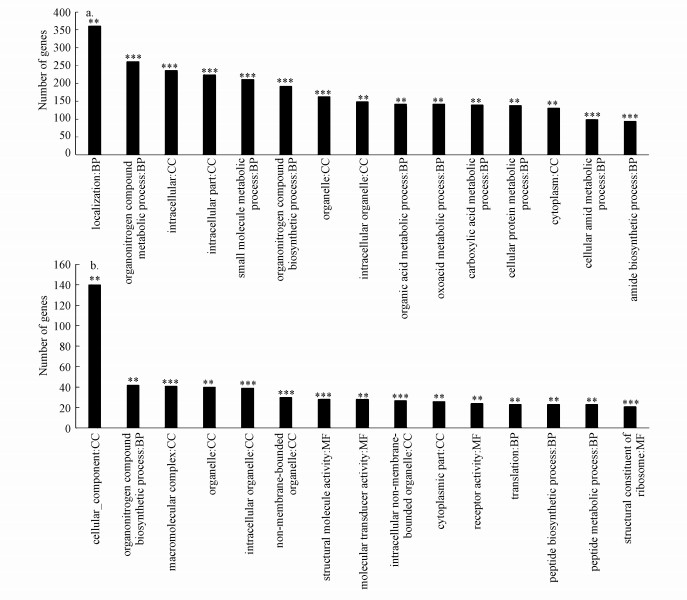 |
| 图 4 GO(Gene Ontology)富集分析柱状图(a.短时暴露条件下转录组与对照组比较的GO富集图; b.表示长时暴露条件下转录组与对照组比较的GO富集图)(注:图中每个柱子为一个通路, 横坐标文字表示通路的名称和分类, 柱子的高度即纵坐标表示富集的基因数; 显著性(富集率)用p表示, 其中, ***p < 0.001, **p < 0.01, *p < 0.05) Fig. 4 Bar chart of the enrichment in the gene ontology (GO) analysis |
将GO富集注释结果与差异表达基因的上调、下调倍数结合分析可知, 生物过程中富集的蛋白、氨基酸等的合成及代谢通路基本为下调通路.因为短时暴露时, 菌出现大量DNA修复相关基因上调, 消除有毒自由基的相关基因上调(超氧化物歧化酶基因DX03_RS11890上调21倍, 谷胱甘肽S-转移酶相关基因DX03_RS09970上调12倍), 来帮助细胞抵御Cr(Ⅵ)毒性(Hu et al., 2005;Chourey et al., 2008), 而蛋白代谢等次要途径则被下调.随Cr(Ⅵ)还原过程的进行, 在长时暴露时, 对抗Cr(Ⅵ)毒性的相关基因上调倍数下降, 其中最明显的是超氧化物歧化酶基因DX03_RS11890上调倍数变为5.6倍, 而被富集的生物过程下调途径也相应变少(图 4b).细胞组分中被富集的相关通路也基本为下调, 因为Cr(Ⅵ)存在时, 菌生长受到抑制, 故所需合成的细胞组分减少.而长时暴露过程中被富集的细胞组分相关通路少于短时暴露时, 这是因为随着菌对Cr(Ⅵ)还原的进行, 菌生长受到抑制减小, 一些通路下调不显著(Viti et al., 2014), 这与差异表达基因分析的结果一致.综上可知, 嗜根寡养单胞菌DSM 14405T细胞在受到200 mg·L-1 Cr(Ⅵ)刺激时会表现出显著的抗性, 具体表现为:上调胞内消除有毒自由基的相关基因上调胞内DNA修复相关基因, 防止DNA因为自由基受损; 同时下调细胞组分及蛋白代谢等相关通路, 减少能量损耗的同时可减少Cr(Ⅵ)的摄入.并且, 随着Cr(Ⅵ)的还原及细胞对环境的适应, Cr(Ⅵ)抗性相关基因及通路的调节在短时暴露中明显强于长时暴露时.
4 结论(Conclusions)1) 嗜根寡养单胞菌DSM 14405T具有较强的Cr(Ⅵ)还原能力, 50 mg·L-1的Cr(Ⅵ)在24 h内能被还原92.4%.
2) 嗜根寡养单胞菌DSM 14405T还原Cr(Ⅵ)的最高效经济的培养条件为30 ℃、pH=7.5、摇床转速180 r·min-1, 且在64 h内能两次完全还原所投加的50 mg·L-1的Cr(Ⅵ), 而在第3次投加后仅能还原35%左右.
3) 嗜根寡养单胞菌DSM 14405T细胞在受到200 mg·L-1的Cr(Ⅵ)刺激时会表现出显著的抗性, 具体表现为:大量上调胞内消除有毒自由基的相关基因; 上调胞内DNA修复相关基因; 同时下调细胞组分及蛋白代谢等相关通路.并且, 随着Cr(Ⅵ)的还原及细胞对环境的适应, Cr(Ⅵ)抗性相关基因及通路的调节在短时暴露中明显强于长时暴露时.
Arıca M Y, Bayramoglu G. 2005. Cr(Ⅵ) biosorption from aqueous solutions using free and immobilized biomass of Lentinus sajor-caju: Preparation and kinetic characterization[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 253(1/3): 203–211.
|
Baruthio F. 1992. Toxic effects of chromium and its compounds[J]. Biological Trace Element Research, 32: 145–153.
DOI:10.1007/BF02784599
|
Cervantes C, Campos-Garcia J, Devars S, et al. 2001. Interactions of chromium with microorganisms and plants[J]. FEMS Microbiology Reviews, 25(3): 335–347.
DOI:10.1111/j.1574-6976.2001.tb00581.x
|
Chourey K, Wei W, Wan X F, et al. 2008. Transcriptome analysis reveals response regulator SO2426-mediated gene expression in Shewanella oneidensis MR-1 under chromate challenge[J]. BMC Genomics, 9: 395.
DOI:10.1186/1471-2164-9-395
|
Egamberdieva D, Kucharova Z, Davarnov K, et al. 2010. Bacteria able to control foot and root rot and to promote growth of cucumber in salinated soils[J]. Biology and Fertility of Soils, 47(2): 197–205.
|
Flora S D, Bagnasco M, Serra D, et al. Genotoxicity of chromium compounds.A review[J]. Mutation Research, 238(2): 99–172.
DOI:10.1016/0165-1110(90)90007-X
|
高玉梅, 刘帅霞. 2014. 植物修复铬污染土壤的研究进展[J]. 广东化工, 2014, 41(5): 88–89.
DOI:10.3969/j.issn.1007-1865.2014.05.045 |
Ha N T, Sakakibara M, Sano S. 2011. Accumulation of Indium and other heavy metals by Eleocharis acicularis:an option for phytoremediation and phytomining[J]. Bioresource Technology, 102(3): 2228–2234.
DOI:10.1016/j.biortech.2010.10.014
|
He M, Li X, Liu H, et al. 2011. Characterization and genomic analysis of a highly chromate resistant and reducing bacterial strain Lysinibacillus fusiformis ZC1[J]. Journal of Hazardous Materials, 185(2/3): 682–688.
|
Hu P, Brodie E L, Suzuki Y, et al. 2005. Whole-genome transcriptional analysis of heavy metal stresses in Caulobacter crescentus[J]. Journal of Bacteriology, 187(24): 8437–8449.
DOI:10.1128/JB.187.24.8437-8449.2005
|
Kamran M A, Am na, Mufti R, et al. 2014. The potential of the flora from different regions of Pakistan in phytoremediation:A review[J]. Environmental Science and Pollution Research, 21(2): 801–812.
DOI:10.1007/s11356-013-2187-7
|
林永华. 2018. 六价铬还原菌Pseudomonas mandelii CH1的分离和鉴定[J]. 化学工程与装备, 2018(9): 312–316.
|
刘雪梅, 马闯, 陶嘉熙, 等. 2018. 二苯碳酰二肼分光光度法及其改进方法测定水体中Cr(Ⅵ)[J]. 应用化工, 2018, 47(6): 1308–1311.
DOI:10.3969/j.issn.1671-3206.2018.06.055 |
马亚梦, 王洋洋, 谭秀民, 等. 2015. Cr(Ⅵ)污染生物修复研究进展[J]. 安徽农业科学, 2015, 43(22): 176–178, 257.
DOI:10.3969/j.issn.0517-6611.2015.22.068 |
Ma Y, Rajkumar M, Luo Y, et al. 2011. Inoculation of endophytic bacteria on host and non-host plants-effects on plant growth and Ni uptake[J]. Journal of Hazardous Materials, 195: 230–237.
DOI:10.1016/j.jhazmat.2011.08.034
|
Megharaj M, Avudainayagam S, Naidu R. 2003. Toxicity of hexavalent chromium and its reduction by bacteria isolated from soil contaminated with tannery waste[J]. Current Microbiology, 47(1): 51–54.
DOI:10.1007/s00284-002-3889-0
|
Miretzky P, Cirelli A F. 2010. Cr(Ⅵ) and Cr(Ⅲ) removal from aqueous solution by raw and modified lignocellulosic materials:a review[J]. Journal of Hazardous Materials, 180(1/3): 1–19.
|
Mugerfeld I, Law B A, Wickham G S, et al. 2009. A putative azoreductase gene is involved in the Shewanella oneidensis response to heavy metal stress[J]. Applied Microbiology and Biotechnology, 82(6): 1131–1141.
DOI:10.1007/s00253-009-1911-1
|
Okeke B C. 2008. Bioremoval of hexavalent chromium from water by a salt tolerant bacterium, Exiguobacterium sp.GS1[J]. Journal of Industrial Microbiology & Biotechnology, 35(12): 1571–1579.
|
Poopal A C, Laxman R S. 2008. Hexavalent chromate reduction by immobilized Streptomyces griseus[J]. Biotechnology Letters, 30(6): 1005–1010.
DOI:10.1007/s10529-008-9662-0
|
Rakhshaee R, Giahi M, Pourahmad A. 2009. Studying effect of cell wall′s carboxyl-carboxylate ratio change of Lemna minor to remove heavy metals from aqueous solution[J]. Journal of Hazardous Materials, 163(1): 165–173.
DOI:10.1016/j.jhazmat.2008.06.074
|
Robins K J, Hooks D O, Rehm B H, et al. 2013. Escherichia coli NemA is an efficient chromate reductase that can be biologically immobilized to provide a cell free system for remediation of hexavalent chromium[J]. PLoS One, 8(3): e59200.
DOI:10.1371/journal.pone.0059200
|
邵明国, 瞿长波, 付美春, 等. 2014. 用观赏植物水培法修复含Cr(Ⅵ)污水[J]. 玉溪师范学院学报, 2014, 30(8): 32–36.
DOI:10.3969/j.issn.1009-9506.2014.08.007 |
Thacker U, Parihk R, Shouche Y, et al. 2007. Reduction of chromate by cell-free extract of Brucella sp.isolated from Cr(Ⅵ) contaminated sites[J]. Bioresource Technology, 98(8): 1541–1547.
DOI:10.1016/j.biortech.2006.06.011
|
Ullah A, Heng S, Munis M F H, et al. 2015. Phytoremediation of heavy metals assisted by plant growth promoting(PGP) bacteria:A review[J]. Environmental and Experimental Botany, 117: 28–40.
DOI:10.1016/j.envexpbot.2015.05.001
|
Viti C, Marchi E, Decorosi F, et al. 2014. Molecular mechanisms of Cr(Ⅵ) resistance in bacteria and fungi[J]. FEMS Microbiology Reviews, 38(4): 633–659.
DOI:10.1111/1574-6976.12051
|
Wolf A. 2002. Stenotrophomonas rhizophila sp.nov., a novel plant-associated bacterium with antifungal properties[J]. International Journal of Systematic and Evolutionary Microbiology, 52: 1937–1944.
|
Yang J, He M, Wang G. 2009. Removal of toxic chromate using free and immobilized Cr(Ⅵ)-reducing bacterial cells of Intrasporangium sp.Q5-1[J]. World Journal of Microbiology and Biotechnology, 25(9): 1579–1587.
DOI:10.1007/s11274-009-0047-x
|
于红艳, 张昕欣, 陈红云, 等. 2018. 利用比较转录组分析克雷白氏肺炎杆菌(Klebsiella pneumoniae Tzyx1)降解多环芳烃特性[J]. 环境科学学报, 2018, 38(2): 689–695.
|
张学洪, 罗亚平, 黄海涛, 等. 2006. 一种新发现的湿生铬超积累植物—李氏禾(Leersia hexandra Swartz)[J]. 生态学报, 2006, 26(3): 950–953.
DOI:10.3321/j.issn:1000-0933.2006.03.042 |
赵娜娜, 许继飞, 宋晓雪, 等. 2019. 嗜盐高效降酚菌株Halomonas sp.H17的筛选及降解苯酚特性[J]. 环境科学学报, 2019, 39(2): 318–324.
|
Zhu W, Yang Z, Ma Z, et al. 2007. Reduction of high concentrations of chromate by Leucobacter sp.CRB1 isolated from Changsha, China[J]. World Journal of Microbiology and Biotechnology, 24(7): 991–996.
|
 2019, Vol. 39
2019, Vol. 39


