随着我国经济的不断发展, 天然水体的污染问题日趋严重(宋钊, 2013;刘尚俭等, 2015).《2017年中国生态环境状况公报》显示, 在全国河流、重点湖泊的1940个国控监测断面中, 劣五类水质断面所占比例达到8.3%, 其中, 氮元素超标是河流污染的重要成因之一(环境保护部, 2017).生物脱氮作为经济有效的脱氮方法, 因具有低耗、高效、无污染等优势而成为河流治理的热点技术(Perelo, 2010).传统脱氮理论认为, 微生物的硝化、反硝化是由两种完全不同的菌群在好氧和缺氧环境下完成的生理生化过程, 很难在天然水体中同时发挥作用.异养硝化-好氧反硝脱氮菌的发现打破了传统脱氮技术的局限性, 使得硝化和反硝化过程在同一空间内完成.异养硝化菌能在利用有机物的同时将NH4+-N转化为NO2--N和NO3--N(Schmid et al., 2003);好氧反硝化菌能同时利用O2和硝化产物作为末端电子受体进行呼吸(Zhao et al., 2010).与自养硝化菌和厌氧反硝化菌相比, 异养硝化-好氧反硝化菌因具有生长速度快、耐氧适应性强、COD及NH4+-N去除率高等优势而具有广阔的应用前景.
近年来, 国内外学者对于异养硝化-好氧反硝化菌进行了广泛深入的研究, 分别从不同环境中筛选出同时具有硝化和反硝化能力的纯培养菌株, 并对其进行菌种鉴定和脱氮性能(Medhi et al., 2017;Wan et al., 2017;Zhao et al., 2018)及分子生物学机制(Li et al., 2012;Zhao et al., 2018)研究, 而且已有不少报道证明异养硝化-好氧反硝化菌株在高氨氮有机废水处理(Yang et al., 2011;Yang et al., 2015;王田野等, 2017)、贫营养型氮污染水库治理(Su et al., 2015)及冬季废水处理(He et al., 2016)等方面具有潜在应用价值.但有研究发现, 混合脱氮菌群生长快速稳定, 在相同实验条件下的脱氮效率和对复杂环境的适应能力均高于单菌株, 具有明显的氮素污染物去除优势(孙菲等, 2010;尹明锐等, 2010;雍佳君等, 2015).因此, 研究异养硝化-好氧反硝化混合菌群的脱氮性能对于生物脱氮技术的实际应用具有重要的意义.目前对于复合脱氮菌剂的制备主要是将分离筛选出的异养硝化-好氧反硝化纯培养菌株进行简单组合, 研究其脱氮性能(尹明锐等, 2010;黄郑郑等, 2017), 而以该种方式得到的复配菌群存在人为配对因素, 并不是自然筛分过程配伍形成的菌群.
基于此, 本研究从河道底泥中直接富集筛选具有异养硝化-好氧反硝化功能的脱氮菌群, 通过添加微量元素进行优化培养, 并考察其对受污染河水的脱氮性能.
2 材料与方法(Materials and methods) 2.1 菌种来源与培养基将取自天津市城区某纳污河流中表层0~10 cm的河道底泥装于灭菌取样瓶中, 放置在便携式低温(4 ℃)冷藏箱内, 24 h内运回实验室, 分别采用以下3种培养基进行功能菌群富集培养.所有培养基在使用前于121 ℃条件下湿热灭菌30 min.
异养硝化-好氧反硝化培养基(SNDM):柠檬酸钠6 g, (NH4)2SO4 1 g, KNO3 2 g, K2 HPO4 0.3 g, KH2PO4 0.2 g, MgSO4·7H2O 0.2 g, 补充蒸馏水至1 L, pH=7.0.
异养硝化培养基(HNM):柠檬酸钠4.902 g, (NH4)2SO4 0.382 g, K2HPO4 0.3 g, KH2PO4 0.2 g, MgSO4·7H2O 0.05 g, NaCl 0.12 g, FeSO4 0.01 g, MnSO4·H2O 0.01 g, 补充蒸馏水至1 L, pH=7.0.
好氧反硝化培养基(DM):柠檬酸钠5 g, KNO3 2 g, K2HPO4 0.3 g, KH2PO4 0.2 g, MgSO4·7H 2O 0.05 g, 补充蒸馏水至1 L, pH=7.0.
2.2 功能菌群的富集筛选取河道底泥5 g, 分别接种于100 mL灭菌的SNDM、HNM、DM培养基中, 于室温下静置培养3~4 d, 分别转接入新鲜的培养基中, 扩大培养3次, 获得初步筛选的优势菌群.每种培养基设置2个平行样, 检测培养基中氨氮、亚硝酸盐氮、硝酸盐氮含量, 取氮素浓度低的混合菌液作为初筛菌群.
将筛选出的异养硝化-好氧反硝化优势功能菌群(H)、异养硝化优势功能菌群(Y)、好氧反硝化优势功能菌群(F)按体积比5%分别接种于装有100 mL新鲜培养基的锥形瓶中, 置于30 ℃的生化培养箱中静置培养, 进行菌群生长和脱氮实验研究.
2.3 功能菌群种群结构分析分别取培养至对数生长期的菌液30 mL, 使用FastDNATM Spin Kit for Soil DNA提取试剂盒提取微生物总DNA, 具体操作步骤按产品说明书进行.对提取出的DNA样品的浓度和纯度采用微量紫外-可见分光光度计(UV-Vis Spectrophotometer Q9000, Quawell, USA)进行检测.提取的DNA一部分于-20 ℃保存, 另一部分用细菌的特异性引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492F (5′-TTGGYTACCTTGTTACGACT-3′)进行PCR扩增, PCR扩增产物用Illumina MiSeq平台(北京诺禾致源科技股份有限公司)双端测序分析.
2.4 功能菌群的优化培养分别向异养硝化-好氧反硝化脱氮菌群、异养硝化菌群、好氧反硝化菌群的无菌培养基中加入不同量的微量元素浓缩液, 微量元素浓缩液与培养基体积比分别设置为0、0.5、1、1.5、2 mL·L-1, 在30 ℃的培养箱中连续培养3 d, 在培养结束后检测培养基中氨氮、硝酸盐氮、总氮浓度.
微量元素浓缩液(1 L):FeSO4·7H2O 5 g, EDTA 50 g, ZnSO4·7H2O 3.93 g, H3BO3 11 g, MnSO4·H2O 4.32 g, CoCl2·6H2O 1.61 g, CuSO4·5H2O 1.57 g, (NH4)6Mo7O24·4H2O 1.1 g, pH=6.0.
2.5 优势功能菌群对模拟河水净化效果实验取优化培养的H、Y、F菌液各10 mL, 在4 ℃、8000 r·min-1下离心10 min, 弃去上清液后, 菌体用无菌纯水洗涤, 离心, 如此方式反复洗涤3次(郭琳, 2015).用无菌纯水将各洗涤后的菌体混匀并稀释至OD600=0.5, 在无菌条件下取各功能菌群的菌液, 按表 1所示的接种量分别接种于300 mL模拟河水中, 36 h后检测模拟河水中氮类元素指标.模拟河水是通过向天然河水样品中添加柠檬酸钠、硫酸铵和硝酸钾来调整部分水质指标近似为地表Ⅴ类水水质, 模拟河水的NH4+-N、NO3--N、TN和COD分别为1.905、0.981、2.886和35 mg·L-1, 未检测到NO2--N.
| 表 1 菌群的组合方案 Table 1 Combination scheme of bacteria group |
菌体浓度采用紫外分光光度法通过测定OD600获得;总氮(TN)、氨氮(NH4+-N)、硝氮(NO3--N)、亚硝氮(NO2--N)等均参照文献方法测定(国家环境保护总局, 2002), 其中, TN测定采用碱性过硫酸钾消解-紫外分光光度法, NH4+-N测定采用纳氏试剂比色法, NO3--N测定采用紫外分光光度法, NO2--N测定采用N-(1-萘基)-乙二胺光度法, COD测定采用HACH法.测定总氮、氨氮、硝氮、亚硝氮、COD时, 样品在4 ℃、8000 r·min-1下离心10 min, 用0.45 μm滤膜过滤上清液后进行测定, 所有指标检测均取3个平行样.
3 结果与讨论(Results and discussion) 3.1 功能菌群生长与脱氮性能将富集的3种脱氮功能菌群分别接种于新鲜培养基中, 于30 ℃恒温静置培养, 取混合菌群菌液样品测定OD600和氮素指标, 用以检测菌体生长及氮素降解过程.3种功能菌群的生长及脱氮性能分别如图 1所示.
 |
| 图 1 异养硝化-好氧反硝化菌群(H)(a)、异养硝化菌群(Y)(b)和好氧反硝化菌群(F)(c)的氮素去除和生长曲线 Fig. 1 Nitrogen removal and microbial growth of three cultures, heterotrophic nitrification-aerobic denitrifiers community (a), heterotrophic nitrifiers community (b) and aerobic denitrifiers community(c) |
由图 1a可知, 异养硝化-好氧反硝化功能菌群H经过短暂的延迟期(大约12 h)后菌体生长活跃, 菌群总量迅速增长, 培养48 h后菌密度OD600达到最大, 随后菌体进入衰亡期.通过生长曲线可掌握该混合菌的生长规律, 为研究其脱氮性能奠定基础.在培养12~60 h时, 观察到氮元素被显著去除, 氨氮从195.804 mg·L-1下降至105.489 mg·L-1, 硝酸盐氮从226.979 mg·L-1下降至7.550 mg·L-1, 且降解趋势保持一致, 说明优势功能菌群H能同时进行硝化反硝化.在细菌生长至稳定期和衰亡期时, 混合菌群H仍能保持较高的氮素降解速率, 说明氮素的去除不仅是细菌细胞合成所致, 同时也是细胞代谢功能的体现, 从而证明了混合菌群的脱氮功能.在培养过程的0~48 h, 亚硝酸盐氮有所积累, 这可能是由于氨化-反硝化速率较快, 造成了亚硝酸盐氮积累, 随后氨化-反硝化速率降低, 亚硝酸盐去除速率提高, 最终被完全降解, 这与Zhang等(2017)的研究结果一致.
由图 1b可知, 异养硝化功能菌群Y经过12 h的缓慢增殖后, 菌体进入对数生长期.培养至48 h时, 菌体浓度达到最高, 氨氮也被迅速降解至11.503 mg·L-1.在此阶段对氨氮的去除与细菌生长趋势保持一致, 说明异养硝化细菌群对氨氮的去除主要为同化作用.48 h后菌体进入衰亡期, 但混合菌Y对氨氮仍具有降解效果, 在72 h时氨氮总去除率达到85.09%.在反应初期, 硝酸盐氮仅有少量积累(7.415 mg·L-1), 随后很快被降解.在氨氮浓度趋于稳定时, 并没有发现硝酸盐氮和亚硝酸盐氮的积累, 说明该混合菌群可能具有反硝化脱氮功能.
由图 1c可知, 经过12 h的缓慢生长, 好氧反硝化混合菌群F进入对数生长期, 48 h后进入稳定生长期.经过72 h的培养, 硝酸盐氮的去除率达到99.25%.在培养过程中出现了亚硝酸氮的积累, 但最终被完全降解, 说明在以硝酸盐氮为唯一氮源的条件下, 混合细菌F的生长伴随着反硝化代谢反应的进行.
3.2 功能微生物种群结构采用Illumina MiSeq高通量测序分析各脱氮功能菌群的种群结构, 结果如图 2所示.异养硝化-好氧反硝化培养(H)中功能菌的相对丰度为54.72%, 分别为Alcaligenes(产碱杆菌属, 50.97%)、Pseudomonas(假单胞菌属, 1.45%)、Hyphomicrobium(生丝微菌属, 1.39%)、Thauera(陶厄氏菌属, 0.91%);异养硝化培养(Y)中功能菌的相对丰度为46.26%, 分别为Pseudomonas(假单胞菌属, 44.45%)、Alcaligenes(产碱杆菌属, 0.94%)、Thauera(陶厄氏菌属, 0.87%);好氧反硝化培养(F)中功能菌的相对丰度达91.57%, 分别为Pseudomonas(假单胞菌属, 78.26%)和Comamonas(从毛单菌属, 13.31%).在上述的菌属中, Pseudomonas(假单胞菌属)、Alcaligenes(产碱杆菌属)和Thauera(陶厄氏菌属)被证实具有异养硝化-好氧反硝化功能, Hyphomicrobium(生丝微菌属)和Comamonas(从毛单菌属)具有好氧反硝化功能(Gumaelius et al., 2001;Liu et al., 2015;史佳媛, 2015;Li et al., 2015;He et al., 2016).因此, 异养硝化培养(Y)的功能菌群也具有反硝化脱氮功能, 在培养过程中, 培养基中没有硝酸盐和亚硝酸盐的积累(图 2).近年来许多研究发现, 好氧反硝化菌同时具有异养硝化功能(苏俊峰等, 2007;王景峰等, 2011), 但不同菌属的硝化和反硝化能力不同.由图 2可知, 在属的水平上, 由于培养条件的不同, 3组优势功能菌群结构存在显著性差异, 但主要为异养硝化-好氧反硝化菌.菌种鉴定结果表明, 各选择性培养基均培养出具有特定功能的混合脱氮菌.
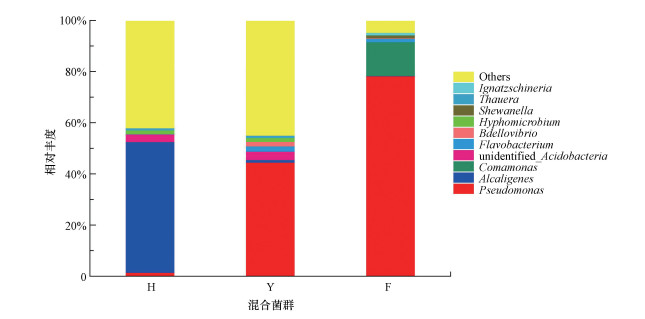 |
| 图 2 属水平上混合脱氮菌群落结构组成 Fig. 2 Heterotrophic nitrification-aerobic denitrifiers community structure at the genus level |
史佳媛(2015)从河道底泥中富集筛选异养硝化-好氧反硝化菌群, 在优化培养及其扩大培养的实验中, 两种混合菌液共检测到204个菌属, 其中, 优势脱氮功能菌均为Pseudomonas(假单胞菌属)和Alcaligenes(产碱杆菌属), 约占微生物总量的73.96%、90.61%.康鹏亮等(2018)从不同湖库沉积物中筛选出好氧反硝化脱氮功能菌群H-30、X-10和C-30, 其中, Pseudomonas(假单胞菌属)和Bacillus(芽孢杆菌属)为主要的优势脱氮功能菌.由于菌种来源、富集方式的不同, 本次筛选的异养硝化-好氧反硝化菌群结构与史佳媛(2015)、康鹏亮等(2018)筛选出的脱氮功能菌群结构具有差异, 但主要优势脱氮功能菌的属种保持一致.
3.3 微量元素对菌群脱氮效果的影响微量元素在微生物的生长繁殖过程中具有重要作用.由图 3可知, 添加一定量的微量元素有助于提高脱氮功能菌群的氮素去除能力.在添加微量元素浓缩液0.5 mL·L-1时, 异养硝化-好氧反硝化菌群(H)和好氧反硝化菌群(F)的脱氮效果均为最佳, 此时菌群H对NH4+-N、NO3--N和TN的去除率分别为69.11%、99.06%和84.86%;菌群F对NO3--N和TN的去除率分别为99.62%和98.23%.但微量元素对异养硝化菌群(Y)脱氮效果的影响不明显, 在不添加微量元素时, NH4+-N和TN去除率最高, 分别为82.60%、81.41%.异养硝化-好氧反硝化菌在代谢底物时, 氨单加氧酶(AMO)将氨氮氧化为羟氨, 在羟氨氧化酶(HAO)的催化作用下, 羟氨一部分被氧化为亚硝酸盐氮, 另一部分直接转化为N2O, AMO和HAO是异养硝化过程中的关键酶;在反硝化过程中, 存在于细胞中的周质硝酸盐还原酶(NAR)和亚硝酸盐还原酶(NIR)在好氧条件下催化还原反应(Richardson et al., 1998;何霞等, 2006;杨婷等, 2017).在这个过程中, 金属离子以各种方式参与酶的催化反应(Kim et al., 2005).研究表明, 氨单加氧酶被认为存在一个易变的Cu2+活性位点, 能被Cu2+刺激活化(于大禹等, 2012), 铜型亚硝酸盐还原酶在有氧和无氧条件下都能表达(王永刚等, 2017);非血红素Fe羟氨氧化酶在异养硝化-好氧反硝化菌中广泛分布, 在氮氧化物还原酶中也检测到Fe2+的存在(宋琴等, 2008);Mn2+能促进异养硝化-好氧反硝化菌的生长和氨氮转化速率, BO33-和Ca2+对NH4+-N的同化也有一定的影响(Zhao et al., 2010).微量元素的添加可以激发混合菌群H和F酶系统的活性, 促进细菌对氮元素的同化、硝化和反硝化进程.一定浓度范围的金属离子对酶活性有一定促进作用, 但当环境中金属离子超过这个范围时, 会抑制酶的活性.王瑶等(2014)在探究金属离子对粪产碱杆菌C16脱氮性能影响实验中发现, 分别添加0、0.1、1、3 mmol·L-1金属离子时, 随着Fe2+浓度增大, Fe2+会明显促进C16的生长和NH4+-N氧化速率, 但较高浓度的Mn2+对C16的生长和氨氮去除有抑制作用.本试验中微量元素未对异养硝化菌群有明显促进作用, 推测是由于异养硝化培养基中已有Fe2+和Mn2+的存在, 微量元素浓缩液的添加使Mn2+超过促进作用浓度范围而产生抑制效果.实验结果表明, 在对不同的异养硝化-好氧反硝化菌群进行优化培养时, 应根据实际情况选择微量元素用量.
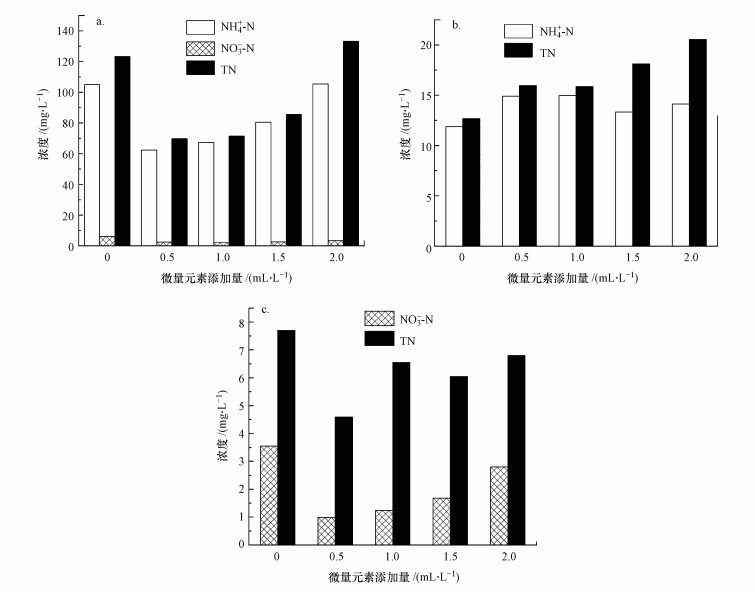 |
| 图 3 微量元素对脱氮菌群脱氮效果影响 (a.异养硝化-好氧反硝化菌群, b.异养硝化菌群, c.好氧反硝化菌群) Fig. 3 Effect of trace elements on nitrogen removal of three heterotrophic nitrification-aerobic denitrifier communities (a. the heterotrophic nitrification-aerobic denitrifiers community, b. the heterotrophic nitrification community, c. the aerobic denitrifiers community) |
将生长至对数期的优化培养的3组功能菌群H、Y、F及其复合菌群按体积比1%的比例直接投加至模拟河水中, 探究其对受污染河水的处理效果, 处理前后的水质如表 2所示.结果表明, 各混合脱氮功能菌群及其复合菌群均能有效地去除COD和TN, 处理后水质均达到地表水Ⅳ类相关标准.与混合菌群Y和F相比, 菌群H对氨氮、硝酸盐氮和总氮的去除效果较好, 去除率分别为88.17%、100%和65.78%.当不同脱氮菌共存于同一环境时, 共同培养存在的协同和竞争作用也会影响脱氮性能(黄郑郑等, 2017).由表 2可见, 复合菌株H+Y、H+F、Y+F、H+Y+F的脱氮性能较相应的混合菌群均有提高, 表明在同一个异养硝化-好氧反硝化反应体系中, 菌群H、Y和F具有协同作用.复合菌群H+Y+F的氮素去除效果最佳, 在36 h时氨氮、硝酸盐氮和总氮的浓度分别为0.182、0.000和0.501 mg·L-1.
| 表 2 模拟河水水质变化情况 Table 2 Nitrogen and COD removal of the simulated river water |
传统的脱氮功能菌群的筛选通常采用平板稀释涂布技术, 通过分离纯化过程获得单一菌株, 存在分离过程的偶然性;将分离筛选出的纯菌株配对组合形成复合菌株, 存在人为干扰因素.本研究通过直接富集筛选具有特定功能的混合微生物, 研究其脱氮性能, 并将复合菌剂应用于城市污染河流的修复过程, 具有更稳定高效的净化效果, 可以在一定程度上降低水体富营养化程度, 改善城市水体环境.
4 结论(Conclusions)1) 采用选择性培养基, 成功地从河道底泥中富集筛选出具有高效脱氮效果的异养硝化-好氧反硝化功能菌群(H)、异养硝化功能菌群(Y)和好氧反硝化功能菌群(F).经高通量测序分析发现, 混合菌群H、Y、F中功能菌的比例分别为54.72%、46.26%和91.57%, 且主要为异养硝化-好氧反硝化菌, 但由于培养条件的不同, 各混合菌群种群结构存在明显差异.
2) 混合菌群H和F在添加微量元素浓缩液0.5 mL·L-1时脱氮性能最佳, 在第72 h时混合菌群H对氨氮、硝酸盐氮和总氮的去除率分别为69.11%、99.06%和84.86%, 混合菌群F对硝酸盐氮和总氮的去除率分别达到99.62%和98.23%, 而混合菌群Y在不添加微量元素时氨氮和总氮的去除效率最高, 分别为82.60%和81.41%.
3) 经优化培养的3组混合菌群的复合菌群(H+Y、Y+F、H+F、H+Y+F)具有协同作用, 脱氮性能较相应混合菌群均有提高.其中, 复合菌群H+Y+F的氮素去除效果最好, 在36 h时氨氮、硝酸盐氮和总氮的去除率分别为89.98%、100%和81.97%, 说明本研究富集筛选出的混合脱氮菌群在实际河水净化中具有潜在应用价值.
Gumaelius L, Magnusson G, Pettersson B, et al. 2001. Comamonas Denitrificans sp.nov., an efficient denitrifying bacterium isolated from activated sludge[J]. International Journal of Systematic and Evolutionary Microbiology, 51(3): 999–1006.
DOI:10.1099/00207713-51-3-999
|
郭琳.2015.水源水库中好氧反硝化菌的筛选及脱氮性能研究[D].西安: 西安建筑科技大学.1-131
http://cdmd.cnki.com.cn/Article/CDMD-10703-1016741615.htm |
国家环境保护总局. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社: 1–784.
|
He T, Li Z, Sun Q, et al. 2016. Heterotrophic nitrification and aerobic denitrification by Pseudomonas tolaasii Y-11 without nitrite accumulation during nitrogen conversion[J]. Bioresource Technology, 200(1): 493–499.
|
何霞, 吕剑, 何义亮, 等. 2006. 异养硝化机理的研究进展[J]. 微生物学报, 2006, 46(5): 844–847.
DOI:10.3321/j.issn:0001-6209.2006.05.034 |
环境保护部.2017.2017年中国生态环境状况公报[R].北京: 环境保护部.1-55
|
黄郑郑, 曹刚, 陈海升, 等. 2017. 异养硝化-好氧反硝化菌协同竞争对脱氮特性的影响[J]. 环境科学研究, 2017, 30(5): 765–7.
|
康鹏亮, 张海涵, 黄廷林, 等. 2018. 湖库沉积物好氧反硝化菌群脱氮特性及种群结构[J]. 环境科学, 2018, 39(5): 2431–2437.
|
Kim J K, Park K J, Cho K S, et al. 2005. Aerobic nitrification-denitrification by heterotrophic Bacillus strains[J]. Bioresource Technology, 96(17): 1897–1906.
DOI:10.1016/j.biortech.2005.01.040
|
Li A, Gai Z, Cui D, et al. 2012. Genome sequence of a highly efficient aerobic denitrifying bacterium, Pseudomonas stutzeri T13[J]. Journal of Bacteriology, 194(20): 5720–5720.
DOI:10.1128/JB.01376-12
|
Li C, Yang J, Wang X, et al. 2015. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a phosphate accumulating bacterium Pseudomonas stutzeri YG-24[J]. Bioresource Technology, 182: 18–25.
DOI:10.1016/j.biortech.2015.01.100
|
Liu Y, Wang Y, Li Y, et al. 2015. Nitrogen removal characteristics of heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis C16[J]. Chinese Journal of Chemical Engineering, 23(5): 827–834.
DOI:10.1016/j.cjche.2014.04.005
|
刘尚俭, 邱建, 安雅敏, 等. 2015. 河流生态修复浅议[J]. 环境影响评价, 2015, 37(1): 82–85.
|
Medhi K, Singhal A, Chauhan D K, et al. 2017. Investigating the nitrification and denitrification kinetics under aerobic and anaerobic conditions by Paracoccus denitrificans ISTOD1[J]. Bioresource Technology, 242: 334–343.
DOI:10.1016/j.biortech.2017.03.084
|
Perelo L W. 2010. Review:In situ and bioremediation of organic pollutants in aquatic sediments[J]. Journal of Hazardous Materials, 177(1/3): 81–89.
|
Richardson D J, Wehrfritz J M, Keech A, et al. 1998. The diversity of redox proteins involved in bacterial heterotrophic nitrification and aerobic denitrification[J]. Biochemical Society Transactions, 26(3): 401–408.
DOI:10.1042/bst0260401
|
Schmidt I, Sliekers O, Schmid M, et al. 2003. New concepts of microbial treatment process for the nitrogen removal in wastewater[J]. Fems Microbiology Reviews, 27(4): 481–492.
DOI:10.1016/S0168-6445(03)00039-1
|
Su J F, Zhang K, Huang T L, et al. 2015. Heterotrophic nitrification and aerobic denitrification at low nutrient conditions by a newly isolated bacterium, Acinetobacter sp.SYF26[J]. Microbiology, 161(4): 829–837.
DOI:10.1099/mic.0.000047
|
史佳媛.2015.脱氮优势菌群筛选及其固定化应用于河道底泥修复[D].南京: 东南大学.1-61
http://cdmd.cnki.com.cn/Article/CDMD-10286-1016753326.htm |
宋琴, 许雷. 2008. 异养硝化作用酶学研究进展[J]. 生物技术通报, 2008(5): 60–62.
|
宋钊. 2013. 城市河流水污染治理及修复技术[J]. 工业用水与废水, 2013, 44(4): 6–8.
DOI:10.3969/j.issn.1009-2455.2013.04.002 |
苏俊峰, 王继华, 马放, 等. 2007. 好氧反硝化细菌的筛选鉴定及处理硝酸盐废水的研究[J]. 环境科学, 2007, 28(10): 2332–2335.
DOI:10.3321/j.issn:0250-3301.2007.10.031 |
孙菲, 方金武, 蔡昌凤, 等. 2010. 好氧反硝化菌群的筛选及其培养条件的研究[J]. 安徽工程大学学报, 2010, 25(2): 36–39.
DOI:10.3969/j.issn.2095-0977.2010.02.011 |
Wan W, He D, Xue Z. 2017. Removal of nitrogen and phosphorus by heterotrophic nitrification-aerobic denitrification of a denitrifying phosphorus-accumulating bacterium Enterobacter cloacae HW-15[J]. Ecological Engineering, 99: 199–208.
DOI:10.1016/j.ecoleng.2016.11.030
|
王景峰, 金敏, 谌志强. 2011. 1株好氧脱氮菌的筛选与脱氮特性研究[J]. 环境科学, 2011, 32(8): 2409–2413.
|
王田野, 魏荷芬, 胡子全, 等. 2017. 一株异养硝化好氧反硝化菌的筛选鉴定及其脱氮特性[J]. 环境科学学报, 2017, 37(3): 945–952.
|
王瑶, 刘玉香, 安华, 等. 2014. 金属离子对粪产碱杆菌C16的脱氮和亚硝酸盐积累的影响[J]. 微生物学通报, 2014, 41(11): 2254–2263.
|
王永刚, 王旭, 张俊娥, 等. 2017. 好氧反硝化细菌研究及应用进展[J]. 工业水处理, 2017(2): 12–17.
|
杨婷, 杨娅, 刘玉香. 2017. 异养硝化-好氧反硝化的研究进展[J]. 微生物学通报, 2017, 44(9): 2213–2222.
|
尹明锐, 汪苹, 刘健楠, 等. 2010. 复合脱氮菌群的构建及其脱氮特性研究[J]. 食品科学技术学报, 2010, 28(3): 55–59.
DOI:10.3969/j.issn.1671-1513.2010.03.011 |
雍佳君, 成小英. 2015. 蠡河底泥中反硝化复合菌群富集及菌群结构研究[J]. 环境科学, 2015, 36(6): 2232–2238.
|
于大禹, 张琳颖, 高波. 2012. 异养硝化-好氧反硝化菌异养硝化性能的影响因素[J]. 化工进展, 2012, 31(12): 2797–2800.
|
Yang L, Ren Y X, Liang X, et al. 2015. Nitrogen removal characteristics of a heterotrophic nitrifier Acinetobacter junii YB and its potential application for the treatment of high-strength nitrogenous wastewater[J]. Bioresource Technology, 193: 227–233.
DOI:10.1016/j.biortech.2015.05.075
|
Yang X P, Wang S M, Zhang D W, et al. 2011. Isolation and nitrogen removal characteristics of an aerobic heterotrophic nitrifying-denitrifying bacterium, Bacillus subtilis A1[J]. Bioresource Technology, 102(2): 854–862.
DOI:10.1016/j.biortech.2010.09.007
|
Zhang S, Sun X, Fan Y, et al. 2017. Heterotrophic nitrification and aerobic denitrification by Diaphorobacter polyhydroxybutyrativorans SL-205 using poly(3-hydroxybutyrate-co-3-hydro-xyvalerate) as the sole carbon source[J]. Bioresource Technology, 241: 500–507.
DOI:10.1016/j.biortech.2017.05.185
|
Zhao B, Cheng D Y, Tan P, et al. 2018. Characterization of an aerobic denitrifier Pseudomonas stutzeri strain XL-2 to achieve efficient nitrate removal[J]. Bioresource Technology, 250: 564–573.
DOI:10.1016/j.biortech.2017.11.038
|
Zhao B, He Y L, Huang J, et al. 2010. Heterotrophic nitrogen removal by Providencia rettgeri strain YL[J]. Journal of Industrial Microbiology and Biotechnology, 37(6): 609–616.
DOI:10.1007/s10295-010-0708-7
|
Zhao B, He Y, Hughes J, et al. 2010. Heterotrophic nitrogen removal by a newly isolated Acinetobacter calcoaceticus HNR[J]. Bioresource Technology, 101(14): 5194–5200.
DOI:10.1016/j.biortech.2010.02.043
|
 2019, Vol. 39
2019, Vol. 39


