2. 广东省环境污染控制与修复技术重点实验室, 广州 510275
2. Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology, Guangzhou 510275
四溴双酚A(Tetrabromobisphenol A, TBBPA)作为溴代阻燃剂的一种典型代表, 具有良好的阻燃特性及低廉的成本优势, 常作为添加型和反应型阻燃剂及反应中间体而广泛应用于塑料、橡胶、纤维和造纸等工业产品及电路板等电子产品中(Binaglia et al., 2015;Liu et al., 2016).这些产品在生产、使用和处理处置过程中, 所含有的TBBPA可通过生活污水、垃圾渗滤液和粉尘等途径进入到环境介质中(Li et al., 2011;Liu et al., 2016;Tao et al., 2016).目前, 已在各种环境介质(Zhu et al., 2014)、生物体(Zhu et al., 2018)及人体内(Jakobsson et al., 2002)检测到TBBPA的存在.与此同时, 相关研究表明TBBPA对微生物、植物和动物均具有一定的生物毒性, 能影响生物的生长、发育、代谢及生殖活动(杜青平等, 2012;Xiong et al., 2015;Xiong et al., 2016;Chen et al., 2018;Zhang et al., 2018), 因而引起全世界的广泛关注.
微生物在去除持久性有机污染物中占有极为重要的地位, 微生物法去除TBBPA具有广泛的适用性, 且其发展相对更为成熟、经济、高效.目前已报道了许多微生物去除TBBPA的成果, 如Kim等(2008)发现在污水处理过程中活性污泥可以去除60%以上的TBBPA;Peng等(2014)和Wang等(2013)研究了不同单一菌株在厌氧条件下对TBBPA的降解特性;An等(2011)研究了单一菌株在好氧条件下对TBBPA的降解特性.目前, 有关微生物降解TBBPA的研究主要集中在单一菌株在厌氧条件下对TBBPA的去除及其风险评估方面, 关注TBBPA在活性污泥中去除的研究相对较少.Peng等(2017a)研究了严格厌氧条件下活性污泥去除TBBPA的特性及产物;Islam等(2018)研究了异养硝化污泥在间歇式活性污泥系统中对TBBPA去除的强化作用.但关于TBBPA在好氧且局部厌氧环境中的降解研究仍有不足.
鉴于此, 本文以TBBPA为研究对象, 探究活性污泥降解TBBPA的特性并优化其降解条件.同时, 研究不同水质及光照条件等外部因素对该降解过程的影响, 并对其降解过程进行生态风险评估, 检测降解中间产物以推导其降解途径, 以期为自然环境中TBBPA的降解过程优化及风险评估提供理论参考.
2 材料与方法(Materials and methods)从广州市番禺区前锋污水处理厂的活性污泥池取回活性污泥, 使用无菌生理盐水洗涤3次以去除夹带物质后启动SBR反应器.在进水中添加5.00 mg·L-1 TBBPA, 待反应器出水水质稳定后, 取反应器内活性污泥进行后续试验.
2.1 主要试剂TBBPA(分析纯, 98%)购自北京百灵威试剂有限公司.活性污泥培养基(营养液)配方:NaCl 530 mg·L-1, KH2PO4 2990 mg·L-1, Na2HPO4 6810 mg·L-1, NH4Cl 20.4 mg·L-1, CaCl2 0.75 mg·L-1, MgSO4·7H2O3 mg·L-1, Ni2SO4·7H2O 0.25 mg·L-1, FeCl3 0.25 mg·L-1, MnCl2·4H2O 0.05 mg·L-1, ZnCl2 0.05 mg·L-1, CoCl2 0.05 mg·L-1, H24Mo7N6O24 0.02 mg·L-1, CuCl2 0.01 mg·L-1, C6H12O6 1000 mg·L-1, pH=7.0;河水水质:NH3-N 1.08 mg·L-1, NO3--N 2.07 mg·L-1, NO2--N 0.18 mg·L-1, TN 5.49 mg·L-1, PO3--P 0.44 mg·L-1, TP 2.03 mg·L-1, COD 11 mg·L-1, pH=7.2.
2.2 试验方法 2.2.1 富集及培养TBBPA降解菌群从SBR反应器中抽取2 mL菌液, 转移至含有200 mL无机盐培养液的锥形瓶中混匀后转移至50 mL离心管中进行离心(4000 r·min-1, 4 ℃, 10 min), 弃去上清液并将菌体沉淀转移至装有200 mL营养液的250 mL锥形瓶中, 加入TBBPA母液(0.1 mol·L-1 NaOH溶液配制)使血清瓶中TBBPA初始浓度为5.00 mg·L-1, 使用透气封口膜封口锥形瓶, 于恒温振荡器(30 ℃, 150 r·min-1)中避光培养.每天定时重复离心、更换营养液、添加TBBPA等步骤.培养3 d后, 将其分装至多个锥形瓶中扩大培养.
2.2.2 批次试验为探究活性污泥降解TBBPA的特性和规律, 设计批次试验.在100 mL锥形瓶中加入OD600=0.60、pH=7.0的菌液100 mL, 再添加一定量的TBBPA母液控制体系内TBBPA浓度为设定值, 置于恒温振荡器(30 ℃, 150 r·min-1)中振荡培养, 定期取样, 每组设置3个平行.
2.2.3 HPLC分析TBBPA浓度的测定采用高效液相色谱法, 每次取1.0 mL样品, 经0.22 μm尼龙有机滤膜过滤后转入2.0 mL棕色样品瓶, 再使用0.5 mL甲醇将滤膜内截留的TBBPA洗下并转移至同一棕色样品瓶.样品于4 ℃保存, 尽快测定.高效液相色谱仪检测器为1260 Infinity Ⅱ VWD(安捷伦, 美国), 检测波长209 nm, 色谱柱采用InfinityLab Poroshell 120 EC-C18 (4.6 mm×100 mm 4-Micron), 流动相为甲醇/水=85/15 (V/V), 流速0.8 mL·min-1, 柱温30 ℃.
2.2.4 统计学分析响应面分析(Response Surface Analysis, RSM)是一种常用的最优化方法, 它以图形的形式将体系中因变量与多个自变量间的函数关系显示出来, 可直观地选择试验设计中的最优化条件(Zhou et al., 2011).本试验使用Design-Expert软件, 以Box-Behnken模型设计建立响应曲面模型, 研究影响TBBPA降解的主要变量间的交互关系, 以确定该活性污泥降解TBBPA的最佳条件(Peng et al., 2013a;Luo et al., 2017).
2.2.5 溴离子含量测定吸取10 mL待测溶液至比色管中, 加入适量乙酸-乙酸钠缓冲溶液调节溶液pH值为4.6 ~ 4.7.加入0.4 mL酚红溶液(0.24 g·L-1)并充分摇匀, 溶液显亮黄色后加入1.00 mL氯胺T溶液(2 g·L-1), 计时摇动2 min.加入1.00 mL硫代硫酸钠溶液(25 g·L-1), 摇动15 s.使用蒸馏水定容至25 mL, 放置15 min, 在波长为595 nm处测定其吸光度, 根据标准曲线计算溴离子浓度.
2.2.6 TBBPA降解中间产物测定降解中间产物的定性分析采用离子淌度-Q-TOF高分辨液质联用仪(LC-Q-TOF-/MS/MS), 参数设置如下:色谱柱为Zorbax Eclipse XDB C18柱(150 mm×2.1 mm, Particle Size. 5 μm), 进样量4 μL, 柱温35 ℃, 流动相中A相为水(0.1%甲酸), B相为甲醇(0.1%甲酸), 洗脱方式为梯度洗脱.
2.2.7 毒性风险评估使用典型明亮发光杆菌(Photobacterium phosphoreumi)作为受试菌, 采用生物毒性测试仪(DXY-3型, 中国研究院南京土壤研究所, 中国)检测其发光强度的变化, 定期取样并立刻进行毒性试验(金彩霞等, 2017).以样品对发光细菌的抑制率表示其毒性大小, 发光细菌发光强度的相对抑制率I按式(1)计算.
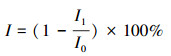
|
(1) |
式中, I1为样品的发光强度, I0为对照组的发光强度.
3 结果与讨论(Results and discussion) 3.1 活性污泥对TBBPA的降解效果研究设置2组试验探究活性污泥对TBBPA的降解效果, 试验设置条件如下:TBBPA初始浓度为5.00 mg·L-1, 其他条件见2.2.2节, 灭菌组为同等浓度的活性污泥经高压蒸汽灭菌(121 ℃, 30 min).反应6 h后, TBBPA降解情况如图 1所示, 结果表明, 活性污泥对TBBPA的降解率在6 h内达到31.46%, 灭菌组的TBBPA降解率不足10%, 说明该活性污泥主要通过代谢作用去除TBBPA, 而非吸附作用(Peng et al., 2017b).
 |
| 图 1 活性污泥对TBBPA的降解 Fig. 1 The degradation of TBBPA by active sludge |
采用响应面分析法, 以接菌量、TBBPA浓度、温度和初始pH为响应因子, TBBPA降解率为响应值, 探究其对活性污泥降解TBBPA的影响, 试验因素及水平如表 1所示(Peng et al., 2013b;2017c).根据Box-Benhnke中心组合试验设计原理, 进行四因素三水平共29组响应面分析试验, 试验设计矩阵及结果如表 2所示.经回归拟合后, 试验因子对响应值的影响可用回归方程(2)表示.
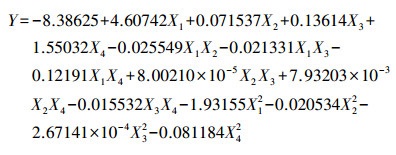
|
(2) |
| 表 1 试验因素和水平 Table 1 Selected process variable and their respective levels |
| 表 2 试验设计矩阵及TBBPA降解率的预测值及实际值 Table 2 Central composite design matrix and the actual and predicted response of dependent variable for three-level-four-factor response surface analysis of TBBPA removal |
式中, Y为TBBPA降解率, X1、X2、X3、X4分别为接菌量(OD600)、TBBPA为浓度(mg·L-1)、温度(℃)、初始pH.
通过方差分析对方程的统计学意义进行评估(表 3), 模型的F值为15.48, 说明模型显著可行;干扰导致模型F值变大的可能性小于0.1%, 说明该模型无明显的拟合误差;模型的失拟项p值为0.0722(p>0.05), 说明其对TBBPA最大降解率的预测可信.该试验中X1(p<0.0001)、X4(p<0.0001), 说明接菌量和初始pH对TBBPA降解率影响最大.X3X4(温度和初始pH)的p值最小(<0.0001), 说明这两个因素互动程度最大.
| 表 3 TBBPA降解拟合二次多项式模型的方差分析 Table 3 Analysis of variance (ANOVA) for the fitted quadratic polynomial model for TBBPA degradation |
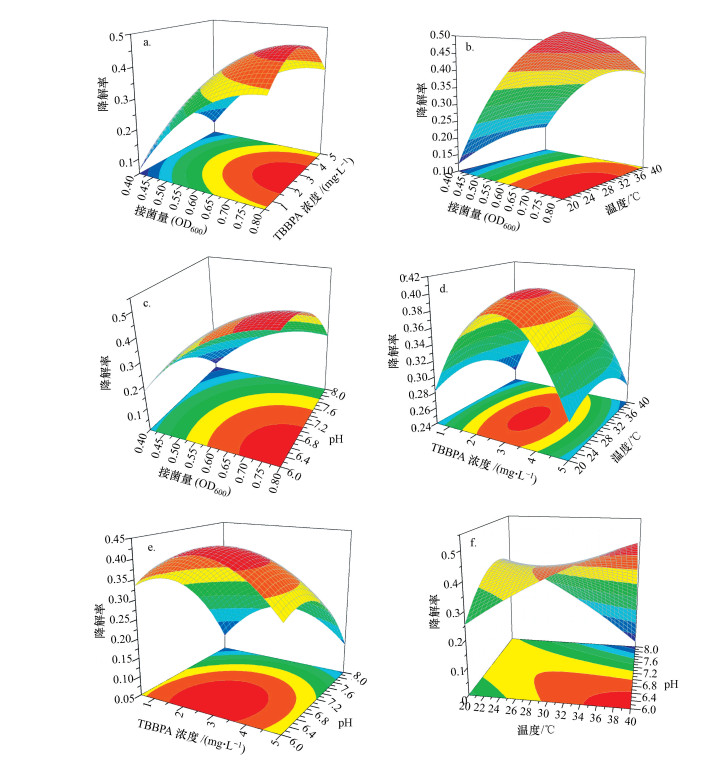
相较于传统的单因素优化试验, 响应面分析法可更快速地获取试验结果.该方法通过绘制响应面曲线来确定变量的相互作用影响和最佳条件, 模型拟合结果式(2)的响应面曲线如图 2a~2f所示.
 |
| 图 2 两两因素交互影响的响应面曲线及对应等高线图 Fig. 2 Response surface plots and contour plots for degradation rate of TBBPA showing interaction between each two variable |
图 2a为X1(接菌量)和X2(TBBPA浓度)对TBBPA降解率的影响, 其中, X3(温度)和X4(初始pH)为常量(即保持零水平值).由图可知, 接菌量OD600为0.40~0.80, 随着接菌量提高, 反应体系中单位体积的微生物量增加, TBBPA降解率随之提高(Peng et al., 2013a;2017b).在TBBPA浓度为0.50~5.00 mg·L-1范围内, TBBPA降解率先增大后减小, 这是因为较高的持久性有机污染物浓度会延长生物降解的滞后期(Cycon et al., 2009).Peng等(2013a;2017b)研究了TBBPA浓度对活性污泥降解TBBPA的影响, 结果表明, 在一定范围内提高TBBPA浓度可获得更高的降解率, 但浓度过高则会使降解率降低.
图 2b为X1(接菌量)和X3(温度)对TBBPA降解率的影响, 其中, X2(TBBPA浓度)和X4(初始pH)为常量(即保持零水平值).由图可知, 接菌量OD600在0.40~0.80范围内, 随着接菌量的提高, TBBPA降解率增大;温度为20~40 ℃时, 随着温度升高, TBBPA降解率基本不变, 仅当OD600接近0.80时, 随着温度升高, TBBPA降解率才呈现逐渐减小的趋势, 说明温度对该活性污泥降解TBBPA的影响不大, 这可能因为该活性污泥降解TBBPA相关的酶对温度较不敏感, 仅当微生物量较大时, 温度对酶的影响才得以反映(Peng et al., 2013b).An等(2011)研究了单一菌株在好氧条件下对TBBPA的降解特性, 发现相较于初始接菌量和pH, 温度对其降解的影响较小.
图 2c为X1(接菌量)和X4(初始pH)对TBBPA降解率的影响, 其中, X2(TBBPA浓度)和X3(温度)为常量(即保持零水平值).由图可知, 接菌量OD600在0.40~0.80范围内, 随着接菌量的提高, TBBPA降解率增大.pH值是影响微生物降解持久性有机污染物能力的重要因素(Zhang et al., 2006).初始pH值在6.0~8.0范围内, 随着pH增加, TBBPA降解率逐渐减小, 说明该活性污泥的微生物适合弱酸性环境.Peng等(2014)研究了3株菌株在共代谢条件下对TBBPA的降解, 结果表明, 在pH=6.0~6.5范围内其降解率较pH=7.0~8.0时更高.
图 2d为X2(TBBPA浓度)和X3(温度)对TBBPA降解率的影响, 其中, X1(接菌量)和X4(初始pH)为常量(即保持零水平值).与图 2a、2b反映一致, 一定范围内增加TBBPA浓度可提高其降解率, 温度对TBBPA降解率的影响不大.
图 2e为X2(TBBPA浓度)和X4(初始pH)对TBBPA降解率的影响, 其中, X1(接菌量)和X3(温度)为常量(即保持零水平值).与图 2a、2d、2c反映一致, 一定范围内增加TBBPA浓度可提高其降解率, 该活性污泥在弱酸性条件下TBBPA降解率更高.
图 2f为X3(温度)和X4(初始pH)对TBBPA降解率的影响, 其中, X1(接菌量)和X2(TBBPA浓度)为常量(即保持零水平值).由图可知, 在温度为20~40 ℃、初始pH为6.0~8.0范围内, 随着温度升高和pH降低, TBBPA降解率逐渐增大.
根据响应面试验结果得到的最优TBBPA降解条件如下:接菌量为OD600=0.77, TBBPA浓度为2.50 mg·L-1, 温度为40 ℃, 初始pH值为6.0, 此时TBBPA降解率达到最大值59.40%.
3.2.3 最优条件验证根据响应面试验得到的最佳TBBPA降解条件进行试验, 结果如图 3所示, 6 h后TBBPA降解率达到58.46%, 与响应面预测结果接近, 进一步说明本次响应面分析方法可靠.同时, 在最佳条件下同步检测了溴离子浓度.随着TBBPA降解, 水体中溴离子浓度逐渐增加, 证明了TBBPA的降解过程存在脱溴反应(Peng et al., 2013b;2017b).经6 h反应, 溴离子浓度为0.64 mg·L-1, 而TBBPA完全脱溴的溴离子理论值为1.47 mg·L-1, 脱溴率为43.80%, 说明活性污泥未完全脱除溴离子, 为不完全脱溴过程.
 |
| 图 3 最优条件下TBBPA的降解及溴离子释放 Fig. 3 Degradation of TBBPA and leakage of Br- under optimal condition |
自然水体中所含物质可能会对活性污泥降解TBBPA产生不同程度影响.为研究不同水质对活性污泥降解TBBPA的影响, 分别以不含腐殖酸和含有含腐殖酸(5.00 mg·L-1)的营养液及河水作为反应体系溶液, 设置6组试验, 营养液成分及河水水质见2.1节.
如图 4所示, 在不添加活性污泥的对照组里, TBBPA在不同水质中的自然降解效果相当(0.63%~1.63%), 可排除不同水质条件下非生物因素的干扰.在添加了活性污泥的3个试验组里, 溶液为营养液的试验组对TBBPA的降解效果最好, 6 h后降解率达到58.75%;溶液为河水的试验组对TBBPA的降解率为43.94%;添加腐殖酸的营养液试验组对TBBPA的降解率仅为33.61%.结果表明, 以河水和添加腐殖酸的营养液为反应溶液时, 活性污泥对TBBPA的降解效果均受到一定程度的抑制.通过对比营养液与河水的成分发现, 河水的COD(11 mg·L-1)远低于营养液(600 mg·L-1), 基质中碳含量过低会影响微生物的生长代谢, 而营养液中添加葡萄糖作为碳源则可提高活性污泥对TBBPA的降解率(Peng et al., 2013a);此外, 河水中存在的有机盐、无机离子和各种有机酸等也可能对活性污泥的生物活性产生一定的抑制作用(Peng et al., 2017b).腐殖酸则可能吸附、结合TBBPA并影响其生物利用度, 从而使得活性污泥对TBBPA的降解效率和速率降低.Ma等(2017)研究了腐殖酸对微生物降解TBBPA的影响, 结果表明, 腐殖酸能够结合22.1%±3.7%的TBBPA并显著抑制TBBPA的生物降解, 与本文结果一致.
 |
| 图 4 不同水质对活性污泥降解TBBPA的影响 Fig. 4 Effects of different solutions on the degradation of TBBPA by active sludge |
自然界中存在的不同光源会影响TBBPA降解及微生物的代谢活性.为研究活性污泥降解TBBPA受不同光源的影响, 设置6组试验, 分别为添加了活性污泥的避光组、自然光组、紫外光组及相应不添加活性污泥的对照组.
如图 5所示, 添加活性污泥的试验组中, 自然光条件下活性污泥对TBBPA的降解效果最好, 降解率为62.96%;避光条件下活性污泥对TBBPA的降解率为59.61%;紫外光条件下活性污泥对TBBPA的降解率为50.37%.不添加活性污泥的对照组中, 紫外光组的TBBPA降解率为28.64%, 优于自然光组的4.95%和避光组的1.53%.结果表明, 自然光对该活性污泥降解TBBPA存在一定程度的促进作用, 紫外光对该活性污泥降解TBBPA存在一定程度的抑制.这是因为在自然光照或紫外光照下TBBPA稳定性会降低, 从而使其生物降解效果提高(阎宁等, 2011;Wang et al., 2015).Bao等(2015)研究了TBBPA在自然光条件下的降解特性, 结果表明, 在180 min内TBBPA的降解率可达72.4%~99.9%.同时, 紫外光照射会影响活性污泥的代谢活性, 也可能使得TBBPA的降解效果变差.阎宁等(2011)研究了紫外光对微生物降解2, 4, 6-三氯酚的影响, 结果表明紫外照射下微生物的组成发生变化导致其降解率下降.
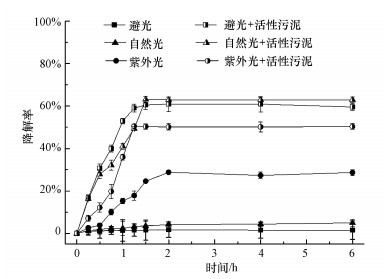 |
| 图 5 不同光源对活性污泥降解TBBPA的影响 Fig. 5 Effects of different light sources on the degradation of TBBPA by active sludge |
根据离子淌度-Q-TOF高分辨液质联用仪(LC-Q-TOF-MS/MS)测得的TBBPA标准质谱图(图 6a)可知, TBBPA的出峰时间是6.119 min, 荷质比m/z为542.7463, 符合TBBPA的质量数.图 6b~6d为检测到的中间产物一级质谱图和二级质谱图, 根据一级质谱和二级质谱的m/z推算, 一共有3种中间产物.
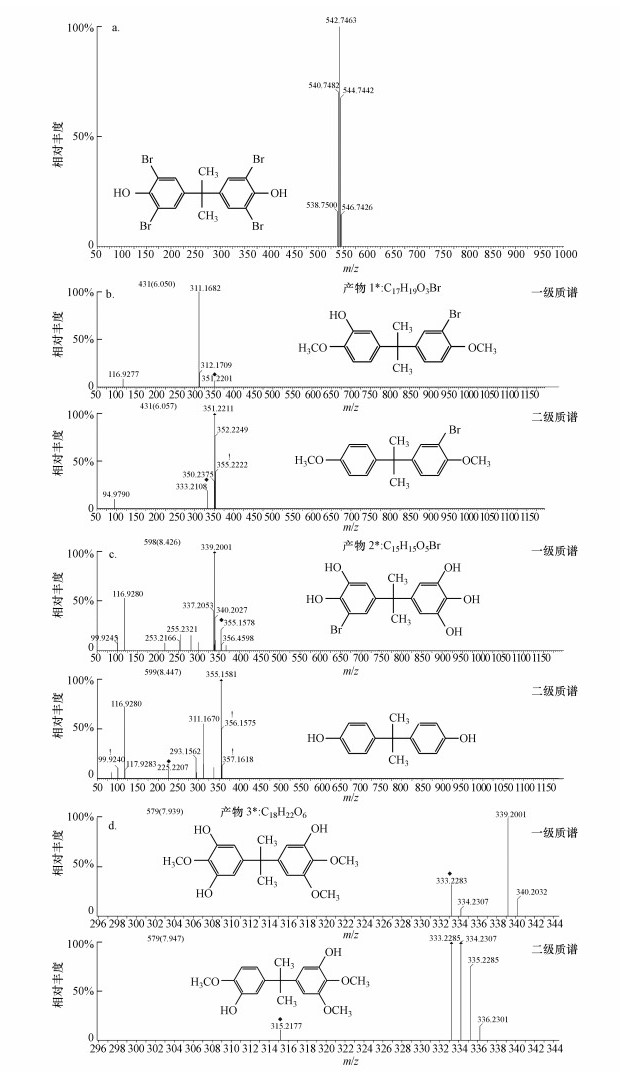 |
| 图 6 TBBPA的标准质谱图(a)和活性污泥降解TBBPA中间产物的质谱图(b~d) Fig. 6 Standard mass spectrogram of TBBPA(a) and the mass spectrum of TBBPA intermediate products(b~d) |
根据产物的种类组成推测, 活性污泥降解TBBPA的机理主要有脱溴、羟基化和甲基化3种方式, 两种推测的降解途径如图 7所示.路径Ⅰ:四溴双酚A发生甲基化并脱去两个溴生成甲基化二溴双酚A, 随后发生羟基取代反应生成5-[1-(3-溴-4-甲氧基-苯基)-1-甲基-乙基]-2-甲氧基-苯酚, 这与George等(2008)的研究一致.路径Ⅱ:TBBPA发生羟基取代反应生成5-[1-(3-溴-4, 5-二羟基-苯基)-1-甲基-乙基]-苯-1, 2, 3-三醇, 并进一步发生脱溴加氢和甲基化反应, 生成5-[1-(3-羟基-4, 5-二甲氧基-苯基)-1-甲基-乙基]-2-甲氧基-苯-1, 3-二醇, 该途径与好氧活性污泥(Li et al., 2014)、光催化(Wang et al., 2015)和零价铁(Peng et al., 2017c)降解四溴双酚A类似.
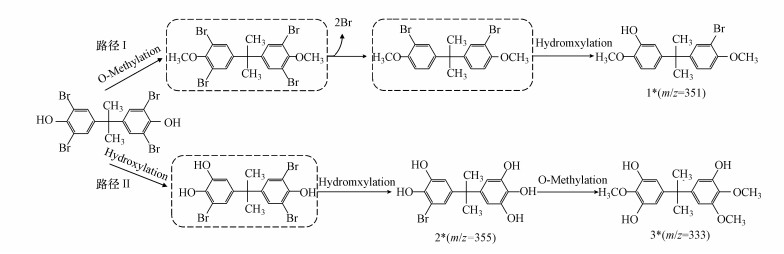 |
| 图 7 活性污泥降解TBBPA可能的代谢途径 (*代表检测到的中间产物) Fig. 7 Proposed metabolic pathway of the degradation of TBBPA by active sludge (* means the metabolite that be detacted) |
活性污泥降解TBBPA过程中, 发光细菌的相对抑制率如图 8所示, 其毒性呈现出先增大后减小的趋势.反应开始前, TBBPA溶液对发光细菌的相对抑制率为42.82%, 说明一定浓度的TBBPA具有生物毒性.在反应20 min和40 min时, 相对抑制率分别为46.30%和41.45%, 与0 min时无显著差异, 说明在活性污泥降解TBBPA前40 min形成的中间物质的毒性水平与TBBPA相近.在反应60 min和90 min后, 相对抑制率分别为52.72%和63.28%, 其毒性明显高于初始值, 说明TBBPA在降解过程前期生成的中间物质具有毒性且毒性可能不低于TBBPA.在反应120 min时, 相对抑制率减小为45.21%, 且在反应360 min时毒性降至12.50%, 说明该活性污泥在降解TBBPA的后期产物毒性可能低于TBBPA(Liu et al., 2016).Zu等(2014)研究了纯菌好氧降解TBBPA过程中雌激素活性的变化, 结果显示其在0~96 h内呈现先降低后升高再降低的趋势, 表明TBBPA在降解过程中由于中间产物的出现可能使其环境风险增加.Peng等(2017b)研究了活性污泥好氧降解TBBPA过程中的毒性变化, 结果显示其在20 min时对发光细菌的相对抑制率达100%, 随后其相对抑制率下降, 与本文一致.
 |
| 图 8 降解过程中的发光细菌抑制率 Fig. 8 Inhibition to Vibrio fischeri in degradation process |
1) 本研究探讨了活性污泥对TBBPA的降解, 结果证实, 活性污泥能够通过代谢而非吸附去除TBBPA, 并通过响应面分析法明确其降解TBBPA的最佳条件为:接菌量为OD600=0.77, TBBPA浓度为2.50 mg·L-1, 温度为40 ℃, 初始pH值为6.0.
2) 活性污泥降解TBBPA过程中, 还原脱溴是其重要的降解步骤, 并进行不完全脱溴, 脱溴率为43.80%.
3) 较复杂的自然水体会抑制活性污泥对TBBPA的降解, 尤其是腐殖酸较高的水体.自然光有利于活性污泥对TBBPA的降解, 而单纯的紫外光照射则会抑制该过程.
4) 活性污泥可通过脱溴、羟基化和甲基化等方式降解TBBPA, 其中, 5-[1-(3-溴-4-甲氧基-苯基)-1-甲基-乙基]-2-甲氧基-苯酚、5-[1-(3-溴-4, 5-二羟基-苯基)-1-甲基-乙基]-苯-1, 2, 3-三醇和5-[1-(3-羟基-4, 5-二甲氧基-苯基)-1-甲基-乙基]-2-甲氧基-苯-1, 3-二醇被检测证实.
5) 发光细菌毒性试验表明, 活性污泥降解TBBPA的前期中间产物的毒性并不低于TBBPA, 但后期中间产物的毒性相对有所降低.
An T C, Zu L, Li G Y, et al. 2011. One-step process for debromination and aerobic mineralization of tetrabromobisphenol-A by a novel Ochrobactrum sp.T isolated from an e-waste recycling site[J]. Bioresource Technology, 102(19): 9148–9154.
DOI:10.1016/j.biortech.2011.06.080
|
Bao Y P, Niu J F. 2015. Photochemical transformation of tetrabromobisphenol A under simulated sunlight irradiation:Kinetics, mechanism and influencing factors[J]. Chemosphere, 134: 550–556.
DOI:10.1016/j.chemosphere.2014.12.016
|
Binaglia M, Ramos-Bordajandi L, Bergman A, et al. 2015. Assessment of the known and the unknown:Brominated flame retardants[J]. Toxicology Letters, 238(2): S11.
|
Chen X, Gu X Y, Zhao X P, et al. 2018. Species-dependent toxicity, accumulation, and subcellular partitioning of cadmium in combination with tetrabromobisphenol A in earthworms[J]. Chemosphere, 210: 1042–1050.
DOI:10.1016/j.chemosphere.2018.07.106
|
George K W, Haeggblom M M. 2008. Microbial o-methylation of the flame retardant tetrabromobisphenol-A[J]. Environmental Science & Technology, 42(15): 5555–5561.
|
Islam M S, Zhou H, Zytner R G. 2018. Biodegradation and Metabolism of Tetrabromobisphenol A (TBBPA) in the bioaugmented activated sludge batch bioreactor system by heterotrophic and nitrifying bacteria[J]. Water Environment Research, 90(2): 122–128.
DOI:10.2175/106143017X15131012152753
|
Jakobsson K, Thuresson K, Rylander L, et al. 2002. Exposure to polybrominated diphenyl ethers and tetrabromobisphenol A among computer technicians[J]. Chemosphere, 46(5): 709–716.
DOI:10.1016/S0045-6535(01)00235-1
|
金彩霞, 司晓薇, 王万峰, 等. 2017. 不同形态磺胺类药物在根-土界面的空间分布及毒性评价[J]. 环境科学, 2017, 38(4): 1683–1688.
|
Kim U J, Oh J E. 2018. Mass-flow-based removal and transformation potentials for TBBPA, HBCDs and PBDEs during wastewater treatment processes[J]. Journal of Hazardous Materials, 355: 82–88.
DOI:10.1016/j.jhazmat.2018.04.011
|
Li F J, Wang J J, Nastold P, et al. 2014. Fate and metabolism of tetrabromobisphenol A in soil slurries without and with the amendment with the alkylphenol degrading bacterium Sphingomonas sp.strain TTNP3[J]. Environmental Pollution, 193: 181–188.
DOI:10.1016/j.envpol.2014.06.030
|
Li Y N, Zhou Q X, Wang Y Y, et al. 2011. Fate of tetrabromobisphenol A and hexabromocyclododecane brominated flame retardants in soil and uptake by plants (EI)[J]. Chemosphere, 82(2): 204–209.
DOI:10.1016/j.chemosphere.2010.10.021
|
Liu A F, Qu G B, Yu M, et al. 2016. Tetrabromobisphenol-A/S and nine novel analogs in biological samples from the Chinese Bohai Sea:Implications for trophic transfer[J]. Environmental Science & Technology, 50(8): 4203–4211.
|
Liu K, Li J, Yan S J, et al. 2016. A review of status of tetrabromobisphenol A (TBBPA) in China[J]. Chemosphere, 148: 8–20.
DOI:10.1016/j.chemosphere.2016.01.023
|
Luo W S, Peng X X, Jing F, et al. 2017. Simultaneous microbial removal of carbon, nitrogen, and phosphorus in a modified anaerobic/aerobic (A/O) bioreactor with no phosphorus release[J]. Water and Environment Journal, 31(2): 158–167.
|
Ma Y N, Zhao Y Y, Wang Y F, et al. 2017. Effects of Cu2+ and humic acids on degradation and fate of TBBPA in pure culture of Pseudomonas sp.strain CDT[J]. Journal of Environmental Sciences, 62: 60–67.
DOI:10.1016/j.jes.2017.07.012
|
Mariusz C, Marcin W, Zofia P S. 2009. Biodegradation of the organophosphorus insecticide diazinon by Serratia sp.and Pseudomonas sp.and their use in bioremediation of contaminated soil[J]. Chemosphere, 76(4): 494–501.
DOI:10.1016/j.chemosphere.2009.03.023
|
Tao L, Wu J P, Zhi H, et al. 2016. Aquatic bioaccumulation and trophic transfer of tetrabromobisphenol-A flame retardant introduced from a typical e-waste recycling site[J]. Environmental Science & Pollution Research, 23(14): 14663–14670.
|
Peng X X, Jia X S. 2013a. Optimization of parameters for anaerobic co-metabolic degradation of TBBPA[J]. Bioresource Technology, 148: 386–393.
DOI:10.1016/j.biortech.2013.08.137
|
Peng X X, Zhang Z L, Luo W S, et al. 2013b. Biodegradation of tetrabromobisphenol A by a novel Comamonas sp.strain, JXS-2-02, isolated from anaerobic sludge[J]. Bioresource Technology, 128(1): 173–179.
|
Peng X X, Qu X D, Luo W S, et al. 2014. Co-metabolic degradation of tetrabromobisphenol A by novel strains of Pseudomonas sp.and Streptococcus sp.[J]. Bioresource Technology, 169(5): 271–276.
|
Peng X X, Wang Z N, Wei D Y, et al. 2017a. Biodegradation of tetrabromobisphenol A in the sewage sludge process[J]. Journal of Environmental Sciences, 61: 39–48.
DOI:10.1016/j.jes.2017.02.023
|
Peng X X, Wang Z N, Huang J F, et al. 2017b. Efficient degradation of tetrabromobisphenol A by synergistic integration of Fe/Ni bimetallic catalysis and microbial acclimation[J]. Water Research, 122: 471–480.
DOI:10.1016/j.watres.2017.06.019
|
Peng X X, Tian Y, Liu S W, et al. 2017c. Degradation of TBBPA and BPA from aqueous solution using organo-montmorillonite supported nanoscale zero-valent iron[J]. Chemical Engineering Journal, 309: 717–724.
DOI:10.1016/j.cej.2016.10.075
|
Wang J, Fu Z Z, Liu G F, et al. 2013. Mediators-assisted reductive biotransformation of tetrabromobisphenol-A by Shewanella sp.XB[J]. Bioresource Technology, 142: 192–197.
DOI:10.1016/j.biortech.2013.04.062
|
Wang X W, Hu X F, Zhang H, et al. 2015. .Photolysis kinetics, mechanisms, and pathways of tetrabromobisphenol A in water under simulated solar light irradiation[J]. Environmental Science & Technology, 49(11): 6683–6690.
|
Xiong J K, Li G Y, An T C, et al. 2016. Emission patterns and risk assessment of polybrominated diphenyl ethers and bromophenols in water and sediments from the Beijiang River, South China[J]. Environmental Pollution, 219: 596–603.
DOI:10.1016/j.envpol.2016.06.021
|
Xiong J K, An T C, Zhang C S, et al. 2015. Pollution profiles and risk assessment of PBDEs and phenolic brominated flame retardants in water environments within a typical electronic waste dismantling region[J]. Environmental Geochemistry & Health, 37(3): 457–473.
|
阎宁, 夏四清, 朱骏, 等. 2011. 紫外辐射下的生物降解及微生物群落的变化[J]. 环境科学, 2011, 32(10): 3059–3066.
|
Zhu B, Zhao G, Yang L H, et al. 2018. Tetrabromobisphenol A caused neurodevelopmental toxicity via disrupting thyroid hormones in zebrafish larvae[J]. Chemosphere, 197: 353–361.
DOI:10.1016/j.chemosphere.2018.01.080
|
Zhu Z C, Chen S J, Zheng J, et al. 2014. Occurrence of brominated flame retardants (BFRs), organochlorine pesticides (OCPs), and polychlorinated biphenyls (PCBs) in agricultural soils in a BFR-manufacturing region of North China[J]. Science of the Total Environment, 481: 47–54.
DOI:10.1016/j.scitotenv.2014.02.023
|
Zhang H J, Liu W L, Chen B, et al. 2018. Differences in reproductive toxicity of TBBPA and TCBPA exposure in male Rana nigromaculata[J]. Environmental Pollution, 243: 394–403.
DOI:10.1016/j.envpol.2018.08.086
|
Zhang X H, Zhang G S, Zhang Z H, et al. 2006. Isolation and characterization of a dichlorvos-degrading strain DDV-1 of Ochrobactrum sp[J]. Pedosphere, 16(1): 64–71.
DOI:10.1016/S1002-0160(06)60027-1
|
Zhou J Y, Yu X J, Ding C, et al. 2011. Optimization of phenol degradation by Candida tropicalis Z-04 using Plackett-Burman design and response surface methodology[J]. Journal of Environmental Sciences, 23(1): 22–30.
DOI:10.1016/S1001-0742(10)60369-5
|
Zu L, Xiong J K, Li G Y, et al. 2014. Concurrent degradation of tetrabromobisphenol A by Ochrobactrum sp.T under aerobic condition and estrogenic transition during these processes[J]. Ecotoxicology & Environmental Safety, 104: 220–225.
|
 2019, Vol. 39
2019, Vol. 39


