2. 北京工业大学环境与能源工程学院, 北京 100124;
3. 北京亦庄水务有限公司, 北京 100176;
4. 清华-伯克利深圳学院 环境与新能源技术工程实验室, 深圳 518055
2. Beijing Key Laboratory for Green Catalysis and Separation, Department of Chemistry and Chemical Engineering, Beijing University of Technology, Beijing 100124;
3. Beijing Yizhuang Water Co., Ltd, Beijing 100176;
4. Shenzhen Environmental Science and New Energy Technology Engineering Laboratory, Tsinghua-Berkeley Shenzhen Institute, Shenzhen 518055
我国淡水资源严重不足, 淡水供应压力与日俱增(王浩等, 2012).污水再生利用是缓解我国水资源危机的重要战略(Miller, 2006; 胡洪营等, 2011).随着对高标准再生水的需求不断提升, 污水再生处理反渗透系统(reverse osmosis, RO)已在国内外获得广泛应用(Westerhoff et al., 2009; 孙迎雪等, 2015).根据Chen等(2016)的估算, 我国2018年RO系统处理量可能超过3500万t·d-1(Chen et al., 2016).但Khedr等(2000)指出, 膜污堵问题给反渗透工艺进一步推广应用带来重要挑战; 在导致膜污堵的原因中, 以生物污堵问题最为严重(Khedr, 2000).
研究表明微生物分泌产物EPS和SMP对RO膜污堵层形成有重要影响.于童(2018)发现EPS分泌量高的细菌, RO膜污堵潜势更高, 细菌数量并非导致RO膜污堵的主要原因; SMP是二级出水有机物(EfOM)的重要组成部分, 也有学者提出SMP中高分子量物质是导致有机污堵的主要污染物(Jarusutthirak et al., 2002).
污水再生处理反渗透RO系统以城市污水处理厂MBR出水作为系统进水.为控制RO进水中微生物生长, 抑制生物污堵, 主要采用消毒预处理工艺(Harif et al., 2011).消毒预处理包括紫外线、超声波等物理杀菌技术, 以及氧化性杀菌剂消毒(如氯消毒)、非氧化性杀菌剂消毒等化学杀菌技术(苏立永等, 2012).物理杀菌技术无法持续抑制微生物生长, 对生物污堵的控制效果不理想, 氧化性杀菌剂会氧化RO膜, 减少膜寿命; 非氧化性抑菌剂杀菌效果好, 对RO膜无损害, 应用十分广泛.
杀菌剂对微生物及生物膜的作用复杂, 除直接使微生物致死外, 还可能通过改变群落结构、影响微生物分泌特性等作用影响膜污堵的程度.有研究称, 氯消毒会对EPS的分泌量、疏水性、细胞粘附性等产生影响, 从而影响生物膜的形成(Rathi et al., 2012; Liu et al., 2017).也有研究表明, 氯消毒不能有效改善海水RO膜生物污堵潜势, 随着氯消毒剂量的增加, RO膜渗透通量没有得到改善并且EPS浓度没有降低(Kim et al., 2009).
在RO系统中, 除氯消毒外, 非氧化性抑菌剂, 如甲基异噻唑啉酮(Methylisothiazolone, MIT)等, 也常被用于控制生物污堵.虽然非氧化性抑菌剂能够抑制微生物生长, 但其对细菌代谢产物分泌特性的影响尚不清楚.而本课题的前期研究表明, 细菌的胞外多聚物(EPS)是导致反渗透膜生物污堵的重要因素, 而非菌体本身(Yu, 2018).
基于此, 本研究系统考察了典型非氧化性抑菌剂甲基异噻唑啉酮(MIT)对MBR出水微生物的生长特性、群落结构及分泌特性的影响, 从而评估MIT对微生物的控制效果, 为污水再生处理RO膜生物污堵的控制提供理论基础.
2 材料与方法(Materials and methods) 2.1 微生物来源与培养方法 2.1.1 水样本研究使用水样来源于北京某污水处理厂MBR系统出水, DOC浓度约为8~10 mg·L-1.
水样用10 L塑料桶承装, 并用保鲜膜密封后置于4 ℃冰箱中保存待用, 待用水样需在一周内使用, 以保证水样的水质与微生物群落的稳定性.水样接种前12 h, 需要将水样置于常温条件下, 以使水样恢复到常温状态.
2.1.2 培养基为了便于统一培养终点, 同时避免培养基残余组分对微生物分泌产物的影响, 选用葡萄糖培养基作为本研究中使用的液体培养基.选用葡萄糖培养基主要是基于该培养基中有机营养物质单一且葡萄糖浓度可测定的特点.
培养基具体组分如下:葡萄糖1000 mg·L-1、硝酸铵1000 mg·L-1、磷酸二氢钾500 mg·L-1、十二水合磷酸氢二钠3780 mg·L-1、氯化钠1000 mg·L-1和硫酸镁100 mg·L-1.
为避免5-羟甲基糠醛生成, 将分装好的每瓶300 mL在115 ℃条件下灭菌20 min.制作6份灭菌后的培养基, 并依次向其中投加0、0.1、0.5、1、2、4 mg·L-1的MIT, 获得含有MIT浓度的300 mL葡萄糖培养基系列备用.
2.1.3 培养方法本研究选用液体培养基以恒温摇瓶培养方式对MBR出水中微生物进行培养, 将20 mL MBR出水接种到上述的300 mL葡萄糖培养基系列中, 培养条件为室温25 ℃、摇床摇速150 r·min-1.
培养过程中, 12 h测定一次培养基中剩余葡萄糖浓度, 作为确定培养终点的依据.当培养基中剩余葡萄糖为零时, 判定为培养终点, 停止培养.本研究中使用(长春汇力生物技术有限公司)氧化酶法葡萄糖测定试剂盒测定葡萄糖浓度.
2.2 微生物生长特性的分析方法 2.2.1 生长曲线绘制从开始培养起, 每间隔12 h从每个梯度菌液中取两个平行样, 每个平行样300 μL, 置于96孔板内.使用酶标仪(MD SpectraMax M5)测定96孔板内各个样品在600 nm波长可见光照射条件下的吸光值(OD600), 平行样品取平均值, 绘制微生物生长曲线.
2.2.2 异养菌平板计数(HPC)使用R2A琼脂培养基接种100 μL菌液后置于HPS-280生化培养箱中以25 ℃条件恒温培养72 h后对菌落进行计数.
2.2.3 冻干质量培养完成后, 每瓶菌液分装于6管灭菌的50 mL离心管中, 使用日立CR22G高速离心机离心分离上清液(离心条件为5000G, 4 ℃, 20 min), 分离后的上清液(含溶解性分泌产物SMP)和菌体(含胞外多聚物EPS)分开保存于-20 ℃冰箱内.
将分离所得的菌体(含EPS), 置于-20 ℃条件下完全冰冻后, 使用冻干机对冰冻的菌体(含EPS)进行低温真空干燥处理, 以除去沉淀物中的水分.冻干24 h后, 称量沉淀物及离心管整体质量, 记为m1.使用0.1 mol·L-1盐酸溶液浸泡离心管15 min后, 用高纯水将离心管冲洗干净.洗净后的离心管再次冻干24 h后称量, 称量质量记为m2.
m1与m2的差值即为50 mL菌液所含菌体与EPS的冻干质量, 反映菌液中微生物的质量浓度.
2.3 微生物分泌特性的分析方法 2.3.1 微生物分泌产物SMP提取方法培养完成后, 每瓶菌液分装于6管灭菌的50 mL离心管中, 使用日立CR22G高速离心机离心分离上清液(离心条件为5000G, 4 ℃, 20 min), 分离后的上清液(含溶解性分泌产物SMP)和菌体(含胞外多聚物EPS)分开保存于零下20 ℃冰箱内.
上清液解冻后, 使用0.22 μm滤膜进行过滤以去除残余菌体, 同时由于上清液中葡萄糖已经完全消耗, 因此滤液中剩余的有机物即是微生物的SMP.
2.3.2 微生物分泌产物EPS提取方法本研究使用水浴法(孙浩等, 2017)提取反渗透膜面微生物EPS.
2.3.3 微生物分泌产物分析方法本研究使用TOCVCPH型总有机碳分析仪测定DOC; 葡萄糖氧化酶法测定培养基葡萄糖含量; 使用硫酸-蒽酮法及Modified-Lowry法分别测定多糖及蛋白质浓度; 使用日立F7000型荧光分光光度计测定分泌产物三维荧光特性.
2.3.4 微生物群落结构与多样性的分析方法以2.3.2节中菌液分离所得菌体作为群落结构及多样性分析的样品, 利用高通量测序技术, 分析不同MIT浓度下MBR出水微生物的群落结构与多样性差异.
3 结果与讨论(Results and discussion) 3.1 MIT对MBR出水中微生物生长特性的影响在不同MIT浓度下培养MBR出水微生物至培养液中葡萄糖消耗完毕, 测定OD600以绘制微生物生长曲线如图 1所示.结果表明, 投加MIT的实验组样品微生物迟滞期明显增长, 但对数期生长速率明显加快, 以OD600表示的最终生物量均高于对照组, 反映投加非氧化性抑菌剂后样品中细菌数增加.另一方面, 群落结构及细菌形态变化也会影响OD600的测定结果.
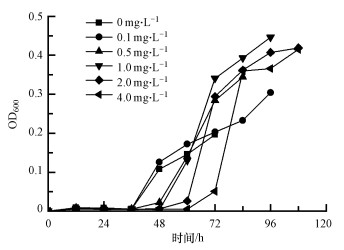 |
| 图 1 不同MIT浓度下的MBR出水中微生物的生长曲线 Fig. 1 Growth curve of microorganisms in the effluent of MBR under different MIT concentrations |
测定培养终止时HPC及冻干质量(干重), 与OD600测定结果比较, 测定结果如图 2所示.可以发现, 除0.1 mg·L-1组以外所有投加MIT的实验组样品以HPC计的生物量均高于对照组, 反映微生物数量浓度增加; 所有投加MIT的实验组样品以干重计的生物量均多于或略多于空白, 反映微生物质量浓度增加.
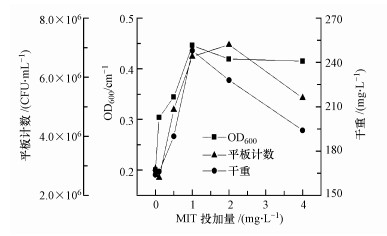 |
| 图 2 不同MIT浓度下的MBR出水中微生物的生物量 Fig. 2 Microbial biomass in the effluent of MBR under different MIT concentrations |
3种生物量测定结果的趋势类似, 实验组微生物生长迟滞期延长, 但培养结束时的数量浓度、质量浓度均较对照组有所增加, 投加MIT反而导致微生物最终生物量增加.
3.2 MIT对MBR出水中微生物群落结构的影响不同MIT浓度下MBR出水中微生物群落结构测定结果见图 3.
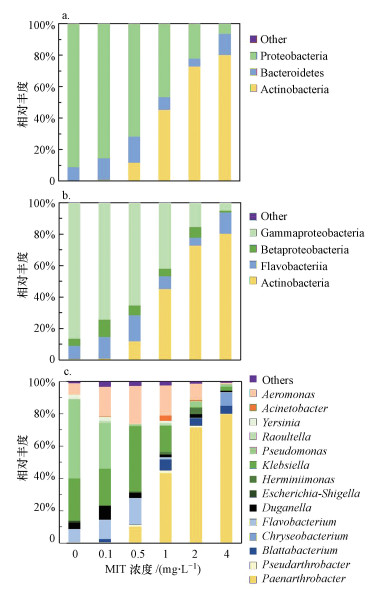 |
| 图 3 不同MIT浓度下MBR出水中微生物群落结构(a.门水平; b.纲水平; c.属水平) Fig. 3 Microbial community structure in effluent of MBR under different MIT concentrations(a. phylum level; b. class level; c. genus level) |
门水平上, 随MIT浓度升高, 群落结构中放线菌门(Actinobacteria)占比上升最为明显, 变形菌门(Proteobacteria)占比下降最为明显.放线菌门在对照组与4 mg·L-1实验组中相对丰度分别为0.4%和80.1%;变形菌门在对照组与4 mg·L-1实验组中相对丰度分别为91.1%和6.4%.
纲水平上, 随MIT浓度升高, 群落结构中放线菌纲(Actinobacteria)占比上升最为明显, γ-变形菌纲占比下降最为明显.放线菌纲在对照组与4 mg·L-1实验组中相对丰度分别为0.4%和80.1%;γ-变形菌纲在对照组与4 mg·L-1实验组中相对丰度分别为86.4%和5.0%.
属水平上, 随MIT浓度升高, 群落结构中类节杆菌属(Paenarthrobacter)占比上升最为明显, 假单胞菌属(Pseudomonas)和克雷伯菌属(Klebsiella)占比下降最为明显.类节杆菌属在对照组与4 mg·L-1实验组中相对丰度分别为0.0%和79.8%;假单胞菌属在对照组与4 mg·L-1实验组中相对丰度分别为49.0%和2.3%;克雷伯菌属在对照组与4 mg·L-1实验组中相对丰度分别为25.9%和0.2%.
结果表明, 高MIT浓度下, 放线菌门、放线菌纲、类节杆菌属是主要微生物类群, 可能对MIT具有较强抗性; 假单胞菌属和克雷伯菌属MIT抗性较弱.有研究报道, 铜绿假单胞杆菌、芽孢杆菌、埃希氏酵母菌等暴露于亚致死浓度异噻唑啉酮作用下, 可诱导其产生对异噻唑酮抗性(Brozel et al., 1991; 1994; Chapman et al., 1995; 孙浩等, 2017).铜绿假单胞杆菌的35 kDa外膜蛋白((蛋白T)缺乏表达, 是导致异噻唑啉酮抗性产生的原因(Brozel et al., 1994).但目前尚未有放线菌纲、类节杆菌属微生物具有对异噻唑啉酮抗性的相关报道.
目前有研究报道的RO膜面污染微生物门水平类群包括Proteobacteria、Acidobacteria、Bacteroidetes、Planctomycetes、Firmicutes、Actinobacteria等(Pang et al., 2007; Bereschenko et al., 2008; Lee et al., 2011).根据Khan等(2014)研究, 放线菌门是WRRO系统膜污堵层中的主要微生物类群, 相对丰度能达到70%以上(Khan et al., 2014).本研究说明甲基异噻唑啉酮对于WRRO系统膜污堵层主要污堵微生物放线菌门有很好的抑制效果.
不同MIT浓度下MBR出水中微生物多样性指数组间差异见图 4, 可以发现, Shannon指数和Simpson指数普遍存在随着MIT浓度增加而递减的趋势, 反映随着MIT浓度增加各组样品中α多样性递减.
 |
| 图 4 不同MIT浓度下MBR出水中微生物α多样性指数组间差异图 Fig. 4 Microbial alpha diversity in effluent of MBR under different MIT concentrations |
SMP物质含量(总量、蛋白、多糖浓度)测定结果见图 5.可以发现, 投加的MIT浓度与微生物分泌SMP浓度(总量、蛋白、多糖浓度)之间没有明显的相关关系.
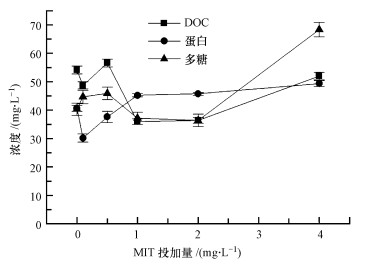 |
| 图 5 不同MIT浓度下MBR出水中微生物SMP各组分浓度变化 Fig. 5 Concentrations of microbial SMP components under different MIT concentrations |
本研究使用日立F-7000型荧光分光光度计测定SMP及EPS三维荧光特性, 以不同荧光激发波长扫描样品, 并生成荧光激发-发射矩阵(excitation emission matrix, EEM), 依此绘制三维荧光指纹图. Wang (2010)根据三维荧光指纹图各区域(Ⅰ~Ⅵ区)与微生物分泌产物中典型荧光物质对应关系, 分析微生物分泌产物中荧光物质变化情况.(Ⅰ区:酪氨酸/色氨酸氨基酸区域; Ⅱ区:酪氨酸/色氨酸蛋白质区域; Ⅲ区:多糖区域; Ⅳ区:富里酸区域; Ⅴ区:聚芳香型腐殖酸区域; Ⅵ区聚羧酸盐型腐殖酸区域(Wang et al., 2010).本研究使用上述方法分析微生物分泌产物中典型荧光物质变化情况.
SMP稀释至相同DOC条件下的三维荧光分布指纹见图 6.可以发现低MIT浓度与高MIT浓度下, SMP三维荧光特性有明显区别.1、2、4 mg·L-1组荧光强度与0、0.1、0.5 mg·L-1组相比明显减弱, 以第Ⅴ区和第Ⅵ区荧光强度衰减最为明显, 分别对应聚芳香类腐殖酸和聚羧酸类腐殖酸.对照SMP中DOC测定结果, 发现随MIT浓度上升, 荧光物质含量明显减少.
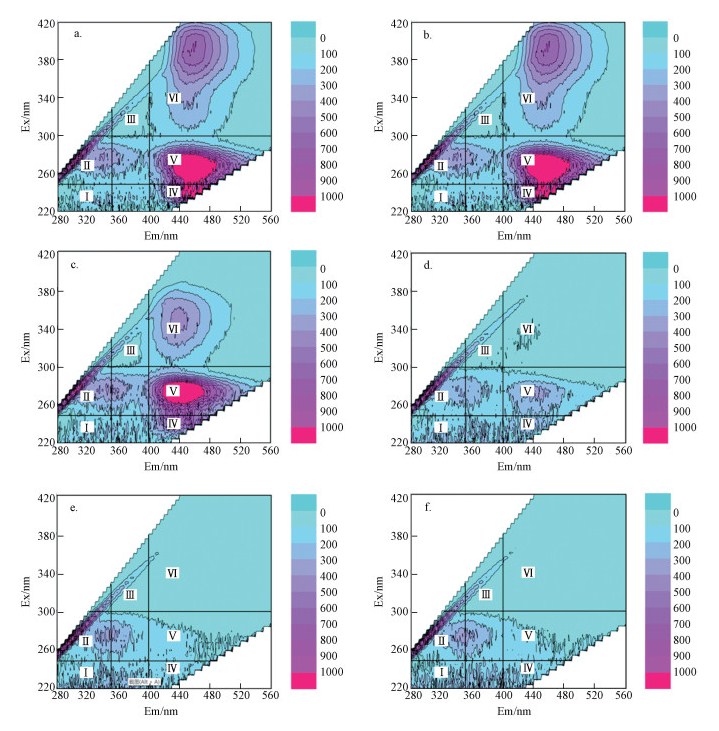 |
| 图 6 不同MIT浓度下MBR出水中微生物SMP三维荧光分布(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1 mg·L-1; e.2 mg·L-1; f.4 mg·L-1) Fig. 6 Fluorescence characteristics in SMP under different MIT concentrations(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1 mg·L-1; e.2 mg·L-1; f.4 mg·L-1) |
EPS物质含量(总量、蛋白、多糖浓度)测定结果见图 7.可以发现, 除0.5 mg·L-1组外, 不同MIT浓度下实验组EPS物质含量(总量、蛋白、多糖浓度)均高于对照组, 这可能导致RO系统进水膜污堵潜势上升.EPS物质含量上升可能是由于MIT作用下, 微生物群落结构发生改变, EPS分泌较多的微生物MIT抗性较强, 相对丰度上升, 从而使微生物群落分泌特性发生改变.目前, 尚未有研究报道异噻唑啉酮对微生物EPS分泌特性的影响.
 |
| 图 7 不同MIT浓度下MBR出水中微生物EPS各组分浓度变化 Fig. 7 Concentrations of microbial EPS components under different MIT concentrations |
EPS稀释至相同DOC条件下的三维荧光分布指纹见图 8.可以发现, 投加的MIT浓度与微生物三维荧光物质分布没有明显相关关系.
 |
| 图 8 不同MIT浓度下MBR出水中微生物三维荧光分布指纹图(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1 mg·L-1; e.2 mg·L-1; f.4 mg·L-1) Fig. 8 Fluorescence characteristics in SMP under different MIT concentrations(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1mg·L-1; e.2 mg·L-1; f.4 mg·L-1) |
1) 将MBR出水微生物接种到葡萄糖培养基中, 并投加不同浓度MIT.随MIT浓度增加, 微生物生长迟滞期明显增长, 但稳定期生物量增加.一定剂量的MIT只能在一定时间内控制微生物的生长, 投加的时间间隔过长, 可能导致更加严重的生物污堵.
2) 放线菌门、放线菌纲、类节杆菌属相对丰度随MIT浓度增加而明显增加, 可能具有MIT抗性.应该关注放线菌门、放线菌纲、类节杆菌微生物对于RO膜长期污堵的影响.
3) 随MIT浓度增加, SMP中的DOC、蛋白、多糖浓度变化无明显规律; 但是EPS中的DOC、蛋白、多糖浓度均增加.
Bereschenko L A, Heilig G H J, Nederlof M M, et al. 2008. Molecular characterization of the bacterial communities in the different compartments of a full-scale reverse-osmosis water purification plant[J]. Applied and Environmental Microbiology, 74(17): 5297–5304.
DOI:10.1128/AEM.00387-08
|
Brozel V S, Cloete T E. 1991. Resistance of bacteria from cooling waters to bactericides[J]. Journal of Industrial Microbiology, 8(4): 273–276.
DOI:10.1007/BF01576066
|
Brozel V S, Cloete T E. 1994. Resistance of pseudomonas-aeruginosa to isothiazolone[J]. Journal of Applied Bacteriology, 76(6): 576–582.
DOI:10.1111/jam.1994.76.issue-6
|
Chapman J S, Diehl M A. 1995. Methylchloroisothiazolone-induced growth-inhibition and lethality in escherichia-coli[J]. Journal of Applied Bacteriology, 78(2): 134–141.
DOI:10.1111/jam.1995.78.issue-2
|
Chen X F, Zhang Z X, Liu L, et al. 2016. RO applications in China:History, current status, and driving forces[J]. Desalination, 397: 185–193.
DOI:10.1016/j.desal.2016.07.001
|
Harif T, Elifantz H, Margalit E, et al. 2011. The effect of UV pre-treatment on biofouling of BWRO membranes:A field study[J]. Desalination and Water Treatment, 31(1/3): 151–163.
|
胡洪营, 等. 2011. 再生水水质安全评价与保障原理[M]. 北京: 科学出版社: 515.
|
Jarusutthirak C, Amy G, Croue J P. 2002. Fouling characteristics of wastewater effluent organic matter (EfOM) isolates on NF and UF membranes[J]. Desalination, 145(PⅡ S0011-9164(02)00419-81-3SI): 247–255.
|
Khan M T, Busch M, Molina V G, et al. 2014. How different is the composition of the fouling layer of wastewater reuse and seawater desalination RO membranes?[J]. Water Research, 59: 271–282.
DOI:10.1016/j.watres.2014.04.020
|
Kim T H, Kim Y S, Choi Y H, et al. 2009. Biofilm formation and its effect on biofouling in RO membrane processes for wastewater reuse[J]. Desalination and Water Treatment, 2(1/3): 70–74.
|
Lee J, Kim I S. 2011. Microbial community in seawater reverse osmosis and rapid diagnosis of membrane biofouling[J]. Desalination, 273(1SI): 118–126.
|
Liu L, Hu Q, Le Y, et al. 2017. Chlorination-mediated EPS excretion shapes early-stage biofilm formation in drinking water systems[J]. Process Biochemistry, 55: 41–48.
DOI:10.1016/j.procbio.2016.12.029
|
Miller G W. 2006. Integrated concepts in water reuse:managing global water needs[J]. Desalination, 187(1/3): 65–75.
|
Pang C M, Liu W. 2007. Community structure analysis of reverse osmosis membrane biofilms and the significance of Rhizobiales bacteria in biofouling[J]. Environmental Science & Technology, 41(13): 4728–4734.
|
Rathi R, Satheesh S. 2012. Exposure to chlorine affects the extracellular polymeric substance production and cell surface hydrophobicity in biofilm bacteria[J]. Oceanological and Hydrobiological Studies, 41(4): 17–24.
|
苏立永, 潘献辉, 葛云红, 等. 2012. 非氧化杀菌剂控制反渗透系统生物污染[J]. 中国给水排水, 2012, 28(20): 17–19.
DOI:10.3969/j.issn.1000-4602.2012.20.005 |
孙浩, 于童, 胡洪营. 2017. 反渗透膜面细菌胞外多聚物提取方法研究[J]. 环境科学学报, 2017, 37(10): 3629–3634.
|
孙迎雪, 胡洪营, 汤芳, 等. 2015. 城市污水再生处理反渗透系统RO浓水的水质特征[J]. 环境科学与技术, 2015, 38(1): 72–79.
|
汤芳. 2016.污水再生处理反渗透工艺膜污染组分识别与控制[D].北京: 清华大学
|
Wang Z, Zhang T. 2010. Characterization of soluble microbial products (SMP) under stressful conditions[J]. Water Research, 44(18): 5499–5509.
DOI:10.1016/j.watres.2010.06.067
|
Westerhoff P, Moon H, Minakata D, et al. 2009. Oxidation of organics in retentates from reverse osmosis wastewater reuse facilities[J]. Water Research, 43(16): 3992–3998.
DOI:10.1016/j.watres.2009.04.010
|
王浩, 王建华. 2012. 中国水资源与可持续发展[J]. 中国科学院院刊, 2012, 5(3): 352–358.
DOI:10.3969/j.issn.1000-3045.2012.03.014 |
Yu T, Sun H, Chen Z, et al. 2018. Different bacterial species and their extracellular polymeric substances (EPSs) significantly affected reverse osmosis (RO) membrane fouling potentials in wastewater reclamation[J]. Science of the Total Environment, 644: 486–493.
DOI:10.1016/j.scitotenv.2018.06.286
|
于童. 2018.污水再生处理反渗透膜面细菌生物污堵潜势研究[D].北京: 清华大学
|
 2019, Vol. 39
2019, Vol. 39


