2. 福建师范大学地理科学学院, 福州 350007
2. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007
凋落物是森林土壤有机质的主要来源, 通过分解参与土壤养分循环及能量流动(Koukol et al., 2006).而凋落物的分解过程主要通过微生物进行, 凋落物可为其提供丰富的有效养分, 刺激微生物的活性(Nevins et al., 2018).研究表明, 大气中CO2浓度升高、氮沉降等全球变化将会提高植物净初级生产力, 进而导致进入到土壤中的外源碳增加(Neff et al., 2002; Hansson et al., 2011; 刘菊秀等, 2009).此外, 森林管理措施亦会引起凋落物的数量变化, 而凋落物的数量和质量决定着土壤微生物群落结构(Kuzyakov et al., 2019), 进而影响土壤碳氮过程(余涵霞等, 2018).关于凋落物数量变化对土壤微生物的影响研究亦有报道, 如利用凋落物添加和去除试验(Detritus input and removal treatments, DIRT)研究植物和土壤微生物群落之间的反馈作用.例如, 王巍巍等(2015)进行了18个月的DIRT试验, 发现凋落物移除对樟子松人工林土壤各类微生物PLFA含量均无显著影响, 但凋落物加倍显著改变了土壤微生物群落结构.万晓华等(2016)通过6个月的野外试验发现, 杉木林中添加米老排凋落物与去除凋落物处理后, 土壤中细菌、真菌和放线菌PLFA含量显著增加.然而, 上述试验尚未考虑较高的添加量梯度, 也未探讨不同添加量凋落物输入与土壤微生物群落结构的关系.
生物质炭(Biochar, BC)是生物质材料在厌氧或者部分厌氧的条件下经高温裂解之后产生的多孔芳香类化学物质(Dong et al., 2018).研究表明, BC具有比表面积大、吸附能力强、稳定性高等特点, 将其添加到土壤中可以改善土壤肥力状况(Lehmann et al., 2011).我国亚热带地区杉木人工林分布广泛, 且土壤呈酸性, 肥力水平较低(郑璐嘉等, 2015).在人工林经营初期, 若将采伐剩余物和凋落物部分制成BC, 并将其返还土壤, 可避免直接火烧造成的环境污染和水肥流失等问题, 亦有可能改善人工林土壤肥力(尹艳等, 2018).凋落物为易分解有机碳源, 而BC属于难分解碳源, 两者单独输入短期内是否会改变杉木人工林土壤微生物群落结构?土壤中各类微生物对添加量的响应是否一致?基于上述问题, 本试验以杉木人工林土壤为研究对象, 采用室内培养试验结合PLFA分析方法, 研究不同添加量的凋落物及BC输入对土壤微生物群落结构的影响, 以期为亚热带人工林土壤有机质管理和生物质资源有效利用提供科学依据.
2 材料与方法(Materials and methods) 2.1 供试材料试验于2018年5月进行, 土壤样品取自福建省建瓯市万木林自然保护区内杉木人工林, 树龄约为36年.该区属中亚热带季风气候, 年均气温19.4 ℃, 年均降水量1731.4 mm, 年均蒸发量1466 m, 土壤为花岗岩发育的普通山地红壤(郭剑芬等, 2006).根据“S”型多点取样, 去除表层凋落物后取0~20 cm土壤, 剔除石块和可见植物残体和根系, 新鲜土壤样品过2 mm筛后置于冰箱4 ℃冷藏备用.
将杉木凋落物于60 ℃下进行烘干, 粉碎机粉碎过2 mm筛后用于培养和BC制备.BC生产采用KTF管式炉, 将适量凋落物用锡箔纸包裹并放置在炉中封闭, 制备温度为350 ℃, 通入氮气厌氧热解2 h, 冷却的BC样品过2 mm筛后充分混匀备用.供试土壤、杉木凋落物及BC基本性质见表 1.
| 表 1 供试土壤、凋落物、生物质炭的基本性质 Table 1 Basic properties of the soil, litter and biochar |
采用双因素试验设计, 包括外源碳类型(凋落物、BC)和添加量(0、1%、2%、3%、4%、5%土壤质量分数), 试验处理:土壤(S)、土壤+1%凋落物(SL1)、土壤+2%凋落物(SL2)、土壤+3%凋落物(SL3)、土壤+4%凋落物(SL4)、土壤+5%凋落物(SL5)、土壤+1%BC(SB1)、土壤+2%BC(SB2)、土壤+3%BC(SB3)、土壤+4%BC(SB4)、土壤+5%BC(SB5), 每个处理4个重复.
称取过2 mm筛的新鲜土壤(相当于40.00 g烘干土)和相应添加量的凋落物或BC, 分别混合均匀置于60 mL塑料杯中, 再将其置于广口瓶中于恒温培养箱中进行培养, 培养温度为25 ℃, 通过称重法维持土壤水分为60%WHC(最大田间持水量).培养28 d后进行破坏性取样, 样品立即冷冻干燥, 随后测定土壤基本理化性质及PLFA含量.
2.3 分析方法pH利用便携式pH计(STARTER 300, 美国)测定, 土壤pH测定时水土比例为2.5:1, BC和凋落物pH测定时选择水与BC或凋落物的比例为15:1;土壤、凋落物和BC的碳、氮含量采用元素分析仪(Elementar Vario EL Ⅲ, Elementar, 德国)测定, 可溶性碳(DOC)含量采用TOC总碳分析仪(TOC-V CPH, 日本)测定.
PLFA含量采用气相色谱仪(Agilent 6890 N, 美国)结合MIDI微生物识别系统(MIDI Inc., Newark, DE)测定(盖霞普等, 2016).以磷脂脂肪酸14:0 iso、15:0 iso、15:0 anteiso、16:0 iso、17:0 iso、17:0 anteiso表征革兰氏阳性细菌(Gram positive bacteria, GP), 以磷脂脂肪酸16:1 ω9c、16:1 ω7c、17:0 cycloω7c、18:1 ω7c、18:1 ω5c、19:0 cycloω7c表征革兰氏阴性细菌(Gram negative bacteria, GN), 以磷脂脂肪酸16:1 w5c表征丛枝菌根真菌(Arbuscular mycorrhizal fungi, AMF), 以磷脂脂肪酸16:0 10-methyl、17:0 10-methyl、18:0 10-methyl表征放线菌(Actinomycetes, ACT), 以磷脂脂肪酸18:2 ω6c、18:1 ω9c表征真菌(Fungi)(Frostegård et al., 2011; Wan et al., 2015).以GP/GN比值表示革兰氏阳性细菌/革兰氏阴性细菌, 以F/B比值表征真菌/细菌.
2.4 数据统计数据用Excel 2013整理, 统计学分析和做图采用SPSS、Origin、Canoco软件.采用单因素方差分析进行差异显著性比较(Duncan多重比较法, α=0.05).用重复测量方差(Repeated measures data ANOVA)分析外源碳类型与添加量及交互作用对土壤微生物群落的影响和主成分得分值的差异显著性, 采用主成分分析(Principal component analysis, PCA)对土壤微生物群落结构进行分析, 通过冗余分析(Redundancy analysis, RDA)研究土壤性质与微生物群落结构之间的关系.图表数据均为平均值±标准差(n=4).
3 结果与分析(Results and analysis) 3.1 凋落物和BC添加对土壤微生物PLFA含量的影响由图 1可知, 凋落物处理均不同程度地提高了土壤各类微生物PLFA含量(AMF及ACT除外), 而BC处理中, 土壤各类微生物PLFA含量均在3%添加量时达到最大, 并且凋落物处理的土壤总PLFA含量显著高于相应的BC处理, 各处理中细菌比例为59.82%~66.90%, 真菌比例为7.37%~21.63%, ACT比例为10.85%~16.91%.由图 2可知, 同对照土壤S相比, 凋落物和BC处理在4%和5%添加量下显著降低了GP/GN比值(p < 0.05).凋落物处理中F/B比值随添加量的增加而升高, 并且各处理间的差异达到了显著水平(p < 0.05).但BC处理中低添加量处理未显著影响F/B比值, 仅在4%和5%添加量处理中显著降低(p < 0.05).
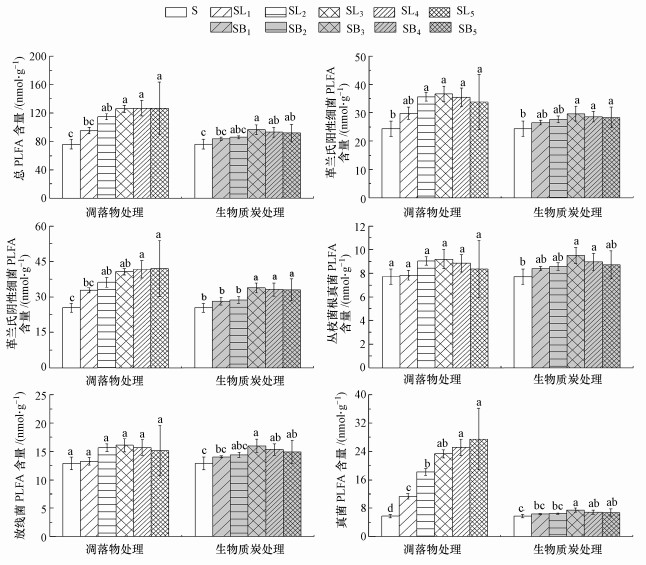 |
| 图 1 不同处理对土壤微生物PLFA含量的影响 Fig. 1 Effect of different treatments on the soil microbial PLFA content |
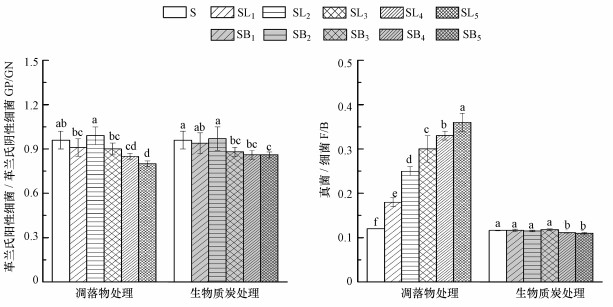 |
| 图 2 不同处理对土壤微生物PLFA特征值比值的影响 Fig. 2 Effect of different treatments on eigenvalue of soil PLFA |
由表 2可知, 外源碳类型极显著地影响了土壤总PLFA、GP、GN、细菌、真菌含量及F/B比值(p < 0.01), 但对AMF、ACT及GP/GN比值的影响并不显著; 而添加量对总PLFA、GN、真菌及GP/GN比值、F/B比值均有极显著影响(p < 0.01), 对细菌有显著影响(p < 0.05).外源碳类型及添加量的交互作用仅对真菌和F/B比值有极显著影响(p < 0.01).通过回归分析发现, 对于凋落物和BC处理, 土壤总PLFA与添加量呈极显著或显著的开口向下的抛物线关系(图 3), GP/GN比值则与添加量呈显著线性关系(p < 0.05), 并随添加量的增加呈降低趋势(图 4).凋落物处理中细菌、真菌PLFA含量及F/B比值与其添加量均呈显著线性关系(p < 0.01), 而GN含量与添加量的关系并不显著; BC处理中GN含量与添加量呈显著线性关系(p < 0.01), 细菌PLFA含量与添加量符合显著的抛物线关系(p < 0.05), 但真菌PLFA含量和F/B比值与添加量的关系并不显著(p>0.05).
| 表 2 外源碳类型和添加量及其交互作用对土壤微生物影响的显著性分析 Table 2 Significance analysis of the effects of external carbon types, addition rates and their interactions on soil microbe |
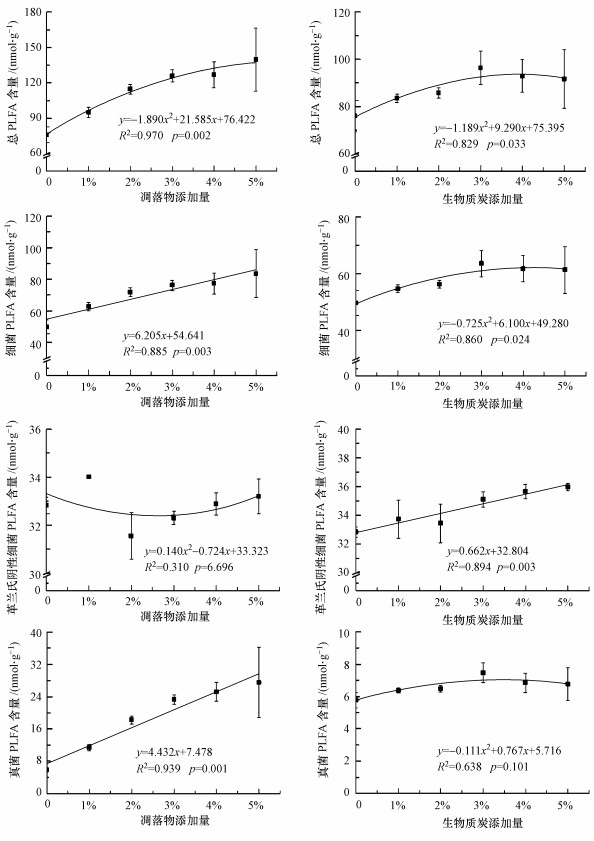 |
| 图 3 凋落物和生物质炭添加量与土壤各类微生物PLFA含量的关系 Fig. 3 Relationship between the addition rates of litter or biochar and soil microbial PLFA content |
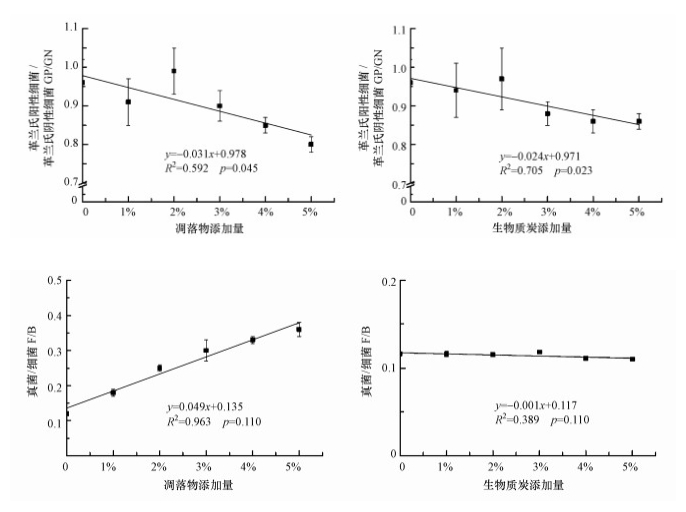 |
| 图 4 凋落物和生物质炭添加量与土壤微生物特征PLFA比值的关系 Fig. 4 Relationship between the addition rates of litter or biochar and eigenvalue of soil microbial PLFA |
主成分分析表明, PCA1对土壤微生物PLFA变异的贡献率为86.74%, PCA2的贡献率为7.29%.对照处理S与凋落物和BC处理均可以较为明显的区分开(图 5a), 结合土壤微生物群落主成分得分值差异的显著性分析, 可知外源碳类型极显著地改变了土壤微生物群落结构且凋落物对其影响更明显(p < 0.01), 但添加量对微生物群落变异的影响较小, 且两者无明显的交互作用(表 3).主成分因子载荷分析表明, 对PCA1贡献较大的PLFA多为表征细菌, 其中, 17:0 cycloω7c、16:1 ω9c、18:1 ω5c表征GN, 15:0 anteiso、17:0 anteiso、17:0 iso表征GP(图 5b).
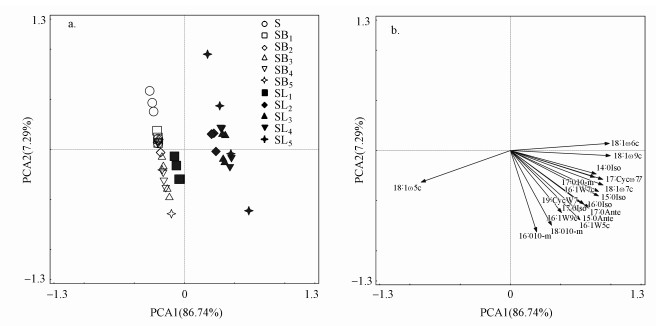 |
| 图 5 不同处理土壤微生物群落结构的主成分分析(a.主成分因子得分图; b.主成分因子载荷图) Fig. 5 Principal component analysis (PCA) of soil microbial community structure under different treatments |
| 表 3 土壤微生物群落主成分得分值差异的显著性分析(F值) Table 3 Significance analysis of the difference between principal components of the soil microbial community in score value (F value) |
以土壤微生物群落PLFA含量作为响应变量, 土壤基本性质作为解释变量进行RDA分析.结果表明, 凋落物处理下RDA1和RDA2分别解释了变量的88.81%与0.75%, 其中, 土壤全氮(TN)的影响最大, 解释了微生物群落结构变异的83.80%, 且与土壤总PLFA(TPLFA)、GP、GN、细菌、真菌、AMF、ACT呈显著正相关(p < 0.05), 与GP/GN比值呈负相关(图 6a).BC处理中RDA1与RDA2分别解释了变量的45.99%、0.34%, 其中, 土壤C/N比值作用最明显, 解释了土壤微生物群落结构变异的41.60%, 且与土壤微生物PLFA含量均呈显著正相关(p < 0.05), 与F/B、GP/GN比值呈负相关(图 6b).
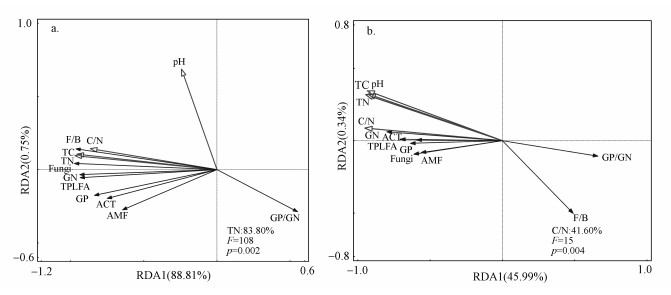 |
| 图 6 凋落物处理(a)和生物质炭处理(b)中土壤微生物群落结构与土壤性质之间的冗余分析(注:TPLFA:总磷脂脂肪酸; GP:革兰氏阳性细菌; GN:革兰氏阴性细菌; ACT:放线菌; AMF:丛枝菌根真菌; GP/GN:革兰氏阳性细菌/革兰氏阴性细菌; F/B:真菌/细菌; pH:土壤酸度; TC:总碳; TN:总氮; C/N:碳氮比值.) Fig. 6 Redundancy analysis (RDA) of microbial community structure and soil properties under litter treatments (a) and biochar treatments(b) |
本研究中凋落物处理下微生物总PLFA含量、细菌和真菌PLFA含量均随添加量的增加而增加, 其原因在于凋落物为微生物生长提供了大量碳源与营养元素, 添加量越高, 越有利于微生物繁殖(Gude et al., 2012).王晓峰等(2013)将杉木凋落物添加到土壤中进行培养试验, 发现土壤微生物生物量碳显著增加, 表明凋落物添加刺激了土壤微生物的活性, 这与本研究结果相似.周际海等(2018)发现, 350~550 ℃热解小麦秸秆BC的添加对土壤微生物活性无显著影响.Mitchell等(2015)将BC(500 ℃, 糖枫木)添加到森林土壤中培养16周, 发现土壤GP、GN、ACT含量均低于对照.而Zhang等(2018)利用Meta分析发现, BC添加后土壤总PLFA、细菌、真菌、ACT、GP和GN的活性分别增加了8.3%、19.8%、19.4%、9.1%、10.9%和13.4%.而本研究中BC添加亦增加了土壤各类微生物PLFA含量(图 1), 原因在于所用BC制备温度为350 ℃, 而低热解温度的BC中脂肪族结构发达, 易挥发组分含量高(Sigua et al., 2016), 而这些易挥发物质容易被微生物利用进而刺激其活性(Stewart et al., 2013).此外, BC比表面积大, 结构疏松多孔, 为微生物提供了生长繁衍所需的空间、水分、空气, 从而使微生物繁殖能力增强(Gude et al., 2012).但本研究也进一步发现, 3%BC添加处理土壤各类微生物PLFA含量均达到最大, 4%和5%添加处理土壤各类PLFA含量并非线性增加而呈下降的趋势, 但依然显著高于对照土壤, 其原因可能在于较高添加量BC致使多环芳烃等有毒物质增加进而降低了微生物活性(Spokas et al., 2011; Hale et al., 2012).这与何玉亭等(2016)的研究结论相近, 在其研究中将0、1%、2%、4%、6%土壤质量的2种BC(烟秆和桑条, 450 ℃)添加到土壤中进行4个月的培养, 发现4%添加量处理土壤细菌、真菌、ACT含量最高.但Gomez等(2014)研究发现, 土壤各类微生物PLFA含量随BC(550 ℃热解橡木)添加量(0、1%、5%、10%、20%土壤质量)的增加而增加, 并且显著改变了土壤微生物群落结构.Farrell等(2013)利用培养试验研究了BC(小麦幼苗和桉树幼苗, 450 ℃热解)添加后土壤微生物PLFA含量的动态变化, 添加量为土壤质量的5%, 结果发现, 同对照土壤相比, BC添加后土壤PLFA含量在第3、9、25 d变化不大, 但74 d培养结束时则显著提高, 土壤微生物群落结构也因可溶性碳和土壤pH的增加而显著变化.导致各研究论存在差异的主要原因在于土壤微生物活性对添加量的响应可能与BC制备条件(原材料与热解温度)、土壤环境、试验条件(添加量和试验时间)等因素的不同有关.本研究亦发现凋落物和BC处理均显著改变了土壤微生物群落结构, 并且凋落物的影响更为显著.这与雷海迪等(2016)的研究结论吻合, 其归因于凋落物是试验用土微生物养分的主要来源, 微生物对其具有更好的适应性.除此之外, BC与凋落物相比碳形态更为稳定, 生物有效性较低, 不易被微生物利用(Lehmann et al., 2011).
Cao等(2010)发现, 在南方巨桉人工林中细菌占主导地位, 并解释是因为南方亚热带季风气候高温高热的环境更有利于细菌生长.本试验中, 凋落物和BC处理土壤微生物也表现为细菌占据绝对优势, 同时在PCA分析中微生物群落结构变异的PLFA大部分表征细菌.研究表明, GN为“富养型”细菌, GP/GN比值可以灵敏地反映土壤养分状况(Moore-Kucera et al., 2007).在本研究中, 4%与5%添加量的凋落物和BC处理均显著降低GP/GN比值, 表明短期内较高外源碳输入增加了土壤中易被利用的碳源与能量, 进而刺激“富养型”细菌的生长, 这与已有的研究结论一致(Gomez et al., 2014).值得关注的是, 本研究中凋落物处理增加了ACT含量, 但未达显著水平, 而3%、4%和5%添加量的BC处理却显著提高土壤ACT含量.这可能与ACT适宜在中性或接近中性的土壤环境中生长有关(陈威等, 2015).但也有可能与BC结构有关, 如Zhu等(2017)发现BC因其高孔隙度及比表面积而增强了土壤总微生物及ACT活性.相较于BC处理, 凋落物处理对真菌PLFA含量的增加更为明显, 其原因是真菌对纤维素、木质素等高分子聚合物的分解效率较高, 单一针叶凋落物(本研究为杉木凋落叶)分解时, 土壤微生物主要通过调节群落真菌促进分解(陈法霖等, 2011).此外, BC添加亦会提高土壤pH值, 而大多数真菌喜好偏酸性的土壤环境(Yuan et al., 2011), 因此, 同BC处理相比, 真菌更倾向于在凋落物处理的土壤中繁殖, 这亦可能是凋落物添加量与真菌PLFA含量呈线性正相关的原因(图 3), 并进一步导致F/B比值亦随添加量的增加而升高.
土壤性质对微生物群落结构有着重要的影响.如Muhammad等(2014)研究表明, BC(500 ℃, 芦苇)添加提高了土壤pH、C/N比值等, 进而改变了土壤微生物群落结构.Jiang等(2016)将BC(550 ℃, 橡木)添加到土壤中进行30个月的培养, 发现土壤C/N比值为影响微生物群落结构改变的主要因素, 并与微生物含量呈显著相关.本研究结果与上述结论吻合, 即BC处理中土壤C/N比值对微生物群落结构的影响最为显著, 土壤微生物含量与C/N比值亦呈显著正相关.其原因是BC添加提高了土壤C/N比值, 并达到了影响微生物生长的阈值, 可能刺激了某些易利用难分解碳的微生物活性, 因而成为主要因素.而本试验中, 凋落物处理中土壤TN解释了微生物群落结构变异的83.80%, 这主要与凋落物在分解过程中氮素积累有关(龙健等, 2019); 同时, 在凋落物处理中真菌变化最为显著, 进而会直接影响到微生物群落结构, 而真菌对氮素敏感度较高(樊芳玲等, 2016), 因而土壤TN为影响凋落物处理中微生物群落结构变化的主要因子.
5 结论(Conclusions)1) 凋落物和BC添加均不同程度地提高了土壤微生物总PLFA含量, 并且土壤中各类微生物对其添加量的响应也截然不同.凋落物处理中土壤微生物总PLFA、细菌、真菌PLFA含量与其添加量均呈显著正相关关系, 在本研究添加量范围内, 土壤微生物活性呈增加趋势; 但BC处理则不同, 土壤微生物总PLFA及各类微生物PLFA含量均在3%添加量处理下达到最大值, 呈开口向下的抛物线关系, 添加量进一步增加, 微生物活性反而下降.
2) 凋落物和BC添加均显著改变了土壤微生物群落结构, 且凋落物的影响更为明显, 而添加量对其影响则较小.本研究还表明, 土壤全氮与C/N比值分别为影响凋落物与BC处理中微生物群落结构变化的关键因素.
Cao Y S, Fu S L, Zou X M, et al. 2010. Soil microbial community composition under Eucalyptus plantations of different age in subtropical China[J]. European Journal of Soil Biology, 46(2): 128–135.
DOI:10.1016/j.ejsobi.2009.12.006
|
陈法霖, 郑华, 欧阳志云, 等. 2011. 土壤微生物群落结构对凋落物组成变化的响应[J]. 土壤学报, 2011, 48(3): 603–611.
|
陈威, 胡学玉, 陆海楠. 2015. 生物炭输入对土壤本体有机碳矿化的影响[J]. 环境科学, 2015, 36(6): 2300–2305.
|
樊芳玲, 谢德体, 魏朝富, 等. 2016. 坡耕地-桑树系统土壤微生物群落结构的PLFA分析[J]. 生态学报, 2016, 36(12): 3812–3823.
|
Farrell M, Kuhn T K, Macdonald L M, et al. 2013. Microbial utilisation of biochar-derived carbon[J]. Science of the Total Environment, 465: 288–297.
DOI:10.1016/j.scitotenv.2013.03.090
|
Frostegård Å, Tunlid A, Bååth E. 2011. Use and misuse of PLFA measurements in soils[J]. Soil Biology and Biochemistry, 43(8): 1621–1625.
DOI:10.1016/j.soilbio.2010.11.021
|
盖霞普, 刘宏斌, 翟丽梅, 等. 2016. 生物炭对中性水稻土养分和微生物群落结构影响的时间尺度变化研究[J]. 农业环境科学学报, 2016, 35(4): 719–728.
|
Gomez J D, Denef K, Stewart C E, et al. 2014. Biochar addition rate influences soil microbial abundance and activity in temperate soils[J]. European Journal of Soil Science, 65(1): 28–39.
DOI:10.1111/ejss.12097
|
Gude A, Kandeler E, Gleixner G. 2012. Input related microbial carbon dynamic of soil organic matter in particle size fractions[J]. Soil Biology and Biochemistry, 47(2): 209–219.
|
郭剑芬, 陈光水, 钱伟, 等. 2006. 万木林自然保护区2种天然林及杉木人工林凋落量及养分归还[J]. 生态学报, 2006, 26(12): 4091–4098.
DOI:10.3321/j.issn:1000-0933.2006.12.023 |
Hale S E, Lehmann J, Rutherford D, et al. 2012. Quantifying the total and bioavailable polycyclic aromatic hydrocarbons and dioxins in biochars[J]. Environmental Science and Technology, 46(5): 2830–2838.
DOI:10.1021/es203984k
|
Hansson K, Olsson B A, Olsson M, et al. 2011. Differences in soil properties in adjacent stands of Scots pine, Norway spruce and silver birch in SW Sweden[J]. Forest Ecology and Management, 262(3): 522–530.
DOI:10.1016/j.foreco.2011.04.021
|
何玉亭, 王昌全, 沈杰, 等. 2016. 两种生物质炭对红壤团聚体结构稳定性和微生物群落的影响[J]. 中国农业科学, 2016, 49(12): 2333–2342.
DOI:10.3864/j.issn.0578-1752.2016.12.009 |
Jiang X, Denef K, Stewart C E, et al. 2016. Controls and dynamics of biochar decomposition and soil microbial abundance, composition, and carbon use efficiency during long-term biochar-amended soil incubations[J]. Biology and Fertility of Soils, 52(1): 1–14.
DOI:10.1007/s00374-015-1047-7
|
Koukol O, Novak F, Hrabal R, et al. 2006. Saprotrophic fungi transform organic phosphorus from spruce needle litter[J]. Soil Biology and Biochemistry, 38(12): 3372–3379.
DOI:10.1016/j.soilbio.2006.05.007
|
Kuzyakov Y, Horwath W R, Dorodnikov M. 2019. Review and synthesis of the effects of elevated atmospheric CO2 on soil processes:NO changes in pools, but increased fluxes and accelerated cycles[J]. Soil Biology and Biochemistry, 128: 66–78.
DOI:10.1016/j.soilbio.2018.10.005
|
Lehmann J, Rillig M C, Thies J, et al. 2011. Biochar effects on soil biota-A review[J]. Soil Biology and Biochemistry, 43(9): 1812–1836.
DOI:10.1016/j.soilbio.2011.04.022
|
雷海迪, 尹云锋, 刘岩, 等. 2016. 杉木凋落物及其生物炭对土壤微生物群落结构的影响[J]. 土壤学报, 2016, 53(3): 790–799.
|
刘菊秀, 段洪浪, 邓琦, 等. 2009. CO2浓度升高与氮沉降对南亚热带森林生态系统植物生物量积累及分配格局的影响[J]. 植物生态学报, 2009, 33(3): 570–579.
DOI:10.3773/j.issn.1005-264x.2009.03.016 |
龙健, 赵畅, 张明江, 等. 2019. 不同坡向凋落物分解对土壤微生物群落的影响[J]. 生态学报, 2019, 39(8): 2696–2704.
|
Mitchell P J, Simpson A J, Soong R, et al. 2015. Shifts in microbial community and water-extractable organic matter composition with biochar amendment in a temperate forest soil[J]. Soil Biology and Biochemistry, 81: 244–254.
DOI:10.1016/j.soilbio.2014.11.017
|
Moore-Kucera J, Dick R P. 2007. PLFA profiling of microbial community structure and seasonal shifts in soils of a douglas-fir chronosequence[J]. Microbial Ecology, 55(3): 500–511.
|
Muhammad N, Dai Z, Xiao K, et al. 2014. Changes in microbial community structure due to biochars generated from different feedstocks and their relationships with soil chemical properties[J]. Geoderma, 226-227(1): 270–278.
|
Neff J C, Townsend A R, Gleixner G, et al. 2002. Variable effects of nitrogen additions on the stability and turnover of organic carbon[J]. Nature, 419: 915–917.
DOI:10.1038/nature01136
|
Nevins C J, Nakatsu C, Armstrong S. 2018. Characterization of microbial community response to cover crop residue decomposition[J]. Soil Biology and Biochemistry, 127: 39–49.
DOI:10.1016/j.soilbio.2018.09.015
|
Sigua G C, Novak J M, Watts D W, et al. 2016. Impact of swichgrass biochars with supplemental nitrogen on carbon-nitrogen mineralization in highly weathered Coastal Plain Ultisols[J]. Chemosphere, 145: 135–141.
DOI:10.1016/j.chemosphere.2015.11.063
|
Spokas K A, Novak J M, Stewart C E, et al. 2011. Qualitative analysis of volatile organic compounds on biochar[J]. Chemosphere, 85(5): 869–882.
DOI:10.1016/j.chemosphere.2011.06.108
|
Stewart C E, Zheng J, Botte J, et al. 2013. Co-generated fast pyrolysis biochar mitigates greenhouse gas emissions and increases carbon sequestration in temperate soils[J]. Global Change Biology Bioenergy, 5(2): 153–164.
DOI:10.1111/gcbb.12001
|
Wan X H, Huang Z Q, He Z M, et al. 2015. Soil C/N ratio is the major determinant of soil microbial community structure in subtropical coniferous and broadleaf forest plantations[J]. Plant and Soil, 387(1/2): 103–116.
|
万晓华, 黄志群, 何宗明, 等. 2016. 改变碳输入对亚热带人工林土壤微生物生物量和群落组成的影响[J]. 生态学报, 2016, 36(12): 3582–3590.
|
王巍巍, 赵琼, 赵欣然, 等. 2015. 凋落物管理对樟子松人工林土壤微生物群落结构的影响[J]. 生态学杂志, 2015, 34(9): 2605–2612.
|
王晓峰, 汪思龙, 张伟东. 2013. 杉木凋落物对土壤有机碳分解及微生物生物量碳的影响[J]. 应用生态学报, 2013, 24(9): 2393–2398.
|
尹艳, 刘岩, 尹云锋, 等. 2018. 生物质炭添加对杉木人工林土壤原有有机碳矿化的影响[J]. 应用生态学报, 2018, 29(5): 1389–1396.
|
Yuan J H, Xu R K, Zhang H. 2011. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 102(3): 3488–3497.
DOI:10.1016/j.biortech.2010.11.018
|
余涵霞, 王家宜, 万方浩, 等. 2018. 植物凋落物影响土壤有机质分解的研究进展[J]. 生物安全学报, 2018, 27(2): 88–94.
DOI:10.3969/j.issn.2095-1787.2018.02.003 |
Zhang L Y, Jing Y M, Xiang Y Z, et al. 2018. Responses of soil microbial community structure changes and activities to biochar addition:A meta-analysis[J]. Science of the Total Environment, 643: 926–935.
DOI:10.1016/j.scitotenv.2018.06.231
|
Zhu X M, Chen B L, Zhu L Z, et al. 2017. Effects and mechanisms of biochar-microbe interactions in soil improvement and pollution remediation:A review[J]. Environmental Pollution, 227: 98–115.
DOI:10.1016/j.envpol.2017.04.032
|
郑璐嘉, 黄志群, 何宗明, 等. 2015. 林龄、叶龄对亚热带杉木人工林碳氮稳定同位素组成的影响[J]. 林业科学, 2015, 51(1): 22–28.
|
周际海, 袁东东, 袁颖红, 等. 2018. 生物质炭与有机物料混施对土壤温室气体排放和微生物活性的影响[J]. 环境科学学报, 2018, 38(7): 2849–2857.
|
 2019, Vol. 39
2019, Vol. 39


