2. 山东省土地生态修复工程技术研究中心, 滨州 256600;
3. 浙江财经大学中国政府管制研究院, 杭州 310018
2. Land Ecological Restoration Engineering Technology Research Center of Shandong Province, Binzhou 256600;
3. China Institute of Regulation Research, Zhejiang University of Finance & Economics, Hangzhou 310018
土地整治作为改善农业生产和生态环境的高效土地管理工具, 主要包括合并零散地块、平整土地、完善农业设施及提高土壤质量等措施, 已在世界上大部分国家得到了广泛应用(Demetriou, 2016; Djanibekov et al., 2018; Stanczuk-Galwiaczek et al., 2018).当前, 为了应对不断凸显的耕地风险所带来的挑战, 土地整治的功能和作用日益丰富, 并逐渐成为解决农业、自然、景观、经济和旅游等众多发展问题的有效手段(刘涓等, 2015; Johansen et al., 2018).然而, 土地整治也会影响农田土壤理化性质和微生物群落, 尤其是土壤微生物多样性(Legrand et al., 2018; Muchova et al., 2018).土壤作为一种宝贵的不可再生资源, 在食品安全和生态环境保护中具有非常重要的作用.土壤质量不仅包括物理化学性质, 同时还受到微生物的影响, 而土壤非生物和生物两种性质相互作用的过程中, 很容易受到土地整治的影响(樊文华等, 2011; Wang et al., 2018).
土壤微生物群落在碳、氮、磷等物质分解和养分循环中发挥着重要作用, 同时也可以对变化的环境做出快速反应(张琼琼等, 2016; 纳小凡等, 2017).土壤微生物中的细菌可以通过固氮和转化有机质等方式改善土壤质量以提高作物产量, 真菌也有迁移和转化重金属来改善土壤环境的作用(张连忠等, 2005; Nicolas et al., 2018; 闫华等, 2018).同时, 土壤环境因子如pH、有机质、重金属等对土壤微生物多样性和组成结构具有极其重要的影响(张媚等, 2018; 王娜等, 2019).已有研究表明, 通过土地整治对农田进行合理管理, 可以有效改善土壤的质量(Ertunc et al., 2018; Wojcik-Len et al., 2018).但目前评价土壤质量的主要标准大多是关于非生物因素的, 极少有对土地整治进行涉及微生物指标的综合评价(刘涓等, 2015; Demetriou, 2016).然而, 土壤微生物对农田土壤环境质量的多重调控作用是毋庸置疑的, 在土地整治的评价研究中还需进一步探讨.
随着生物信息技术的发展, 高通量测序技术已被广泛应用于土壤微生物群落组成分析和功能预测(刘静等, 2010).因此, 本文通过测定嘉善县土地整治区中土壤性质及土壤细菌和真菌群落的多样性和组成, 分析土地整治影响下细菌和真菌群落的差异, 以研究土地整治和相关土壤环境因子对土壤微生物的影响, 并确定对土壤微生物群的组成和功能方面具有重要影响作用的土壤环境因子.
2 材料与方法(Materials and methods) 2.1 研究区概况嘉善县位于中国东部沿海地区、江浙沪中心位置(30°45′36″~31°1′12″N, 120°44′22″~121°1′45″E), 境内水路通达, 物产丰富, 拥有数千年的水稻种植历史.研究区地处北亚热带南缘的东亚季风区, 年平均气温15.8 ℃, 年平均降雨量1155.7 mm, 以黄斑田和青紫泥田为主, 十分适宜作物生长.由于地理位置优越, 气候条件适宜, 嘉善县历来都是中国粮食生产的龙头县.然而, 耕地破碎化和土壤贫瘠仍然是制约嘉善县农业可持续发展的严重问题.因此, 近年来土地整治已成为该地区集中耕地、改善土壤质量的一项重要任务.在土地整治区, 主要采取合并地块、平整土地、筑造沟渠及施用有机肥等措施来改善土壤质量.本文主要关注合并地块和施用有机肥对土壤微生物的影响.
2.2 土样采集2018年9月在嘉善县56个样地采集土壤样品, 其中1/2的样地在土地整治区内(土地整治3年以上), 其余1/2的样地为靠近土地整治区的地块(耕作10年以上).所有采样点均为水田, 作物为水稻, 土壤样品均采用“S”形多点采样法采集0~10 cm的表层土(Legrand et al., 2018; Yu et al., 2018).
所有土壤样品去除石头、植物残留物、动物和其他杂物后, 每个土样称取20 g土壤样本储存于-80 ℃的冰箱用于DNA提取, 另将500 g土壤样品根据不同理化指标化验要求存储于实验室中备用(吕纯剑等, 2018).土壤经均质化处理后, 对每个土壤样本进行3次重复DNA提取和土壤理化分析.
2.3 理化性质化验采用常规方法测定土壤样品的理化性质.简言之, 土壤pH以土水比1:2.5的比例通过pH计测定, 土壤含水量(MC)通过电热恒温烘箱在105 ℃的条件下烘6 h测定, 土壤中的Cu、Cd和Pb等重金属含量由电感耦合等离子体质谱仪(Agilent 7800, California, USA)测定, 土壤有机质(OM)、总氮(TN)、有效磷(AP)和速效钾(AK)分别由总有机碳分析仪(BOCS301, Shimadzu, Japan)、自动凯氏定氮仪(K9860, 海南, 中国)、分光光度计和火焰光度计测定(吴讷等, 2016; Song et al., 2018).
2.4 DNA提取及高通量测序根据FastDNA SPIN试剂盒(MP Biomedicals, USA)的使用说明, 从0.5 g土壤样品(一式3份)中提取用于PCR扩增的土壤基因组DNA.通过Nanodrop 2000分光光度计(Thermo Scientific, USA)测定提取的DNA的质量和浓度, 并将提取的DNA于-20 ℃下储存等待进一步使用(芮文鸿等, 2018).用引物338F和806R对细菌16S rRNA基因的V3~V4区域进行扩增, 并使用引物ITS1F和IT2R对真菌DNA基因的ITS区域进行扩增(刘奎等, 2018).细菌的PCR采用20 μL反应体系, 包括4 μL 5×Pyrobest Buffer、2 μL 2.5 mmol·L-1 dNTPs、0.8 μL 338F/806R(5 μmol·L-1)、0.4 μL FastPfu聚合酶、0.2 μL BSA、10 ng DNA模板.真菌的PCR反应体系则包括2 μL 10×Buffer、2 μL 2.5 mmol·L-1 dNTPs、0.8 μL ITS1F/IT2R(5 μmol·L-1)、0.2 μL rTaq聚合酶、0.2 μL BSA、10 ng DNA模板.整个过程在PCR仪(ABI GeneAmp 9700)中进行, 程序如下:95 ℃下预变性3 min;95 ℃下变性30 s, 60 ℃下退火30 s, 72 ℃下延伸45 s, 10个循环;然后在72 ℃下延伸10 min, 10 ℃下再延伸30 min.然后, 在Illumina HiSeq4000平台上进行测序.原始DNA测序数据用QIIME 2(Quantitative Insights Into Microbial Ecology 2)处理, 以97%的相似性为标准将有效序列聚类成OTU(操作分类单位)进行后续分析(Nottingham et al., 2018).
2.5 分析方法通过mothur1.30.1估算Sobs、Shannon、Simpson、Ace、Chao1及Coverage等微生物α多样性指数(Shao et al., 2019).Student′s t test和Wilcoxon rank-sum test用于不同组之间多样性指数的显著差异分析.并且通过QIIME 2和软件R 2.1.3进行包括层次聚类、主坐标分析(PCoA)和冗余分析(RDA)等β多样性分析(Jiang et al., 2019).通过QIIME 2评估环境因子与微生物组成或多样性之间的相关性.使用PICRUSt软件进行细菌功能预测.
本研究中16S rRNA基因序列在GenBank中的项目登记号为PRJNA523453, 序列登记号为SAMN10977546-SAMN10977601;ITS基因序列在GenBank中的项目登记号为PRJNA523461, 序列登记号为SAMN10977657-SAMN10977712.
3 结果与分析(Results and analysis) 3.1 土壤环境因子本研究选取28个土地整治区(标记为A组), 并在每个整治区附近选取水田作为对照组(标记为B组).所选的水田土壤都具有相似的质地, 以紫色粘性土壤为主.表 1总结了两组土壤的环境因子, 其中, 理化性质包括酸碱度(pH)、有机质(OM)、含水量(MC)、有效磷(AP)、速效钾(AK)和总氮(TN), 重金属包括铜(Cu)、镉(Cd)和铅(Pb).结果显示, 土地整治区的平均土壤pH为7.10, 更接近中性, 同时, 有机质、有效磷及全氮的含量都得到了显著提高.此外, 由于土地整治工程的实施, 铜(Cu)、镉(Cd)和铅(Pb)等重金属含量都有所下降.
| 表 1 土壤环境因子数据 Table 1 Data of soil environmental factors |
共有2572593条有效的细菌16S rDNA序列经聚类得到9157个OUT, 共54门和991属.门水平上, 变形菌门(25.97%)、绿弯菌门(18.32%)、酸杆菌门(9.75%)、拟杆菌门(6.14%)、放线菌门(5.14%)、浮霉菌门(3.77%)、疣微菌门(3.09%)、芽单胞菌门(2.83%)、厚壁菌门(2.64%)、蓝藻菌门(2.25%)、硝化螺旋菌门(1.70%)占据超过80%的OTU.在属水平上, 硝化螺菌属(Nitrospira)、嗜盐海洋粘细菌(Haliangium)、玫瑰弯菌属(Roseiflexus)、地杆菌属(Geobacter)、布氏杆菌(Bryobacter)、芽单胞菌属(Gemmatimonas)、厌氧绳菌属(Anaerolinea)、厌氧粘细菌(Anaeromyxobacter)和鞘丝藻属(Leptolyngbya)等则是样品中丰度最高的菌属(图 1).
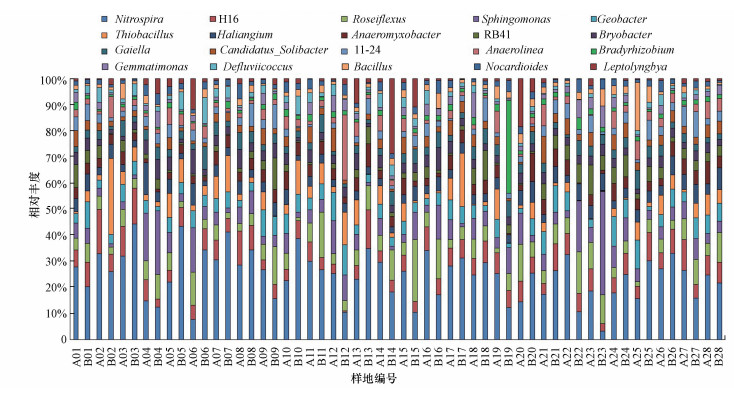 |
| 图 1 属水平上土壤细菌群落组成 Fig. 1 Composition of soil bacterial community at the genus level |
对于真菌而言, 共有3148068条有效的ITS序列聚类为5762个OUT, 共7门和476属.除了未分类的真菌, 超过90%的OTU被分至子囊菌门(70.26%)、担子菌门(15.22%)和壶菌门(6.26%).其中, 主导菌属为赤霉菌属(Gibberella)、柄孢壳属(Zopfiella)、镰刀菌属(Fusarium)、支顶孢属(Acremonium)、被孢霉属(Mortierella)和弯孢霉属(Curvularia)等真菌(图 2).
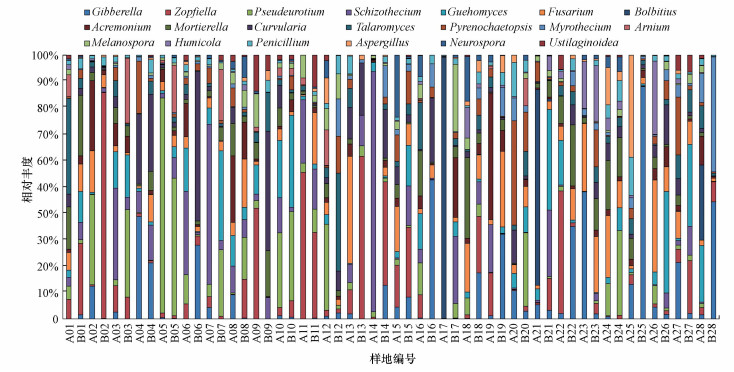 |
| 图 2 属水平上土壤真菌群落组成 Fig. 2 Composition of soil fungal community at the genus level |
Wilcoxon rank-sum检验结果显示, 土地整治是显著影响细菌群落多样性的因素, 包括合并地块、平整土地、筑造沟渠及施用有机肥(p < 0.01).土地整治区(A组)中的土壤细菌α多样性指数Sobs、Shannon、Simpson、Ace、Chao1及Coverage都在1%水平上显著高于非土地整治区(B组).同时, 两组样品中实施过合并地块、平整土地、筑造沟渠或施用有机肥的地块中的土壤细菌α多样性均得到了显著提高.图 3展示了土地整治区与非土地整治区中的土壤细菌α多样性指数均一化结果.
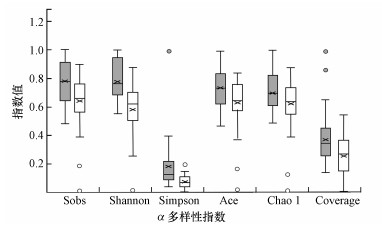 |
| 图 3 土地整治区(灰色填充)与非土地整治区(白色填充)中的土壤细菌α多样性指数 Fig. 3 The α-diversity indexes of soil bacteria in land consolidation area (gray filling) and non-land consolidation area (white filling) |
土地整治也对土壤细菌群落结构造成了显著影响.通过β多样性分析可见, A组中的土壤细菌多样性显著高于B组.在门水平上, 两组土壤样品的细菌均以变形菌门、绿弯菌门、酸杆菌门和放线菌门为主.但在属水平上, 硝化螺菌属、鞘脂单胞菌属、地杆菌属在A组中具有较高丰度, 而硝化螺菌属、玫瑰弯菌属和硫杆菌属在B组中处于主导地位.通过软件Circos-0.67-7, 将土壤细菌中占OTU总数80%的菌种定义为核心物种(Legrand et al., 2018).在属水平上, 无色杆菌属、Aquicella、Catenuloplanes、Dechloromonas、Dongia、地发菌属、红杆菌属和互养菌属仅在A组中被检测到, 而Altererythrobacter、固氮弓菌属、除硫单胞菌属、Ilumatobacter、Microvirga、颗粒申氏杆菌、Skermanella和Sulfurifustis仅在B组中被检测到.同时, 研究结果还表明, 在施用有机肥的水田中, 鞘脂单胞菌属和地杆菌等有益菌具有较高丰度.
 |
| 图 4 基于PCoA分析的A组(土地整治区内)和B组(土地整治区外)土壤细菌群落β多样性 Fig. 4 β-diversity of bacterial communities of soil samples from group A(land consolidation area) and group B(outside land consolidation area) based on PCoA analysis |
16S rRNA基因是研究微生物群落功能的关键工具.通过PICRUSt软件获取COG家族信息和KEGG Ortholog(KO)信息以计算对应的功能丰度(Wong et al., 2016).根据所有土壤样品的功能预测结果, 氨基酸转运和代谢、能量生产和转化、信号转导机制及细胞壁/膜生物发生是最主要的功能, 尤其在A组土壤中.并且A组和B组土壤细菌的功能差异较为显著(p < 0.01), 这也导致了相应的细菌群落组成结构的显著差异.
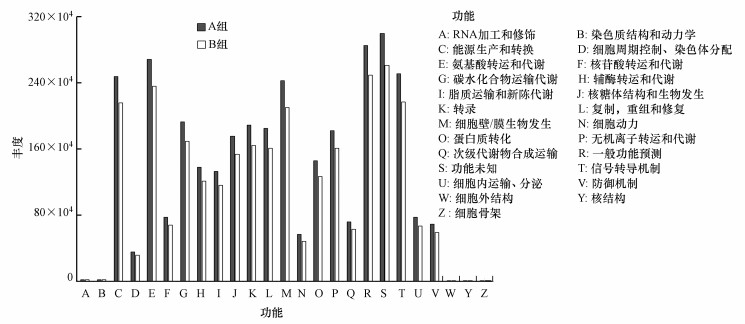 |
| 图 5 土地整治区(A组)与非土地整治区(B组)土壤样品中PICRUSt推断的功能丰度 Fig. 5 The abundance of functions inferred by PICRUSt in the soil samples under land consolidation (group A) or not (group B) |
通过RDA揭示了细菌群落组成结构与环境因子(土壤性质和重金属含量)之间的关系.其中, 与样点土壤细菌群落结构显著相关的环境因子有OM(r=0.37, p < 0.001)、Cu(r=0.33, p < 0.01)、Cd(r=0.22, p < 0.001)、Pb(r=0.35, p < 0.05)、MC(r=0.18, p < 0.001)、pH(r=0.33, p < 0.001)和TN(r=0.21, p < 0.001) (图 6).A组土壤细菌群落结构主要受到pH、Cu、Cd和Pb的影响, 其中, 放线菌门、硝化螺旋菌门、变形菌门、拟杆菌门、疣微菌门和纤维杆菌门等13门与环境因子显著相关(p≤0.05).而B组土壤细菌群落结构主要受到AP、MC、OM、Cu、Cd及Pb的影响, 其中, 芽单胞菌门、蓝藻菌门、硝化螺旋菌门、厚壁菌门、拟杆菌门等11门与环境因子显著相关(p≤0.05).
 |
| 图 6 环境因子对两组土壤细菌群落结构的影响 (注:黑色箭头代表细菌, 灰色箭头代表环境因子;黑色箭头的长度表示环境因子对细菌的影响程度;黑色箭头和灰色箭头之间的角度表示正负相关(锐角:正相关;钝角:负相关;直角:无相关)) Fig. 6 Effects of environmental factors on the structure of soil bacterial communities in the two groups |
与细菌群落相似, A组土壤样品中真菌群落的α多样性指数Sobs、Shannon、Simpson、Ace、Chao1及Coverage显著高于B组(Student′s t test, p < 0.01).同时, 除Shannon指数外, 有机肥的施用还显著提高了真菌群落的α多样性指数, 并且大多数α多样性指数在大规模水田中也得到了显著提高.
对于β多样性, 土地整治也在影响两组真菌群落结构方面发挥了重要作用.在属水平上(Wilcoxon rank-sum tes, α=0.05), 被孢霉属、青霉菌属和内养囊霉属在A组土壤中更丰富, 而被孢霉属、曲霉菌属和镰孢霉属在B组土壤中更为普遍.在核心菌属中, 旋孢腔菌属、双曲孢属、青褶伞属、弯孢聚壳属等24属仅在A组土壤样品在被检测到, 而腐皮壳属、油壶菌属、粪锈伞属、斜盖伞属等19属仅在B组土壤样品在被检测到.结果还表明, 在施用有机肥的样点, 而镰孢霉属、青霉菌属和曲霉菌属更为丰富.
3.4.2 环境因子对土壤真菌多样性和结构的影响根据RDA结果(图 7), 与所有样本土壤真菌群落显著相关的环境因子是OM (r=0.11, p < 0.01)、Cu (r=0.24, p < 0.001)、Cd (r=0.36, p < 0.05)、Pb (r=0.21, p < 0.05)、pH (r=0.39, p < 0.001)、AK (r=0.36, p < 0.01)、AP (r=0.32, p < 0.01)和TN (r=0.44, p < 0.01).Spearman分析表明, A组土壤样品中支顶孢属、链格孢属、柄孢壳菌属、Arnium、Cistella、弯孢霉属、赤霉菌属及黑孢壳属在1%水平上与环境因子显著相关.然而, 在B组中, 支顶孢属、链格孢属、Arnium、弯孢霉属、木拉克酵母属、柄孢壳菌属以及Pseudeurotium等16属与环境因子显着正相关或负相关(p < 0.01).
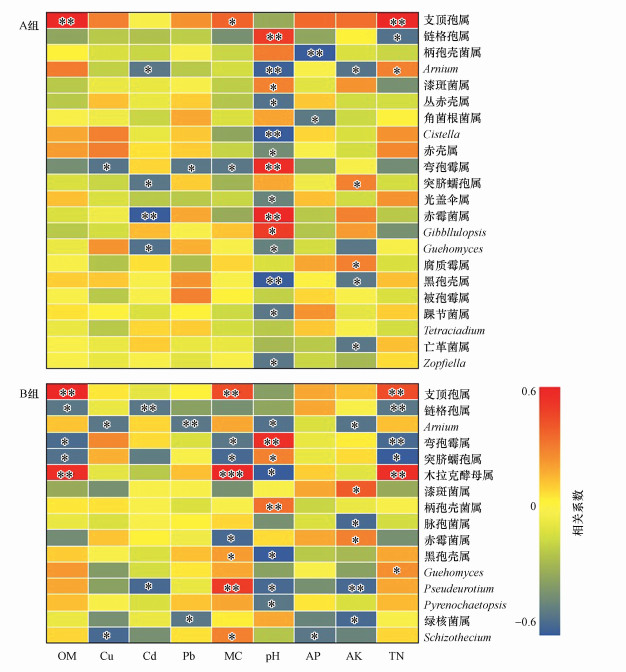 |
| 图 7 环境因子对两组土壤真菌群落结构的影响 (图中显示环境因子与真菌之间的相关性, 暖色调表示正相关, 冷色调表示负相关(*表示0.01<p≤0.05, **表示0.001<p≤0.01, ***表示p≤0.001)) Fig. 7 Effects of environmental factors on the structure of soil fungal communities in the two groups |
根据实验结果, 土地整治对土壤微生物多样性和群落结构具有较大影响, 并且细菌和真菌群落对土地整治的反应有所不同.土地整治, 如合并地块和施用有机肥, 被认为是推动微生物群落动态变化的重要因素(韦翔华等, 2009).本研究中, 土地整治区土壤样品中的细菌群落多样性显著高于非土地整治区域.具体而言, 施用有机肥样点的土壤细菌群落多样性显著高于仅接受化肥的样点, 整治区内外的土壤样本差异尤为明显; 同时, 合并地块的方式也有同样的效果.这些结果与先前的研究一致(Assainar et al., 2018; Delgado-Baquerizo et al., 2018).此外, 土地整治区中的土壤细菌功能多样性得到了显著改善(p < 0.05).根据以往的研究成果, 这主要得益于有机肥的应用(Zhong et al., 2010; Langille et al., 2013).尽管真菌群落的多样性不如细菌的高, 但整治区内外的土样仍存在显著差异.
与此同时, 土地整治区土壤微生物群落β多样性也显著高于非整治区土壤微生物群落, 表明土地整治为丰富土壤微生物群落提供了巨大动力, 这与先前相关研究结果是一致的(Wang et al., 2018).在属的水平上, 硝化螺菌、鞘脂单胞菌和地杆菌在土地整治区的土壤细菌中更为丰富, 而来自非土地整治区的土壤样本则以硝化螺菌、玫瑰弯菌和硫杆菌为主.土地整治区土壤中的鞘脂单胞菌和地杆菌是水田中的有益细菌, 有助于减少重金属污染并为植物提供营养物质(程坤等, 2017; Fan et al., 2018; Xu et al., 2018).真菌方面, 土地整治有助于减少曲霉菌和镰孢霉菌等致病菌在土壤中的丰度.由于复杂的自然和社会条件, 土壤微生物群落与以往的研究结果并不完全相同, 但也比较接近(Nilsson et al., 2018; Sun et al., 2018; Yu et al., 2018), 所以本次研究结果仍然是可信的.
4.2 土壤环境因子对微生物群落的影响除土地整治的影响外, 环境因子中的土壤理化性质(pH、OM、MC、AP、AK和TN)和重金属污染水平(Cu、Cd和Pb)也是与微生物组成结构和多样性显著相关的因素.同时, 土壤OM、Cd、MC、pH和TN是影响细菌群落组成结构变化的最重要因素.然而, 真菌群落组成受Cu和pH的影响更大.由此可见, 与真菌群落相比, 细菌群落在环境因子的压力下显得更敏感.这些结果与先前的研究高度一致(Liu et al., 2017; Malik et al., 2018; Li et al., 2019).
Cu、Cd、Pb、Cr和Ni是土壤中主要的重金属污染物(Fu et al., 2008; Song et al., 2015).尽管许多研究已经证实了重金属含量与土壤中微生物群落的组成和多样性之间的相关性(Beattie et al., 2018; Hemmat-Jou et al., 2018; Alejandro Iocoli et al., 2019), 但本研究结果表明, 影响土壤微生物群落组成和多样性的关键重金属为Cu、Cd和Pb.土地整治有效提高了海绵杆菌、异常球菌、WS2、迷踪菌等细菌及柄孢壳、透孢黑团壳等真菌的丰度, 这些都是可以借助有机质显著减少Cu、Cd和Pb等重金属污染的有益菌(Covelo et al., 2007; Huu et al., 2012).
5 结论(Conclusions)土壤微生物群落多样性和组成结构与土地整治和土壤环境因子显著相关, 并且细菌群落对这些变化显得更为敏感.在本研究中, 土地整治可以通过合并地块和施用有机肥来有效提高土壤微生物多样性和功能性, 证明了土地整治对改善土壤质量的重要作用.此外, 在相同的土地整治措施下, 土壤微生物组成和多样性具有很高的相似性, 这表明类似的土地整治措施可能会提高这些水田之间生物组成和功能多样性的相似性.与此同时, 本研究还发现了一些有助于减少土壤中重金属污染的特定细菌和真菌.简言之, 这些结果有助于更好地了解土地整治对改善土壤微生物群落结构和提升土壤质量的重要作用, 可为实现土壤可持续发展提供技术参考.
Alejandro Iocoli G, Celina Zabaloy M, Pasdevicelli G, et al. 2019. Use of biogas digestates obtained by anaerobic digestion and co-digestion as fertilizers:Characterization, soil biological activity and growth dynamic of Lactuca sativa L.[J]. Science of The Total Environment, 647: 11–19.
DOI:10.1016/j.scitotenv.2018.07.444
|
Assainar S K, Abbott L K, Mickan B S, et al. 2018. Response of wheat to a multiple species microbial inoculant compared to fertilizer application[J]. Frontiers in Plant Science, 9: 1–10.
DOI:10.3389/fpls.2018.00001
|
Beattie R E, Henke W, Campa M F, et al. 2018. Variation in microbial community structure correlates with heavy-metal contamination in soils decades after mining ceased[J]. Soil Biology & Biochemistry, 126: 57–63.
|
程坤, 周际海, 金志农, 等. 2017. 土壤微生物活性对石油原油、铅镉及其复合污染的响应[J]. 环境科学学报, 2017, 37(5): 1976–1982.
|
Covelo E F, Vega F A, Andrade M L. 2007. Simultaneous sorption and desorption of Cd, Cr, Cu, Ni, Pb, and Zn in acid soils Ⅰ.selectivity sequences[J]. Journal of Hazardous Materials, 147(3): 852–861.
DOI:10.1016/j.jhazmat.2007.01.123
|
Delgado-Baquerizo M, Eldridge D J, Hamonts K, et al. 2018. Experimentally testing the species-habitat size relationship on soil bacteria:A proof of concept[J]. Soil Biology & Biochemistry, 123: 200–206.
|
Demetriou D. 2016. The assessment of land valuation in land consolidation schemes_The need for a new land valuation framework[J]. Land Use Policy, 54: 487–498.
DOI:10.1016/j.landusepol.2016.03.008
|
Djanibekov U, Finger R. 2018. Agricultural risks and farm land consolidation process in transition countries:The case of cotton production in Uzbekistan[J]. Agricultural Systems, 164: 223–235.
DOI:10.1016/j.agsy.2018.03.009
|
Ertunc E, Cay T, Hakli H. 2018. Modeling of reallocation in land consolidation with a hybrid method[J]. Land Use Policy, 76: 754–761.
DOI:10.1016/j.landusepol.2018.03.003
|
樊文华, 白中科, 李慧峰, 等. 2011. 不同复垦模式及复垦年限对土壤微生物的影响[J]. 农业工程学报, 2011, 27(2): 330–336.
|
Fan Y, Li B, Yang Z, et al. 2018. Abundance and diversity of iron reducing bacteria communities in the sediments of a heavily polluted freshwater lake[J]. Applied Microbiology and Biotechnology, 102(24): 10791–10801.
DOI:10.1007/s00253-018-9443-1
|
Fu J, Zhou Q, Liu J, et al. 2008. High levels of heavy metals in rice (Oryza sativa L.) from a typical E-waste recycling area in southeast China and its potential risk to human health[J]. Chemosphere, 71(7): 1269–1275.
DOI:10.1016/j.chemosphere.2007.11.065
|
Hemmat-Jou M H, Safari-Sinegani A A, Mirzaie-Asl A, et al. 2018. Analysis of microbial communities in heavy metals-contaminated soils using the metagenomic approach[J]. Ecotoxicology, 27(9): 1281–1291.
DOI:10.1007/s10646-018-1981-x
|
Huu H H, Swennen R, Cappuyns V, et al. 2012. Potential release of selected trace elements (As, Cd, Cu, Mn, Pb and Zn) from sediments in Cam River-mouth (Vietnam) under influence of pH and oxidation[J]. Science of The Total Environment, 435: 487–498.
|
Jiang B, Adebayo A, Jia J, et al. 2019. Impacts of heavy metals and soil properties at a Nigerian e-waste site on soil microbial community[J]. Journal of Hazardous Materials, 362: 187–195.
DOI:10.1016/j.jhazmat.2018.08.060
|
Johansen P H, Ejrnaes R, Kronvang B, et al. 2018. Pursuing collective impact:A novel indicator-based approach to assessment of shared measurements when planning for multifunctional land consolidation[J]. Land Use Policy, 73: 102–114.
DOI:10.1016/j.landusepol.2018.01.040
|
刘静, 吴凤芝, 杨阳, 等. 2010. 氧化钠胁迫下苯丙烯酸对黄瓜根际细菌DNA分子水平多态性的影响[J]. 应用生态学报, 2010, 21(3): 661–667.
|
刘涓, 杜静, 魏朝富, 等. 2015. 紫色土区土地整理年限对土壤理化特性的影响[J]. 农业工程学报, 2015, 31(10): 254–261.
DOI:10.11975/j.issn.1002-6819.2015.10.034 |
刘奎, 葛壮, 徐英德, 等. 2019. 不同耕作方式下黑土微生物群落对干湿交替的响应[J]. 土壤学报, 2019.
DOI:10.11766/trxb201808230253 |
吕纯剑, 高红杰, 宋永会, 等. 2018. 潮汐流-潜流组合人工湿地微生物群落多样性研究[J]. 环境科学学报, 2018, 38(6): 2140–2149.
|
Langille M G I, Zaneveld J, Caporaso J G, et al. 2013. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J]. Nature Biotechnology, 31(9): 814.
DOI:10.1038/nbt.2676
|
Legrand F, Picot A, Cobo-Diaz J F, et al. 2018. Effect of tillage and static abiotic soil properties on microbial diversity[J]. Applied Soil Ecology, 132: 135–145.
DOI:10.1016/j.apsoil.2018.08.016
|
Li M, Zhang L, Liu G. 2019. Estimation of thermal properties of soil and backfilling material from thermal response tests (TRTs) for exploiting shallow geothermal energy:Sensitivity, identifiability, and uncertainty[J]. Renewable Energy, 132: 1263–1270.
DOI:10.1016/j.renene.2018.09.022
|
Liu J, Yu Z, Yao Q, et al. 2017. Distinct soil bacterial communities in response to the cropping system in a Mollisol of northeast China[J]. Applied Soil Ecology, 119: 407–416.
DOI:10.1016/j.apsoil.2017.07.013
|
Malik A A, Puissant J, Buckeridge K M, et al. 2018. Land use driven change in soil pH affects microbial carbon cycling processes[J]. Nature Communications, 9: 1–10.
DOI:10.1038/s41467-017-02088-w
|
Muchova Z, Konc L, Petrovic F. 2018. Land plots valuation in land consolidation in slovakia:a need for a new approachi[J]. International Journal of Strategic Property Management, 22(5): 372–380.
DOI:10.3846/ijspm.2018.5221
|
纳小凡, 郑国旗, 邢正操, 等. 2017. 连作对再植枸杞根际细菌群落多样性和群落结构的影响[J]. 土壤学报, 2017, 54(5): 1280–1292.
|
Nicolas C, Martin-Bertelsen T, Floudas D, et al. 2018. The soil organic matter decomposition mechanisms in ectomycorrhizal fungi are tuned for liberating soil organic nitrogen[J]. The ISME Journal, 13(4): 977–988.
|
Nilsson R H, Anslan S, Bahram M, et al. 2018. Mycobiome diversity:high-throughput sequencing and identification of fungi[J]. Nature reviews microbiology, 17(2): 95–109.
|
Nottingham A T, Fierer N, Turner B L, et al. 2018. Microbes follow Humboldt:temperature drives plant and soil microbial diversity patterns from the Amazon to the Andes[J]. Ecology, 99(11): 2455–2466.
DOI:10.1002/ecy.2018.99.issue-11
|
芮文鸿, 陈吉祥, 王永刚, 等. 2018. 天然气管道施工对脆弱黄土区土壤养分及细菌多样性影响[J]. 环境科学学报, 2018, 38(8): 3278–3285.
|
Shao P, Liang C, Rubert-Nason K, et al. 2019. Secondary successional forests undergo tightly-coupled changes in soil microbial community structure and soil organic matter[J]. Soil Biology and Biochemistry, 128: 56–65.
DOI:10.1016/j.soilbio.2018.10.004
|
Song Q, Li J. 2015. A review on human health consequences of metals exposure to e-waste in China[J]. Environmental Pollution, 196: 450–461.
DOI:10.1016/j.envpol.2014.11.004
|
Song X, Yang F, Ju B, et al. 2018. The influence of the conversion of grassland to cropland on changes in soil organic carbon and total nitrogen stocks in the Songnen Plain of Northeast China[J]. Catena, 171: 588–601.
DOI:10.1016/j.catena.2018.07.045
|
Stanczuk-Galwiaczek M, Sobolewska-Mikulska K, Ritzema H, et al. 2018. Integration of water management and land consolidation in rural areas to adapt to climate change:Experiences from Poland and the Netherlands[J]. Land Use Policy, 77: 498–511.
DOI:10.1016/j.landusepol.2018.06.005
|
Sun J, Pan L, Li Z, et al. 2018. Comparison of greenhouse and open field cultivations across China:Soil characteristics, contamination and microbial diversity[J]. Environmental Pollution, 243(B): 1509–1516.
|
韦翔华, 李华兴, 冯宏, 等. 2009. 不同肥料对后茬土壤微生物及玉米生长的影响[J]. 水土保持学报, 2009, 23(2): 138–142.
DOI:10.3321/j.issn:1009-2242.2009.02.029 |
吴讷, 侯海军, 汤亚芳, 等. 2016. 稻田水分管理和秸秆还田对甲烷排放的微生物影响[J]. 农业工程学报, 2016, 32(S2): 69–76.
|
Wang C, Lu X, Mori T, et al. 2018. Responses of soil microbial community to continuous experimental nitrogen additions for 13 years in a nitrogen-rich tropical forest[J]. Soil Biology & Biochemistry, 121: 103–112.
|
Wang H, Wang S, Zhang Y, et al. 2018. Tillage system change affects soil organic carbon storage and benefits land restoration on loess soil in North China[J]. Land Degradation & Development, 29(9): 2880–2887.
|
Wojcik-Len J, Sobolewska-Mikulska K, Sajnog N, et al. 2018. The idea of rational management of problematic agricultural areas in the course of land consolidation[J]. Land Use Policy, 78: 36–45.
DOI:10.1016/j.landusepol.2018.06.044
|
Wong K, Shaw T I, Oladeinde A, et al. 2016. Rapid microbiome changes in freshly deposited cow feces under field conditions[J]. Frontiers in Microbiology, 7: 1–12.
|
Xu Y, Niu L, Qiu J, et al. 2018. Stereoselective accumulations of hexachlorocyclohexanes (HCHs) are correlated with Sphingomonas spp.in agricultural soils across China[J]. Environmental Pollution, 240: 27–33.
DOI:10.1016/j.envpol.2018.04.078
|
闫华, 欧阳明, 张旭辉, 等. 2018. 不同程度重金属污染对稻田土壤真菌群落结构的影响[J]. 土壤, 2018, 50(3): 513–521.
|
杨金宏, 孔卫青. 2015. 基于16SrRNA测序研究蒙桑根际细菌多样性[J]. 基因组学与应用生物学, 2015, 34(10): 2161–2168.
|
Yu X, Yang L, Fei S, et al. 2018. Effect of Soil Layer and Plant-Soil Interaction on Soil Microbial Diversity and Function after Canopy Gap Disturbance[J]. Forests, 9(11): 1–14.
|
张连忠, 路克国, 王宏伟, 等. 2005. 重金属和生物有机肥对苹果根区土壤微生物的影响[J]. 水土保持学报, 2005, 19(2): 92–95.
DOI:10.3321/j.issn:1009-2242.2005.02.024 |
张媚, 林马水, 曹秀秀, 等. 2018. 不同经营模式山核桃林地土壤pH值、养分与细菌多样性的差异[J]. 生物多样性, 2018, 26(6): 611–619.
|
张琼琼, 黄兴如, 郭逍宇. 2016. 基于T-RFLP技术的不同水位梯度植物根际细菌群落多样性特征分析[J]. 生态学报, 2016, 36(14): 4518–4530.
|
Zhong W, Gu T, Wang W, et al. 2010. The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J]. Plant and Soil, 326(1/2): 511–522.
|
 2019, Vol. 39
2019, Vol. 39


