2. 挥发性有机物污染治理技术与装备国家工程实验室, 广州 510006;
3. 广东省大气环境与污染控制重点实验室, 广州 510006;
4. 广东省环境风险防控与应急处置工程技术研究中心, 广州 510006
2. National Engineering Laboratory for VOCs Pollution Control Technology and Equipment, Guangzhou 510006;
3. Guangdong Provincial Key Laboratory of Atmospheric Environment and Pollution Control(SCUT), Guangzhou 510006;
4. Guangdong Provincial Engineering and Technology Research Centre for Environmental Risk Prevention and Emergency Disposal, South China University of Technology, Guangzhou Higher Education Mega Centre, Guangzhou 510006
近年来CO2的排放量不断攀升, 大气中CO2的浓度已经突破400 ppm, 由此带来的生态环境问题严重影响了人类的生活(Centi et al., 2013; Goeppert et al., 2014; Aresta et al., 2014; Porosoff et al., 2016; Jia et al., 2017).不断增加的能源需求以及日益重视的环境问题使得CO2转化成为研究热点(Olah, 2013).当前CO2加氢反应被认为是CO2转化及利用的有效途径.通过CO2加氢反应, 可得到多种化工原料, 包括醇类、烃类以及醚类等(Halder et al., 2018).甲醇因其较高的能量密度、需求量巨大等特点, 被认为是未来的能源载体(Perathoner et al., 2014).同时作为基础化工原料, 甲醇可用于制备多种化工产品, 因此研究CO2加氢直接合成甲醇对于实现CO2减排及满足能源需求都具有重大意义(Olah, 2005; Natesakhawat et al., 2012; Olah, 2013; Halder et al., 2018), 但CO2加氢制备甲醇反应过程中伴随发生的逆水煤气变换(RWGS)反应会产生大量CO, 从而使甲醇的选择性降低.
目前, 工业制甲醇以Cu/ZnO/Al2O3催化的合成气(H2/CO2/CO)加氢为主(Behrens et al., 2012), 同时, Cu/ZnO基催化剂也被广泛应用于CO2直接加氢合成甲醇, 但反应活性位仍存在很大争议(Grunwaldt et al., 2000; Behrens et al., 2012; Kuld et al., 2014; Kuld et al., 2016; Kattel et al., 2017).暴露的金属Cu表面被广泛认为是RWGS反应与甲醇合成的主要活性中心(Galván et al., 2016).Cu的不同价态以及Cu-ZnO之间的协同效应会对催化活性起到促进作用, 比如:单独存在的金属Cu(Chinchen et al., 1986)、溶解于ZnO晶格的Cu+(Galván et al., 2016)、Cu颗粒表面形成的Cu-Zn合金(Derrouiche et al., 2012)、部分还原的ZnOx修饰的金属Cu表面(Lunkenbein et al., 2015; Behrens et al., 2012; Kuld et al., 2016)、Cu纳米颗粒形貌的变化(Hansen et al., 2002)、ZnO表面缺陷的形成(Galván et al., 2016)、Cu-ZnO界面的肖特基势垒(Lunkenbein et al., 2015)或CO和CO2化学吸附的活性位(Galván et al., 2016)等.此外, 纯ZnO对于CO2加氢几乎没有催化活性, 加入Cu后, Cu与ZnO之间的协同效应使得Cu/ZnO催化剂的催化性能明显提高, 但反应过程总伴随副反应RWGS反应的发生, 产生大量的CO, 关于RWGS反应与甲醇合成是否发生在同一活性位点及其反应机理仍存在许多争议, 同时了解CO形成的活性位也有利于设计合成高甲醇选择性的催化剂.
因此, 通过RWGS反应来研究CO生成的活性位, 可以直接得到生成CO的影响因素, 从而对CO2加氢制甲醇的活性位研究提供理论依据.利用不同气氛还原催化剂, 形成具有不同界面结构的Cu-ZnO催化剂, 探究其对RWGS反应的影响, 揭示CO产生的活性位.本文通过浸渍法制备Cu/盘状ZnO模型催化剂, 采用XRD、H2-TPR、CO2-TPD、in situ UV-Raman、XPS等表征手段来研究还原后催化剂的形貌结构及其对CO2活化性能的影响, 进而阐述CO产生的活性位.
2 实验部分(Experiment) 2.1 化学试剂所需试剂:无水醋酸锌(Zn(CH3COO)2, AR), 上海泰坦科技股份有限公司; 六次甲基四胺((CH2)6N4, AR), 广州化学试剂厂; 乙酸铜一水合物(C4H6CuO4·H2O, AR), 阿拉丁科技有限公司; 醋酸缓冲液(CH3COOH); 实验中使用的水均为去离子水.
2.2 催化剂的制备 2.2.1 盘状ZnO的制备盘状ZnO通过简单的水热法制备得到(Li et al., 2008).称取6.3 g的Zn(CH3COO)2于100 mL烧杯中, 加入70 mL去离子水, 置于搅拌器上剧烈搅拌, 滴加醋酸缓冲液使之完全溶解; 另外称取0.4 g(CH2)6N4倒入上述烧杯中, 剧烈搅拌5 min; 将溶液转移至100 mL反应釜, 在100 ℃下水热6 h.水热后自然冷却至室温, 去除上清液后离心洗涤, 然后70 ℃干燥12 h, 得到ZnO.
2.2.2 Cu/盘状ZnO模型催化剂的制备以Cu(CO2CH3)2·H2O为Cu源, 采用浸渍法制备Cu/盘状ZnO模型催化剂.实验过程如下:室温下, 称取以质量分数1 wt%(Cu/(Cu+ZnO))计量的Cu(CO2CH3)2·H2O, 滴加少量去离子水搅拌至完全溶解, 再将计量的ZnO加入烧杯中不停搅拌浸渍, 静置待水分挥发后转移到烘箱, 在70 ℃下干燥12 h.随后将得到的干燥样品以2 ℃·min-1升温速率升至350 ℃干空焙烧4 h, 最终得到所需的Cu/盘状ZnO模型催化剂(记为CZ催化剂).
2.3 催化剂的表征TGA测试在德国NETZSCH STA 449C型同步热分析仪上进行, 气氛为干燥空气.H2-TPR/CO-TPR在美国Micromeritics化学吸附仪上进行, 使用10%CO/Ar或10%H2/Ar还原, 在线MS(Hiden Analytical, HPR 20)检测, 数据倒数表示H2或CO的消耗量.XRD测试使用德国Bruker的X射线衍射仪, 扫描范围:2θ = 20°~80°.SEM和mapping图在德国Zeiss扫描电子显微镜上得到, 使用Nano Measurer 1.2软件测量粒径.XPS在美国Thermo Scientific EscaLab 250Xi型X射线光电子能谱仪扫谱上进行.UV-Raman在法国HYJ拉曼光谱仪上得到, 扫描范围为400~1400 cm-1.CO2-TPD在美国Micromeritics化学吸附仪上进行, 400 ℃下还原6 h, 降温至60 ℃, 在20%CO2/Ar中吸附1 h, 然后He吹扫进行升温脱附, 采用在线MS检测.
2.4 催化剂活性评价RWGS反应是在一个高压固定床连续流动反应器-气相色谱(GC)的组合系统上进行评价.将0.5 g 40~60目的催化剂装填在反应钢管中间, 其他空间用石英砂填充固定.还原气氛分别为5%CO/Ar、2.5%H2/2.5%CO/Ar或5%H2/Ar, 气流速度为30 mL·min-1, 以2 ℃·min-1的升温速率从室温升至400 ℃还原6 h; 降至室温后切换反应气进行反应.反应条件是GHSV = 3600 mL·h-1·g-1, V(H2):V(CO2):V(N2) = 69:23:8, 气流速度30 mL·min-1, 反应温度320~400 ℃.使用气相色谱仪(GC-2014C, 苏州)对反应物及产物进行在线检测分析.CO2转化率通过N2内标法得到, 产物选择性通过“C基归一法”计算(Bao et al., 2009).同时结合CO2加氢制甲醇反应来分析CO生成的活性位点, 还原条件与RWGS反应一致, 催化剂用量为0.2 g 40~60目催化剂, 反应条件为GHSV = 9000 mL·h-1·g-1, V(H2):V(CO2):V(N2) = 69:23:8, P = 3.0 MPa, 气流速度30 mL·min-1, 反应温度220~300 ℃, 分析方法与RWGS反应一致.
3 结果与讨论(Results and discussion) 3.1 Cu/盘状ZnO模型催化剂的表征 3.1.1 热重分析图 1为焙烧后CZ催化剂在空气中的热重谱图.由图可知, 焙烧后的催化剂在400 ℃以下基本没有质量损失, 并且热量变化也不明显, 说明焙烧后得到的催化剂结构是相对稳定的, 选用350 ℃作为焙烧温度可以用于后续最高400 ℃的反应.
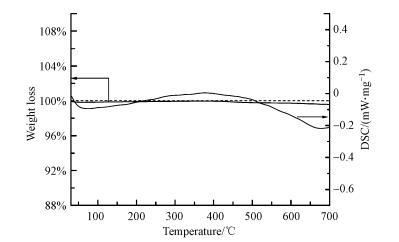 |
| 图 1 焙烧后CZ催化剂的TGA谱图 Fig. 1 TGA analysis of the calcined CZ catalyst in dry air |
H2-TPR和CO-TPR谱图用于研究焙烧后CZ催化剂的还原性能, 如图 2所示.从图中可以看出, 在200 ℃以下H2还原和CO还原的谱图均出现了还原峰, 归属为CuO的还原(王冠男等, 2014).H2/Ar还原催化剂的过程中, 在158 ℃处出现了一个主要的还原峰, 并且稍低温度伴随着肩峰的出现, 这可能是因为CuO还原是分步进行的, CuO还原为Cu+, 再进一步还原为Cu0(Yang et al., 2017; Jones et al., 2009).然而, CO/Ar还原催化剂的过程中, 只出现了一个对称的还原峰, 且还原峰温度为155 ℃, 高分散的CuO一步还原以及稍低的还原峰温度是由于CO的还原性强于H2.此外, H2-TPR谱图在高温段出现H2的脱附现象, 这是由于ZnO本身具有较强的H2储存能力(Ahmad et al., 2010).由于0~500 ℃范围内只在200 ℃以下出现了CuO的还原峰, 由此可知本文选用400 ℃作为催化剂的还原温度完全可以将CuO还原为Cu0, 并且与Cu0形成的结构可能影响催化剂的催化性能.
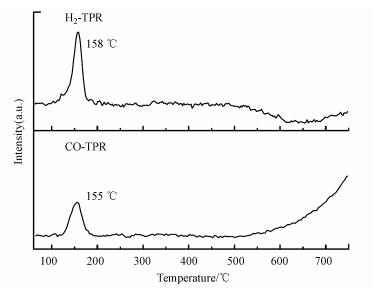 |
| 图 2 焙烧后CZ催化剂的H2-TPR和CO-TPR谱图 Fig. 2 H2-TPR and CO-TPR profiles of the calcined CZ catalyst |
图 3是纯盘状ZnO、焙烧后CZ催化剂及还原后CZ催化剂的XRD谱图.图中主要特征衍射峰的峰位、峰型均与典型六方对称纤锌矿结构的ZnO(JCPDS 36-1451)相吻合(Liao et al., 2011; Lv et al., 2015), 表明催化剂中ZnO的结构基本不变.从局部放大图可以观察到:焙烧后CZ催化剂没有出现明显的CuO相关的衍射峰, 表明CuO高度分散在ZnO表面(李淑君等, 2018);而还原后的催化剂出现了与Cu有关的衍射峰, CZ-5CO样品在~42.7°处出现了Cu3Zn合金的(111)衍射峰(JCPDS 65-6567)(Derrouiche et al., 2012), CZ-5H2与CZ-2.5H2-2.5CO均在~43.2°处出现了金属Cu(111)的衍射峰, 结果表明CuO被还原为Cu0, ZnO仍主要以氧化态形式存在, 但经CO/Ar还原后有Cu3Zn合金生成.进一步采用谢乐公式(以Cu或Cu3Zn的XRD主衍射峰(111)峰型参数)计算Cu相关颗粒直径, 结果如下:CZ-2.5H2-2.5CO (19.2 nm) > CZ-5CO (18.4 nm) > CZ-5H2 (15.0 nm), 这可能是由于CO具有更强的还原性导致颗粒集聚增大更明显, 甚至形成合金相.
 |
| 图 3 盘状ZnO(a)、焙烧后CZ催化剂(b)、CZ-5CO(c)、CZ-2.5H2-2.5CO(d)、CZ-5H2(e)的XRD谱图 Fig. 3 XRD patterns of the pristine ZnO plate (a), calcined (b) and the reduced CZ catalysts in 5%CO/Ar (c), 2.5%H2/2.5%CO/Ar (d) and 5%H2/Ar (e) |
通过SEM观察焙烧后和还原后CZ催化剂的形貌结构特征, 结果如图 4所示.从各样品的表面元素分布图中可以看出, 所有催化剂均显示出相似的Zn、Cu、O元素分布, 且Cu元素均匀分布在ZnO的表面.从图 4a中可以看出, 焙烧后催化剂的ZnO主体仍保持六边形结构, 六边形表面均匀负载着CuO纳米颗粒, 通过粒径统计得到平均粒径约为11.5 nm.图 4b~4d显示了3种不同还原气氛400 ℃还原处理6 h后的电镜图, ZnO主体结构没有发生明显变化, 大部分Cu相关纳米颗粒仍均匀分布在ZnO表面, 但相比焙烧后的颗粒均明显增大, 这是由于高温还原造成表面颗粒轻微烧结聚集增大(丁艳敏等, 2009).同样对表面颗粒粒径进行统计, 所有还原后催化剂粒径分布图大致呈火山型分布, 但3种气氛还原后呈现出差异明显的平均颗粒粒径尺寸:2.5%H2/2.5%CO/Ar(19.6 nm) > 5%CO/Ar(18.8 nm) > 5%H2/Ar(17.6 nm), 与XRD计算颗粒粒径变化规律一致.由此可得, 含有CO的气氛处理后催化剂表面颗粒增长明显大于H2还原, 除高温因素外, CO气氛可能更容易诱导表面颗粒聚集增大.
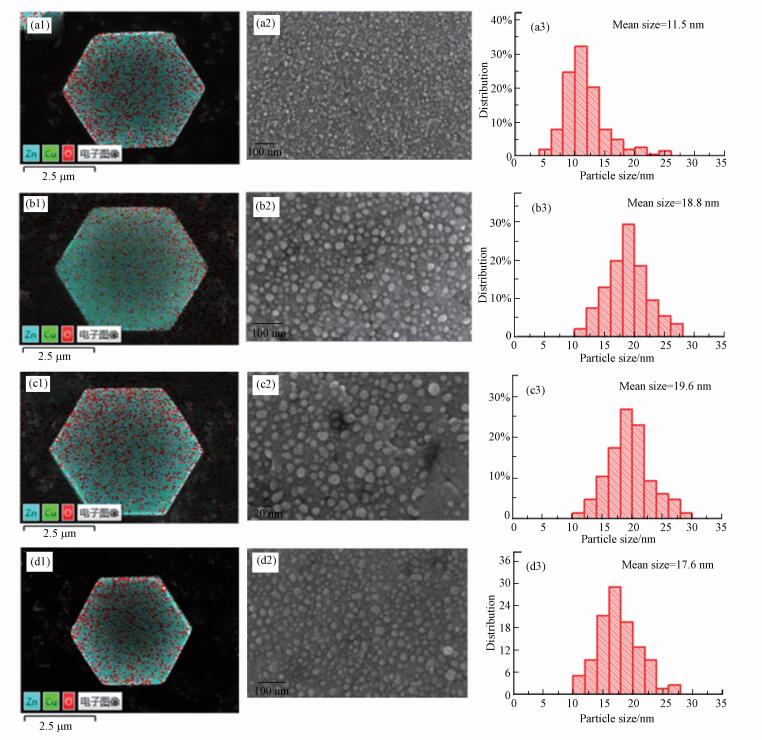 |
| 图 4 焙烧后CZ催化剂(a)、CZ-5CO(b)、CZ-2.5H2-2.5CO(c)、CZ-5H2(d)的SEM及Cu粒径分布图 Fig. 4 SEM images and the corresponding Cu NPs size distribution diagrams of calcined CZ catalyst (a), and the reduced CZ catalysts in 5%CO/Ar (b), 2.5%H2/2.5%CO/Ar (c) and 5%H2/Ar (d) |
利用XPS来探测CZ催化剂中Cu、Zn物种及其表面物种组成.表 1列出了400 ℃还原6 h后催化剂表面Zn/(Zn+Cu)比值及变化量.通常, Cu纳米颗粒聚集增大将造成更多的ZnO衬底暴露, 从而导致Zn/(Zn+Cu)比值增大.此外, 据报道(Grunwaldt et al., 2000; Lunkenbein et al., 2015; Kuld et al., 2016), Cu/ZnO催化剂在还原过程中存在Zn物种从体相ZnO迁移到Cu纳米颗粒表面的现象.从表中可知, 3种还原气氛下比值变化量呈以下趋势:2.5%H2/2.5%CO/Ar > 5%CO/Ar > 5%H2/Ar, 该结果与XRD、SEM得到的表面Cu颗粒尺寸变化一致, 说明表面颗粒烧结增大会导致Zn/(Zn+Cu)比值变化, 同时部分Zn迁移的现象也可能导致该比值增大.
| 表 1 通过XPS全谱计算得到焙烧后、还原后的Zn/(Cu+Zn)原子比 Table 1 Zn/(Cu+Zn) atomic ratios of the calcined and reduced samples, calculated from XPS survey scans |
在CZ催化剂的UV-Raman谱图中, ~580 cm-1处是典型的E1(LO)模式峰, 与晶格中的缺陷有关, 如氧空位(Vo)和锌间隙缺陷(Zni)(Chen et al., 2014);~1150 cm-1处是2A1(LO)模式峰(Lv et al., 2015).根据文献报道(Šćepanović et al., 2010), 通常Raman可以表征催化剂表面缺陷的相对浓度, E1(LO)与2A1(LO)的强度比(IE1(LO)/I2A1(LO))反映CZ催化剂在还原过程中的缺陷变化情况, 如图 5所示.N2中升温过程的比值几乎是稳定的, 表明惰性气氛下催化剂的缺陷量基本没有变化.而还原气氛中, 升温过程的比值均随温度升高而升高, 但增速逐渐变缓, 与N2相比, 还原气氛下的比值均增加.升温过程中, 3种还原气氛400 ℃还原催化剂促使催化剂表面缺陷的相对浓度增加, 规律如下:5%CO/Ar > 5%H2/Ar ≈ 2.5%H2/2.5%CO/Ar, 5%CO/Ar还原后的表面相对缺陷浓度最高可能是源于Cu3Zn合金的形成导致表面更多缺陷, 而5%H2/Ar还原稍高于2.5%H2/2.5%CO/Ar还原, 这与两种条件下形成的Cu-ZnO的界面有关, 与XRD、SEM给出的5%H2/Ar还原的Cu颗粒尺寸小于2.5%H2/2.5%CO/Ar还原的颗粒尺寸结果相一致.
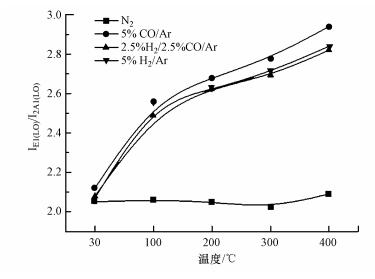 |
| 图 5 通过IE1(LO)/I2A1(LO)得到的CZ催化剂缺陷相对浓度 Fig. 5 Defects concentration of CZ catalysts by the intensity ratios of E1(LO) to 2A1(LO) |
图 6是纯盘状ZnO及CZ催化剂在不同还原气氛还原后的CO2-TPD谱图.将CO2脱附曲线基于脱附温度去卷积得到5个峰, 分别记为a、b、c、d和e.由图可知, 经5%H2/Ar还原后的纯盘状ZnO在551 ℃、666 ℃、761 ℃处出现明显的脱附峰c、d、e, 而在361 ℃处仅出现极弱的脱附峰, 这表明ZnO本身对CO2具有较强的吸附能力.载体表面负载Cu后, CO2的脱附峰曲线发生了变化, 除仍存在的高温脱附峰c、d、e外, 还原后的CZ催化剂均表现出另外两种低温脱附峰a和b, 分别在280 ℃和460 ℃左右, 且脱附峰b较为微弱, 各脱附峰温度往低处偏移, 这可能是由于Cu的引入形成了Cu-ZnO界面(Grunwaldt et al., 2000; Galván et al., 2016).脱附峰a和b通常归为中等强度吸附点位上的吸附峰, 比如Zn—O上的吸附(Dong et al., 2016; Dong et al., 2017);脱附峰c、d、e归属为强吸附点位上的吸附峰, 比如低配位氧原子上的吸附(Ren et al., 2015; Dong et al., 2017).从图中可以看出纯盘状ZnO对CO2吸附几乎只有强吸附点位吸附, 而还原后CZ催化剂出现的中等强度吸附应该与Cu-ZnO界面有关, 比如界面存在大量缺陷促进了CO2的吸附活化.表 2列出了各样品的脱附峰的相对大小以及脱附中心温度.与纯盘状ZnO相比, 还原后催化剂的CO2总脱附量均有所增加, 表明Cu的引入有利于CO2的吸附活化.同时中等强度的吸附量变化也是CZ-5CO > CZ-5H2 > CZ-2.5H2-2.5CO, 这与原位紫外拉曼得到的缺陷相对浓度变化规律一致.
 |
| 图 6 纯盘状ZnO、CZ催化剂400 ℃还原后的CO2-TPD谱图 Fig. 6 CO2-TPD profiles of ZnO plate and CZ catalysts after reduction at 400 ℃ |
| 表 2 纯盘状ZnO和CZ催化剂的CO2脱附量 Table 2 CO2 desorption capabilities of the ZnO plate and CZ catalysts |
图 7是不同气氛400 ℃还原CZ催化剂后催化RWGS反应的活性评价结果.在320~400 ℃反应区间中, 常压反应下含碳产物主要是CO, 近似用CO2转化率代表CO的收率, 从图中可以看出, CO2转化率随着反应温度的升高而升高, 且3种条件下的转化率变化趋势一致, 在相同反应温度下, CO2转化率变化如下:CZ-5H2 > CZ-2.5H2-2.5CO > CZ-5CO.结果表明, 5%H2/Ar在400 ℃还原催化剂可以使催化剂获得更多有利于CO生成的结构, 而含有CO的还原气氛在400 ℃处理催化剂表现出更低的转化率.此外, 催化剂在400 ℃还原6 h后催化CO2加氢制甲醇的活性评价结果如图 8所示.在220~300 ℃反应区间中, CO2转化率同样随反应温度升高而升高(图 8a), 在同一温度下CZ-5CO与CZ-5H2的CO2转化率相近, 但高于CZ-2.5H2-2.5CO; 在相同CO2转化率下, 甲醇的选择性(图 8b)呈现相似规律:CZ-5CO > CZ-5H2 > CZ-2.5H2-2.5CO, CO的选择性(图 8c)变化如下:CZ-2.5H2-2.5CO > CZ-5CO ≈ CZ-5H2.
 |
| 图 7 不同还原气氛下CZ催化剂催化RWGS反应的CO2转化率(mcat = 0.5 g, V(H2):V(CO2):V(N2) = 69:23:8, T =320~400 ℃, GHSV = 3600 mL·gcat-1·h-1) Fig. 7 CO2 conversions for RWGS reaction over CZ catalysts reduced in different gases |
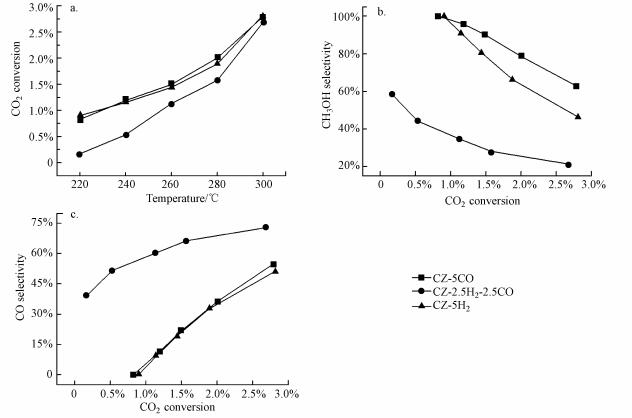 |
| 图 8 不同还原气氛下CZ催化剂催化CO2加氢制甲醇反应的CO2转化率(a)、甲醇选择性随CO2转化率变化曲线(b)和CO选择性随CO2转化率变化曲线(c)(mcat = 0.2 g, V(H2):V(CO2):V(N2) = 69:23:8, T = 220-300 ℃, P = 3.0 MPa, GHSV = 9000 mL·gcat-1·h-1) Fig. 8 CO2 convension(a), CH3OH selectivity vs CO2 convension (b) and CO selectivity vs CO2 convension (c) for CO2 hydrogenation to methanol over CZ catalysts reduced in different gases |
进一步讨论CO2的中等强度吸附对催化剂催化活性的影响, 将脱附峰a、b与RWGS反应以及相同还原条件下甲醇合成的活性结果进行作图分析, 如图 9所示.通过图 9a发现:RWGS反应中CO2转化率随着脱附峰a的增加而增加, 而脱附峰b、a+b与CO2转化率的变化趋势相差较大, 表明脱附峰a与CO2加氢反应中产物CO的生成紧密相关, 3种条件下该脱附峰位置基本不变, 这可能为Cu-ZnO界面处对CO2的吸附活化.结合XRD及SEM表征可知CZ-5H2具有最小的Cu纳米颗粒, 与ZnO形成Cu-ZnO界面处存在丰富的表面缺陷, 在CO2脱附中具有最大的脱附峰a, 促进CO2的吸附活化, 获得最佳的CO活性; 介于之间的CZ-2.5H2-2.5CO具有最大的Cu纳米颗粒, 与ZnO的界面接触减小, 同时界面处的缺陷也相对减少, 脱附峰a的脱附量也相对减少, 从而影响CO的生成, 展现出低于CZ-5H2的CO活性; 对于CZ-5CO, 尽管Cu3Zn合金的存在可能使催化剂拥有更多表面缺陷, 但表面Cu相关颗粒较大, 脱附峰a具有最小的脱附量, 因此展现出最差的CO活性.
 |
| 图 9 a、b峰脱附量与RWGS反应的CO2转化率(380 ℃)关系图(a)和a、b峰脱附量与CO2加氢制甲醇反应的CH3OH收率、CO收率(280 ℃)关系图(b~d) Fig. 9 The relationships between the amount of CO2 desorption form peak a, b and CO2 conversions in RWGS reactions (380 ℃) (a); the relationships between the amount of CO2 desorption form peak a, b and CH3OH conversions, CO conversions in CO2 hydrogenation to methanol reactions (280 ℃) (b~d) |
此外, 从图 9b~9d可知, CO2加氢制甲醇反应中CH3OH收率随着脱附峰b、a+b的增加呈现出增加的趋势, 而脱附峰a的变化趋势与CH3OH收率、CO收率均不一致, 表明脱附峰a和b可能均促进甲醇的生成.结合图 9a可知脱附峰a与CO的生成密切相关, 说明脱附峰a对CO及甲醇的生成均有利, 而脱附峰b可能只与甲醇生成有关, 且脱附峰b的相对量均较小, 这可能与少量Zn迁移形成的结构有关.至此, 所有结果证实了CZ-5H2催化剂表面形成较小的Cu颗粒, Cu-ZnO界面处丰富的表面缺陷促进CO2的吸附活化, CO2的脱附峰a对应的界面活化的CO2越多越有利于CO的生成.虽然Behrens等(2012)提出Cu-Zn合金是重要的活性位点, 但Kattel等(2017)发现Cu-Zn合金中的Zn逐渐被氧化为ZnO后才有较好的活性, 因此Cu3Zn合金的出现可能对催化剂的活性没有起到促进作用.
4 结论(Conclusions)1) 采用浸渍法成功制备Cu负载量为1%的Cu/盘状ZnO模型催化剂, 用5%CO/Ar、2.5%H2/2.5%CO/Ar及5%H2/Ar对催化剂进行还原, 对RWGS反应的催化活性如下:CZ-5H2 > CZ-2.5H2-2.5CO > CZ-5CO.
2) CZ-5H2具有最小的Cu颗粒, 形成的Cu-ZnO界面对CO2的吸附活化量最多, 展现出最佳的反应活性.CZ-5CO有Cu3Zn合金生成, 表面存在中等尺寸的Cu相关颗粒, 而其Cu-ZnO界面对CO2吸附活化量最少, 展现出最差的反应活性.CZ-2.5H2-2.5CO具有最大的Cu颗粒, 形成的Cu-ZnO界面对CO2的吸附活化量介于CZ-5H2与CZ-5CO之间, 同时也展现出介于它们之间的反应活性.
Ahmad M, Pan C, Zhu J. 2010. Investigation of hydrogen storage capabilities of ZnO-based nanostructures[J]. The Journal of Physical Chemistry C, 114: 2560–2565.
DOI:10.1021/jp100037u
|
Aresta M, Dibenedetto A, Angelini A. 2014. Catalysis for the valorization of exhaust carbon: from CO2 to chemicals, materials, and fuels. Technological use of CO2[J]. Chemical Reviews, 114(3): 1709–1742.
DOI:10.1021/cr4002758
|
Bao Y, Huang C, Chen L, et al. 2018. Highly efficient Cu/anatase TiO2 {001}-nanosheets catalysts for methanol synthesis from CO2[J]. Journal of Energy Chemistry, 27(2): 381–388.
DOI:10.1016/j.jechem.2017.12.015
|
Behrens M, Studt F, Kasatkin I, et al. 2012. The active site of methanol synthesis over Cu/ZnO/Al2O3 industrial catalysts[J]. Science, 336(6083): 893–897.
DOI:10.1126/science.1219831
|
Centi G, Quadrelli E A, Perathoner S. 2013. Catalysis for CO2 conversion:a key technology for rapid introduction of renewable energy in the value chain of chemical industries[J]. Energy & Environmental Science, 6(6): 1711–1731.
|
Chen D, Wang Z, Ren T, et al. 2014. Influence of defects on the photocatalytic activity of ZnO[J]. The Journal of Physical Chemistry C, 118(28): 15300–15307.
DOI:10.1021/jp5033349
|
Chinchen G C, Waugh K C, Whan D A. 1986. The activity and state of the copper surface in methanol synthesis catalysts[J]. Applied Catalysis, 25(1/2): 101–107.
|
Derrouiche S, Lauron-Pernot H, Louis C. 2012. Synthesis and treatment parameters for controlling metal particle size and composition in Cu/ZnO materials-first evidence of Cu3Zn alloy formation[J]. Chemistry of Matericals, 24: 2282–2291.
DOI:10.1021/cm3001915
|
Dong X, Li F, Zhao N, et al. 2017. A study on the order of calcination and liquid reduction over Cu-based catalyst for synthesis of methanol from CO2/H2[J]. Catalysis Letters, 147(5): 1235–1242.
DOI:10.1007/s10562-017-2007-7
|
Dong X, Li F, Zhao N, et al. 2016. CO2 hydrogenation to methanol over Cu/ZnO/ZrO2 catalysts prepared by precipitation-reduction method[J]. Applied Catalysis B: Environmental, 191: 8–17.
DOI:10.1016/j.apcatb.2016.03.014
|
丁艳敏, 李彩亭, 曾光明, 等. 2009. Mn/Fe-Mn改性HZSM-5在NH3-SCR中的催化性能[J]. 环境科学学报, 2009, 29(12): 2572–2577.
DOI:10.3321/j.issn:0253-2468.2009.12.015 |
Figueiredo R T, Santos M S, Andrade H M C, et al. 2011. Effect of alkali cations on the CuZnOAl2O3 low temperature water gas-shift catalyst[J]. Catalysis Today, 172(1): 166–170.
|
Galván C Á, Schumann J, Behrens M, et al. 2016. Reverse water-gas shift reaction at the Cu/ZnO interface: Influence of the Cu/Zn ratio on structure-activity correlations[J]. Applied Catalysis B: Environmental, 195: 104–111.
DOI:10.1016/j.apcatb.2016.05.007
|
Goeppert A, Czaun M, Jones J P, et al. 2014. Recycling of carbon dioxide to methanol and derived products-closing the loop[J]. Chemical Society Reviews, 43(23): 7995–8048.
DOI:10.1039/C4CS00122B
|
Grunwaldt J D, Molenbroek A M, Topsøe N Y, et al. 2000. In situ investigations of structural changes in Cu/ZnO catalysts[J]. Journal of Catalysis, 194(2): 452–460.
DOI:10.1006/jcat.2000.2930
|
Halder A, Kilianová M, Yang B, et al. 2018. Highly efficient Cu-decorated iron oxide nanocatalyst for low pressure CO2 conversion[J]. Applied Catalysis B: Environmental, 225: 128–138.
DOI:10.1016/j.apcatb.2017.11.047
|
Hansen P L, Wagner J B, Helveg S, et al. 2002. Atom-resolved imaging of dynamic shape changes in supported copper nanocrystals[J]. Science, 295(15): 2053–2055.
|
Jia J, Qian C, Dong Y, et al. 2017. Heterogeneous catalytic hydrogenation of CO2 by metal oxides: defect engineering-perfecting imperfection[J]. Chemical Society Reviews, 46(15): 4631–4644.
DOI:10.1039/C7CS00026J
|
Jones S D, Hagelin-Weaver H E. 2009. Steam reforming of methanol over CeO2- and ZrO2-promoted Cu-ZnO catalysts supported on nanoparticle Al2O3[J]. Applied Catalysis B: Environmental, 90(1/2): 195–204.
|
Kattel S, Ramírez P J, Chen J G, et al. 2017. Active sites for CO2 hydrogenation to methanol on Cu/ZnO catalysts[J]. Science, 355(6331): 1296–1299.
DOI:10.1126/science.aal3573
|
Kuld S, Conradsen C, Moses P G, et al. 2014. Quantification of zinc atoms in a surface alloy on copper in an industrial-type methanol synthesis catalyst[J]. Angewandta Chemie International Edition, 53(23): 5941–5945.
DOI:10.1002/anie.201311073
|
Kuld S, Thorhauge M, Falsig H, et al. 2016. Quantifying the promotion of Cu catalysts by ZnO for methanol synthesis[J]. Science, 352(6288): 969–974.
DOI:10.1126/science.aaf0718
|
Li G R, Hu T, Pan G L, et al. 2008. Morphology-function relationship of ZnO: polar planes, oxygen vacancies, and activity[J]. The Journal of Physical Chemistry C, 112: 11859–11864.
DOI:10.1021/jp8038626
|
Liao F, Huang Y, Ge J, et al. 2011. Morphology-dependent interactions of ZnO with Cu nanoparticles at the materials' interface in selective hydrogenation of CO2 to CH3OH[J]. Angewandta Chemie International Edition, 50(9): 2162–2165.
DOI:10.1002/anie.v50.9
|
Lunkenbein T, Schumann J, Behrens M, et al. 2015. Formation of a ZnO overlayer in industrial Cu/ZnO/Al2O3 catalysts induced by strong metal-support interactions[J]. Angewandta Chemie International Edition, 54(15): 4544–4548.
DOI:10.1002/anie.201411581
|
Lv J, Sun Y, Cao L, et al. 2015. Effect of reaction temperature on surface morphology and photoelectric properties of ZnO grown by hydrothermal method in mixed solvent[J]. J Mater Sci: Mater Electron, 26(7): 5518–5523.
DOI:10.1007/s10854-015-3109-x
|
李淑君, 彭若斯, 孙西勃, 等. 2018. Pt/CeO2催化氧化甲苯反应机制研究[J]. 环境科学学报, 2018, 38(4): 1426–1436.
|
Natesakhawat S, Lekse J W, Baltrus J P, et al. 2012. Active sites and structure-activity relationships of copper-based catalysts for carbon dioxide hydrogenation to methanol[J]. ACS Catalysis, 2(8): 1667–1676.
DOI:10.1021/cs300008g
|
Olah G A. 2013. Towards oil independence through renewable methanol chemistry[J]. Angewandta Chemie International Edition, 52(1): 104–107.
DOI:10.1002/anie.201204995
|
Olah G A. 2005. Beyond oil and gas:the methanol economy[J]. Angewandta Chemie International Edition, 44(18): 2636–2639.
DOI:10.1002/(ISSN)1521-3773
|
Perathoner S, Centi G. 2014. CO2 recycling: a key strategy to introduce green energy in the chemical production chain[J]. ChemSusChem, 7: 1274–1282.
DOI:10.1002/cssc.201300926
|
Porosoff M D, Yan B, Chen J G. 2016. Catalytic reduction of CO2 by H2 for synthesis of CO, methanol and hydrocarbons: challenges and opportunities[J]. Energy & Environmental Science, 9(1): 62–73.
|
Ren H, Xu C H, Zhao H Y, et al. 2015. Methanol synthesis from CO2 hydrogenation over Cu/γ-Al2O3 catalysts modified by ZnO, ZrO2 and MgO[J]. Journal of Industrial Engineering Chemistry, 28: 261–267.
DOI:10.1016/j.jiec.2015.03.001
|
Šćepanović M, Grujić-Brojčin M, Vojisavljević K, et al. 2010. Raman study of structural disorder in ZnO nanopowders[J]. Journal of Raman Spectroscopy, 41: 914–921.
DOI:10.1002/jrs.v41:9
|
王冠男, 陈礼敏, 郭园园, 等. 2014. 铬助剂对Cu/ZrO2/CNTs-NH2催化剂催化CO2加氢合成甲醇性能的影响[J]. 物理化学学报, 2014, 30(5): 923–931.
|
Yang X, Chen H, Meng Q, et al. 2017. Insights into influence of nanoparticle size and metal-support interactions of Cu/ZnO catalysts on activity for furfural hydrogenation[J]. Catalysis Science & Technology, 7(23): 5625–5634.
|
 2019, Vol. 39
2019, Vol. 39


