2. 华东勘测设计研究院有限公司, 杭州 311122;
3. 华中科技大学环境学院, 武汉 430074;
4. 长江勘测规划设计研究有限责任公司, 武汉 430010
2. Huadong Engineering Corporation Umited, Hangzhou 311122;
3. School of Environmental Science and Engineering, Huazhong University of Science and Technology, Wuhan 430074;
4. Changjiang Institute of Survey, Planning, Design and Research, Wuhan 430010
我国水体重金属污染问题十分突出, 重金属废水排入天然水体后对地球生物健康造成严重危害.铜是工业生产中应用较为广泛且具有回收价值的一种重金属, 探究废水中铜的有效处理和回收显得尤为重要.目前治理含铜废水的方法主要有物理吸附法、化学沉淀法、离子交换法、电解法、膜分离法等.其中物理吸附法因有高效、经济、绿色等优点而被广泛应用(卢文静等, 2018).传统吸附剂普遍存在再生成本高、使用寿命短、难以回收重金属资源等问题, 尤其是Cu2+浓度非常低时, 宏观的吸附界面往往难以将极微量金属离子短时间内有效去除(Nassar, 2010).因此, 制备高效率、低成本、易于回收的新型吸附剂具有重要意义.
磁性吸附材料是目前的研究热点, 在水处理中的应用较为广泛(Cui et al., 2013; Cui et al., 2014; Su, 2017). Fe3O4纳米粒子具有磁学性质、低毒以及比表面积大等特点, 对重金属离子有较强的吸附能力, 易于从水中快速分离回收, 在重金属离子深度处理中有良好的应用前景(刘艳等, 2005; 薛娟琴等, 2016).然而由于量子尺寸效应和磁偶极矩等作用, 使得Fe3O4纳米粒子呈现出易团聚、易氧化、化学稳定性差、易酸解流失等缺点, 因此有必要对其进行包覆和表面修饰.采用无毒无害的SiO2包覆Fe3O4可极大地改善颗粒在水中的分散性、化学稳定性和生物相容性, 同时SiO2表面丰富羟基的存在可提高其表面功能化的可能(董景伟等, 2010).壳聚糖来源广泛、经济绿色, 其分子结构中富含氨基和羟基, 能与大部分过渡金属离子发生配位反应, 可有效吸附废水中的低浓度金属离子.此外, 通过酸或EDTA洗脱可回收利用贵金属, 是一种极具潜力的重金属吸附材料(Wang et al., 2014; 李珂珂等, 2018).采用壳聚糖在磁性材料表面进行修饰, 可以制备出具有崭新吸附性能的复合磁性纳米材料.
本研究以Fe3O4纳米粒子为核, 采用Stöber法制备Fe3O4@SiO2, 以戊二醛为交联剂, 制得Fe3O4@SiO2-Chitosan复合磁性纳米粒子, 并对其进行结构和外貌表征, 探究其对水中Cu2+的吸附性能和再生回用能力.
2 实验部分(Experiment) 2.1 实验试剂Cu(NO3)2·3H2O、FeCl3·6H2O、CH3COOH、HCl、PEG-4000、NH3·H2O、C2H5OH (95%)、NaOH, 国药集团化学试剂有限公司; FeSO4·7H2O, 广东光华化学厂有限公司; Chitosan、C8H12O8Si (TEOS)、C25H52、Span-80、(C2H5)2NCSSNa·3H2O (DDTC), 北京百灵威科技有限公司; C5H8O2 (GLA), 梯希爱化成工业发展有限公司.以上药剂至少为分析纯级, 实验用水均为自制去离子水.
2.2 材料合成 2.2.1 Fe3O4纳米粒子的制备采用共沉淀法制备Fe3O4纳米粒子, 其步骤如下:称取7.00 g FeCl3·6H2O和3.60 g FeSO4·7H2O溶解在60 mL去离子水中, 在氮气条件下, 超声搅拌至铁盐全部溶解, 加入30 mL浓度为0.02 g·mL-1的PEG-4000水溶液, 注入500 mL三颈烧瓶中, 水浴加热至60 ℃, 剧烈搅拌下滴加pH=9的浓氨水与PEG-4000混合液, 恒温80 ℃, 机械搅拌3 h, 经磁分离后将沉淀物分别用C2H5OH和去离子水洗涤3次, 60 ℃真空干燥12 h, 得黑色磁性Fe3O4纳米粒子.
2.2.2 Fe3O4@SiO2的制备采用Stöber工艺合成Fe3O4@SiO2复合纳米粒子, 其步骤如下:将制得的Fe3O4加入C2H5OH和氨水混合液中, 注入500 mL三颈烧瓶中, 连续通入N2进行30 ℃水浴加热, 剧烈搅拌下滴加TEOS与C2H5OH混合液, 继续搅拌12 h, 经磁分离后将沉淀物分别用C2H5OH和去离子水洗涤3次, 50 ℃真空干燥6 h, 得Fe3O4@SiO2复合纳米粒子.
2.2.3 Fe3O4@SiO2-Chitosan复合磁性纳米粒子的制备参照Li等(et al2008)交联壳聚糖的实验方法合成Fe3O4@SiO2-Chitosan复合磁性纳米粒子, 具体步骤如下:将制得的Fe3O4@SiO2溶于60 mL C25H52和1.0 mL Span-80中, 注入500 mL的单口烧瓶中.称取1.6 g Chitosan溶于30 mL(2%, V/V) CH3COOH中, 将混合液加入上述单口烧瓶, 超声溶解40 min, 加入3 mL浓度为25%的GLA, 机械搅拌4 h, 经磁分离后将沉淀物分别用C2H5OH和去离子水洗涤3次, 50 ℃真空干燥6 h, 制得Fe3O4@SiO2-Chitosan复合磁性纳米粒子.
2.3 材料表征方法采用Empyrean XRD-2型X射线粉末衍射仪(荷兰帕纳科公司)对样品的晶体结构和粒子尺寸进行分析.采用JEM 1200EX透射电子显微镜(日本电子(柱)式会社(JEOL))观察样品的形貌特征和核壳结构.采用Vertex 70型傅立叶变换红外光谱仪(德国Bruker Optics公司)分析样品组分及所带官能团.
2.4 吸附性能测试 2.4.1 Cu2+浓度的测定采用二乙基二硫代氨基甲酸钠分光光度法(杨润萍等, 2007)获得Cu2+标准曲线, Cu2+浓度在0.1~10 μg·mL-1范围内与吸光度值呈良好的线性关系, 线性回归方程为: y=0.0562x-0.0041, 可决系数R2=0.9995, 检测限为0.0042 μg·mL-1.样品中Cu2+浓度可依据其吸光度值, 根据线性回归方程计算得出.
2.4.2 吸附剂投加量对吸附的影响配置一系列250 mL浓度为50 mg·L-1的Cu(Ⅱ)溶液, 分别加入10.0、20.0、30.0、40.0、50.0、60.0、80.0、100.0 mg制得的Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan纳米材料, 用0.1 mol·L-1的HCl和NaOH溶液调节pH至6.0, 置于25 ℃恒温振荡器内振荡2 h, 磁吸分离, 取上清液经微孔滤膜过滤后测定其吸光度, 计算样品的Cu2+浓度和吸附量.
2.4.3 溶液pH值对吸附的影响配置一系列250 mL浓度为50 mg·L-1的Cu(Ⅱ)溶液, 分别加入30.0 mg制得的Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan纳米材料, 配制不同pH的缓冲溶液, 调节pH至2.0、3.0、4.0、5.0、6.0, 置于25 ℃恒温振荡器内振荡2 h, 取样, Cu(Ⅱ)的吸附量测定同2.4.2节.
2.4.4 吸附动力学配置一系列250 mL浓度为50 mg·L-1的Cu(Ⅱ)溶液, 分别加入30.0 mg制得的Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan纳米材料, 调节pH至6.0, 置于25 ℃恒温振荡器内振荡, 隔一定时间取样, Cu(Ⅱ)的吸附量测定同2.4.2节.
2.4.5 吸附等温线配置一系列250 mL不同浓度的Cu(Ⅱ)溶液, 分别加入30.0 mg制得的Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan纳米材料, 调节pH至6.0, 置于25 ℃恒温振荡器内振荡2 h, 取样, Cu(Ⅱ)的吸附量测定同1.4.2节.
2.4.6 吸附再生回用性评价将吸附后的Fe3O4@SiO2-Chitosan纳米材料加入到25 mL pH为2.0的HCl溶液中超声解吸30 min, 经磁分离后将沉淀物洗涤至中性, 干燥后再次进行吸附-解吸实验, 重复4~5次.
3 结果与讨论(Results and discussion) 3.1 吸附剂的表征 3.1.1 X射线衍射图谱分析图 1为实验制得的Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan纳米材料的X射线衍射(XRD)图谱, 峰形尖锐, 样品结晶完整. 3种纳米材料在2θ=30.10°、35.51°、43.11°、53.60°、57.23°、62.71°和74.22°处出现明显特征峰, 符合Fe3O4标准衍射特征峰, 表明其均为面心立方反尖晶石结构, SiO2的包覆过程和Chitosan的交联过程并没有改变Fe3O4的物相.此外, Fe3O4@SiO2和Fe3O4@SiO2-Chitosan在2θ=20°~26°范围内还出现了较宽的归属于无定形SiO2的特征峰, 表明非晶态SiO2对Fe3O4纳米粒子进行了较好的包覆(丁冰晶等, 2015), 与Shi等(2015)制备的Fe3O4@SiO2@Chitosan磁性纳米材料得出相似的结果.根据谢乐公式计算可得Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan的平均晶粒尺寸分别为12.3、17.4和20.6 nm.
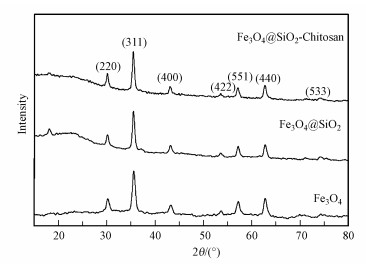 |
| 图 1 Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan的XRD图谱 Fig. 1 The XRD patterns of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2-Chitosan |
采用透射电镜(TEM)对Fe3O4@SiO2-Chitosan复合磁性纳米粒子的形貌和结构进行分析.如图 2所示, 可以看出, Fe3O4@SiO2-Chitosan大体呈球形或椭球形, 分散良好.粒子中心颜色较深为Fe3O4核, 平均粒径在12 nm左右.结合FTIR结果分析, 边缘颜色较浅部分为SiO2壳层, 厚度约为5 nm; 表面不均匀包覆一层壳聚糖浅灰色薄膜, 厚度约为2 nm, 说明成功制备了具有核壳结构的Fe3O4@SiO2-Chitosan.与Shi等(2015)制备的Fe3O4@SiO2@Chitosan磁性纳米材料相比尺寸较小, 这可能是由于两实验制备材料过程所采用的表面活性剂不同所致.粒子间的壳层呈链状分布, 局部出现粘连, 这也许是因为TEOS水解时粒子间发生缩聚反应, 局部形成Si—O—Si键间的相互作用引起的(古蒙蒙等, 2018).
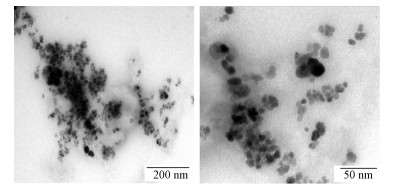 |
| 图 2 Fe3O4@SiO2-Chitosan的TEM图谱 Fig. 2 TEM patterns of Fe3O4@SiO2-Chitosan |
采用红外吸收光谱(FT-IR)对3种材料所含官能团进行分析, 进而推断材料中物质的存在, 结果如图 3所示.对比可知, Fe3O4@SiO2-Chitosan包含Fe3O4@SiO2所有的特征吸收峰, Fe3O4@SiO2包含Fe3O4的吸收峰, 与本实验的合成路径相一致. Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan分别在3441、3437、3449 cm-1和1632、1637、1638 cm-1附近有明显的吸收峰, 对应的是纳米粒子表面吸附水的—OH的反对称伸缩振动峰和弯曲振动峰(王雪等, 2013). Fe3O4在1107 cm-1处出现PEG-4000的C—O醇羟基的伸缩吸收峰(张峰等, 2009). Fe3O4在581 cm-1处的宽吸收带为Fe—O伸缩振动峰, 而Fe3O4@SiO2、Fe3O4@SiO2-Chitosan中的Fe—O—Fe键分别移至561 cm-1和564 cm-1处, 发生了蓝移且强度有所减弱, 这可能是由于TEOS水解并在Fe3O4表面形成了新的Si—O—Fe键(古蒙蒙等, 2018). Fe3O4@SiO2、Fe3O4@SiO2-Chitosan分别在469、802、1095 cm-1和467、799、1099 cm-1处出现明显的Si—O—Si振动峰, 表明SiO2被成功包覆在Fe3O4表面, 进一步证明了XRD的分析结果.此外, 在955 cm-1和954 cm-1处的吸收峰是由Si—OH的弯曲振动引起的, 提高了后续表面功能化的可能(张乐等, 2018). Fe3O4@SiO2-Chitosan在2925 cm-1和2954 cm-1处分别为C—H的伸缩振动吸收峰和非对称的—CH2伸缩振动峰. Fe3O4@SiO2-Chitosan在1377 cm-1处的特征峰是由Chitosan中的C3—OH引起的, 在1459 cm-1处为N—H的变形振动吸收峰, 在2856 cm-1处为Chitosan残糖基上对称的—CH3伸缩振动峰, 表明Chitosan成功修饰在Fe3O4@SiO2表面(李建军等, 2017).
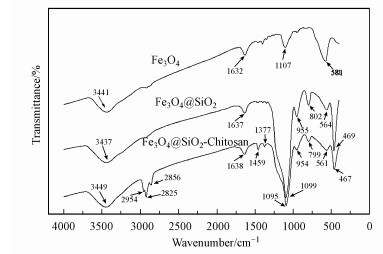 |
| 图 3 Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan的FT-IR图谱 Fig. 3 The FT-IR spectra of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2-Chitosan |
探究吸附剂的投加量对Cu2+吸附性能的影响, 可以有效提高吸附剂的利用率.从图 4a曲线可以看出, 随着吸附剂投加量的增加, 单位铜离子吸附量逐渐下降.这是由于当溶液中Cu2+的总量保持不变时, 参与络合吸附的活性位点随吸附剂投加量的增加而增加, 导致单位质量吸附剂上的活性位点对Cu2+的吸附量呈下降趋势.当投加量增加至40.0 mg·L-1时, Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan的单位铜离子吸附量依次为33.4、40.0和54.4 mg·g-1.当吸附剂达到一定投加量时, 即可吸附掉溶液中大部分Cu2+, 出于成本节约的考虑, 选定本实验吸附剂的最佳投加量为12.0 mg·L-1, Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan的单位铜离子吸附量分别为63.9、74.2和119.2 mg·g-1.
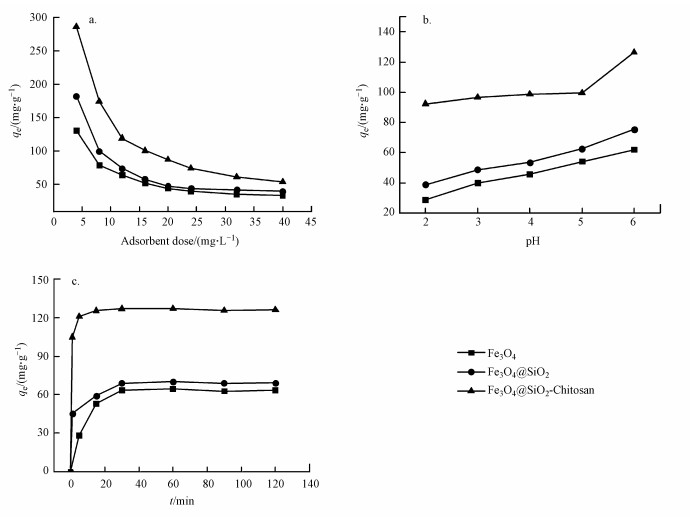 |
| 图 4 投加量(a)、pH(b)和吸附时间(c)对Cu2+吸附效果的影响 Fig. 4 Effect of adsorbent dose(a), pH(b) and time(c) on the adsorption of Cu2+ |
溶液pH不仅影响吸附剂功能基团的存在形态, 还会影响Cu2+的离子化程度和配合螯合作用.鉴于pH值大于6.0时, Cu2+会形成沉淀, 所以本实验选择在pH=2.0~6.0下考察吸附剂对Cu2+吸附性能的影响(常皓等, 2007).由图 4b可知, 随着pH值的增大, Fe3O4和Fe3O4@SiO2的单位铜离子吸附量呈较为均匀的增长趋势.而pH ≤ 5.0时, Fe3O4@SiO2-Chitosan对Cu2+的单位吸附量随着pH值的增大略有上升, 当pH > 5.0时, 吸附量显著增加.这可能是由于pH ≤ 5.0时, 溶液中H+浓度较大, H+和Cu2+与Fe3O4@SiO2-Chitosan上的吸附位点产生竞争性结合, 使得自由氨基的数量有所减少, 与Cu2+发生螯合作用的机会也随之下降.此外质子化的氨基带正电, 对Cu2+有静电排斥作用, 导致吸附量进一步降低(成岳等, 2017).当pH > 5.0时, 随着体系pH的升高, H+在吸附竞争中逐渐处于劣势, 质子化氨基数量减少, 吸附剂对Cu2+的吸附量也显著增加.当pH=6.0时, 吸附剂均表现出最优的吸附性能, Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan的吸附量分别为61.9、75.4和126.5 mg·g-1.因此, pH=6.0是吸附实验下最佳pH值.
3.2.3 吸附时间的影响及吸附动力学不同时间内吸附剂对Cu2+的吸附性能如图 4c所示.在30 min内, Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan对Cu2+的吸附容量迅速增加, 且Fe3O4@SiO2-Chitosan对Cu2+的初始吸附速率远高于Fe3O4和Fe3O4@SiO2, 30 min左右吸附反应均趋于平衡.这是由于在吸附初期, 吸附剂表面提供了大量的吸附位点, 两相之间的Cu2+浓度差产生较大的传质动力, 使得Cu2+被迅速络合在吸附剂表面, 吸附过程主要以表面扩散为主; 随着反应进行, Cu2+向吸附剂内部扩散, 直至达到吸附平衡(卢文静等, 2018).
为了进一步探究制得的3种纳米材料对Cu2+的吸附行为, 采用准一级动力学方程、准二级动力学方程和颗粒的内扩散速率方程对吸附数据进行拟合, 所得动力学参数见表 1.
| 表 1 动力学参数 Table 1 Kinetic parameters for the adsorption of Cu2+ on different adsorbents |
Fe3O4对Cu2+的准一级动力学曲线的线性相关系数更高, 这表明准一级动力学占主导位置, 属物理吸附. Fe3O4@SiO2和Fe3O4@SiO2-Chitosan对准二级动力学的拟合程度较高, 表明遵循准二级吸附动力学模型, 对Cu2+的吸附以表面反应过程控制的化学吸附为主, 而非扩散控制. Fe3O4@SiO2-Chitosan对Cu2+的初始吸附速率h远高于Fe3O4和Fe3O4@SiO2, 与图 4c相吻合, 这是因为Fe3O4@SiO2-Chitosan表面含有丰富的—NH2和—OH.
3.2.4 吸附等温线采用Langmuir和Freundlich吸附等温方程对吸附数据进行拟合, 见图 5, 参数如表 2所示.可以看出, Fe3O4对Cu2+的吸附过程较为遵循Freundlich模型, 为多层吸附. Fe3O4@SiO2和Fe3O4@SiO2-Chitosan的吸附遵循Langmuir模型, 拟合的相关系数较高, 为单分子层吸附. RL < 1, 属于优惠型吸附, 其中Fe3O4@SiO2-Chitosan对应的RL最小, 表明其对Cu2+的吸附较易进行. Fe3O4@SiO2-Chitosan对应的KL较大, 表明对Cu2+的吸附能力最强, 与实验结果相一致.同时Freundlich模型也能较好的拟合吸附数据, 1/n < 1, 表明吸附过程是易于发生的; KF也能粗略地反映吸附能力, Fe3O4@SiO2-Chitosan的KF较大, 与Langmuir模型的拟合结果相一致.
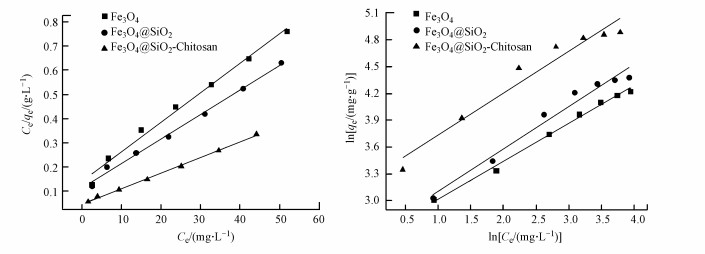 |
| 图 5 Langmuir(a)和Freundlich(b)模型拟合曲线 Fig. 5 Fitting curves of Langmuir(a) and Freundlich(b) model |
| 表 2 Langmuir和Freundlich模型参数 Table 2 Langmuir and Freundlich model parameters |
表 3展示的是不同吸附剂对Cu2+的Langmuir吸附容量.本文制备的Fe3O4@SiO2-Chitosan平衡吸附容量为154.80 mg·g-1, 与表中其它吸附剂相比容量较大, 表明其是一种有较大发展潜力的吸附材料.
| 表 3 对比吸附剂对于Cu2+的Langmuir吸附容量 Table 3 Comparison of Langmuir adorption capacities of adsorbents for Cu2+ |
采用Langmuir和Freundlich等温模型拟合不同温度下Fe3O4@SiO2-Chitosan对Cu2+的吸附, 等温线参数见表 4. Fe3O4@SiO2-Chitosan对Cu2+的吸附较为遵循Langmuir模型, 其吸附量和KL均随温度的升高而降低. 1/n < 1, 说明此吸附在298 ~308 K是易于发生的, 且温度升高不利于反应的发生(周利民等, 2010).
| 表 4 Fe3O4@SiO2-Chitosan对Cu2+吸附的等温线参数 Table 4 Isotherm parameters of Cu2+ on Fe3O4@SiO2-Chitosan |
为更加直观地考察吸附过程中的能量变化, 采用范特霍夫方程、吉布斯函数进行热力学研究.绘制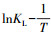
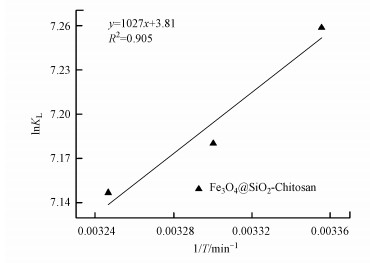 |
| 图 6 Fe3O4@SiO2-Chitosan的Van′t Hoff曲线 Fig. 6 Van′t Hoff plots of Fe3O4@SiO2-Chitosan |
将吸附再生的Fe3O4@SiO2-Chitosan再次对Cu2+进行吸附, 重复利用5次, 其结果见图 7.随着重复利用次数的增加, Fe3O4@SiO2-Chitosan的吸附性能略有降低, 但降幅不大. Fe3O4@SiO2-Chitosan对Cu2+的吸附性能有所下降可能是由于材料中的部分基团与Cu(Ⅱ)形成了络合物, 很难被洗脱下来.循环吸附4次时, 吸附容量为第1次的83%左右, 表明Fe3O4@SiO2-Chitosan具有较好的再生稳定性.
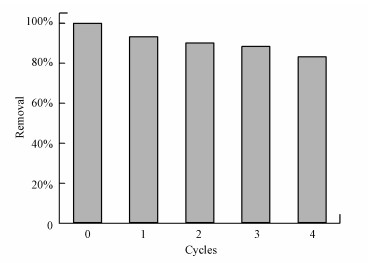 |
| 图 7 Fe3O4@SiO2-Chitosan的吸附解吸再生吸附量 Fig. 7 Adsorption capacities of Fe3O4@SiO2-Chitosan at adsorption-desorption cycles |
1) XRD分析表明Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan结晶较好, 具有Fe3O4反尖晶石型面心立方结构. TEM和FT-IR表征显示SiO2和Chitosan成功包覆在Fe3O4表面, 本实验成功制备出了具有核壳结构的Fe3O4@SiO2-Chitosan复合磁性纳米粒子.
2) 通过Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-Chitosan对水中对Cu2+的吸附研究, 得出吸附剂最佳投加量为12 mg·L-1, 反应最佳pH为6.0, 在30 min左右达到吸附平衡. Fe3O4@SiO2-Chitosan对Cu2+的吸附遵循准二级吸附动力学模型和Langmuir等温模型, 为易于自发进行的单分子层化学吸附, 降温有利于反应的进行.在298 K下, Fe3O4@SiO2-Chitosan对Cu2+的最大吸附量可以达到154.8 mg·g-1.研究结果表明Fe3O4@SiO2-Chitosan具有较高的吸附容量, 可实现再生重复利用, 有望应用于含铜废水处理与回收利用中.
常皓, 柴立元, 王云燕, 等. 2007. Cu2+-H2O系羟合配离子配位平衡研究[J]. 矿冶工程, 2007, 27(6): 37–40.
DOI:10.3969/j.issn.0253-6099.2007.06.012 |
Cui H J, Cai J K, Zhao H, et al. 2014. Fabrication of magnetic porous Fe-Mn binary oxide nanowires with superior capability for removal of As(Ⅲ) from water[J]. Journal of Hazardous Materials, 279: 26–31.
DOI:10.1016/j.jhazmat.2014.06.054
|
Cui H J, Shi J W, Yuan B, et al. 2013. Synthesis of porous magnetic ferrite nanowires containing Mn and their application in water treatment[J]. Journal of Materials Chemistry A, 1(19): 5902–5907.
DOI:10.1039/c3ta01692g
|
成岳, 肖治国, 余宏伟, 等. 2017. 氨基化修饰介孔Fe3O4@SiO2@mSiO2磁性吸附剂的制备及吸附性能的研究[J]. 功能材料, 2017, 48(12): 12135–12141.
|
丁冰晶, 范立维, 林兆宇, 等. 2015. 磁性核壳型Fe3O4@SiO2的制备及表征[J]. 合成材料老化与应用, 2015, 44(4): 44–47.
DOI:10.3969/j.issn.1671-5381.2015.04.010 |
董景伟, 张志荣, 张旸, 等. 2010. 反相微乳液法制备超顺磁性核壳Fe3O4@SiO2纳米颗粒[J]. 材料导报, 2010, 24(s1): 166–169.
|
古蒙蒙, 蔡卫权, 马甜. 2018. 一锅共缩聚法制备氨基改性Fe3O4@SiO2及其Cr(Ⅵ)吸附性能增强[J]. 无机化学学报, 2018, 34(7): 1293–1302.
|
Li G Y, Jiang Y R, Huang K L, et al. 2008. Preparation and properties of magnetic Fe3O4-chitosan nanoparticles[J]. Journal of Alloys and Compounds, 466(1/2): 451–456.
|
Li J, Jiang B, Liu Y, et al. 2017. Preparation and adsorption properties of magnetic chitosan composite adsorbent for Cu2+ removal[J]. Journal of Cleaner Production, 158: 51–58.
DOI:10.1016/j.jclepro.2017.04.156
|
李建军, 鲍旭, 吴先锋, 等. 2017. 磁性壳聚糖复合微球的制备及其Cu2+吸附性能[J]. 无机化学学报, 2017, 33(3): 383–388.
|
李珂珂, 段正洋, 云露, 等. 2018. 改性壳聚糖材料在含重金属废水处理中的应用研究进展[J]. 硅酸盐通报, 2018, 37(5): 1637–1642.
|
刘艳, 梁沛, 郭丽, 等. 2005. 负载型纳米二氧化钛对重金属离子吸附性能的研究[J]. 化学学报, 2005, 63(4): 312–316.
DOI:10.3321/j.issn:0567-7351.2005.04.011 |
卢文静, 雷超, 万俊力, 等. 2018. Cu2+印迹交联壳聚糖微球制备及其对水中Cu2+的吸附研究[J]. 水处理技术, 2018, 44(6): 65–70.
|
Nassar N N. 2010. Rapid removal and recovery of Pb(Ⅱ) from wastewater by magnetic nanoadsorbents[J]. Journal of Hazardous Materials, 184(1/3): 538–546.
|
Ng J C Y, Cheung W H, McKay G. 2002. Equilibrium studies of the sorption of Cu(Ⅱ) ions onto chitosan[J]. Journal of Colloid and Interface Science, 255(1): 64–74.
DOI:10.1006/jcis.2002.8664
|
Su C. 2017. Environmental implications and applications of engineered nanoscale magnetite and its hybrid nanocomposites:A review of recent literature[J]. Journal of Hazardous Materials, 322(Pt A): 48–84.
|
Sutirman Z A, Sanagi M M, Karim K J A, et al. 2018. Equilibrium, kinetic and mechanism studies of Cu(Ⅱ) and Cd(Ⅱ) ions adsorption by modified chitosan beads[J]. International Journal of Biological Macromolecules, 116: 255–263.
DOI:10.1016/j.ijbiomac.2018.05.031
|
Shi H, Yang J, Zhu L, et al. 2016. Removal of Pb2+, Hg2+, and Cu2+ by Chain-Like Fe3O4@SiO2@Chitosan Magnetic Nanoparticles[J]. Journal of Nanoscience and Nanotechnology, 16(2): 1871–1882.
DOI:10.1166/jnn.2016.10712
|
王雪, 孟令友, 代莹, 等. 2013. Fe3O4@SiO2-NH2磁性复合材料对水中单宁酸的吸附性能研究[J]. 环境科学学报, 2013, 33(8): 2193–2198.
|
Wang J, Chen C. 2014. Chitosan-based biosorbents:Modification and application for biosorption of heavy metals and radionuclides[J]. Bioresource Technology, 160(5): 129–141.
|
薛娟琴, 徐尚元, 朱倩文, 等. 2016. 氨基化修饰介孔Fe3O4@SiO2@mSiO2磁性核壳复合微球的可控制备及吸附性能[J]. 无机化学学报, 2016, 32(9): 1503–1511.
|
杨润萍, 李晓霞, 丁磊, 等. 2007. 污染水中铜离子浓度的快速测定[J]. 中国卫生检验杂志, 2007, 17(12): 2217–2218.
DOI:10.3969/j.issn.1004-8685.2007.12.036 |
张峰, 朱宏. 2009. 聚乙二醇包覆纳米Fe3O4颗粒的制备及表征[J]. 磁性材料及器件, 2009, 40(4): 27–30.
DOI:10.3969/j.issn.1001-3830.2009.04.007 |
张乐, 邵慧萍, 郑航, 等. 2018. Fe3O4@SiO2磁性复合微球的制备与表征[J]. 稀有金属材料与工程, 2018, 47(2): 594–599.
|
周利民, 刘峙嵘, 黄群武. 2010. 硫脲改性Fe3O4/壳聚糖微球对Hg2+的吸附性能[J]. 高分子材料科学与工程, 2010, 26(4): 78–81.
|
 2019, Vol. 39
2019, Vol. 39


