2. 中国科学院大学, 北京 100049;
3. 西安建筑科技大学, 环境与市政工程学院, 西安 710055;
4. 广州大学, 珠江三角洲水质安全与保护教育部重点实验室, 广州 510006
2. University of Chinese Academy of Sciences, Beijing 100049;
3. School of Environmental and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an 710055;
4. Key Laboratory of Water Quality and Conservation of the Pearl River Delta, Ministry of Education, Guangzhou University, Guangzhou 510006
砷(As)是一种广泛存在于自然水环境中的高毒性类重金属元素.砷主要以砷酸盐As(Ⅴ)和亚砷酸盐As(Ⅲ)两种无机形式存在, 其中As(Ⅲ)比As(Ⅴ)具有更强的可溶性、毒性和流动性, 较难以去除(Bissen et al., 2003; 曾辉平等, 2018).砷在地下水中主要以As(Ⅲ)的形态存在, 这极大地增大了含砷地下水的毒性.如江苏南通地下水中砷主要以As(Ⅲ)形态存在, 没有As(Ⅴ)检出(杨程等, 2015).长期饮用高砷水, 将导致砷中毒, 引发角化症、黑变病、癌症等一系列疾病(王文凯等, 2017; Jain et al., 2018).为了减少健康风险, 世界卫生组织(WHO)规定饮用水中砷的浓度限值为10 μg·L-1.饮用水中砷含量超标是一个全球性的问题, 目前全世界约有1.4亿人饮用砷含量超标的地下水, 在我国, 以高砷地下水为饮用水水源的居民高达200多万人(Rodríguezlado et al., 2013; Jia et al., 2018).因此, 廉价、高效除砷技术的研究一直是国内外饮水安全领域的研究热点.
由于吸附法具有成本低廉、可再生且环境友好等特点, 常被认为是最有应用前景的水体除砷方法之一(Habuda-Stanic et al., 2015; Lata et al., 2016).据文献报道, 传统的吸附剂如一些碳质类吸附剂、粘土、粉煤灰等除砷效果受pH影响较大, 对三价砷去除能力差, 需要进行预氧化(Auta et al., 2012; 马玉玲等, 2018).随着进一步研究表明, 复合型金属氧化物不但可以克服母体金属氧化物自身的局限性, 而且金属氧化物之间还具有显著的协同作用, 得到了广泛关注. Chen等用共沉淀法制备了铈锰摩尔比为3:1铈锰复合氧化物, 与单独的铈和锰氧化物相比, 对As(Ⅲ)有更好的吸附效果(Chen et al., 2018).与铁、铈单一金属氧化物相比, Wen等制备的花状铈铁复合氧化物, 具有更好的选择性及更高的砷吸附容量(Wen et al., 2018).除此之外, 制备的铁镧(张伟等, 2014)、铁铜(Zhang et al., 2013)、铁钛(仲艳等, 2018)、锆锰(Zhang et al., 2013)、铁铜铝(杨雪等, 2018)、铁铝铈(Wu et al., 2013)、镁铝锆(Wang et al., 2017)等复合氧化物也具有良好协同作用, 有效提高了对吸附质的吸附能力.
然而, 粉末状吸附剂在实际应用中由于机械强度弱、易板结等缺点, 导致其很难在固定床或者其他流动床系统中使用.为了拓展吸附剂的应用范围, 一些研究者利用负载法、压力成型法和包覆法等将粉末吸附剂颗粒化(Li et al., 2012; Qi et al., 2015; 李海宁等, 2016), 其中利用黏合剂将吸附材料包覆改性是目前常用的一种经济有效的吸附剂固定方法.壳聚糖是一种环境友好、无毒的天然高分子聚合物, 具有良好的黏结性和可生物降解性, 是粉末吸附剂固定化的骨架支撑材料(Sargun et al., 2015).付军等利用壳聚糖作为黏合剂, 制备铁锰复合金属氧化物/壳聚糖颗粒, 展现了良好的水力特性和机械强度(付军等, 2016). Futalan等制备了膨润土/壳聚糖和高岭土/壳聚糖颗粒, 对As(Ⅴ)具有好的吸附效果(Futalan et al., 2018).除此之外, Cho等开发了能够同时去除水中的F离子和Pb离子污染物的复合吸附剂氧化锆/壳聚糖珠(Cho et al., 2016). Yang等利用壳聚糖做黏合剂用一步法合成Fe(OH)3/壳聚糖珠, 用作阴离子染料去除的有效吸附剂(Yang et al., 2018).因此, 本研究以壳聚糖为黏合剂材料, 制备了一种新型的颗粒状铁铜锰复合氧化物(GFCM)吸附剂, 对其表面结构进行表征, 考察了GFCM的再生性能, 并对As(Ⅲ)进行了系统的吸附研究, 而且进一步探究了As(Ⅲ)的吸附机制.
2 实验部分(Experimental sections) 2.1 颗粒状铁铜锰复合氧化物的制备颗粒状铁铜锰复合氧化物(GFCM)的制备过程分为两步:第一步是将一定量的FeSO4·7H2O和CuSO4·5H2O溶解于500 mL水中, 然后将一定量的KMnO4和NaOH溶解于200 mL水, 确保最终FeSO4·7H2O:CuSO4·5H2O:KMnO4的物质的量比为6:3:2.在不断搅拌的条件下, 将KMnO4与NaOH的混合溶液缓慢滴加到铁盐和铜盐混合溶液中.滴加完成后, 继续搅拌, 然后陈化, 多次清洗, 抽滤、烘干, 研磨、过筛, 制得铁铜锰复合金属氧化物; 第二步是在3% (V/V)的乙酸中溶解壳聚糖(质量浓度为5%), 然后将铁铜锰复合金属氧化物分散在一定的去离子水中, 与溶解的壳聚糖混合均匀, 缓慢滴入到0.2 mol·L-1的NaOH溶液中, 滴加完毕后, 在碱液里陈化数小时, 然后分离反复清洗颗粒至中性, 55 ℃烘干, 得到颗粒状铁铜锰复合氧化物.
2.2 颗粒状铁铜锰复合氧化物的表征利用扫描电镜(SEM, Hitachi S-4800, Japan)和能谱仪(EDS)观察颗粒状铁铜锰复合氧化物的微观形貌和元素组成; 将吸附As(Ⅲ)前后的颗粒状铁铜锰复合氧化物研磨成粉、过筛, 用傅氏变换拉曼红外谱仪(Nicolet IS10, Thermo SCIENTIFIC)和X射线光电子能谱分析仪(Thermo VG ESCALAB 250)分别测定吸附前后吸附剂的FTIR谱图和XPS谱图, 用于分析吸附剂表面的官能团结构和元素化学价态变化. XPS谱图拟合时, 以C1s峰(284.8 eV)作为内标校准峰进行能量校正, 采用XPS peak 4.1软件进行分峰拟合, 设置L/G(%Lorentzian-Gaussian)为20%, 半峰宽不大于2.7 eV, 多次调整拟合峰的面积、位置和半峰宽等参数, 尽可能使拟合后数据和原始数据重合, 确保拟合结果的可靠性.
2.3 颗粒状铁铜锰复合氧化物的As(Ⅲ)吸附实验称取0.05 g颗粒状吸附剂置于100 mL的塑料瓶中, 加入总体积为50 mL的含As(Ⅲ)溶液, 吸附实验在温度为(25 ± 0.1) ℃、转速为170 r·min-1的条件下进行, 背景电解质NaNO3浓度为0.01 mol·L-1.在整个吸附过程中, 使用NaOH或HNO3不断调节pH, 使pH稳定在(7.0 ± 0.1)(pH对吸附的影响除外).吸附36 h后样品经0.45 μm滤膜过滤后, 用ICP-OES (Optima DV7000)测定As(Ⅲ)的剩余浓度.
设定As(Ⅲ)初始浓度为5.2 mg·L-1, 称取1.5 g吸附剂置于1.5 L As(Ⅲ)溶液中进行动力学实验.每隔一定时间取样, 过膜后分析溶液中的As(Ⅲ)浓度.在整个吸附实验过程中, 调节pH使其稳定在(7.0 ± 0.1)范围内.在(25 ± 0.1) ℃下进行吸附等温线测定实验, As(Ⅲ)浓度梯度为5.0~80.0 mg·L-1, 称取0.05 g吸附剂加入到50 mL的As(Ⅲ)溶液中进行吸附实验.
为了研究溶液pH和离子强度对As(Ⅲ)吸附的影响, 配制一系列初始浓度为5.9 mg·L-1的As(Ⅲ)溶液, 设置溶液pH范围为5.0~10.0, NaNO3的浓度梯度为0.1、0.01和0.001 mol·L-1.除此之外, 在As(Ⅲ)初始浓度为5.2 mg·L-1时, 还分别考察了不同浓度的(0、0.1、1.0、10.0 mmol·L-1) PO43-、SO42-、Cl-、CO32-、SiO32-对As(Ⅲ)吸附效果的影响.
为了评估颗粒状铁铜锰复合氧化物(GFCM)的可重复使用性, 采用碱液对吸附As(Ⅲ)的GFCM吸附剂进行脱附再吸附循环实验.颗粒状铁铜锰复合氧化物吸附剂在初始浓度为5.2 mg·L-1 As(Ⅲ)溶液中进行吸附实验, 吸附24 h后取样分析.脱附实验是将吸附As(Ⅲ)的GFCM吸附剂加入1.0 mol·L-1的NaOH溶液中, GFCM的投加量为4 g·L-1, 25 ℃下振荡12 h后取样、分离, 反复洗涤至中性, 在DHG-9140A型电热恒温鼓风干燥箱中65 ℃鼓风烘干, 无氮气保护, 然后继续进行吸附脱附实验, 一共进行4次再生循环.
为了考察吸附剂GFCM在吸附过程中的溶胀、溶出情况, 配置系列50 mL初始浓度为5.9 mg·L-1的As(Ⅲ)溶液进行实验, 分别投加0.05 g吸附剂, 用HNO3或NaOH调节溶液pH, 使最终pH稳定在不同预定值(5.5~10.0), 36 h吸附平衡后, 取样, 利用电感耦合等离子体质谱仪(PerkinElmer, Optima DV7000)分析过膜后溶液中Fe、Cu、Mn的浓度, 利用有机碳分析仪(Shimadu TOC VCPH)测量溶液中总有机碳(TOC)浓度考察吸附剂GFCM中壳聚糖的溶出.此外, 还用KY-20颗粒强度测定仪和游标卡尺分别测量吸附前后吸附剂GFCM的机械强度和粒径.
3 结果与讨论(Results and discussion) 3.1 颗粒状铁铜锰复合氧化物的表征颗粒状铁铜锰复合氧化物为不完全球状, 对颗粒状铁铜锰复合氧化物进行扫描电镜表征, 结果如图 1所示.从图 1a可以清晰观察到制得的球状GFCM表面较粗糙, 凹凸不平. 图 1b高倍放大图像观察表明, GFCM表面形成褶皱和裂缝, 这有利于溶液中的吸附质向吸附剂颗粒内部输送, 使得As(Ⅲ)与GFCM表面更多的活性位点接触. BET结果分析, GFCM的孔容为0.02 cm3·g-1, 比表面积为6.68 m2·g-1.
 |
| 图 1 GFCM的扫描电镜图片(a. GFCM×100倍; b. GFCM×10000倍) Fig. 1 SEM images of the GFCM (a. GFCM×100; b. GFCM×10K) |
吸附动力学是评估吸附剂吸附速率的重要参数. As(Ⅲ)在颗粒状铁铜锰复合氧化物上的吸附随时间变化如图 2a所示.从图中可以看出, GFCB对As(Ⅲ)的吸附速度在前9 h内较快, 达到了平衡吸附能力的75%以上.这可能是因为在吸附的初始过程, GFCM吸附剂表面有较多的活性位点, 有利于亚砷酸盐分子从溶液中输送到吸附剂的活性部位.在接下来的时间里, 当反应12 h之后, 砷的吸附速度减慢, 几乎达到了平衡吸附能力的85%. GFCM对As(Ⅲ)的吸附达到平衡的时间约为24 h, 因此整个吸附反应36 h满足实验需要.分别采用准一级和准二级动力学模型对As(Ⅲ)吸附过程进行拟合, 拟合公式如式(1)、(2)所示.
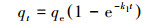
|
(1) |
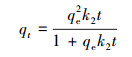
|
(2) |
 |
| 图 2 GFCM吸附As(Ⅲ)的动力学 (a.准一级和准二级动力学模型拟合, b.颗粒内扩散模型拟合; 吸附剂投加量=1.0 g·L-1, 转速=170 r·min-1, 平衡时间=36 h, pH=(7.0 ± 0.1), T=(25 ± 1) ℃, As(Ⅲ)初始浓度=5.2 mg·L-1) Fig. 2 Kinetics of As(Ⅲ) adsorption on the GFCM (a. Fitted with the pseudo-first order and pseudo-second order models, b. fitted with the intra-particle diffusion model; Adsorbent dose=1.0 g·L-1, agitation speed=170 r·min-1, equilibrium time=36 h, pH=(7.0 ± 0.1), T=(25 ± 1) ℃, initial As(Ⅲ) concentration=5.2 mg·L-1) |
式中, k1和k2分别为准一级吸附速率常数(min-1)和准二级吸附速率常数(g·mg-1·min-1), qt为t时刻的吸附量(mg·g-1), qe为平衡时的吸附量(mg·g-1).
拟合结果如表 1所示, 结果表明准二级动力学(R2=0.997)较准一级动力学模型(R2=0.988)能更好地拟合该吸附过程.由于准二级动力学模型是基于假设吸附速率受化学吸附机制控制的, 说明As(Ⅲ)在颗粒状铁铜锰复合氧化物表面可能发生了化学吸附(Chen et al., 2018).
| 表 1 准一级和准二级动力学模型拟合参数 Table 1 The pseudo-first order and pseudo-second order models parameters |
虽然上述两种动力学模型可以很好地描述吸附过程的特征, 但颗粒状铁铜锰复合氧化物对As(Ⅲ)吸附的限制步骤无法确定.因此, 采用颗粒内扩散模型对As(Ⅲ)吸附过程进行拟合, 拟合公式如(3)所示.
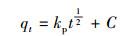
|
(3) |
式中, 常数kp为内扩散吸附速率(mg·g-1·min-1/2), qt为t时刻的吸附量(mg·g-1), 常数C代表边界层效应(mg·g-1).
如图 2b所示, 吸附As(Ⅲ)量对t1/2的曲线显示出多线性相关性, 表明在吸附过程中发生了3个阶段, 前两阶段分别对应外扩散和颗粒内扩散(吸附质从吸附剂表面到颗粒内活性部位)过程.如果颗粒内扩散是速率控制步骤, 则qt对t1/2的曲线应该是线性的并且经过原点(Zhang et al., 2018).然而, C的值(表 2)不等于0, 偏离了原点.因此, 可以得出结论, As(Ⅲ)吸附是多步骤过程, 并且粒子外部扩散和内部扩散在整个吸附过程中占主导地位.
| 表 2 颗粒内扩散模型拟合参数 Table 2 Intra-particle diffusion parameters |
为了评估颗粒状铁铜锰复合氧化物对As(Ⅲ)的吸附能力, 对GFCM进行了吸附等温线实验研究.在温度为(25 ± 1) ℃条件下, 颗粒状铁铜锰复合氧化物对As(Ⅲ)的吸附等温线如图 3所示. As(Ⅲ)的吸附量随着溶液中As(Ⅲ)平衡浓度的增加逐渐升高.
 |
| 图 3 GFCM对As(Ⅲ)的吸附等温线 (吸附剂投加量=1.0 g·L-1, 转速=170 r·min-1, pH=(7.0±0.1), T=(25±1) ℃, As(Ⅲ)初始浓度=0~80 mg·L-1, 平衡时间=36 h) Fig. 3 Adsorption isotherm of As(Ⅲ) on the GFCM (Adsorbent dose=1.0 g·L-1, agitation speed=170 r·min-1, pH =(7.0±0.1), T=(25±1) ℃, initial As(Ⅲ) concentration=0~80 mg·L-1, equilibrium time=36 h) |
分别采用非线性Langmuir和Freundlich理论模型对实验数据进行拟合, 拟合公式如式(4)、(5)所示.
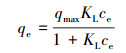
|
(4) |
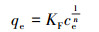
|
(5) |
式中, kL和kF分别为与热力学和吸附强度有关的常数, ce为吸附平衡时溶液中As(Ⅲ)浓度(mg·L-1), 常数n与吸附能力相关, qmax和qe分别为吸附剂最大吸附容量和吸附平衡时吸附量(mg·g-1).
用Freundlich模型对吸附等温线数据拟合的可决系数R2为0.987, Langmuir模型拟合的相关系数R2为0.977(表 3), 可以看出, 两种吸附模型都能较好地描述GFCM对As(Ⅲ)的吸附过程.按Langmuir模型计算GFCM对As(Ⅲ)的最大吸附容量为56.5 mg·g-1, 与文献中报道的除砷吸附剂比较(表 4), 显著高于多数颗粒状除砷吸附剂的砷吸附容量, 表明GFCM对As(Ⅲ)具有良好的吸附效果.结合Fe-Cu复合氧化物(Zhang et al., 2013)、Fe-Mn复合氧化物(Zhang et al., 2014)与Fe-Mn颗粒的砷吸附性能(Qi et al., 2015), 推断GFCM吸附剂中铜氧化物的存在, 可能改变了铁氧化物与锰氧化物的结合形式, 强化了组分氧化物间的协同效应, 有助于增强复合氧化物颗粒吸附剂的砷吸附性能.
| 表 3 吸附等温线拟合结果 Table 3 Adsorption isotherms parameters |
| 表 4 与其他文献中报道的As(Ⅲ)吸附剂比较 Table 4 Comparison of maximum As(Ⅲ) adsorption capacities for different adsorbents |
溶液pH是影响吸附剂表面电荷和As(Ⅲ)种类的关键因素之一, 溶液pH对颗粒状铁铜锰复合氧化物吸附As(Ⅲ)的影响如图 4所示, 在较广泛pH范围(5.0~9.0)内, GFCM对As(Ⅲ)均具有较好的吸附性能, 推断主要因为铁氧化物在偏酸性(pH < 7)溶液中对砷具有较好的吸附性能(Zhang et al., 2009), 而铜氧化物由于具有较高的等电点, 在pH 3.0~9.0的范围内, 对砷均具有较好吸附性能(Zhang et al., 2013), GFCM吸附剂继承了组分铁氧化物与铜氧化物的吸附特性, 而且铜氧化物的存在使得GFCM吸附剂在偏碱性条件下对砷亦具有良好的吸附性能, 拓宽了该吸附剂的pH适用范围.当溶液pH>9时, GFCM吸附剂对As(Ⅲ)的吸附容量随着pH的升高吸附量逐渐下降, 且酸性条件能使壳聚糖分子中的氨基质子化, 破坏分子内氢键结构, 导致壳聚糖溶解(Khan et al., 2016), 因此GFCM吸附剂的适用pH范围为5.0~9.0.
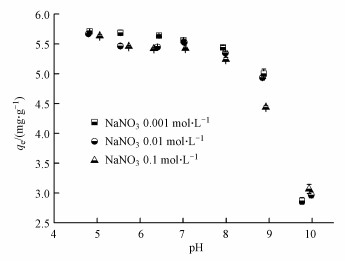 |
| 图 4 溶液pH与离子强度对GFCM吸附As(Ⅲ)的影响 (吸附剂投加量=1.0 g·L-1, 转速=170 r·min-1, pH=(7.0±0.1), T=(25±1) ℃, As(Ⅲ)初始浓度=5.9 mg·L-1, 平衡时间=36 h) Fig. 4 Effects of pH and ionic strength on As(Ⅲ) adsorption by the GFCM (Adsorbent dose=1.0 g·L-1, agitation speed=170 r·min-1, pH =(7.0 ± 0.1), T=(25 ± 1) ℃, initial As(Ⅲ) concentration=5.9 mg·L-1, equilibrium time=36 h) |
研究表明, 阴离子的外层机制吸附会随离子强度的增加受到竞争影响, 而内层机制吸附过程受离子强度的变化影响不大, 甚至会对阴离子的吸附起促进作用.从图 4中可看出, 随着离子强度从0.001 mol·L-1增加到0.1 mol·L-1时, 颗粒状铁铜锰复合氧化物对As(Ⅲ)的吸附效果没有发生明显变化.因此推断, 颗粒状铁铜锰复合氧化物对As(Ⅲ)的吸附为特征吸附, 可能形成内层络合物(吴秋月等, 2015).
3.2.4 共存离子的影响吸附选择性是影响去除效果的重要因素.在自然环境水体中通常会存在阴离子, 这些阴离子可能通过竞争吸附剂表面的活性位点抑制As(Ⅲ)的去除.因此评估共存阴离子对GFCM吸附As(Ⅲ)的影响是有必要的.如图 5所示, 低浓度阴离子SO42-、Cl-和CO32-的共存对GFCM吸附As(Ⅲ)没有影响, 当浓度高达10 mmol·L-1时, 有轻微的抑制作用.然而, 共存阴离子SiO32-和PO43-对As(Ⅲ)的去除有显著的阻碍作用, 尤其是在高浓度条件下.在这些阴离子中, 不同浓度梯度的PO43-对GFCM吸附As(Ⅲ)存在竞争影响.当PO43-的浓度从0 mmol·L-1增加到10 mmol·L-1时, As(Ⅲ)的去除率减少了大约47.8%.这种显著地减少归因于分子结构的相似性, 使得磷酸根与砷酸根之间对于吸附剂表面上的活性吸附位点存在强烈的竞争. 5种阴离子对颗粒状铁铜锰复合氧化物吸附As(Ⅲ)的影响大小顺序为: PO43- > SiO32- > CO32- > Cl- > SO42-.
 |
| 图 5 共存离子对GFCM吸附As(Ⅲ)的影响 (吸附剂投加量=1.0 g·L-1, pH =(7.0 ± 0.1), As(Ⅲ)初始浓度=5.2 mg·L-1) Fig. 5 Effects of coexisting anions on As(Ⅲ) adsorption by the GFCM (Adsorbent dose=1.0 g·L-1, pH=(7.0 ± 0.1), initial As(Ⅲ) concentration=5.2 mg·L-1) |
吸附前, 随机挑选GFCM颗粒70个, 对它们的直径和机械强度分别进行测量.颗粒直径主要在0.7~1.0 mm范围内, 其中0.80~0.90 mm约占66%, 机械强度在4.0~10.4 N之间, 其中5.5~7.5 N约占61%.吸附剂GFCM在溶液中浸泡36 h后, 吸附剂的直径范围为0.76~1.12 mm, 其中在0.80~0.90 mm约占68%, 机械强度范围为3.6~10.2 N, 其中5.5~7.5 N约占55%, 仍具有较高的机械强度, 基本无粘连.
溶液pH在5.5~10.0范围内, 吸附剂GFCM在吸附As(Ⅲ)过程中Fe、Cu、Mn和壳聚糖的溶出情况如图 6所示.酸性条件下(pH < 7), 颗粒表面壳聚糖分子中的部分氨基发生质子化, 导致壳聚糖稍有溶解, 溶液TOC浓度约为0.56~0.95 mg·L-1, 低于《生活饮用水卫生标准》(GB5749—2006) 5.0 mg·L-1, 且壳聚糖常用作食品添加剂, 具有较好的生态安全性.在中性与碱性条件下(pH ≥ 7), 壳聚糖基本未溶解.在实验考察的pH范围内, 溶液中铁含量(0.015~0.03 mg·L-1)低于0.3 mg·L-1, 铜含量(0.02~0.7 mg·L-1)低于1.0 mg·L-1, 锰含量(0.01~0.02 mg·L-1)低于0.1 mg·L-1, 符合《生活饮用水卫生标准》(GB5749-2006).由此, 当水体pH在5.5~10.0范围时, 吸附剂GFCM中Fe、Cu、Mn和壳聚糖的溶出浓度均较低, 符合相应的水质标准, 具有良好的应用前景.
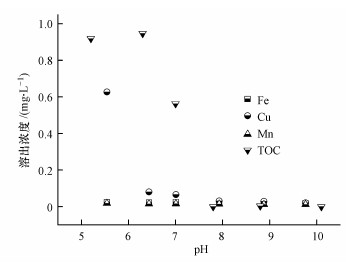 |
| 图 6 不同pH条件下吸附剂溶出情况 Fig. 6 Adsorbent dissolution in the process of As(Ⅲ) removal at different pH |
吸附As(Ⅲ)前后的颗粒状铁铜锰复合氧化物的EDS图谱如图 7所示.吸附As(Ⅲ)之前, GFCM有显著的铁、铜和锰元素的特征峰, 吸附As(Ⅲ)后GFCM的EDS图谱除了铁、铜和锰元素的特征峰外, 还出现了砷元素的特征峰, 表明GFCM对水体中的As(Ⅲ)具有吸附性能.
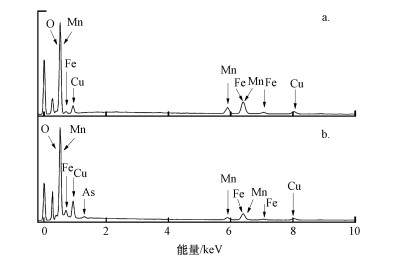 |
| 图 7 GFCM吸附As(Ⅲ)前后的EDS图谱 (a.吸附As(Ⅲ)前; b.吸附As(Ⅲ)后) Fig. 7 The EDS of the GFCM before and after adsorption As(Ⅲ) (a. Original GFCM; b. GFCM with As(Ⅲ) adsorption) |
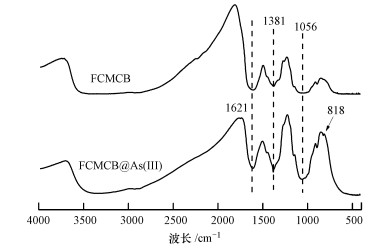
颗粒状铁铜锰复合氧化物吸附As(Ⅲ)前后的红外谱如图 8所示.其中, 1621 cm-1的吸收峰是GFCM吸附剂物理结合水的弯曲振动峰; 在1381 cm-1处的吸收峰可归属于NO3-的振动吸收, 因为该实验用硝酸钠来调节溶液的离子强度(Zhang et al., 2009); 1056 cm-1处的吸收峰可属于Fe-OH的弯曲振动.颗粒状铁铜锰复合氧化物与As(Ⅲ)反应之后, 在818 cm-1处出现一个新峰, 对应于As—O的不对称伸缩振动.由于As(Ⅲ)—O和As(Ⅴ)—O的振动吸收峰分别位于794 cm-1和820 cm-1处(Chen et al., 2018), 这表明在吸附过程中部分As(Ⅲ)被氧化成As(Ⅴ), 吸附在GFCM上.
 |
| 图 8 GFCM与As(Ⅲ)反应前后的FTIR图谱 (吸附剂投加量=1.0 g·L-1, 转速=170 r·min-1, pH=(7.0±0.1), T=(25±1) ℃, As(Ⅲ)初始浓度=5.9 mg·L-1, 平衡时间=36 h) Fig. 8 FTIR spectra of the GFCM before and after As(Ⅲ) adsorption (Adsorbent dose=1.0 g·L-1, agitation speed=170 r·min-1, pH=(7.0±0.1), T = (25±1) ℃, initial As(Ⅲ) concentration=5.9 mg·L-1, equilibrium time=36 h) |
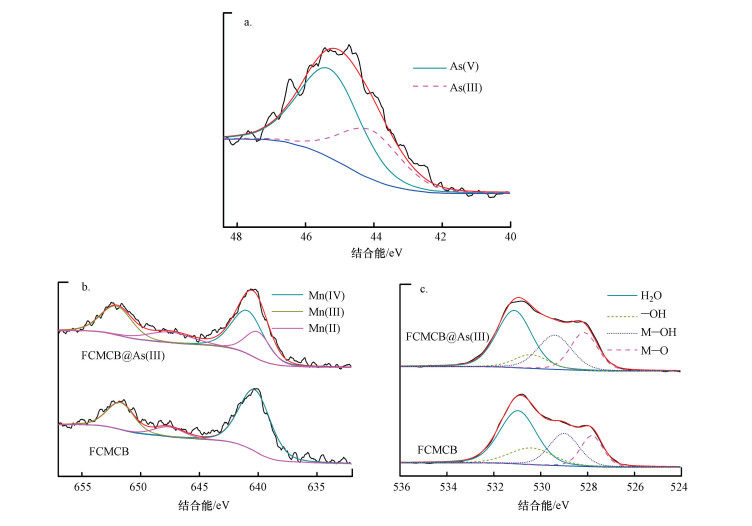
为了分析吸附剂对As(Ⅲ)的吸附机制, 对吸附As(Ⅲ)前后的颗粒状铁铜锰复合氧化物样品进行了XPS分析.如图 9a所示, As 3d图表明As(Ⅲ)已吸附在颗粒状铁铜锰复合氧化物吸附剂上, 在45.3 eV和44.1 eV处有两个拟合峰, 分别对应As(Ⅴ) (45.2~45.6)和As(Ⅲ) (44.1~33.4) (Chen et al., 2018).根据XPS分析, 在As(Ⅲ)初始浓度为5.2 mg·L-1时, 大约64.5%的As(Ⅲ)氧化为As(Ⅴ).通过拟合Mn 2p3/2和Mn 2p1/2, 分析了Mn 2p的价态图.在颗粒状铁铜锰复合氧化物吸附剂中Mn(Ⅳ)、Mn(Ⅲ)和Mn(Ⅱ)的百分比分别为65.6%、24.6%和9.8%, 表明GFCM吸附剂中Mn主要以Ⅳ价态形式存在(Hou et al., 2017). As(Ⅲ)吸附后, Mn(Ⅳ)的含量降低为40.1%, Mn(Ⅲ)和Mn(Ⅱ)分别增加到26.1%和33.8%.
 |
| 图 9 GFCM与As(Ⅲ)反应前后的XPS图谱 (a. As 3d图谱, b. Mn 2p图谱, c. O 1s图谱) Fig. 9 XPS spectra of the GFCM before and after As(Ⅲ) adsorption (a. As 3d spectra, b. Mn 2p spectra, c. O 1s spectra) |
| 表 5 GFCM吸附As(Ⅲ)前后As、Mn、O的峰值参数 Table 5 Peak parameters for As, Mn and O in the GFCM before and after As(Ⅲ) adsorption |
图 9c为颗粒状铁铜锰复合氧化物吸附As(Ⅲ)前后的O 1s谱图, 根据不同氧与金属(M)的结合能, O 1s谱分为4个峰, 位于527.8、529.0、530.4和531.0 eV, 分别对应氧与金属结合(M—O), 羟基与金属结合(M—OH), 羟基(—OH)和吸附的H2O(H—O—H) (Wang et al., 2018).羟基(—OH)是金属氧化物吸附砷酸根的一个关键因素, 吸附前比例为16.8%.吸附As(Ⅲ)之后, —OH的比例明显降低到10.1%, 而M—O和M—OH分别由吸附前的15.9%与22.2%增加至22.3%与24.9%.这表明在吸附过程中GFCM吸附剂上的羟基被砷酸根与亚砷酸根取代, 形成内层络合物, 达到去除效果.
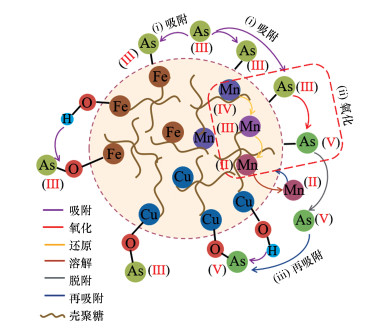
基于上述研究, 结合文献报道的Fe-Cu复合氧化物(Zhang et al., 2013)、Fe-Mn复合氧化物(Zhang et al., 2014)以及Fe-Mn-La生物质炭复合材料(Lin et al., 2019)的砷吸附去除机制, 推断在As(Ⅲ)的吸附去除过程中, 颗粒状铁铜锰复合氧化物中的锰氧化物主要起到氧化作用, 将As(Ⅲ)有效地氧化为As(Ⅴ); 铁氧化物与铜氧化物主要起到吸附作用, 通过高效吸附氧化生成的As(Ⅴ)与部分未被氧化的As(Ⅲ), 增强对As(Ⅲ)的去除效果.由此, 颗粒状铁铜锰复合氧化物对As(Ⅲ)的去除机理如图 10所示:① As(Ⅲ)物质首先从溶液中输送到固/液界面, 然后通过形成配合物吸附到吸附剂表面上. ②由于颗粒状铁铜锰复合氧化物吸附剂中存在Mn(Ⅳ)和Mn(Ⅲ), 使As(Ⅲ)有效氧化成As(Ⅴ), 形成的As(Ⅴ)可以更容易被GFCM吸附剂中的Fe、Cu氧化物吸附. ③随着Mn氧化物的还原溶解, 一部分形成的As(Ⅴ)和Mn(Ⅱ)释放到溶液中, 然后将溶液相中形成的As(Ⅴ)输送到固/液界面, 随后吸附在颗粒状铁铜锰复合氧化物吸附剂中, 由于表面带负电, Mn(Ⅱ)也被吸附到表面上.
 |
| 图 10 GFCM对As(Ⅲ)去除的机制图 Fig. 10 The proposed possible mechanisms of As(Ⅲ) removal by the GFCM |
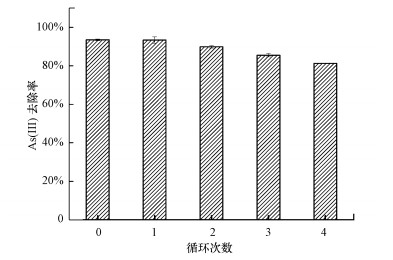
为了有效地评价颗粒状铁铜锰复合氧化物吸附剂的重复使用性能, 对负载As(Ⅲ)的GFCM吸附剂进行脱附再生研究, 实验结果如图 11所示, 初次吸附后As(Ⅲ)的去除率为93.5%, 脱附再生两次后, As(Ⅲ)去除率约为90%.进一步增加脱附再生次数, GFCM吸附剂对As(Ⅲ)的吸附能力有所下降, 但下降幅度不大.再生4次后, As(Ⅲ)的去除率为81.2%, 仍具有较强的砷吸附能力, 推断主要是由于碱液中—OH易与吸附剂表面吸附的砷酸根与亚砷酸根发生离子交换, 吸附质形成溶解性物质, 实现脱附, 吸附剂表面重新带有羟基.而且, 碱性条件下Mn(Ⅱ)易被氧化为Mn(Ⅳ), 再生后吸附剂的空气浴干燥, 也有助于Mn(Ⅱ)的氧化, 使得颗粒状铁铜锰复合氧化物的吸附性能与氧化性能都进行了较好的再生.对于再生废液, 收集浓缩, 加入钙盐, 充分混合, 反应后固液分离, 得到砷酸钙和亚砷酸钙沉淀物回收利用.
 |
| 图 11 GFCM5次循环吸附脱附As(Ⅲ) Fig. 11 As(Ⅲ) adsorption and desorption in five consecutive cycles for the GFCM |
1) 以壳聚糖为黏合剂, 采用包覆法制备的颗粒状铁铜锰复合氧化物对As(Ⅲ)具有良好的吸附性能, 在pH=(7.0 ± 0.1)时, 最大吸附容量为56.5 mg·g-1; 并且在较广泛pH范围(5.0~9.0)内对As(Ⅲ)都有较好去除效果.
2) 阴离子的存在会对As(Ⅲ)在颗粒状铁铜锰复合氧化物上的吸附产生抑制吸附作用, 影响顺序为: PO43- > SiO32- > CO32- > Cl- > SO42-.
3) 实验条件下, 颗粒状铁铜锰复合氧化物经过4次吸附-脱附-再生循环后, 对As(Ⅲ)的去除率为81.2%, 仍具有较强的砷吸附能力.
4) 在As(Ⅲ)的去除过程中, 颗粒状铁铜锰复合氧化物吸附剂中的锰氧化物对于As(Ⅲ)氧化形成As(Ⅴ)起主要作用, 铁氧化物与铜氧化物主要作用是吸附As(Ⅲ)与氧化形成的As(Ⅴ), 且铜氧化物的存在有助于强化复合氧化物组分间协同效应, 拓宽吸附剂的pH适用范围, 增强砷吸附性能.
Andjelkovic I, Jovic B, Jovic M, et al. 2016. Microwave-hydrothermal method for the synthesis of composite materials for removal of arsenic from water[J]. Environmental Science and Pollution Research, 23(1): 469–476.
DOI:10.1007/s11356-015-5283-z
|
Auta M, Hameed B H. 2012. Modified mesoporous clay adsorbent for adsorption isotherm and kinetics of methylene blue[J]. Chemical Engineering Journal, 198-199(4): 219–227.
|
Bissen M, Frimmel F H. 2003. Arsenic-a Review. Part Ⅰ:Occurrence, Toxicity, Speciation, Mobility[J]. Acta hydrochim hydrobiol, 31(1): 9–18.
DOI:10.1002/aheh.200390025
|
Chen J, Wang J, Zhang G, et al. 2018. Facile fabrication of nanostructured cerium-manganese binary oxide for enhanced arsenite removal from water[J]. Chemical Engineering Journal, 334: 1518–1526.
DOI:10.1016/j.cej.2017.11.062
|
Cho D W, Jeon B H, Jeong Y, et al. 2016. Synthesis of hydrous zirconium oxide-impregnated chitosan beads and their application for removal of fluoride and lead[J]. Applied Surface Science, 372: 13–19.
DOI:10.1016/j.apsusc.2016.03.068
|
Dou X, Mohan D, Pittman C U. 2013. Arsenate adsorption on three types of granular schwertmannite[J]. Water Research, 47(9): 2938–2948.
DOI:10.1016/j.watres.2013.01.035
|
Futalan C M, Huang Y, Chen J, et al. 2018. Arsenate removal from aqueous solution using chitosan-coated bentonite, chitosan-coated kaolinite and chitosan-coated sand:parametric, isotherm and thermodynamic studies[J]. Water Science and Technology, 78(3): 676–689.
DOI:10.2166/wst.2018.339
|
付军, 范芳, 李海宁, 等. 2016. 铁锰复合氧化物/壳聚糖珠:一种环境友好型除磷吸附剂[J]. 环境科学, 2016, 37(12): 4882–4890.
|
Gupta A, Chauhan V S, Sankararamakrishnan N. 2009. Preparation and evaluation of iron-chitosan composites for removal of As(Ⅲ) and As(Ⅴ) from arsenic contaminated real life groundwater[J]. Water Research, 43(15): 3862–3870.
DOI:10.1016/j.watres.2009.05.040
|
Habuda-Stanic M, Nujic M. 2015. Arsenic removal by nanoparticles:a review[J]. Environmental Science and Pollution Research, 22(11): 8094–8123.
DOI:10.1007/s11356-015-4307-z
|
Hou J, Luo J, Song S, et al. 2017. The remarkable effect of the coexisting arsenite and arsenate species ratios on arsenic removal by manganese oxide[J]. Chemical Engineering Journal, 315: 159–166.
DOI:10.1016/j.cej.2016.12.115
|
Jain N, Chandramani S. 2018. Arsenic poisoning-An overview[J]. Indian Journal of Medical Specialities, 178: 1–3.
|
Jia Y, Xi B, Jiang Y, et al. 2018. Distribution, formation and human-induced evolution of geogenic contaminated groundwater in China:A review[J]. Science of the Total Environment, 643: 967.
DOI:10.1016/j.scitotenv.2018.06.201
|
Khan S A, Khan S B, Kamal T, et al. 2016. Antibacterial nanocomposites based on chitosan/Co-MCM as a selective and efficient adsorbent for organic dyes[J]. International Journal of Biological Macromolecules, 91: 744–751.
DOI:10.1016/j.ijbiomac.2016.06.018
|
Lata S, Samadder S R. 2016. Removal of arsenic from water using nano adsorbents and challenges:A review[J]. Journal of Environmental Management, 166: 387–406.
DOI:10.1016/j.jenvman.2015.10.039
|
Lenoble V, Laclautre C, Serpaud B, et al. 2004. As(Ⅴ) retention and As(Ⅲ) simultaneous oxidation and removal on a MnO2-loaded polystyrene resin[J]. Science of the Total Environment, 326(1/3): 197–207.
|
李海宁, 陈静, 李秋梅, 等. 2016. 铁锰复合氧化物包覆海砂的吸附除磷研究[J]. 环境科学学报, 2016, 36(3): 880–886.
|
Li X, He K, Pan B, et al. 2012. Efficient As(Ⅲ) removal by macroporous anion exchanger-supported Fe-Mn binary oxide:Behavior and mechanism[J]. Chemical Engineering Journal, 193-194(3): 131–138.
|
Lin L, Zhang G, Liu X, et al. 2019. Synthesis and adsorption of Fe-Mn-La-impregnated biochar composite as an adsorbent for As(lll) removal from aqueous solutions[J]. Environmental Pollution, 247: 128–135.
DOI:10.1016/j.envpol.2019.01.044
|
马玉玲, 马杰, 陈雅丽, 等. 2018. 水铁矿及其胶体对砷的吸附与吸附形态[J]. 环境科学, 2018, 1: 179–186.
|
Miller S M, Spaulding M L, Zimmerman J B. 2011. Optimization of capacity and kinetics for a novel bio-based arsenic sorbent, TiO2-impregnated chitosan bead[J]. Water Research, 45(17): 5745–5754.
DOI:10.1016/j.watres.2011.08.040
|
Pintor A M A, Vieira B R C, Santos S C R, et al. 2018. Arsenate and arsenite adsorption onto iron-coated cork granulates[J]. Science of The Total Environment, 642(15): 1075–1089.
|
Qi J, Zhang G, Li H. 2015. Efficient removal of arsenic from water using a granular adsorbent:Fe-Mn binary oxide impregnated chitosan bead[J]. Bioresource Technology, 193: 243–249.
DOI:10.1016/j.biortech.2015.06.102
|
Rodríguezlado L, Sun G, Berg M, et al. 2013. Groundwater arsenic contamination throughout China[J]. Science, 341(6148): 866–868.
DOI:10.1126/science.1237484
|
Sargun I, Kaya M, Arslan G, et al. 2015. Preparation and characterisation of biodegradable pollen-chitosan microcapsules and its application in heavy metal removal[J]. Bioresource Technology, 177: 1–7.
DOI:10.1016/j.biortech.2014.11.067
|
Wang H, Wang Y, Sun Y, et al. 2018. Differences in Sb(Ⅴ) and As(Ⅴ) adsorption onto a poorly crystalline phyllomanganate (δ-MnO2):Adsorption kinetics, isotherms, and mechanisms[J]. Process Safety and Environmental Protection, 113: 40–47.
DOI:10.1016/j.psep.2017.09.015
|
Wang M, Yu X, Yang C, et al. 2017. Removal of fluoride from aqueous solution by Mg-Al-Zr triple-metal composite[J]. Chemical Engineering Journal, 322: 246–253.
DOI:10.1016/j.cej.2017.03.155
|
Wang T, Yang W, Song T, et al. 2015. Cu doped Fe3O4 magnetic adsorbent for arsenic:synthesis, property, and sorption application[J]. RSC Advances, 5: 50011–50018.
DOI:10.1039/C5RA03951G
|
王文凯, 阎莉, 段晋明, 等. 2017. 二氧化钛滤柱对高砷污酸废水的吸附去除[J]. 环境工程学报, 2017, 11(3): 1322–1328.
|
吴秋月, 陈静, 张伟, 等. 2015. 新型纳米结构铈锰复合氧化物的磷吸附行为与机制研究[J]. 环境科学学报, 2015, 35(6): 1824–1832.
|
Wu X, Zhang Y, Dou X, et al. 2013. Fluoride adsorption on an Fe-Al-Ce trimetal hydrous oxide:Characterization of adsorption sites and adsorbed fluorine complex species[J]. Chemical Engineering Journal, 223: 364–370.
DOI:10.1016/j.cej.2013.03.027
|
杨程, 刘德晔, 常青. 2015. 南通地区地下水中砷的形态分布特征研究[J]. 环境监测管理与技术, 2015, 6: 26–29.
|
杨雪, 陈静, 李秋梅, 等. 2018. 新型铁铜铝三元复合氧化物除磷性能与机制研究[J]. 环境科学学报, 2018, 38(2): 501–510.
|
Yang X, Li Y, Gao H, et al. 2018. One-step fabrication of chitosan-Fe(OH)3, beads for efficient adsorption of anionic dyes[J]. International Journal of Biological Macromolecules, 117: 30–41.
DOI:10.1016/j.ijbiomac.2018.05.137
|
曾辉平, 吕赛赛, 杨航, 等. 2018. 铁锰泥除砷颗粒吸附剂对As(Ⅴ)的吸附去除[J]. 环境科学, 2018, 1: 170–178.
|
Zhang G, Fan F, Li X, et al. 2018. Superior adsorption of thallium(Ⅰ) on titanium peroxide:Performance and mechanism[J]. Chemical Engineering Journal, 331: 471–479.
DOI:10.1016/j.cej.2017.08.053
|
Zhang G, Khorshed A, Paul C J. 2013. Simultaneous removal of arsenate and arsenite by a nanostructured zirconium-manganese binary hydrous oxide:Behavior and mechanism[J]. Journal of Colloid and Interface Science, 397: 137–143.
DOI:10.1016/j.jcis.2012.11.056
|
Zhang G, Liu F, Liu H, et al. 2014. Respective role of Fe and Mn Oxide contents for arsenic sorption in iron and manganese binary oxide:An X-ray absorption spectroscopy investigation[J]. Environmental Science & Technology, 48(17): 10316–10322.
|
Zhang G, Liu H, Liu R, et al. 2009. Adsorption behavior and mechanism of arsenate at Fe-Mn binary oxide/water interface[J]. Journal of Hazardous Materials, 168(2/3): 820–825.
|
Zhang G, Ren Z, Zhang X, et al. 2013. Nanostructured iron(Ⅲ)-copper(Ⅱ) binary oxide:A novel adsorbent for enhanced arsenic removal from aqueous solutions[J]. Water Research, 47(12): 4022–4031.
DOI:10.1016/j.watres.2012.11.059
|
张伟, 陈静, 张高生. 2014. 铁镧复合氧化物纳米吸附剂的制备、表征及As(Ⅲ)吸附性能研究[J]. 环境科学, 2014, 35(11): 4198–4204.
|
仲艳, 王建燕, 陈静, 等. 2018. 制备方法对铁钛复合氧化物磷吸附性能的影响:共沉淀法与机械物理混合法[J]. 环境科学, 2018, 39(7): 3230–3239.
|
 2019, Vol. 39
2019, Vol. 39


