2. 挥发性有机物污染治理技术与装备国家工程实验室, 广州 510006;
3. 广东省大气环境与污染控制重点实验室, 广州 510006
2. National Engineering Laboratory for VOCs Pollution Control Technology and Equipment, Guangzhou 510006;
3. Guangdong Provincial Key Laboratory of Atmospheric Environment and Pollution Control, Guangzhou 510006
近年来, 低温等离子体技术被广泛应用于低浓度挥发性有机物(VOCs)的治理, 该技术在常温常压下即可去除VOCs, 具有反应快、操作简单等优点(Klett et al., 2014).但单独的低温等离子体技术存在能量利用效率低、CO2选择性低、易产生二次污染等问题, 许多研究尝试将催化剂与等离子体结合, 形成等离子体催化技术, 通过等离子体与催化剂之间的协同效应提高反应效率并减少副产物的产生(Wu et al., 2014).其中, 金属氧化物催化剂如Mn(Li et al., 2014)、Co(Xu et al., 2017)、Ni(Xu et al., 2016)、Cu(Zheng et al., 2017)、Fe(Youn et al., 2018)、Ce(Jia et al., 2018)等, 因具有价格便宜、催化活性高和选择性高等优势被广泛应用于等离子体催化体系中(Guo et al., 2015).近几年的研究发现, 稀土氧化物CeO2应用于等离子体中可提高VOCs的完全氧化程度.例如, Sultana等(2015)发现CeO2协同等离子体催化降解三氯乙烯, 可以有效提高碳氧化物的选择性, 抑制氯化副产物产生.Jia等(2018)研究表明, CeO2可分解等离子体区域中的O3产生大量活性氧原子, 进而提高甲苯的转化率和CO2选择性.Zhu等(2017b)研究发现, Ce掺杂的La0.8Ce0.2MnO3催化剂显示出最高的乙酸乙酯转化率(94.2%)和CO2选择性(54.4%), 其次是Sr、Ca、Mg和Ba掺杂的LaMnO3催化剂.由于不同形貌的CeO2暴露不同活性的晶面, 其表面氧空位形成能和储氧能力等性质存在显著差异, 最终影响CeO2的催化活性(Huang et al., 2014).因此, 有必要选择形貌合适的CeO2以优化等离子体-CeO2催化体系的性能.
在等离子体催化体系中, VOCs的氧化同时发生在等离子体放电区域及催化剂表面, 前者主要涉及电子、自由基等活性物种对VOCs的碰撞反应, 后者表面催化反应机制取决于催化剂的特性, 不同催化剂往往表现出显著的活性差异.活性氧物种在催化剂表面的变化过程与VOCs的氧化密切相关(Chang et al., 2018), 这些活性氧物种可能是催化剂本身的表面活性氧物种, 也可能是等离子体区域的O3、O2、含氧自由基等通过吸附活化转变产生的.Jia等(2018)认为催化剂表面起作用的活性氧物种来自于催化剂本身的活性氧或是等离子体区域的O3和活性氧原子.Mao等(2018)用原位红外测出O3在CeO2催化剂上分解会产生O22-、O2-等活性氧物种, 这些活性氧物种参与苯的氧化, 证明了O3在CeO2协同等离子体催化体系中发挥着重要的作用.很多学者对催化剂在等离子体中的表面活性氧来源及作用进行了研究, 并有不同的推测, 但未有通过实验来确定各来源的氧物种对于提高表面催化性能的具体贡献值的报道.通过贡献值研究将有助于深入理解等离子体协同CeO2降解VOC的反应机理, 明确主要活性氧物种的来源与作用, 指导科研人员从催化剂设计角度进一步提升系统性能.
基于此, 本研究制备了3种形貌的CeO2催化剂, 考察其协同等离子体催化氧化甲醇的反应性能.同时, 通过设计系列实验(甲醇-TPD、有无O2条件下甲醇常温催化、催化剂内后置比较、O3催化氧化等), 探究CeO2在等离子体场内的表面活性氧物种来源与作用.
2 实验部分(Experimental part) 2.1 材料制备3种形貌CeO2的制备方法参考前期研究(廖银念, 2013), CeO2纳米棒以醋酸铈Ce(CH3COO)3·H2O为铈源, 纳米颗粒和纳米立方体以硝酸铈Ce(NO3)3·6H2O为铈源, 分别溶于不同浓度的氢氧化钠(NaOH)水溶液中, 混合搅拌后转移到100 mL反应釜中利用水热合成法制备而成.
2.2 材料表征BET使用美国Micromeritics公司的ASAP 2020 M全自动表面分析仪测定, 测之前将100 mg样品在120 ℃下脱气4 h;SEM使用德国MERLIN公司的Carl Zeiss观测;表面氧空位使用法国HYJ公司的LabRAM Aramis型拉曼光谱仪进行Raman测试, 使用325 nm UV光源, 扫描范围为300~800 cm-1;催化剂表面氧物种类型使用美国Micromeritics AutoChem 2920全自动程序升温化学吸附仪进行O2-TPD测试, 样品在He(30 mL·min-1)气氛下, 350 ℃吹扫1 h后降至60 ℃, 再通入20% O2/He(20 mL·min-1)吸附平衡后用He吹扫1 h, 以10 ℃·min-1升温速率从60 ℃升到800 ℃, 记录升温过程中脱附的O2量.
2.3 等离子体催化性能评价等离子体催化性能评价装置如图 1所示, 反应在常温常压下进行.反应器采用线筒式介质阻挡(DBD)放电, 高压极为直径2 mm的不锈钢棒, 接地极用铁网缠绕.高低压电极间距为3 mm, 放电长度为35 mm.反应器电源为南京苏曼CTP-2000K交流电源, 频率为1.968 kHZ, 外接普源示波器DS-1052E测试放电特性, 用利萨如方法计算DBD反应器放电功率P(W), 计算公式如下:
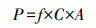
|
(1) |
 |
| 图 1 实验装置示意图 Fig. 1 Schematic diagram of the experimental setup |
式中, f为放电频率(1.968 kHZ), C为电容(0.47 μF), A为利萨如面积.
气体总流速、甲醇浓度和催化剂用量分别为100 mL·min-1、446 ppm和100 mg, N2和O2的比例为4:1, 反应前后的气体成分和浓度用气相色谱仪(凡上海伟仪器设备有限公司)分析, 甲醇转化率(RM)和CO2选择性(S)计算公式如下所示:
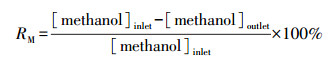
|
(2) |
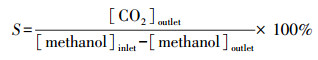
|
(3) |
式中, [methanol]和[CO2]分别为甲醇和CO2浓度(ppm).
2.4 催化剂表面活性氧物种来源探究为探究CeO2在没有外界O2存在时能否氧化甲醇, 进行了甲醇-TPD实验, 将催化剂放置于石英玻璃管内, 在110 ℃条件下用N2吹扫30 min后降至室温, 通入446 ppm甲醇/N2在室温下吸附至饱和状态, 再用N2吹扫60 min, 并在N2气氛下以5 ℃·min-1的升温速率从30 ℃升到450 ℃, 用Hidden HPR-20质谱仪跟踪尾气的甲醇和CO2信号变化.针对O2的影响, 开展了甲醇在不同背景气下的常温催化反应, 分别通入446 ppm甲醇/N2和甲醇/空气与催化剂进行反应;针对等离子体场内短寿命活性物种的影响, 设计了催化剂内置方式(IPC)和后置方式(PPC)实验, 后置方式即把催化剂放置在距离放电区域约5 cm的位置, 其他测试条件与2. 3节实验一致;针对O3的影响进行了O3分解和O3催化氧化实验.将650 ppm O3/N2通入到不同形貌的CeO2中, 用O3分析仪检测反应前后O3浓度, O3分解性能(OC)计算公式如式(4)所示.O3催化氧化实验即在常温下通入650 ppm O3和100 ppm甲醇与CeO2反应.以上实验催化剂用量均为100 mg, 气体流量为100 mL·min-1.除了甲醇-TPD实验, 其他实验均用气相色谱检测反应前后的甲醇和CO2浓度变化.

|
(4) |
式中, [O3]为O3浓度(ppm).
3 结果与讨论(Results and discussion) 3.1 材料表征表 1列出了不同形貌CeO2的比表面积和孔容.CeO2纳米棒具有最大的比表面积和孔容, 这可能有利于反应物种与催化剂表面之间的接触, 并促进甲醇在等离子体催化系统中的氧化.
| 表 1 CeO2催化剂的BET比表面积 Table 1 BET of the CeO2 catalysts |
所合成的CeO2材料形貌如图 2所示.纳米棒的宽度为(22±2) nm, 长度在400~500 nm之间, 纳米颗粒直径大多在30~40 nm之间, 纳米立方体的粒径约为250 nm.很明显, 3种CeO2纳米晶体都具有预期的形貌.
 |
| 图 2 不同形貌CeO2的SEM图(a.纳米棒; b.纳米颗粒; c.纳米立方体) Fig. 2 SEM images of the CeO2 catalysts with different morphology (a.rod, b.particle, c.cube) |
对于CeO2催化剂, 其表面氧空位作为表面缺陷经常是催化反应的活性位点(Lin et al., 2018; He et al., 2018).图 3为3种形貌CeO2的紫外拉曼谱图, 可以看到所有催化剂在200~800 cm-1间都有两个紫外拉曼峰, 458 cm-1处归属于CeO2立方萤石结构的F2g对称伸缩振荡峰, 592 cm-1处的峰D与CeO2晶格中Ce3+的存在而形成的氧空位有关(Peng et al., 2016).氧空位与立方萤石结构的特征峰积分强度比(ID/IF2g)反映了氧空位的相对浓度.结果表明, 3种形貌CeO2的表面氧空位浓度大小顺序为纳米棒>纳米颗粒>纳米立方体.
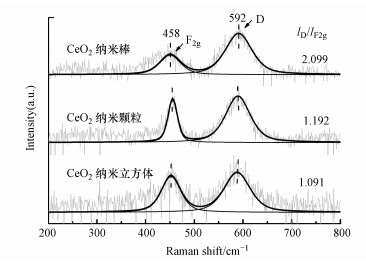 |
| 图 3 CeO2催化剂的UV Raman谱图 Fig. 3 UV Raman patterns of the CeO2 catalysts |
图 4为不同CeO2的O2-TPD实验结果, 一般而言, O2在催化剂上吸附后会经过以下变化:O2(ads)→O2-(ads)→O-(ads)→O2-(latt)(Li et al., 2011).100 ℃附近的峰归结于O2-(ads), 300~400 ℃的峰为O-(ads), 二者都归为表面脱附氧(Bielański et al., 1979), 600 ℃以上的脱附峰反映了晶格氧的脱附.从图可以看出, 纳米棒的表面脱附氧量远大于纳米颗粒和纳米立方体, 说明纳米棒含有更多的表面吸附氧物种.表面吸附氧的量与催化剂材料中氧空位的充满度相关(Forni et al., 2002; Wang et al., 2017), 由此可推测纳米棒表面存在更丰富的氧空位.这与拉曼光谱的分析结果是一致的.
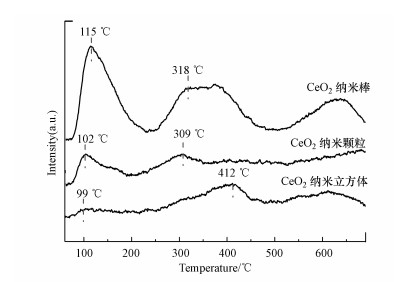 |
| 图 4 CeO2催化剂的O2-TPD谱图 Fig. 4 The O2-TPD pattern of the CeO2 catalysts |
图 5为3种形貌CeO2协同等离子体催化降解甲醇的性能评价结果.无催化剂时, 甲醇转化率和CO2选择性均较低.这是因为在单独等离子体中, VOCs的降解过程主要是活性物种的碰撞导致的, 反应无选择性, 表现为能量效率低、副产物多(Jõgi et al., 2014).当CeO2放置到等离子体区域后, 反应性能大大提高, 且不同形貌CeO2在等离子体中的催化性能不同, 排序为:纳米棒>纳米颗粒>纳米立方体.CeO2纳米棒呈现出最高的甲醇转化率(94.1%)和CO2选择性(90.1%), 说明纳米棒可促进更多的甲醇深度氧化为CO2.Peng等(2016)研究了3种形貌CeO2热催化降解甲苯, 同样发现纳米棒表现出最好的催化性能, 其原因是纳米棒存在更多的氧空位, 有利于气相O2在氧空位上吸附活化, 从而形成更多的表面活性氧物种.而在等离子体催化体系中, 影响催化活性的因素很多.物理方面, 将催化剂引入到等离子体区域改变了输入能量和放电特性, 从而影响到等离子体的化学反应特性;化学方面, 不同催化剂在等离子体中的表面供氧能力不同, 这些表面活性氧物种包括放电前催化剂本身存在的表面活性氧物种, 以及放电时CeO2对各种含氧物种(包括含氧自由基、O2、O3等)的吸附活化产生的物种(Li et al., 2014; Jia et al., 2016; Zhu et al., 2017a).
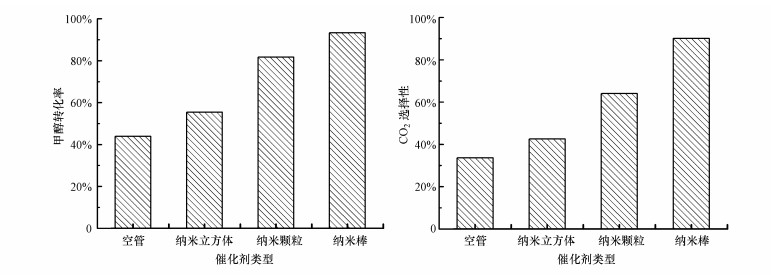 |
| 图 5 甲醇在等离子体催化和单独等离子体体系下的降解性能(a.甲醇转化率; b.CO2选择性) Fig. 5 Methanol oxidation in plasma-catalytic systems and plasma alone (a.methanol conversion, b.CO2 selectivity) |
为了排除CeO2催化剂对等离子体输入能量和放电特性的影响, 考察了空管放电和协同催化剂放电的利萨如曲线(图 6a)和电压电流情况(图 6b).从图 6a可以看出, 两种体系放电的利萨如图面积相近, 计算得到的功率均为0.056 W, 说明CeO2引入等离子体区域几乎没有改变能量输入.Feng等(2018)研究发现, 钛酸钡由于具有高介电常数, 在等离子体场中表面局部场强增大, 从而产生了更多高能电子和活性自由基.而CeO2的介电常数远小于钛酸钡, 因此, 对等离子体区域的放电影响不明显.放电电压电流是反映等离子体放电变化的主要参数(Song et al., 2018), 因此, 图 6b进一步给出了DBD反应器的电压电流图, 电流尖峰表明这是典型的丝状放电, 放电电流尖峰时短时长说明等离子体微放电不是一个绝对稳定的状态.加入催化剂后, 放电丝长度没有显著变化, 说明CeO2几乎没有改变等离子体的放电特性, 且本研究中3种形貌CeO2的电压电流图几乎一致, 意味着等离子体区域产生的能量电子及活性自由基数量应相近.可以推测, CeO2协同等离子体催化降解甲醇时, 表面催化机制尤其是表面活性氧物种的差异是影响催化活性的主要原因.针对CeO2催化剂在等离子体中如何提供表面活性氧物种, 进而提高表面催化活性还需要进一步深入研究.
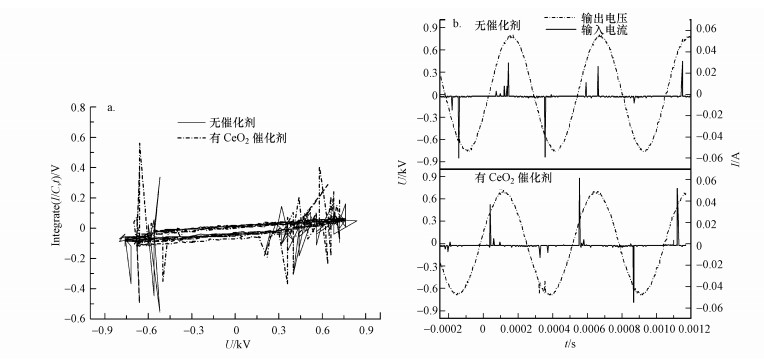 |
| 图 6 DBD反应器在不同体系下的利萨如曲线(a)和放电特性(b) Fig. 6 Lissajous curves (a) and typical voltage, current waveforms (b) for DBD reactors |
为了研究CeO2本身表面活性氧物种的作用, 进行了甲醇-TPD实验(吸附过程背景气为甲醇/N2).从图 7a可以发现, 随着温度的升高, 所有样品在100 ℃以内都出现了甲醇脱附峰, 甲醇在CeO2纳米棒上的脱附量最大, 可能是由于其比表面积最大, 有利于吸附更多的甲醇.纳米棒上甲醇起始脱附温度最高, 说明甲醇与其结合更为紧密.图 7b为甲醇-TPD过程的CO2信号变化, 所有样品都出现了CO2峰, 说明CeO2催化剂在没有气相氧存在的情况下对甲醇进行了氧化, 起到氧化作用的物种可能是催化剂本身存在的表面活性氧物种(Yao et al., 2018).Wu等(2012)发现甲醇吸附在CeO2上使紫外拉曼谱图的D峰发生了红移, 这个红移现象归因于氧空位增加(Wu et al., 2010; Lee et al., 2011).由此可推测甲醇吸附在CeO2表面会消耗部分氧物种, 使得表面氧空位增加.CeO2纳米棒产生的CO2量最多, 有更多的表面活性氧物种被消耗, 说明纳米棒上存在更多的表面活性氧物种, 这与O2-TPD的结果一致.由此说明在等离子体催化体系下, CeO2本身表面活性氧物种可对部分甲醇起到氧化作用.
 |
| 图 7 不同CeO2的甲醇TPD谱图(a.甲醇, b.CO2) Fig. 7 The methanol-TPD pattern of the CeO2 catalysts |
为了研究CeO2在常温常压下是否具有活化O2的作用, 设计了有无O2条件下CeO2纳米棒常温催化氧化甲醇的实验, 结果如图 8所示.从图 8可以看出, 两种背景气氛下甲醇吸附在CeO2上产生的CO2量几乎相同, 说明CeO2在常温下不会大量吸附活化气相O2.结合O2-TPD发现O2的吸附活化需要在较高温度(大于100 ℃)下实现, 本实验整个低温等离子体气体温度接近室温条件(25 ℃), 此温度达不到活化O2所需要的能量.这与一些学者的观点不一致, 例如, Yao等(2018)认为等离子体放电下O2可以参与钴锰催化剂对己醛的表面催化反应;Yi等(2017)认为Co3O4容易将O2吸附活化为O-和O2-, 这些活性氧物种有利于在等离子体中催化降解甲苯.由此本研究推测, 由于等离子体场内高能电子(温度高达105 K(Schiavon et al., 2017))的作用, 可能会使催化剂表面产生局部的高温, 进而引发CeO2吸附活化O2.
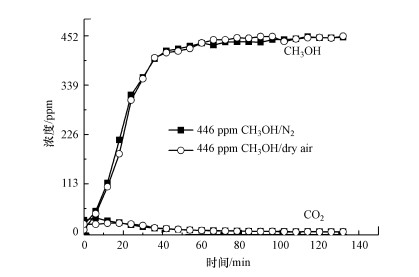 |
| 图 8 不同背景气氛中甲醇在CeO2纳米棒上的常温催化反应 Fig. 8 Methanol oxidation over CeO2 rod in different background gas at room temperature |
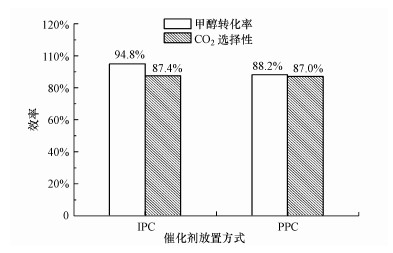
当催化剂内置时(IPC), 一些短寿命物种扩散到催化剂表面, 参与表面催化反应.当催化剂后置时(PPC), 只剩下长寿命物种如O3和NOx会参与催化反应.通过比较干空和O2/He条件下的放电性能, 发现污染物转化率和选择性相近, 因此, 可基本排除含氮物种的影响.为了解短寿命物种(包括含氧自由基)的作用, 对内置和后置两种方式的系统性能进行比较, 结果如图 9所示.内置方式甲醇转化率(94.8%)相比于后置方式下提高了6.6%, 两个系统的CO2选择性相近.Roland等(2002)认为等离子体区域产生的短寿命物种(O(1D)、O(3P)、OH等)有可能作用于催化剂表面, 一方面是因为催化剂的表面吸附作用可能会延长这些活性物种的寿命, 另一方面是由于强电场的存在, 短寿命物种可直接在催化剂孔道内产生.由此推测, 在内置方式中, 少部分等离子体区域的短寿命物种可参与CeO2表面催化反应.同时观察到后置方式甲醇降解效果显著, 其甲醇转化率和CO2选择性分别高达88.2%和87%, 说明长寿命物种O3在等离子体催化体系中发挥着重要的作用.
 |
| 图 9 催化剂不同放置位置对反应性能的影响 Fig. 9 Effect of different placement positions of the catalyst on performance of the plasma-catalytic system |
以干空为背景气的条件下, 等离子体放电不可避免地会产生O3, 过渡金属氧化物可以分解O3产生氧分子和其他的活性氧物种(Jia et al., 2016), 这些活性氧物种相比于O3有更强的氧化能力, 可以有效分解VOCs及其中间产物(Li et al., 2014).因此, 有必要研究不同形貌催化剂对O3的分解情况, 结果如图 10所示, 纳米棒、纳米颗粒和纳米立方体的O3转化率分别为100%、75%和10%, 其中, CeO2纳米棒分解O3的性能最好.这可能是由于CeO2纳米棒存在更多的氧空位, O3吸附在氧空位上, 继而生成表面氧物种, 促进甲醇的深度氧化(Zhu et al., 2017c; Mao et al., 2018).
 |
| 图 10 不同CeO2催化剂的O3分解性能 Fig. 10 Ozone conversion on various CeO2 catalysts |
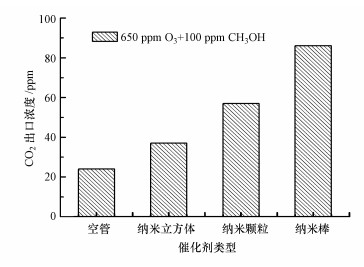
为了进一步证实O3对甲醇的深度氧化能力, 开展了O3催化氧化甲醇实验, 产物CO2的产生量如图 11所示.不同形貌CeO2协同O3催化氧化100 ppm甲醇时, 反应约1 h后纳米棒、纳米颗粒、纳米立方体和空管的出口CO2浓度分别为87、57、37和24 ppm.其中, 纳米棒展现出最好的O3催化氧化活性, 其CO2选择性高达87%, 结合O3分解实验可推测CeO2纳米棒为甲醇的O3催化氧化提供了更多的活性氧物种, 由此提高了甲醇的深度氧化能力.对比甲醇常温催化反应图 8可以发现, O3的催化作用远大于CeO2催化剂本身活性氧物种.这可能是由于催化剂本身的表面活性氧物种量相对有限, 维持其催化活性需要不断地补充大量的气相O3.在等离子体催化甲醇性能评价中, 不同形貌CeO2(纳米立方体、纳米颗粒、纳米棒)出口的臭氧浓度分别为645、234、118 ppm, 说明CeO2纳米棒可以大量消耗等离子体区域产生的O3, 活化为表面活性氧物种, 最终促进表面催化活性(Naydenov et al., 1995; Jia et al., 2018; Mao et al., 2018).
 |
| 图 11 常温下O3催化氧化100 ppm甲醇的CO2产生量 Fig. 11 Amount of CO2 produced in ozone catalytic oxidation of 100 ppm of CH3OH |
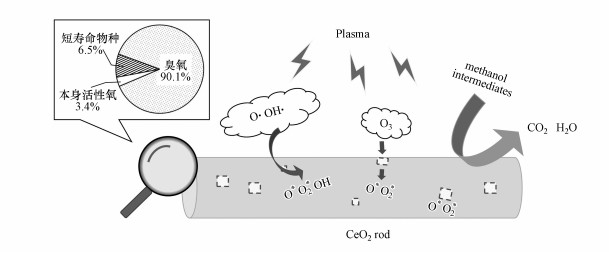
以上分析表明, 催化剂本身存在的活性氧物种和等离子体产生的O3、短寿命物种都参与了表面催化作用.分别计算各部分活性物种催化降解相同浓度的甲醇产生的CO2量(446 ppm甲醇/N2反应1 h后产生15 ppm CO2, 这部分CO2相当于催化剂本身活性氧物种的作用;等离子体放电下比较催化剂内置方式和后置方式产生的CO2量, 内置方式CO2浓度增加了28 ppm, 这部分CO2相当于短寿命活性物种表面催化作用;446 ppm甲醇/O3反应并扣除气相部分影响可得到388 ppm CO2, 这部分CO2相当于O3产生的表面活性氧物种的作用, 估算各部分CO2比例可得到表面活性氧物种各部分来源对提高表面催化性能的贡献值), 结果如图 12所示.可以发现, 在3种来源中O3贡献比例高达90.1%, 说明O3在CeO2上分解产生的活性氧物种是CeO2表面甲醇氧化的主要物种.
 |
| 图 12 等离子体催化降解甲醇的表面活性氧各部分来源贡献值及催化作用 Fig. 12 Relative importance and catalytic oxidation mechanism of different sources of surface active oxygen on plasma-catalytic removal of methanol |
等离子体区域的O3可在氧化铈的氧空位上分解产生表面活性氧物种(Mao et al., 2018), 这些活性氧物种与表面吸附的甲醇和不完全产物(包括甲醛、甲酸等)反应(Norsic et al., 2016; Zhu et al., 2016; Norsic et al., 2018), 从而促进了甲醇转化和深度氧化(图 12)(Wang et al., 2017; Jia et al., 2018).CeO2纳米棒由于存在更多的表面氧空位, 导致O3分解产生更多的表面活性氧物种, 最终促进其在等离子体中的表面催化活性.
4 结论(Conclusions)1) CeO2几乎没有改变等离子体的放电特性, 说明催化剂的作用是等离子体催化系统性能提升的主要因素, 而表面活性氧物种的存在直接影响其催化活性.CeO2在等离子体中的表面活性氧物种包括催化剂自身存在的活性氧物种, 还有等离子体区域的短寿命物种和长寿命物种(O3等)吸附活化后产生, 其中, O3在催化剂表面分解产生的活性氧物种是性能提高的主要因素.
2) 相对于CeO2纳米颗粒和纳米立方体, 纳米棒协同等离子体催化降解甲醇的性能最优.原因是CeO2纳米棒存在更多的氧空位, 能有效利用等离子体区域的O3, 产生更多的表面活性氧物种, 从而提高催化性能.
Bielański A, Haber J. 1979. Oxygen in catalysis on transition metal oxides[J]. Catalysis Reviews:Science and Engineering, 19(1): 1–41.
|
Chang T, Shen Z, Huang Y, et al. 2018. Post-plasma-catalytic removal of toluene using MnO2-Co3O4 catalysts and their synergistic mechanism[J]. Chemical Engineering Journal, 348: 15–25.
DOI:10.1016/j.cej.2018.04.186
|
Feng X, Liu H, He C, et al. 2018. Synergistic effects and mechanism of a non-thermal plasma catalysis system in volatile organic compound removal:a review[J]. Catalysis Science & Technology, 8(4): 936–954.
|
Forni L, Rossetti I. 2002. Catalytic combustion of hydrocarbons over perovskites[J]. Applied Catalysis B:Environmental, 38(1): 29–37.
DOI:10.1016/S0926-3373(02)00024-3
|
Guo Y, Liao X, Fu M, et al. 2015. Toluene decomposition performance and NOx by-product formation during a DBD-catalyst process[J]. Journal of Environmental Sciences, 28: 187–194.
DOI:10.1016/j.jes.2014.06.048
|
Huang W, Gao Y. 2014. Morphology-dependent surface chemistry and catalysis of CeO2 nanocrystals[J]. Catalysis Science & Technology, 4(11): 3772–3784.
|
He H, Lin X, Li S, et al. 2018. The key surface species and oxygen vacancies in MnOx(0.4)-CeO2 toward repeated soot oxidation[J]. Applied Catalysis B:Environmental, 223: 134–142.
DOI:10.1016/j.apcatb.2017.08.084
|
Jia J, Zhang P, Chen L. 2016. Catalytic decomposition of gaseous ozone over manganese dioxides with different crystal structures[J]. Applied Catalysis B:Environmental, 189: 210–218.
DOI:10.1016/j.apcatb.2016.02.055
|
Jia Z, Wang X, Foucher E, et al. 2018. Plasma-catalytic mineralization of toluene adsorbed on CeO2[J]. Catalysts, 8(8).
DOI:10.3390/catal8080303
|
Jia Z, Amar M B, Yang D, et al. 2018. Plasma catalysis application of gold nanoparticles for acetaldehyde decomposition[J]. Chemical Engineering Journal, 347: 913–922.
DOI:10.1016/j.cej.2018.04.106
|
Jõgi I, Haljaste A, Laan M. 2014. Hybrid TiO2 based plasma-catalytic reactors for the removal of hazardous gasses[J]. Surface and Coatings Technology, 242: 195–199.
DOI:10.1016/j.surfcoat.2013.10.016
|
Klett C, Duten X, Tieng S, et al. 2014. Acetaldehyde removal using an atmospheric non-thermal plasma combined with a packed bed:Role of the adsorption process[J]. Journal of Hazardous Materials, 279: 356–364.
DOI:10.1016/j.jhazmat.2014.07.014
|
Li J, Na H, Zeng X, et al. 2014. In situ DRIFTS investigation for the oxidation of toluene by ozone over Mn/HZSM-5, Ag/HZSM-5 and Mn-Ag/HZSM-5 catalysts[J]. Applied Surface Science, 311: 690–696.
DOI:10.1016/j.apsusc.2014.05.138
|
Li P, He C, Cheng J, et al. 2011. Catalytic oxidation of toluene over Pd/Co3AlO catalysts derived from hydrotalcite-like compounds:Effects of preparation methods[J]. Applied Catalysis B:Environmental, 101(3/4): 570–579.
|
Li Y, Fan Z, Shi J, et al. 2014. Post plasma-catalysis for VOCs degradation over different phase structure MnO2 catalysts[J]. Chemical Engineering Journal, 241: 251–258.
DOI:10.1016/j.cej.2013.12.036
|
廖银念.2013.铈基金属氧化物催化氧化甲苯的形貌及尺寸效应[D].广州: 华南理工大学.128
http://cdmd.cnki.com.cn/Article/CDMD-10561-1014153382.htm |
Lin X, Li S, He H, et al. 2018. Evolution of oxygen vacancies in MnOx-CeO2 mixed oxides for soot oxidation[J]. Applied Catalysis B:Environmental, 223: 91–102.
DOI:10.1016/j.apcatb.2017.06.071
|
Lee Y, He G, Akey A J, et al. 2011. Raman analysis of mode softening in nanoparticle CeO2-δ and Au-CeO2-∂ during CO oxidation[J]. Journal of the American Chemical Society, 133(33): 12952–12955.
DOI:10.1021/ja204479j
|
Mao L, Chen Z, Wu X, et al. 2018. Plasma-catalyst hybrid reactor with CeO2/γ-Al2O3 for benzene decomposition with synergetic effect and nano particle by-product reduction[J]. Journal of Hazardous Materials, 347: 150–159.
DOI:10.1016/j.jhazmat.2017.12.064
|
Norsic C, Tatibouët J M, Batiot-Dupeyrat C, et al. 2018. Methanol oxidation in dry and humid air by dielectric barrier discharge plasma combined with MnO2-CuO based catalysts[J]. Chemical Engineering Journal, 347: 944–952.
DOI:10.1016/j.cej.2018.04.065
|
Norsic C, Tatibouët J M, Batiot-Dupeyrat C, et al. 2016. Non thermal plasma assisted catalysis of methanol oxidation on Mn, Ce and Cu oxides supported on γ-Al2O3[J]. Chemical Engineering Journal, 304: 563–572.
DOI:10.1016/j.cej.2016.06.091
|
Naydenov A, Stoyanova R, Mehandjiev D. 1995. Ozone decomposition and CO oxidation on CeO2[J]. Journal of Molecular Catalysis A:Chemical, 98(1): 9–14.
DOI:10.1016/1381-1169(94)00060-3
|
Peng R, Sun X, Li S, et al. 2016. Shape effect of Pt/CeO2 catalysts on the catalytic oxidation of toluene[J]. Chemical Engineering Journal, 306: 1234–1246.
DOI:10.1016/j.cej.2016.08.056
|
Roland U, Holzer F, Kopinke F D. 2002. Improved oxidation of air pollutants in a non-thermal plasma[J]. Catalysis Today, 73(3/4): 315–323.
|
Schiavon M, Torretta V, Casazza A, et al. 2017. Non-thermal plasma as an innovative option for the abatement of volatile organic compounds:a review[J]. Water, Air, & Soil Pollution, 228(10).
DOI:10.1007/s11270-017-3574-3
|
Sultana S, Vandenbroucke A M, Mora M, et al. 2015. Abatement of trichloroethylene by combined use of non-thermal plasma and CeO2[J]. Studies, 8: 10.
|
Song H, Hu F, Peng Y, et al. 2018. Non-thermal plasma catalysis for chlorobenzene removal over CoMn/TiO2 and CeMn/TiO2:Synergistic effect of chemical catalysis and dielectric constant[J]. Chemical Engineering Journal, 347: 447–454.
DOI:10.1016/j.cej.2018.04.018
|
Wang B, Chi C, Xu M, et al. 2017. Plasma-catalytic removal of toluene over CeO2-MnOx catalysts in an atmosphere dielectric barrier discharge[J]. Chemical Engineering Journal, 322: 679–692.
DOI:10.1016/j.cej.2017.03.153
|
Wu J, Xia Q, Wang H, et al. 2014. Catalytic performance of plasma catalysis system with nickel oxide catalysts on different supports for toluene removal:effect of water vapor[J]. Applied Catalysis B:Environmental, 156: 265–272.
|
Wu Z, Li M, Mullins D R, et al. 2012. Probing the surface sites of CeO2 nanocrystals with well-defined surface planes via methanol adsorption and desorption[J]. Acs Catalysis, 2(11): 2224–2234.
DOI:10.1021/cs300467p
|
Wu Z, Li M, Howe J, et al. 2010. Probing defect sites on CeO2 nanocrystals with well-defined surface planes by Raman spectroscopy and O2 adsorption[J]. Langmuir, 26(21): 16595–16606.
DOI:10.1021/la101723w
|
Xu X, Wu J, Xu W, et al. 2017. High-efficiency non-thermal plasma-catalysis of cobalt incorporated mesoporous MCM-41 for toluene removal[J]. Catalysis Today, 281: 527–533.
DOI:10.1016/j.cattod.2016.03.036
|
Xu W, Xu X, Wu J, et al. 2016. Removal of toluene in adsorption-discharge plasma systems over a nickel modified SBA-15 catalyst[J]. RSC Advances, 6(106): 104104–104111.
DOI:10.1039/C6RA21704D
|
Youn J S, Bae J, Park S, et al. 2018. Plasma-assisted oxidation of toluene over Fe/zeolite catalyst in DBD reactor using adsorption/desorption system[J]. Catalysis Communications, 113: 36–40.
DOI:10.1016/j.catcom.2018.05.013
|
Yao X, Li Y, Fan Z, et al. 2018. Plasma catalytic removal of hexanal over Co-Mn solid solution:Effect of preparation method and synergistic reaction of ozone[J]. Industrial & Engineering Chemistry Research, 57(12): 4214–4224.
|
Yi H, Yang X, Tang X, et al. 2017. Removal of toluene from industrial gas over 13X zeolite supported catalysts by adsorption-plasma catalytic process[J]. Journal of Chemical Technology & Biotechnology, 92(9): 2276–2286.
|
Zheng M, Yu D, Duan L, et al. 2017. In-situ fabricated CuO nanowires/Cu foam as a monolithic catalyst for plasma-catalytic oxidation of toluene[J]. Catalysis Communications, 100: 187–190.
DOI:10.1016/j.catcom.2017.06.031
|
Zhu X, Zhang S, Yang Y, et al. 2017a. Enhanced performance for plasma-catalytic oxidation of ethyl acetate over La1-xCexCoO3+∂ catalysts[J]. Applied Catalysis B:Environmental, 213: 97–105.
DOI:10.1016/j.apcatb.2017.04.066
|
Zhu X, Tu X, Chen M, et al. 2017b. La0.8M0.2MnO3 (M=Ba, Ca, Ce, Mg and Sr) perovskite catalysts for plasma-catalytic oxidation of ethyl acetate[J]. Catalysis Communications, 92: 35–39.
DOI:10.1016/j.catcom.2016.12.013
|
Zhu G, Zhu J, Jiang W, et al. 2017c. Surface oxygen vacancy induced α-MnO2 nanofiber for highly efficient ozone elimination[J]. Applied Catalysis B:Environmental, 209: 729–737.
DOI:10.1016/j.apcatb.2017.02.068
|
Zhu X, Liu S, Cai Y, et al. 2016. Post-plasma catalytic removal of methanol over Mn-Ce catalysts in an atmospheric dielectric barrier discharge[J]. Applied Catalysis B:Environmental, 183: 124–132.
DOI:10.1016/j.apcatb.2015.10.013
|
 2019, Vol. 39
2019, Vol. 39


