2. 安徽工业大学生物膜法水质净化及利用技术教育部工程研究中心, 马鞍山 243032
2. Water Purification by Biofilm Method and Utilization, Engineering Research Center of Ministry of Education, Anhui University of Technology, Ma'anshan 243032
重金属钼(Mo)是动植物生存必需的一种微量元素, 同时也是一种不可再生的重要战略资源.研究表明, 钼的化学形态及迁移能力对氧化还原环境较为敏感, 在自然条件下钼尾矿中质量分数占80%以上的MoS2易被水和空气氧化, 转化为MoO42-随碱性排水淋滤进入环境.而正六价的钼酸根离子在环境中相对稳定, 且在大多数体系里容易被生物所摄取(Bostick et al., 2003), 当水溶液中钼浓度超过5×10-6时,即对环境带来危害, 其毒性级别介于Zn(Ⅱ)和Cr(Ⅲ)的化合物之间(Moret et al., 2003), 长期的口腔暴露能导致胃肠失调、生长迟缓、贫血, 以及关节畸形等疾病(Afkhami et al., 2009).土壤中钼含量低于10 mg·kg-1一般认为不会对土壤造成污染(Smedley et al., 2017), 然而在我国葫芦岛钼矿区及闽东某钼矿周边土壤钼浓度远超该限值(Lian et al., 2013a; 贾婷等, 2015), 对于土壤重金属钼污染的修复研究却鲜有报道.
相关研究表明, 对重金属污染土壤进行生物修复和植被重建是治理其污染和危害的最有效途径(Rascio et al., 2011; 张杏丽等, 2015).目前, 国内外学者围绕超富集植物修复重金属污染已进行了大量的研究, 但较小的生物量成为制约植物修复重金属污染的瓶颈问题.然而, 若将植物修复和微生物修复进行组合, 将会最大程度的发挥生物修复的作用.根瘤菌与豆科植物能够形成共生固氮体系, 由于所有生物固氮系统都需要固氮酶, 而钼是固氮酶的结构组分, 因此该固氮体系为修复重金属钼污染提供了很好的研究思路.通过对某铅锌尾矿区植物类群调查表明, 豆科植物为该地区自然发生的植物类群, 具有重金属耐性的特殊能力(张志权等, 2002).同时豆科作物根瘤中钼浓度比其叶片中的浓度高10倍左右(曹恭等, 2004), 因此开展豆科植物富集重金属钼的研究, 对土壤中钼污染修复具有一定的科学价值.
豆科植物紫花苜蓿(Medicago sativa L.)素有“牧草之王”之称, 具有生长快、生物量大、适应性强的特点.应用紫花苜蓿修复土壤Cd、Zn(黄晶等, 2012)、Cu(陈生涛等, 2014)、Cr(王爱云等, 2012)污染已被证明具有较好的修复效果, 但对土壤钼的修复特性还未见报道.此外, 重金属污染区域中存有大量重金属抗性根瘤菌, 不仅可以提高污染土地的氮素含量, 还可与豆科植物形成共生体系参与土壤Hg(Nonnoi et al., 2012)、Ni、Zn(Wani et al., 2007)、Cu、Cd (陈雯莉等, 2003)的修复.可见利用根瘤菌与紫花苜蓿共生体系对土壤钼污染进行生态修复是具有一定可行性的.
本文采用温室盆栽试验方法, 以紫花苜蓿为宿主植物, 对比研究了根瘤菌影响下紫花苜蓿对土壤中钼的富集特征, 以及钼在土壤中的形态响应关系, 并进一步分析了不同处理下重金属钼对土壤微生物数量及酶活性的影响作用, 以期为土壤钼污染生态修复技术发展提供一定的理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料紫花苜蓿(Medicago sativa L.)种子购于南京仙林花卉市场, 苜蓿根瘤菌(REBIOY0053)购自上海嘉楚生物工程有限公司, 5种酶的活性试剂盒购于上海索桥生物科技有限公司.供试土样采自马鞍山市某蔬菜基地田间土壤, 土壤理化性质测定参考文献(鲍士旦, 2005), 其理化性质见表 1.其余试剂均为分析纯.
| 表 1 供试土壤理化性质 Table 1 Physical and chemical properties of the tested soil |
在温室条件下设计盆栽实验, 共设4个处理组:①种植紫花苜蓿, 不接种根瘤菌(M); ②接种根瘤菌R1(土壤质量的4%), 不种植紫花苜蓿(R1); ③接种根瘤菌R1, 并种植紫花苜蓿(MR1); ④接种根瘤菌R2(土壤质量的10%), 并种植紫花苜蓿(MR2); 同时设置一个土壤对照组(CK).每个处理设置4个重复.
供试土样除去石砾等杂物, 自然风干、锤碎、磨细后过4 mm筛.使用塑料花盆(口径20 cm, 深25 cm)分别装入2.0 kg干土, 将配制好的Na2MoO4溶液均匀加入供试土样中, 充分拌匀, 使土壤中钼处理浓度(以Mo6+计)为500 mg·kg-1, 室内静置10 d后待用.按土壤质量的4%和10%用量分别称取80、200 g根瘤菌拌入相应的实验土壤中, 拌匀后加水至50%田间持水量, 静置过夜.紫花苜蓿种子用0.5%次氯酸钠溶液浸泡消毒30 min, 用去离子水冲洗干净后, 于室温下过夜催芽, 待种子白露后, 将种子播于相应实验盆中, 2~3 d出苗, 其后在1周和2周时两次间苗, 最后每盆留苗5株.整个实验过程中每周随机交换花盆位置, 并在植物生长过程中定期浇水.不同实验组的植物、土壤样品均在90 d后收获.
2.3 样品采集与分析方法土壤样品:采用五点法分别从5组花盆10~20 cm土层中均匀采集土样, 混合后再分成4份分别进行相应地测试分析.第一部分采用土壤分析方法标准(F-HZ-DZ-TR-0106)进行土壤全钼含量的测定(孙鸿烈等, 1996), 第二部分采用连续提取法测试各形态钼含量(Tessier et al., 1979); 第三部分鲜样过2 mm筛, 保存于4 ℃冰箱待测微生物数量; 最后一部分土样经风干、磨碎、过1 mm筛后, 进行相关酶活性的测试.土壤中细菌、真菌采用平板计数法测定, 分别用牛肉膏蛋白胨琼脂与马丁培养基测定, 并以每克干土中的菌落数表示(许光辉等, 1986).土壤脲酶、蔗糖酶, 及过氧化氢酶的活性测定分别采用靛酚比色法、3, 5-二硝基水杨酸比色法, 及紫外分光光度法(许光辉等, 1986); 硝酸还原酶和亚硝酸还原酶活性采用酚二磺酸比色法和格里试剂比色法(李振高等, 2008), 为消除误差和土壤中其他因素的影响, 测定过程中均设定3次重复.
植物样品:将收集的紫花苜蓿用蒸馏水洗净, 再用Na-EDTA溶液浸泡根部约15 min, 以除去表面吸附的钼酸根离子, 最后用去离子水冲洗干净.用滤纸处理掉根外部水分, 并用不锈钢剪刀把清洗后的样品地上部和地下部分开, 在105 ℃下杀青30 min后于70 ℃烘干至恒重, 最后用电子天平分别称重.烘干样品粉碎过0. 425 mm筛, 采用HNO3-HCIO4法进行消解, 消解溶液的钼酸根离子采用原子吸收分光光度法测定, 同时计算生物富集因子(BCF)和转运系数(TA).
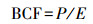
|
(1) |
式中, P为植物体内钼含量(mg·kg-1); E为土壤中钼剩余含量(mg·kg-1).

|
(2) |
式中, As为植物地上部分钼含量(mg·kg-1); Ar为植物地下部分钼含量(mg·kg-1).
实验数据采用Excel 2007、Origin Pro 9和SPSS 19.0软件进行处理, 并采用One-Way ANOVA方法进行显著性分析.
3 结果与讨论(Results and discussion) 3.1 紫花苜蓿生物量及其对钼富集特征培养90 d后紫花苜蓿生物量如图 1所示.整个实验过程中, 各处理组的紫花苜蓿长势良好, 说明紫花苜蓿对钼有较好的耐受性.不同处理组生物量顺序为:MR2>MR1>M.与M组对比, MR1和MR2处理组地上部干重(A-P)增加幅度分别为4.17%和5.56%, 地下部干重(U-P)增加幅度分别为8.57%和12.86%, 说明接种根瘤菌能够有效促进紫花苜蓿的生长, 而投加200 g的根瘤菌比80 g的更有利于紫花苜蓿的生长.不同处理组紫花苜蓿不同部位干重间的差异不具有统计学意义(p>0.05), 而接种根瘤菌的紫花苜蓿株高与未接种的株高存在显著性差异(p < 0.05).相关研究表明, 接种根瘤菌的大豆, 在As胁迫下其总生物量相对未接种的植物提高了38%(Reichman, 2007); Younis等研究表明, 在Cd、Zn、Co、Cu胁迫下Lablab purpureus接种根瘤菌后, 生物量有显著升高(Younis, 2007).可见, 根瘤菌与植物能够形成比较稳定的互惠关系, 植物为根瘤菌提供了必要的营养元素和寄宿地, 而根瘤菌可以通过分泌促植物生长物质, 或降低重金属对植物生长的抑制作用来提高植物生物量(张宗迪等, 2017).
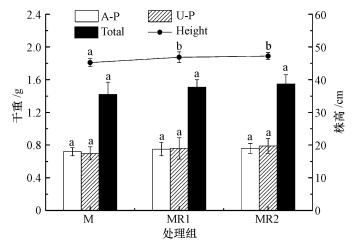 |
| 图 1 不同处理方式对紫花苜蓿生物量的影响 (图中不同小写字母表示各处理组同等指标的差异显著(p < 0.05);A-P:地上部干重, U-P:地下部干重, 下同) Fig. 1 Effects of different treatments on the biomass of alfalfa |
重金属富集能力是选择修复植物的重要依据, 而植物与土壤中重金属含量的相对比例, 及其在植物体内的分布特征是考察植物富集重金属能力的重要指标.由图 2可知, 3组对照实验的钼富集因子(BCF)由高到底排序为MR1>MR2>M, 显然根瘤菌的加入提高了紫花苜蓿富集钼的能力.根瘤菌能够通过分泌有机酸增加植物对磷及其他营养物质的吸收, 并改善土壤理化性质, 促进植物生长, 因此适当添加根瘤菌能够促进植物对重金属的吸收(韦革宏等, 2010; Adamczyk-Szabela et al., 2015), 但高剂量的根瘤菌并不利于土壤中钼的植物累积.相关研究表明, 接种根瘤菌后土壤pH会降低0.5个单位, 主要是由于根瘤菌在代谢过程中会分泌有机酸等多种代谢产物(陈雯莉等, 2003).然而酸度是影响有效钼含量最重要的因素之一, pH值越低, 土壤中有效钼含量越少, 土壤pH值每提高一个单位, MoO42-的浓度往往增大100倍(刘鹏等, 2001).因此高剂量根瘤菌的加入会导致钼在土壤中的沉积, 并降低了植物吸收钼的比例.
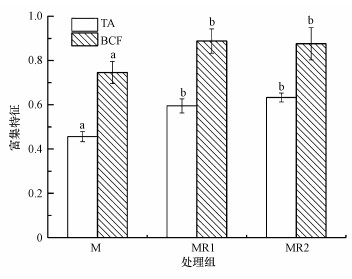 |
| 图 2 不同处理方式对紫花苜蓿富集钼特征的影响 Fig. 2 Effects of different treatments on the enrichment of Mo by alfalfa |
含根瘤菌的MR1与MR2处理组较M组的转运系数(TA)高, 表明根瘤菌能够促进钼由紫花苜蓿根部向地上部位运输.陈生涛等在研究黑麦草对Cu吸收作用的过程中也发现类似规律, Rhizobium sp. W33能够提高黑麦草对土壤中Cu的富集因子和转运能力(陈生涛等, 2014).因此适量根瘤菌的接种能够有效促进紫花苜蓿对钼的富集作用.
3.2 土壤钼剩余含量及其形态变化特征经过90 d的处理, 各实验组土壤钼含量及其存在形态如图 3所示.R1与CK组相比土壤钼剩余含量差异不显著(p>0.05), 说明根瘤菌在没有寄主植物的存在下几乎不起作用, 这与刘世亮等的研究相符(刘世亮等, 2004); MR1和MR2组土壤钼剩余含量相对偏低, 主要是由于根瘤菌促进了紫花苜蓿对土壤钼的吸收, 然而MR1与MR2组土壤钼剩余含量差异不显著(p>0.05), 说明较高剂量的根瘤菌对系统钼去除能力有限.在形态方面, 水溶态钼在各实验组均占有较高的比例, 其次是碳酸态和交换态, 表明土壤中钼的富集形态以离子络合或离子交换等结合力较弱的形式为主, 这与作者前期开展的人工湿地去除钼的研究结果一致(Lian et al., 2013b).M组有效态钼含量最高(85.49%), 可能与紫花苜蓿根际分泌物的释放有关.曾希柏等(2013)认为土壤重金属微生物修复主要是通过微生物吸附、分泌物的螯合作用, 以及氧化-还原等过程实现, 然而微生物对土壤重金属存在形态的影响并未有统一的认识.周慧芳等认为, 耐镉菌能够对残渣态镉产生较好的活化作用(周慧芳等, 2017); 而马莹等研究表明, 内生细菌可以通过释放螯合剂、改变土壤电位等方式降低重金属的生物有效性(马莹等, 2013).因此, 微生物对土壤重金属的活性发挥起促进还是抑制作用, 与微生物的种类及其在土壤中的分泌物有密切关系.另外, 各处理组土壤有机态和残渣态钼所占比例与对照组相比差异都不显著(p>0.05), 表明根瘤菌对土壤Mo(Ⅵ)形态的影响主要体现在生物有效性较高的重金属形态方面, 这与陈雯莉等(2003)的研究结果吻合.
 |
| 图 3 不同处理方式对土壤钼含量及其形态特征的影响 (图中不同小写字母表示各实验组同等指标的差异显著(p < 0.05)) Fig. 3 Effects of different treatments on the concentrations and speciation of Mo in soil |
土壤微生物数量直接影响土壤的生物化学活性及土壤养分的组成与转化.细菌和真菌是构成土壤微生物的主要生物量, 其数量变化能够显示土壤中物质代谢的旺盛程度.由表 2可知, 与对照组相比各处理组微生物数量均有所增加, 且差异显著(p < 0.05), 表明紫花苜蓿、根瘤菌及其组合系统均能提高土壤微生物的数量.相关研究表明, 根瘤菌-豆科植物具有较强的固氮作用, 对提高土壤生物量有一定的促进作用(黄兴如等, 2016).
| 表 2 不同处理组土壤微生物数量 Table 2 The number of the soil microorganism in different treatments |
土壤酶是一种生物催化剂, 其活性反映了土壤中各种生物化学过程的强度和方向, 是土壤肥力评价和土壤自净能力评价的重要指标(周慧芳等, 2017).由于钼是豆科植物根瘤固氮酶的重要组成成分, 因此开展钼胁迫下土壤5种酶的响应关系具有重要意义.
土壤脲酶活性与其微生物数量、总氮、有机物含量有关.由表 3可知, 5个实验组土壤脲酶活性差异均不显著(p>0.05);脲酶与土壤其他酶的活性相比较低, 可能是重金属钼对土壤脲酶产生了一定的抑制作用.脲酶活性是反映土壤受重金属污染程度较为敏感的一个指标, 因此可作为土壤钼污染评价的一个生物学指标.
| 表 3 不同处理组土壤酶活性 Table 3 The soil enzyme activity in different treatments |
土壤过氧化氢酶能促进过氧化氢的分解, 有利于防止其对生物体的毒害作用, 其活性大小与土壤有机质的转化速度有密切关系(邓霞等, 2018).与对照组相比, 根瘤菌、紫花苜蓿及其组合处理对土壤过氧化氢酶的活性均有所提高, 表明处理后土壤钼的生物毒害作用均有所降低.
蔗糖酶能够水解蔗糖变成相应的单糖而被机体吸收, 其活性能反应土壤中碳的转化和呼吸强度, 是评价土壤肥力的重要指标.由表 3可知, 根瘤菌与紫花苜蓿都可以提高土壤蔗糖酶的活性, 其活性递增顺序与土壤微生物数量增加趋势一致.
硝酸还原酶与亚硝酸还原酶分别是土壤硝酸盐还原为亚硝酸盐, 以及亚硝酸盐还原至NO或NH3的关键酶, 两者的活性均反映了生物降解过程中氮素的转化效率.由表 3可知, 与对照组相比, 钼胁迫下根瘤菌和紫花苜蓿均能提高土壤这两种酶的活性, 且紫花苜蓿与适量的根瘤菌组合作用下这两种酶的活性最高, 与对照组相比差异显著(p < 0.05), 说明该处理组不仅能够更大程度的提高土壤氮转化效率, 促进植物生长, 同时还能充分利用土壤钼元素, 从而实现土壤钼污染的有效修复.
4 结论(Conclusions)1) 接种根瘤菌不仅有利于紫花苜蓿的生长, 而且还提高了紫花苜蓿对钼的富集因子, 促进了钼向紫花苜蓿地上部的转移能力, 有利于钼从土壤体系中的有效移除.
2) 根瘤菌紫花苜蓿组合系统修复后的土壤钼剩余含量较对照组降低了1.89%~2.35%;钼在土壤中主要以水溶态形式存在, 经组合系统处理后碳酸态比例较对照组提高了0.61%~1.59%, 而有机态和残渣态比例无显著差异.
3) 与对照组相比, 各处理组均提高了土壤细菌和真菌数量, 并提高了土壤相关酶的活性; 根瘤菌的接种更有利于促进土壤体系生物功能的多样性.
4) 根瘤菌与紫花苜蓿组合系统, 不仅能有效降低土壤中的钼含量, 还可恢复土壤微生物生态功能的稳定性, 在钼污染土壤生态修复工程中具有一定的应用潜力.
Adamczyk-Szabela D, Markiewicz J, Wolf W M. 2015. Heavy metal uptake by herbs. Ⅳ. Influence of Soil pH on the Content of Heavy Metals in Valeriana officinalis L[J]. Water, Air, & Soil Pollution, 226(4): 1–8.
|
Afkhami A, Norooz A R. 2009. Removal, preconcentration and determination of Mo(Ⅵ) from water and wastewater samples using maghemite nanoparticles[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 346(1/3): 52–57.
|
鲍士旦. 2005. 土壤农化分析[M]. 北京: 中国农业出版社.
|
Bostick B C, Fendorf S, Helz G R. 2003. Differential adsorption of molybdate and tetrathiomolybdate on pyrite[J]. Environmental Science and Technology, 37(2): 285–291.
DOI:10.1021/es0257467
|
曹恭, 梁鸣早. 2004. 钼-平衡栽培体系中植物必需的微量元素[J]. 土壤肥料, 2004, 3: 2–3.
|
陈生涛, 何琳燕, 李娅, 等. 2014. Rhizobium sp. W33对不同植物吸收铜和根际分泌物的影响[J]. 环境科学学报, 2014, 34(8): 2077–2084.
|
陈雯莉, 黄巧云, 郭学军. 2003. 根瘤菌对土壤铜、锌和镉形态分配的影响[J]. 应用生态学报, 2003, 14(8): 1278–1282.
|
邓霞, 崔东, 王兴磊, 等. 2018. 伊犁煤矿土壤重金属累积对土壤酶活性的影响[J]. 环境化学, 2018, 37(7): 1554–1564.
|
黄晶, 凌婉婷, 孙艳娣, 等. 2012. 丛枝菌根真菌对紫花苜蓿吸收土壤中镉和锌的影响[J]. 农业环境科学学报, 2012, 31(1): 99–105.
|
黄兴如, 张彩文, 张晓霞. 2016. 根瘤菌在污染土壤修复中的地位和作用[J]. 中国土壤与肥料, 2016, 5: 5–10.
|
贾婷, 贾洋洋, 余淑娟, 等. 2015. 闽东某钼矿周边农田土壤钼和重金属的污染状况[J]. 中国环境监测, 2015, 31(1): 45–49.
|
Lian J J, Xu S G, Chang N B, et al. 2013a. Removal of Molybdenum(Ⅵ) from mine tailing effluents with the aid of loessial soil and slag waste[J]. Environmental Engineering Science, 30(5): 213–220.
DOI:10.1089/ees.2011.0441
|
Lian J J, Xu S G, Zhang Y M, et al. 2013b. Molybdenum(Ⅵ) removal by using constructed wetlands with different filter media and plants[J]. Water Science and Technology, 67(8): 1859–1866.
DOI:10.2166/wst.2013.067
|
刘鹏, 杨玉爱. 2001. 土壤中的钼及其植物效应的研究进展[J]. 农业环境保护, 2001, 20(4): 280–282.
|
刘世亮, 骆永明, 丁克强, 等. 2004. 苯并[a]芘污染土壤的丛枝菌根真菌强化植物修复作用研究[J]. 土壤学报, 2004, 41(3): 336–342.
|
李振高, 骆永明, 滕应. 2008. 土壤与环境微生物研究法[M]. 北京: 科学出版社.
|
马莹, 骆永明, 滕应, 等. 2013. 内生细菌强化重金属污染土壤植物修复研究进展[J]. 土壤学报, 2013, 50(1): 195–202.
|
Moret A, Rubio J. 2003. Sulphate and molybdate ions uptake by chitin-based shrimp shells[J]. Minerals Engineering, 16(8): 715–722.
DOI:10.1016/S0892-6875(03)00169-9
|
Nonnoi F, Chinnaswamy A, Torre V S G, et al. 2012. Metal tolerance of rhizobial strains isolated from nodules of herbaceous legumes (Medicago spp. and Trifolium spp.) growing in mercury- contaminated soils[J]. Applied Soil Ecology, 61: 49–59.
|
Rascio N, Navari I F. 2011. Heavy metal hyper accumulating plants:how and why do they do it? And what makes them so interesting?[J]. Plant Science, 180(2): 169–181.
DOI:10.1016/j.plantsci.2010.08.016
|
Reichman S M. 2007. The potential use of the legume-rhizobium symbiosis for the remediation of arsenic contaminated sites[J]. Soil Biology and Biochemistry, 39: 2587–2593.
|
Smedley P L, Kinniburgh D G. 2017. Molybdenum in natural waters:A review of occurrence, distributions and controls[J]. Applied Geochemistry, 84(2017): 387–432.
|
孙鸿烈, 刘光崧. 1996. 土壤理化分析与剖面描述[M]. 北京: 中国标准出版社.
|
Tessier A, Campbell P G C, Bisson M. 1979. Sequential extraction procedure for the speciation of particulate trace-metals[J]. Analytical Chemistry, 51(7): 844–851.
DOI:10.1021/ac50043a017
|
王爱云, 黄姗姗, 钟国峰, 等. 2012. 铬胁迫3种草本植物生长及铬积累的影响[J]. 环境科学, 2012, 33(6): 2028–2037.
|
Wani P A, Khan M S, Zaidi A. 2007. Effect of metal tolerant plant growth promoting Bradyrhizobium sp. (vigna) on growth, symbiosis, seed yield and metal uptake by greengram plants[J]. Chemosphere, 70(1): 36–45.
DOI:10.1016/j.chemosphere.2007.07.028
|
韦革宏, 马占强. 2010. 根瘤菌-豆科植物共生体系在重金属污染环境修复中的地位、应用及潜力[J]. 微生物学报, 2010, 50(11): 1421–1430.
|
许光辉, 郑洪元. 1986. 土壤微生物分析方法手册[M]. 北京: 农业出版社.
|
Younis M. 2007. Responses of Lablab purpureus-rhizobium symbiosis to heavy metals in pot and field experiments[J]. World Journal of Agricultural Sciences, 3(1): 111–122.
|
曾希柏, 徐建明, 黄巧云, 等. 2013. 中国农田重金属问题的若干思考[J]. 土壤学报, 2013, 50(1): 186–194.
|
张杏丽, 邹威, 周启星. 2015. 镉-八氯代二苯并呋喃复合污染土壤中紫茉莉对镉的修复能力[J]. 环境科学, 2015, 36(8): 3045–3055.
|
张志权, 束文圣, 廖文波, 等. 2002. 豆科植物与矿业废弃地植被恢复[J]. 生态学杂志, 2002, 21(2): 47–52.
|
张宗迪, 崔夏倩, 杨延斌, 等. 2017. 不同微生物制剂对土壤中结合态Zn稳定性的影响[J]. 上海交通大学学报(农业科学版), 2017, 35(3): 70–75.
|
周慧芳, 王京文, 孙吉林, 等. 2017. 耐镉菌联合植物吸收对土壤重金属镉污染的修复[J]. 浙江大学学报(农业与生命科学版), 2017, 43(3): 341–349.
|
 2019, Vol. 39
2019, Vol. 39


