2. 福建省植物生理生态重点实验室, 福州 350007;
3. 湿润亚热带山地生态国家重点实验室培育基地, 福州 350007
2. Fujian Provincial Key Laboratory for Plant Eco-physiology, Fuzhou 350007;
3. Cultivation Base of State Key Laboratory of Humid Subtropical Mountain Ecology, Fuzhou 350007
氧化亚氮(N2O)是一种强有力的温室气体, 其在100年时间尺度上的升温潜能比CO2高250倍(IPCC et al., 2014).其次, N2O是最重要的臭氧层耗竭物质, 且在大气中的生命周期很长(Ravishankara et al., 2009).地球表面的土壤是N2O排放的最大贡献者, 大约6.0 Tg·a-1的N2O来源于自然土壤, 4.2 Tg·a-1的N2O来自农业土壤(Syakila et al., 2011).尽管森林土壤是N2O主要的源, 但也有证据表明土壤可以成为N2O的汇(Jrm et al., 1991).
土壤-大气界面的N2O净通量(即N2O排放量)是土壤中N2O产生和消耗过程动态平衡的结果(等于N2O产生量减去N2O消耗量, 小于0时又称净负通量或净负排放量, 表明存在N2O消耗过程)(Hansen et al., 2014).产生N2O的主要机制包括硝化和反硝化作用, 其他生物或非生物过程产生的N2O量极少(Chapuis-Lardy et al., 2007).但目前仍鲜有关于森林土壤消耗N2O机制的研究.有学者认为土壤微生物进行的反硝化过程可能是N2O唯一的汇, 在反硝化过程的最后一个阶段, N2O通过N2O还原酶(Nos酶)的催化被还原为N2, 导致N2O消耗(Chapuis-Lardy et al., 2007).N2O的消耗过程可以概括为两种, 即N2O异化还原为N2(Knowles, 1982), 或通过同化还原过程变为NH3(Vieten et al., 2008).目前已经有一些国内外原位的研究和综述报道了N2O的净负通量(土壤N2O产生量与N2O消耗量之差为负值)(Klemedtsson et al., 1997; Flechard et al., 2005; Chapuis-Lardy et al., 2007; Goldberg et al., 2009; Stewart et al., 2012; Wu et al., 2013; Hansen et al., 2014).Frasier等(2010)对加拿大魁北克南部的森林土壤进行了研究, 结果表明, O层土壤的N2O消耗比A层土壤快, 净负通量低达-111 ng·g-1·d-1.本研究的部分实验地(建瓯与武夷山两处米槠常绿阔叶林)以前的研究发现, N2O负通量出现的频率分别为33.18%和36.11%, 其平均负通量变化范围分别为-14.53~-0.016 μg·m-2·h-1和-10.3~-0.002 μg·m-2·h-1(李爱萍, 2016).但目前对森林土壤消耗N2O的潜力及其主要控制因素仍缺乏一定认知.
影响土壤中N2O通量的环境因素包括生物地球化学因素(如NO3-、NH4+和碳有效性)和物理因素(如土壤质地、孔隙度、含水量及温度等)(Megonigal et al., 2004; Chapuis-Lardy et al., 2007; Ullah et al., 2008).这些因素可能会因地形位置和森林类型的变化而不同, 进而影响与N2O通量相关的土壤微生物功能类群及生物量的大小(Ullah et al., 2008).但这些因素控制N2O通量的方式尚未完全清楚, 尤其是对于N2O的消耗过程的影响更是知之甚少(Chapuis-Lardy et al., 2007).另外, 在反硝化过程中负责N2O消耗的酶(Nos酶)对pH和O2特别敏感(Hansen et al., 2014).在大范围评估森林土壤N2O排放时所涉及到的一些因素也可能影响N2O的消耗潜力(Ullah et al., 2008).一般来说, 限制N2O扩散的因素会促进其消耗, 如较低的矿质氮含量和较高的含水量, 这说明反硝化作用是N2O消耗的一个主要机制(Bandibas et al., 1994; Megonigal et al., 2004).因此, 本研究做出以下假设:①水分较高和厌氧过程有利于森林土壤通过反硝化途径消耗N2O;②在厌氧反硝化过程中, 如果作为产生N2O基质的土壤矿质氮有效性低, 会发生完全反硝化作用并消耗大气中的N2O;③土壤矿质氮有效性低时, 碳有效性提高会增加微生物有效能量储备并促进大气中N2O的还原.
为验证以上假设, 本研究在福建北部建瓯和武夷山两个自然保护区选择4种森林类型(建瓯的米槠天然林、杉木人工林及其毗邻的罗浮栲天然林和武夷山的米槠天然林), 通过提高培养瓶顶空N2O浓度的室内培养实验测定森林土壤消耗N2O的速率, 从而确定N2O消耗潜势, 并辨识有利于N2O消耗的关键因素.旨在更全面地了解中亚热带森林土壤的N2O消耗特点及因素的调控方式.
2 材料与方法(Materials and methods) 2.1 研究区概况和样地设置建瓯实验样地位于福建省建瓯万木林自然保护区, 其地理位置为118°09′E、27°03′N, 最高海拔556 m, 相对高度为334 m.保护区的土壤为南方山地黄红壤, 土壤质地疏松, 少石砾, 土壤呈微酸性, pH值在5.5左右.该地属典型中亚热带气候, 年平均温度18.7 ℃, 气温最高月为7月, 平均为28.5 ℃, 最低月为1月, 平均为8 ℃, 一年中>5 ℃活动积温达6853.3 ℃, 年均降雨量为1663.8 cm.万木林自然保护区迄今已有600多年历史, 由原杉木人工林逐渐演替为中亚热带常绿阔叶林地带.武夷山实验样地位于福建省武夷山自然保护区, 其地理位置为27°42′~27°44′N、117°44′30″~117°45′10″E, 集水区内海拔1000 m以下以常绿阔叶林为主, 面积309.8 hm2.该地属于中亚热带季风气候, 年平均气温为13~19 ℃, 年平均降水量为1600~2000 mm, 年平均相对湿度在70%~85%以上.主要群落类型有甜槠林(Castanopsis eyrei)、木荷林(Schima superba)、丝栗栲林(Castanopsis fargesii)、米槠林(Castanopsis carlesii)等, 均为中亚热带典型常绿阔叶林.
本研究选取4个类型样地, 即建瓯的杉木人工林(JCL)及其毗邻的罗浮栲天然林(JCF)和较高位置的米槠天然林(JCC)及武夷山的米槠天然林(WCC).建瓯米槠林有600余年的演替史, 武夷山米槠林为建国初期原始林经“拔大毛”(即择伐作业)形成的次生林.两个地点的米槠林样地各有9个, 分上、中和下坡沿等高线分别设置3个, 每个10 m×10 m;罗浮栲天然林和杉木人工林样地毗邻, 各3个, 分上、中和下坡分别设置1个, 每个20 m×20 m.样地的基本信息见表 1.
| 表 1 样地的基本特征 Table 1 Basic characteristics of sampling plots |
于2014年7月分别在各样地用土钻采取0~10 cm(表层土)和10~20 cm(亚表层土)土层土芯25个(在样地中均匀分布), 使用聚乙烯塑料袋封装带回实验室, 分别将4个森林两个土层样地土壤混合均匀, 共形成8个复合样品, 去除碎石、凋落物、细根等杂物, 过2 mm筛, 一部分土样保存于4 ℃条件下, 用于相关指标的测定;另一部分土样自然风干后测定土壤理化性质.
2.3 室内培养实验 2.3.1 土壤预处理(代码0)进行该处理的目的是通过淋洗和厌氧反硝化过程消耗NO3-和溶解性有机氮, 降低氮有效性, 同时降低碳有效性.称取相当于25 g干土重的鲜土放入垫有直径0.45 μm的微孔滤膜(事先置于400 ℃下烘2 h以除去其中的有机碳)的布氏漏斗中, 用45 mL去离子水(Deionized Water, DI)分3次(每次15 mL)进行淋洗, 然后用真空抽滤机施压(真空度约-0.07 MPa)使土壤恢复到鲜土原来状态.淋滤液保存在4 ℃条件下用于测定TOC和TDN含量.将淋洗后的土壤全部转移到容积为360 mL的培养瓶中, 加20 mL DI, 加盖密封, 用无O2的N2冲洗以创造厌氧条件, 然后在室温(25 ℃)条件下培养11 d以进一步消耗土壤中的碳氮, 分别于0、40、184、264 h时从培养顶空抽取气样置于50 mL德霖气袋中用于测定N2O浓度.
2.3.2 实验处理土壤预处理之后进行以下处理实验:①基线处理(代码1):该处理的目的是创造反硝化厌氧条件(无氧、淹水), 提高培养瓶顶空的N2O浓度, 使N2O还原底物不受限制, 以确定N2O消耗潜势, 同时检验假设1.
培养瓶用1 ppm N2O钢气瓶(背景气N2)洗气, 使顶空的N2O浓度升高到近大气中N2O浓度的3倍(1 ppm)(Frasier et al., 2010), 确保N2O还原为N2的底物供应不受限制.将培养瓶放在旋转振荡器上振荡(75 r·min-1), 使土壤呈泥浆状以促进顶空气体溶解平衡.在室温(25 ℃)条件下培养8 h并分别在0、2、4、8 h时抽取20 mL气样于50 mL德霖气袋中用于测定N2O浓度.
② 添加NO3-处理(代码3):该处理的目的是检验假设2.用注射器将KNO3溶液(约15 μg·g-1烘干土(以N计))均匀施加到培养瓶泥浆中, 其他条件同基线处理.
③ 添加葡萄糖处理(代码2):该处理的目的是检验假设3.用注射器将葡萄糖溶液(约0.8 mg·g-1烘干土(以C计))均匀施加到培养瓶泥浆中, 其他条件同基线处理.
④ 非淋洗处理(代码4):该处理的目的是区别于预处理中降低氮有效性的方法.除预处理过程中土壤未淋洗外, 其他条件同基线处理.
⑤ 不添加N2O处理(代码5):除顶空不添加N2O外, 其他条件同基线处理.
⑥ 添加N2O好气鲜土处理(代码6):该处理目的是去除基线处理中存在的气体扩散限制.土壤未经过预处理, 但正式培养过程中顶空仍要添加N2O.
⑦ 不添加N2O好气鲜土处理(代码7):该处理模拟野外条件, 土壤不进行预处理, 正式培养过程中不添加任何物质.
整个实验每种植被土壤分土层进行8个处理(包括预处理), 3个重复.
2.4 土壤理化性质分析土壤pH采用便携式pH计(Starter 300, 上海)测定, 土壤TC、TN采用碳氮元素分析仪(Elemental vario MAX analyzer, 德国)测定, 土壤TP采用高氯酸-硫酸消解-连续流动分析仪测定, 土壤TOC、TDN采用0.5 mol·L-1 K2SO4溶液(40 mL)浸提法测定, 土壤中的NH4+-N、NO3--N使用2 mol·L-1 KCl溶液(土水比1:6, V/V)浸提, 使用连续流动分析仪(SKALAR SAN+ +, 荷兰)测定.淋滤液中的NH4+-N、NO3--N和TDN、TOC分别使用连续流动分析仪(SKALAR SAN+ +, 荷兰)和TOC仪进行测定.
2.5 N2O浓度测定与通量计算气体样品中的N2O通过气相色谱仪(Shimadzu GC-2014, 日本)测定, 载气为95% Ar-CH4, 流速为30 mL·min-1, 检测器为ECD, 检测器温度为320 ℃, 使用3 m长的Porapak Q(80/100目)分离柱, 柱温为70 ℃.
N2O浓度的计算公式(Carter et al., 2006)如下:

|
(1) |
式中, Cst为土壤在培养过程中t时刻的N2O浓度(μg·g-1), VN2Ot为t时刻土壤中排放N2O的体积(μL), P为标准大气压(101.325 kPa), 28.0134为计算常数, 单位为g(N2O-N)·mol-1, R为通用气体常数(8.31451 L·kPa·mol-1·k-1), T为温度(25 ℃=298.15 K), Ms为干土重(25 g).其中, t时刻土壤中排放的N2O体积计算公式如下:

|
(2) |
式中, Cgt为t时刻气相中的N2O气体浓度(μL·L-1), Vh为培养顶空的体积(mL), Vwater为培养过程中土壤中所含有的水的体积(mL), α为Bunsen吸收系数, 25 ℃下取值为0.544 mL·mL-1(以每mL水中的N2O计), CFn值是无量纲校正因子(式(3)), 1的单位为L, 1000的单位为mL, 该分数用于单位换算.N2O净通量为培养期4个时间点的N2O气体浓度(Cst)拟合回归直线的斜率.
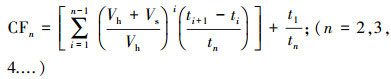
|
(3) |
式中, ti为从培养开始起的累积采样时间(h), 本实验中t0=0 h、t1=2 h、t3=4 h、t4=8 h.
2.6 统计分析采用SPSS 19.0软件对数据进行统计分析.采用单因素方差分析(one-way ANOVA)比较处理2~7与处理1之间的N2O平均净通量差异;采用双因素方差分析(two-way ANOVA)检验森林类型和土层对N2O平均净通量的效应显著性;采用Pearson法对基线处理1的N2O平均净通量与土壤理化性质(所有森林类型和土层混合样本)进行相关性分析.采用Origin 8.0软件作图, 图中数据为平均值±标准误.
3 结果(Results) 3.1 土壤的基本理化性质本研究中, 两个土层土壤的pH与铵态氮含量在4种森林之间均具有显著差异.4种森林土壤的TC、TN、NH4+含量均为表层土高于亚表层土(表 2).
| 表 2 土壤基本理化性质 Table 2 Basic physical and chemical properties of soil |
两种米槠林土壤的TC、C:N要显著高于JCL和JCF土壤.4种森林土壤中的铵态氮与硝态氮含量相对有机氮含量来说并不高, JCF土壤的硝态氮含量高于其他3种土.JCF、JCC土壤及WCC表层土壤具有较高的溶解性总碳含量.
3.2 土壤预处理效果表 3中的硝态氮损失率、碳损失率、氮损失率分别为表 3中的溶解性总碳、溶解性总氮、硝态氮与表 2中对应指标的比值.从表 3可以看出, 对土壤进行淋洗会造成土壤溶解性总碳(27%~56%)和溶解性总氮(50%~64%)损失.WCC亚表层土的溶解性碳含量损失最为严重(56%), 其次是JCC的表层土(47%)与JCF的亚表层土(46%).然而淋洗造成的硝态氮损失却相当少, 只有JCL表层土损失达16%, 甚至JCF亚表层土的损失率仅为1%.由于表 2中的溶解性总碳、总氮含量为由K2SO4浸提而得的样品所测浓度, 而淋滤液的溶解性碳、氮含量为去离子水淋洗而得的样品所测浓度.众所周知, 利用K2SO4浸提所得样品浓度比去离子水浸提出来的高, 因此, 实际上淋滤液中的溶解性碳、氮含量应该高于表 3, 因而碳、氮损失率应更高.
| 表 3 土壤淋滤液中的溶解性碳、氮含量 Table 3 The dissolved carbon and nitrogen content of soil leachates |
由图 1可知, 4种森林土壤在预处理(处理0)条件下的N2O净通量为负值(-0.056~-0.012 μg·g-1·h-1), 绝对值接近零, 说明土壤中N2O消耗速率很低.基线处理(处理1)下(符合促进N2O消耗的假设条件:氮有效性低、厌氧、水分饱和、外源N2O), 4种森林土壤都观察到了一定量的N2O净负通量, 其中, JCC表层土壤具有最高的N2O消耗潜力(净通量约为-1.39 μg·g-1·h-1).在基线处理基础上额外添加葡萄糖以增加有机碳含量(处理2), JCL(两个土层)、JCF(两个土层)及JCC(亚表层)的N2O消耗与基线处理相比都有增加趋势, 但并不显著;然而, JCC表层土与WCC土壤的N2O消耗却低于基线处理.处理3为在基线处理基础上额外添加NO3-以增加氮有效性, 几乎所有土壤的N2O消耗都显著减少, 甚至在JCF土壤中观察到了高达2.19~2.38 μg·g-1·h-1的净通量.处理4除土壤未经淋洗(即无氮有效性低)外其他同基线处理, 结果显示, 除WCC外, 其他3种森林土壤的N2O消耗均略有增加, 但并不显著.
 |
| 图 1 8个处理下4种森林土壤的平均N2O净通量 (±标准误)(0.预处理(淋洗和厌氧培养);1.基线(预处理后加N2O);2.添加葡萄糖;3.添加硝酸盐;4.未淋洗;5.无N2O添加;6.未淋洗、野外水分含量、好氧条件、添加N2O;7.模拟野外条件;负值表示土壤中存在N2O消耗(更准确地说是土壤N2O消耗大于土壤N2O产生);处理2~7与处理1之间的统计学显著性水平用*p < 0.05和**p < 0.01表示, 两个土层单独表示) Fig. 1 Average net N2O fluxes (±standard error) in four forest soils under the 8 treatments |
研究发现, 在处理5(除未添加N2O外其他同基线处理)下进行培养时, 所有土壤的N2O消耗均显著减少, 还发现4种森林土壤的N2O净通量十分相近(范围为-0.30~-0.39 μg·g-1·h-1).处理6在土壤未经预处理但仍添加N2O的条件下培养, 除JCC表层土壤与WCC亚表层土壤外, 其他土壤的N2O消耗均略有增加.处理7模拟野外条件进行培养(即土壤未经预处理也不额外添加任何基质), 所有土壤的N2O消耗均显著减少.处理6与处理7的区别只在于处理6有额外添加N2O, 结果显示, 在处理6下JCL(两个土层)、JCC(两个土层)及WCC(亚表层)的N2O消耗都显著高于处理7, JCF(两个土层)和WCC(表层)土壤的N2O消耗也高于处理7, 但差异并不显著.
据方差分析, 森林类型和土层对基线处理下的N2O净通量都具有显著效应, 但交互作用不显著.JCC表层土的N2O净通量与其他3种森林土壤之间均具有显著差异, 但这3种森林土壤之间的差异并不显著;4种森林亚表层土壤的N2O净通量之间均无显著差异.
3.4 N2O净通量的相关因素分析相关分析表明(表 4), 在基线处理(处理1)下的N2O净通量与土壤总碳、总氮呈显著负相关(p < 0.05), 与铵态氮呈显著负相关(p < 0.01), 表明总碳、总氮及铵态氮含量越高的土壤具有越大的N2O消耗潜力.
| 表 4 处理1下土壤N2O净通量与土壤理化性质的Pearson相关系数(N=12) Table 4 Pearson′s correlation coefficients between N2O net flux for treatment 1 and soil properties |
研究表明, 土壤能够从大气中转化消耗N2O而成为N2O的有效汇途径(Minami, 1997).本研究4种森林类型8个土壤样品在基线处理实验过程中都观察到较强的N2O消耗, 同样表明这些排水良好的森林土壤在厌氧和氮有效性低的条件下具有重要的N2O还原能力.尽管本研究所采用的室内培养法在许多方面都无法与野外自然条件相比, 出现这样大小的N2O消耗潜势表明这些过程在确定土壤N2O净通量中起重要作用.这一结果表明今后需要开展原位N2O消耗研究, 并在研究土壤的氮循环、气体通量时将N2O还原过程考虑进去.有研究表明, 厌氧、高水分含量、低NO3-浓度和丰富的有机碳含量常被认为是促进土壤N2O消耗的有利条件, 因为在这些环境条件下会极大促进土壤通过反硝化作用将N2O还原为N2过程的发生(Chapuis-Lardy et al., 2007; Blackmer et al., 2013), 厌氧反硝化作用通常被认为是调控土壤N2O消耗还原的主要过程(续勇波等, 2008).而本研究所设置的促进N2O还原的条件包括:①厌氧代谢及水分饱和;②对土壤进行淋洗和预培养, 即通过淋洗降低培养土壤中的氮含量, 从而降低电子受体的有效性;③提高作为替代性电子受体的有效碳含量;④添加外源N2O.基线处理(处理1)结果显示, 4种森林土壤在厌氧、水分饱和、氮有效性低及添加外源N2O的组合条件下培养时都得到了相对显著的N2O消耗潜势, 进一步验证了这些原理.相关分析结果表明(表 4), 土壤TC、TN及NH4+含量较高的土壤具有较大的N2O消耗潜势, 本研究中JCC表层土具有较大的TC、TN及NH4+含量, 且其在基线处理下也具有最大的N2O净通量(图 1).
4.2 有机碳水平对土壤消耗N2O的影响反硝化过程中主要存在以下3种途径:①反硝化细菌的厌氧反硝化作用;②好氧异养硝化细菌的反硝化作用;③硝化细菌的反硝化作用.大多数反硝化微生物都属于化能异养型(Morley et al., 2010), 以含碳化合物作为电子供体进行氧化反应, 并完成自身的生殖代谢.有机碳可激活土壤中微生物的呼吸作用, 加快氧的消耗, 为N2O彻底还原为N2提供良好的低氧环境(Morkved et al., 2007; Sánchez-Martín et al., 2008).反硝化作用是在一系列反硝化酶的作用下发生的微生物还原过程, Nos酶参与催化N2O向N2转化(冯洁等, 2014).土壤中有机碳含量及其生物有效性是调控土壤微生物活性和强度的重要因子.本研究处理2中葡萄糖的额外添加仅增加了部分土壤的N2O消耗速率, 且差异并不显著.JCL与JCF土壤的C:N比要低于两种米槠林(表 2), 而且图 1结果显示在处理2下JCL与JCF土壤的N2O消耗速率高于基线处理, 而两种米槠林却与之相反.Cavigelli等(2001)指出, Nos酶对低C:N比极其敏感, 即土壤C:N比越低, Nos酶活性越强, 从而导致N2O还原能力越强.而且土壤中的有机碳水平对土壤中的反硝化细菌种群而言也是一个相对重要的因素, 这或许也可以解释为何在提高了有机碳水平条件下两地米槠林土壤的N2O消耗速率仍低于基线处理.相关分析(表 4)表明, 总碳与N2O净通量呈显著负相关, 所以当土壤中的碳含量较丰富时, 额外添加的碳可产生的效果会受到限制.
4.3 氮水平对土壤消耗N2O的影响NO3-的额外添加(处理3)及土壤在未淋洗状态下进行培养(处理4)都是为了与基线处理下的N2O消耗进行比较.有研究表明, 当土壤中NO3-含量非常低的时候, 大气或土壤中的N2O就可能成为反硝化作用的唯一电子受体而被还原为N2, 因此, 氮有效性低的生态系统常常会被认为是N2O负排放区域(Chapuis-Lardy et al., 2007; Wu et al., 2013; Schlesinger, 2013).土壤中NO3-含量较高时会抑制N2O还原成N2, Wu等(2013)也进一步证实了该结论.处理4中土壤氮有效性并未降低, 在该处理结果中并未观测到N2O消耗速率大幅降低, 从而验证了上述结论.本研究淋洗处理能显著降低土壤的总氮水平(表 3), 预处理下呈现的趋于零的N2O净通量证实了这一处理能够降低土壤中的氮含量, 并在其他几个有进行预处理的培养中能够将N2O作为备用电子受体从而完成N2O的消耗.Ryden(1983)和Rosenkranz等(2006)认为土壤N2O负排放现象的出现与土壤低水平的NO3-含量直接相关.有研究证明, 当NO3-作为唯一的电子受体时, N2O的产生与消耗同时进行, 但N2O的排放大于消耗从而呈现N2O净排放现象(Mei et al., 2004), 本研究中处理3的结果也证实了这一现象(图 1).
4.4 额外添加N2O对土壤消耗N2O的影响将过剩的N2O在氮有效性低条件下作为其消耗机制的备用电子受体一直以来都饱受争议(Mei et al., 2004).Majumdar(2013)就指出当N2O成为环境中唯一的电子受体时, N2O还原微生物的数量是影响N2O最终浓度的唯一因素.Martin等(2007)认为土壤中原有的N2O也有可能参与还原反应形成N2.处理5中培养顶空未添加外源N2O导致大部分实验土壤的N2O消耗速率均显著降低(图 1), 这表明在其他条件都相同的情况下, 由于土壤孔隙中的N2O并未被完全利用可能会造成N2O消耗减少.较低的N2O净通量表明土壤孔隙中较低的N2O浓度可能会抑制土壤中的N2O完全还原成N2.
处理6与7均未经过预处理, 且都在田间持水量水平条件下进行培养, 区别在于处理6的顶空额外添加了N2O, 研究结果表明, 在顶空额外添加外源N2O有利于促进N2O的消耗.有研究发现, 含水量较低的土壤在氧气浓度为21%的培养条件下N2O仍能还原成N2(Wu et al., 2013).本研究处理6、7均在好氧条件下培养, 但由于顶部空间有限且时间较长, 所以其顶空的氧气浓度在培养过程中会越来越低.而较低的氧气浓度能促进NO3-还原酶(Nar)、NO2-还原酶(Nir)、NO还原酶(Nor)和Nos酶活性的提高, 相比之下Nos酶的活性高于前3种酶, 从而导致N2O的消耗(冯洁等, 2014).处理6中几乎所有供试土壤的N2O消耗都高于基线处理, 尽管处理7的N2O消耗没有基线处理强, 但也呈现了一定的消耗潜势, 也间接表明低氧浓度与较低含水量也可促进N2O消耗.
5 结论(Conclusions)中亚热带常绿阔叶林和杉木人工林下排水良好的土壤在厌氧、水分饱和及添加外源N2O条件下培养时通过反硝化作用发生N2O的消耗.土壤中氮含量较低时有利于N2O还原成N2.表层土表现出比亚表层土具有更大的N2O消耗潜力.厌氧、水分饱和的土壤条件有利于N2O消耗的发生, 这种N2O消耗过程可能会严重影响土壤中的N2O净通量;但当土壤中水分含量、氧气浓度较低时也能发生N2O消耗.本研究结果还表明, 在上述条件下进行培养的土壤N2O净通量在4种森林类型之间与两个土层之间均具有显著差异, 总碳、总氮与铵态氮含量较高的土壤具有较大的N2O消耗潜力.由于本研究测定的是净通量, 无法区分N2O的产生量和消耗量, 进一步应用同位素示踪的方法能够为N2O消耗的研究提供更为准确的依据.
致谢(Acknowledgements): 本研究的野外取样工作得到福建省建瓯市万木林自然保护区和武夷山森林生态系统国家定位研究站工作人员的大力支持, 在此表示衷心的感谢!
Bandibas J, Vermoesen A, Groot D E, et al. 1994. The effect of different moisture regimes and soil characteristics on nitrous oxide emission and consumption by different soils[J]. Soil Science, 158(2): 106–114.
DOI:10.1097/00010694-199408000-00004
|
Blackmer A M, Bremner J M. 2013. Potential of soil as a sink for atmospheric nitrous oxide[J]. Geophysical Research Letters, 3(12): 739–742.
|
Carter M R, Gregorich E G. 2006. Soil Sampling and Methods of Analysis (Second Edition)[M]. USA: Taylor & Francis Group: 1224.
|
Cavigelli M A, Robertson G P. 2001. Role of denitrifier diversity in rates of nitrous oxide consumption in a terrestrial ecosystem[J]. Soil Biology & Biochemistry, 33(3): 297–310.
|
Chapuis-Lardy L, Wrage N, Metay A, et al. 2007. Soils, a sink for N2O? A review[J]. Global Change Biology, 13(1): 1–17.
|
冯洁, 张克强, 陈思, 等. 2014. 土壤N2O吸收和消耗机制及研究进展[J]. 农业环境科学学报, 2014, 33(11): 2084–2089.
DOI:10.11654/jaes.2014.11.002 |
Flechard C R, Neftel A, Jocher M, et al. 2005. Bi-directional soil/atmosphere N2O exchange over two mown grassland systems with contrasting management practices[J]. Global Change Biology, 11(12): 2114–2127.
DOI:10.1111/gcb.2005.11.issue-12
|
Forster P, Ramaswamy V, Artaxo P, et al.2007.Changes in Atmospheric Constituents and in Radiative Forcing//Climate Change 2007: The Physical Science Basis.Contribution of Working Group I to the 4th Assessment Report of the Intergovernmental Panel on Climate Change[M].New York, USA: Cambridge University Press.129-234
|
Frasier R, Ullah S, Moore T R. 2010. Nitrous oxide consumption potentials of well-drained forest soils in Southern Québec, Canada[J]. Geomicrobiology Journal, 27(1): 53–60.
DOI:10.1080/01490450903232199
|
Goldberg S D, Gebauer G. 2009. N2O and NO fluxes between a Norway spruce forest soil and atmosphere as affected by prolonged summer drought[J]. Soil Biology & Biochemistry, 41(9): 1986–1995.
|
Hansen M, Clough T J, Bo E. 2014. Flooding-induced N2O emission bursts controlled by pH and nitrate in agricultural soils[J]. Soil Biology & Biochemistry, 69(1): 17–24.
|
Jrm A, Smith K A, Crichton I J, et al. 1991. Nitrous oxide production and denitrification in Scottish arable soils[J]. European Journal of Soil Science, 42(3): 351–367.
DOI:10.1111/ejs.1991.42.issue-3
|
Klemedtsson L, Kasimir K A, Moldan F, et al. 1997. Nitrous oxide emission from Swedish forest soils in relation to liming and simulated increased N-deposition[J]. Biology & Fertility of Soils, 25(3): 290–295.
|
Knowles R. 1982. Denitrification[J]. Microbiology and Molecular Biology Reviews, 46: 43–70.
|
李爱萍.2016.中亚热带森林土壤N2O的产生与还原[D].福州: 福建师范大学
|
Majumdar D. 2013. Biogeochemistry of N2O uptake and consumption in submerged soils and rice fields and implications in climate change[J]. Critical Reviews in Environmental Science and Technology, 43(24): 2653–2684.
DOI:10.1080/10643389.2012.694332
|
Martín J A, Yates M, Ávila P, et al. 2007. Nitrous oxide formation in low temperature selective catalytic reduction of nitrogen oxides with V2O5/TiO2, catalysts[J]. Applied Catalysis B Environmental, 70(1): 330–334.
|
Megonigal J P, Hines M E, Visscher P T.2004.Anaerobic Metabolism: Linkages to Trace Gases and Aerobic Processes//Schlesinger W H(Ed.).Biogeochemistry[M].Oxford, UK: Elsevier-Pergamon.317-324
|
Mei L, Yang L, Wang D, et al. 2004. Nitrous oxide production and consumption in serially diluted soil suspensions as related to in situ N2O emission in submerged soils[J]. Soil Biology & Biochemistry, 36(7): 1057–1066.
|
Minami K. 1997. Atmospheric methane and nitrous oxide:sources, sinks and strategies for reducing agricultural emissions[J]. Nutrient Cycling in Agroecosystems, 49(1/3): 203–211.
DOI:10.1023/A:1009730618454
|
Morkved P T, Dorsch P, Bakken L R. 2007. The N2O product ratio of nitrification and its dependence on long-term changes in soil pH[J]. Soil Biology & Biochemistry, 39(8): 2048–2057.
|
Morley N, Baggs E M. 2010. Carbon and oxygen controls on N2O and N2 production during nitrate reduction[J]. Soil Biology and Biochemistry, 42(10): 1864–1871.
DOI:10.1016/j.soilbio.2010.07.008
|
Pachauri R K, Meyer L A.2014.Contribution of Working Groups Ⅰ, Ⅱ and Ⅲ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[M]. Geneva, Switzerland: IPCC.151
|
Ravishankara A R, Portmann R W. 2009. Nitrous oxide (N2O):The dominant ozone-depleting substance emitted in the 21st century[J]. Science, 326(5949): 123–125.
DOI:10.1126/science.1176985
|
Rosenkranz P, Brüggemann N, Papen H, et al. 2006. N2O, NO and CH4 exchange, and microbial N turnover over a Mediterranean pine forest soil[J]. Biogeosciences, 3(2): 121–133.
|
Ryden J C. 1983. Denitrification loss from a grassland soil in the field receiving different rates of nitrogen as ammonium nitrate[J]. European Journal of Soil Science, 34(2): 355–365.
DOI:10.1111/ejs.1983.34.issue-2
|
Schlesinger W H. 2013. An estimate of the global sink for nitrous oxide in soils[J]. Global Change Biology, 19(10): 2929–2931.
DOI:10.1111/gcb.2013.19.issue-10
|
Schuster M, Conrad R. 1992. Metabolism of nitric oxide and nitrous oxide during nitrification and denitrification in soil at different incubation conditions[J]. Fems Microbiology Letters, 101(2): 133–143.
|
Stewart K J, Brummell M E, Farrell R E, et al. 2012. N2O flux from plant-soil systems in polar deserts switch between sources and sinks under different light conditions[J]. Soil Biology & Biochemistry, 48(4): 69–77.
|
Syakila A, Kroeze C. 2011. The global nitrous oxide budget revisited[J]. Greenhouse Gas Measurement & Management, 1(1): 17–26.
|
Ullah S, Frasier R, King L, et al. 2008. Potential fluxes of N2O and CH4 from soils of three forest types in Eastern Canada[J]. Soil Biology & Biochemistry, 40(4): 986–994.
|
Vieten B, Conen F, Seth B, et al. 2008. The fate of N2O consumed in soils[J]. Biogeosciences, 5: 129–132.
DOI:10.5194/bg-5-129-2008
|
Wu D, Dong W, Oenema O, et al. 2013. N2O consumption by low-nitrogen soil and its regulation by water and oxygen[J]. Soil Biology & Biochemistry, 60(1): 165–172.
|
续勇波, 蔡祖聪. 2008. 亚热带土壤氮素反硝化过程中N2O的排放和还原[J]. 环境科学学报, 2008, 28(4): 731–737.
DOI:10.3321/j.issn:0253-2468.2008.04.019 |
Yeomans J C, Beauchamp E G. 1982. Sulfur in acetylene inhibition of nitrous-oxide reduction by soil-microorganisms[J]. Soil Science Society of America Journal, 46(1): 75–77.
DOI:10.2136/sssaj1982.03615995004600010014x
|
Yu K W, Seo D C, Delaune R D. 2010. Incomplete acetylene inhibition of nitrous oxide reduction in potential denitrification assay as revealed by using 15N-nitrate tracer[J]. Communications in Soil Science & Plant Analysis, 41(18): 2201–2210.
|
 2019, Vol. 39
2019, Vol. 39


