2. 陕西省膜分离重点实验室, 西安 710055
2. Key Laboratory of Membrane Separation of Shannxi Province, Xi'an 710055
1-萘酚(1-naphthol, 简称1NAP)是农药、染料、医药等合成的重要中间体, 也是微生物降解多环芳烃(polycyclic aromatic hydrocarbons, 简称PAHs)过程中极易积累的典型含氧多环芳烃(oxygen- containing polycyclic aromatic hydrocarbons, 简称OPAHs)类二次污染物, 因此, 成为环境中普遍存在的污染物(郑星泉等, 1988;高珊珊等, 2007; Haritash et al., 2009;罗永宏等, 2012;梁晓辉, 2014).OPAHs易扩散、难降解、毒性大、具有持久性, 其积累直接影响多环芳烃污染环境的修复效果(Yu et al., 2002;吉云秀等, 2003;温洪宇等, 2005;Lundstedt et al., 2007;Lemieux et al., 2008; Benjamin et al., 2011).已报道的降解OPAHs的微生物种类很少, 涉及到的有短黄杆菌(高晋云, 2015)、杀鲑气单胞菌(Nie et al., 2016)、节杆菌(李峰, 2014)、枯草芽孢杆菌(Zang et al., 2008)等.王菲(2013)研究了施氏假单胞菌N2在不同pH、不同金属离子、外加共存碳源、微量元素等条件下降解1-羟基-2-萘甲酸的特性.采用微生物降解1NAP, 明确其降解特性和机理, 将为加速PAHs及OPAHs类有机污染物的矿化提供治理新思路, 对于解决PAHs污染环境修复过程中OPAHs类高毒中间产物积累问题具有重要意义.
许多环境污染物常以复杂同系混合物的形式存在, 即使对同一种化合物而言, 代谢过程中也可能需要不同的降解酶共同作用, 单一菌种难以单独胜任降解工作(李娟等, 2017).Zang等(2010)发现将黑曲霉和枯草芽孢杆菌联合代谢2-萘酚, 其降解效果比单一菌株明显.本课题组通过前期筛选驯化, 获得能耐高浓度OPAHs毒性的两种共生菌株——成晶节杆菌NT16和芽孢杆菌NG16.本文以1NAP为目标污染物, 研究成晶节杆菌NT16和其共生芽孢杆菌NG16联合代谢1NAP的特性机理及相互作用特征, 以期为实际修复中微生物群落协同作用降解含氧多环芳烃类污染物提供数据支撑.
2 材料与方法(Materials and methods) 2.1 实验材料菌种:成晶节杆菌NT16和芽孢杆菌NG16由本实验室分离并保存, 成晶节杆菌NT16和芽孢杆菌NG16的16S rRNA序列登录号分别为KY368136和MH915548.
参考王琰等(2017)的方法配置试剂、基础反应液及培养基.
2.2 实验方法 2.2.1 NT16、NG16菌株以1-萘酚或其中间产物为唯一碳源的生长特性测定在无菌操作条件下, 将平板保存菌NT16、NG16分别接种于100 mL牛肉膏蛋白胨培养基中, 30 ℃、150 r·min-1恒温摇床上培养16 h.将培养菌液NT16菌、NG16菌各按照10%的比例、NT16菌和NG16菌以5%:5%的比例混合分别接入到相应的100 mL体系无机盐培养基中, 并加入1NAP标准溶液或对羟基苯乙酸标准溶液, 使其终浓度为50 mg·L-1, 30 ℃、150 r·min-1培养, 定时取样涂平板计数.每个菌株设3组平行, 根据生长量平均值绘制生长曲线.
2.2.2 1-萘酚及其中间产物降解率的测定按照方法2.2.1节进行取样, 并将样品参考王琰等(2017)的方法处理.采用日本分光公司LC2000高效液相色谱系统进行检测.1NAP色谱条件:色谱柱为PAH柱, 流速为1 mL·min-1, 检测波长为298 nm, 流动相A为超纯水, 流动相D为甲醇, 两者体积比为10:90, 室温, 进样量为10 μL.对羟基苯乙酸色谱条件:色谱柱为PAH柱, 流速为1 mL·min-1, 检测波长为275 nm, 流动相A为超纯水, 流动相D为乙腈, 两者体积比为70:30, 室温, 进样量为10 μL.根据峰面积计算降解率.
2.2.3 1-萘酚降解液总有机碳(TOC)的测定将定时所取反应液, 于4 ℃, 10000 r·min-1, 低温离心10 min, 去除菌体.将上清液稀释到一定倍数(使其在标准曲线测定范围内), 用硝酸调节pH至酸性, 用德国元素TOC分析仪(German Element-er)测定TC、TIC的面积, 自动积分求得TOC值.
2.2.4 1-萘酚中间降解产物的GC-MS测定具体方法参考王琰等(2017), 本实验中中间产物鉴定所用仪器为美国安捷伦公司气相色谱-质谱联用仪(Agilent 7890GC-MS), 其中升温程序为:100 ℃保持1 min, 以5 ℃·min-1的速率升至200 ℃(保持15 min), 再以10 ℃·min-1的速率升至280 ℃(保持5 min).
2.2.5 1-萘酚中间降解产物紫外光谱检测将培养液在4 ℃下10000 r·min-1离心10 min, 取上清液, 用美国哈希DR5000紫外分光光度计在波长200~500 nm范围内进行紫外波长扫描.
3 结果与讨论(Results and discussion) 3.1 NT16、NG16菌株代谢1-萘酚的特性 3.1.1 以1-萘酚为唯一碳源和能源的生长特性按照2.2.1节方法进行实验, 结果如图 1所示.NT16菌和NG16菌均能以1NAP为唯一碳源和能源生长, 但NG16菌与NT16菌相比生长量更大.由于1NAP的毒性, NG16菌和NT16菌的生长适应期延长至120 h, 随后NG16菌较NT16菌生长量大幅度增长.当NT16菌和NG16菌以1:1比例共培养, 联合代谢1NAP时, 其生长量与两菌单独培养时显著提高, 并且未观察到明显的延迟生长期.在培养144 h时, 共培养菌株的生长量可达到6.1075×109 cfu·mL-1, 而单独培养的NT16菌和NG16菌在此时的生长量分别为3.3495×109 cfu·mL-1和4.7075×109 cfu·mL-1, 并且从图 1可知, 菌株在此时生长仍在继续.通过测定降解过程中体系的pH值, 发现其呈持续下降趋势, 据此推测在降解过程中可能产生酸性中间产物.
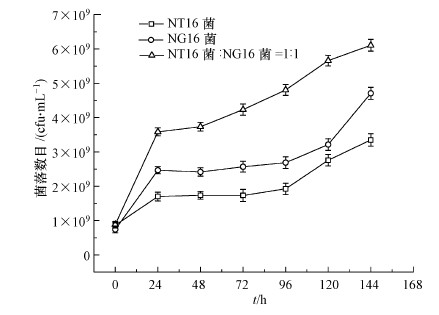 |
| 图 1 NT16菌、NG16菌、NT16菌和NG16菌联合代谢以1-萘酚为唯一碳源的生长曲线 Fig. 1 Growth curve of Arthrobacter crystallopoietes NT16 and Bacillus NG16 in the metbolism of 1-naphthol as the sole carbon source |
从图 2可知, 在50 mg·L-1 1NAP降解体系中, NT16菌和NG16菌对1NAP均有降解效果且随着时间的延长缓慢提高.其中NG16菌较NT16菌对1NAP的降解率更高, 在144 h时, NG16菌与NT16菌对1NAP的降解率相比高近10%, 这与图 1中NT16菌和NG16菌的生长量相对应.同时, NT16菌和NG16菌联合代谢与NT16菌和NG16菌单独降解1-萘酚的降解率相比提高了近20%.由此可见, 菌株联合代谢不仅加速了体系内细胞生长量的增大, 还提高了1NAP的降解效率, 并且菌体生长越快, 1NAP的降解率就越高.
 |
| 图 2 NT16菌、NG16菌、NT16菌和NG16菌联合代谢以1-萘酚为唯一碳源的降解效率 Fig. 2 Degradation efficiency of 1-naphthol, as the sole carbon source, by Arthrobacter crystallopoietes NT16, Bacillus NG16, and the co-metabolism |
按2.2.3节中的方法, 以TOC为测定指标, 比较NT16菌、NG16菌以及NT16菌和NG16菌联合代谢对1NAP的矿化度, 结果如图 3所示.由图 3可知, NT16菌和NG16菌单独降解1NAP时, 反应液中TOC值分别从0 h的1753.04 mg·L-1和1752.32 mg·L-1降到144 h时的421.53 mg·L-1和303.24 mg·L-1;当NT16菌和NG16菌联合代谢1NAP时, TOC值可从1758 mg·L-1降至265.78 mg·L-1, 且矿化速率在各时段更快, 表明NT16菌和NG16菌联合代谢能够提高1NAP的矿化度.菌株在降解1NAP的过程中一部分彻底矿化成CO2和水, 还有一部分转化产物未被彻底代谢留在体系中, 这与中间产物的积累特性有密切关系.张心意等(2015)也曾表示中间产物虽能诱导菌株产生降解所需的关键酶, 但中间产物本身可能对菌株有一定的毒副作用, 在中间产物浓度较低时作用不明显, 但随着浓度升高毒副作用增强.结合3.2节的结果, 推测NT16菌和NG16菌联合代谢1NAP能够减少中间产物对矿化程度的影响.
 |
| 图 3 NT16菌、NG16菌、NT16菌和NG16菌联合代谢以1-萘酚为唯一碳源的TOC变化 Fig. 3 TOC degradation of 1-naphthol as the sole carbon source by Arthrobacter crystallopoietes NT16, Bacillus NG16, co-culture of Arthrobacter crystallopoietes NT16 and Bacillus NG16 |
从上述结果看, NT16菌和NG16菌联合代谢与两菌株单独代谢比较, 更易提高对1NAP的降解效率, 并且NG16菌比NT16菌对1NAP的降解效果更好, 但两菌株单独培养时均有较长的生长延迟期, 1NAP的转化趋势亦相对缓慢, 这说明体系中存在或积累了某些影响菌株降解1NAP的代谢产物而联合代谢体系可能不易积累此类代谢产物(Wu et al., 2009;Bandowe et al., 2010;李静等, 2011).因此, 分析NT16菌和NG16菌不同降解阶段的中间代谢产物及其积累特征, 并与联合代谢过程中中间产物的积累特征进行比较分析, 将明确两菌株在降解1NAP过程中的相互作用特征, 并为NT16菌和NG16菌联合降解1NAP的机理研究提供基础依据.
按照2.2.4节的方法, 提取NT16菌、NG16菌、NT16菌和NG16菌联合代谢1NAP 144 h的中间产物, 用气相色谱与质谱联用仪对其进行分离鉴定, 鉴定的主要中间产物和相对含量见表 1.应当说明的是, 为了保护色谱柱, 同时达到好的分离效果, 中间产物是硅烷基化衍生后进行色谱分离的.因此, 表 1中各中间产物的质谱图是硅烷基化衍生物.衍生物的质谱图中易出现质荷比为73[Si(CH3)3]、89[O-Si(CH3)3]、117[COOSi(CH3)3]的质谱碎片, 若有两个官能团被衍生, 则易出现147碎片, 或者直接打掉三甲基硅烷基后的质子碎片.代谢产物结构鉴定是通过与标准样品及NIST Chemistry WebBook数据库(https://webbook.nist.gov/chemistry/)中标准谱图的比对而实现的.
| 表 1 NT16菌、NG16菌以及NT16菌和NG16菌联合代谢1-萘酚144 h积累的中间产物相对含量 Table 1 Intermediates′ relative contents of 1-naphthol by NT16, NG16, the combined metabolism of NT16 and NG16 in 144 h |
通过比较NT16菌、NG16菌以及NT16菌和NG16菌联合代谢1NAP 144 h时产生的中间产物的相对含量(表 1), 可以推测出NT16菌和NG16菌联合代谢1NAP可能存在两种途径:其一, 1NAP羟化后开环, 进入邻苯二甲酸代谢途径, 该降解途径为[邻苯二甲酸]→[苯甲酸]→[水杨酸]→[2, 6-二羟基苯甲酸]→[邻三羟基苯].其中NT16菌、NT16菌和NG16菌联合代谢1NAP均产生该途径的中间产物, 而NG16菌产生该途径中间产物相对含量较少甚至不存在, NT16菌则更容易进入邻苯二甲酸代谢途径, Wen等(2014)研究发现节杆菌属能够矿化中间产物——邻苯二甲酸.其二, 1NAP羟化后开环, 进入苯丙酸代谢途径, 该降解途为[苯丙酸]→[苯乙酸]→[对羟基苯乙酸].NG16菌在降解1NAP过程中产生大量该途径的中间产物, 而NT16菌和NG16菌联合代谢以及NT16菌单独代谢1NAP则产生少量该途径的中间产物[苯丙酸], 甚至没有产生中间产物[苯乙酸]、[对羟基苯乙酸].由此推测NT16菌和NG16菌联合代谢1NAP既不易积累途径二终端代谢产物[对羟基苯乙酸], 又能够产生较大浓度的小分子中间代谢产物;NG16菌代谢1NAP产生中间产物的总含量比NT16菌更大, 其易迅速降解1NAP并积累对羟基苯乙酸, 但难以进一步开环产生小分子中间代谢产物, 而NT16菌较难代谢1NAP, 却能有效利用对羟基苯乙酸.两菌联合代谢过程中1NAP的矿化效率高, 可能是NT16菌能够将NG16菌快速降解1NAP过程中积累的对羟基苯乙酸完全降解.因此, 通过进一步研究NT16菌和NG16菌分别对途径二终端代谢产物[对羟基苯乙酸]的生长及降解特性, 将初步证实NT16菌和NG16菌联合代谢1NAP的特征.
3.2.2 NT16菌、NG16菌代谢对羟基苯乙酸的特性为探究NT16菌和NG16菌联合代谢1NAP过程中菌株的相互作用特征, 以NG16菌代谢1NAP过程中极易积累的中间代谢产物—对羟基苯乙酸为目标物, 研究NT16菌和NG16菌分别以对羟基苯乙酸为唯一碳源和能源的生长和降解特性.从图 4可知, NT16菌和NG16菌在前期12 h内生长趋势相近, 对底物均有一定程度的利用, 而12 h后NG16菌进入生长延迟期, 生长趋势也略为下降, NT16菌的生长量则持续增长.在48 h时, NT16菌的生长量可达到5.096×109 cfu·mL-1, 比NG16菌高2.3205×109 cfu·mL-1, 可见NT16菌能够以对羟基苯乙酸为碳源良好生长, 而NG16菌在富含对羟基苯乙酸的环境中生长会受到抑制.
 |
| 图 4 NT16菌、NG16菌以对羟基苯乙酸为唯一碳源的生长曲线 Fig. 4 Growth curve of 4-Hydroxyphenylacetic acid as the sole carbon source by Arthrobacter crystallopoietes NT16, Bacillus NG16 |
按照2.2.5节的方法测定紫外吸收光谱, 图 5a和图 5b分别显示了NG16菌和NT16菌降解对羟基苯乙酸过程中对羟基苯乙酸最大吸收峰峰值的变化.李宗霖等(2014)曾报道对羟基苯乙酸的最大吸收波长在275 nm附近, 由图 5a可知, NG16菌在降解对羟基苯乙酸12~48 h内, 对羟基苯乙酸最大吸收峰的峰值未降低, 且峰型没有变, 说明NG16菌较难降解对羟基苯乙酸.而从图 5b可以明显观察到, NT16菌在降解对羟基苯乙酸0~12 h内, 对羟基苯乙酸最大吸收峰的峰值迅速减小, 并且峰的位置发生明显左偏移, 说明伴随着对羟基苯乙酸的逐渐降解有新物质生成.在24~36 h, 对羟基苯乙酸最大吸收峰的峰值急剧下降并且峰型改变, 说明NT16菌能够在短时间内快速降解对羟基苯乙酸.但随着时间的延长, 在48 h的峰值比36 h时大, 可能是由于紫外光谱的局限, 两种结构相差不大的物质, 其最大吸收峰的位置基本一样, 说明在此过程中有结构相似的新物质生成.因此, 有必要采用HPLC准确测定对羟基苯乙酸降解过程中的浓度变化, 确定NT16菌和NG16菌以对羟基苯乙酸为唯一碳源的同步降解效率.
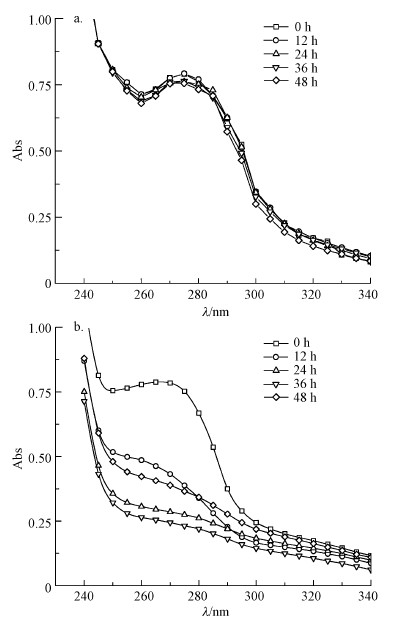 |
| 图 5 不同反应时间下NG16菌(a)和NT16菌(b)代谢对羟基苯乙酸反应液的紫外光谱 Fig. 5 Ultraviolet spectra of metabolic 4-Hydroxyphenylacetic acid reaction solution by Bacillus NG16(a)Arthrobacter crystallopoietes NT16(b) under different reaction time |
按照2.2.2节的方法, 使用高效液相色谱法测定NT16菌和NG16菌对对羟基苯乙酸的降解率, 结果如图 6所示.NG16菌难以高效降解对羟基苯乙酸, 随着时间的延长, 其降解率一直仅为10%, 且无增长趋势.而NT16菌在24 h内即能够迅速降解对羟基苯乙酸, 降解率高达80%, 与上述紫外吸收光谱的降解趋势一致, 并且在24~48 h内NT16菌仍能继续降解对羟基苯乙酸, 虽然降解速率变缓但仍保持持续增长的趋势.由此可见, NT16菌能够在短时间内快速降解对羟基苯乙酸, 而NG16菌对对羟基苯乙酸几乎无降解, 进一步验证了之前的推断.
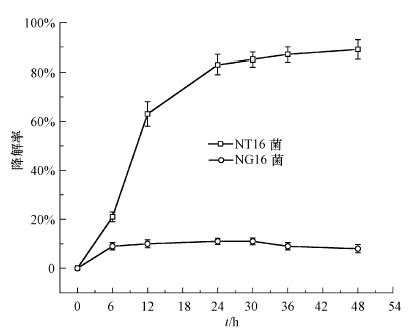 |
| 图 6 T16菌、NG16菌降解对羟基苯乙酸的效率 Fig. 6 Degradation efficiency of 4-Hydroxyphenylacetic acid by NT16 and NG16 |
依据3.2.1节初步鉴定的中间代谢产物, 结合高晋云(2015)和王菲(2013)报道的芳环类有机物的主要代谢途径, 推测NT16菌和NG16菌联合代谢1NAP的途径如图 7所示.
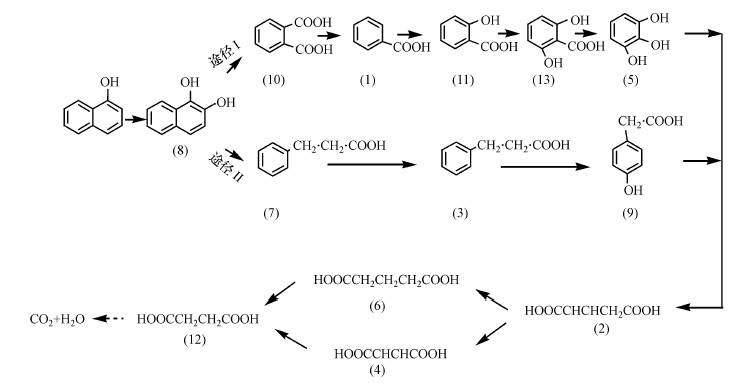 |
| 图 7 NT16菌和NG16菌联合代谢1-萘酚的推测途径 Fig. 7 Proposed pathway of the combined metabolism of 1-naphthol by NT16 and NG16 |
从图 7的推测途径来看, NT16菌和NG16菌联合代谢1NAP可按照两个途径进行.其一, 1NAP羟化后开环, 进入邻苯二甲酸代谢途径.NT16菌更易进入该途径, 而NG16菌则不易通过该途径降解1NAP;其二, 1NAP羟化后开环, 进入苯丙酸代谢途径.NG16菌更易通过该途径迅速降解1NAP, 产生较多的中间产物, 但易积累对羟基苯乙酸且无法继续将其降解利用, 而NT16菌虽不易降解1NAP, 但在两菌联合降解体系中, 能高效降解NG16菌积累的对羟基苯乙酸, 并使其分解成较短烷基链的小分子化合物直至矿化, 从而达到更好的降解效率和矿化率.从中间产物的积累特性来看, 脱羧和羟化起主要代谢作用.
4 结论(Conclusions)1) 成晶节杆菌NT16和共生芽孢杆菌NG16均能以1NAP为唯一碳源和能源生长, 两种菌株联合代谢比NT16菌、NG16菌单独降解1-萘酚的生长量分别高2.758×109 cfu·mL-1和1.4×109 cfu·mL-1, 对1NAP的降解率更高, 可提高20%.
2) 成晶节杆菌NT16和共生芽孢杆菌NG16联合代谢1NAP可按照两个途径进行, 其一, 1NAP羟化后开环, 进入邻苯二甲酸代谢途径.NT16菌更易进入该途径, 而NG16菌则不易通过该途径降解1NAP;其二, 1NAP羟化后开环, 进入苯丙酸代谢途径.NG16菌迅速将1-萘酚降解为对羟基苯乙酸, 并在体系中积累, NT16菌虽无法高效降解1-萘酚, 却能够降解对羟基苯乙酸至较短烷基链的小分子化合物.
3) 成晶节杆菌NT16和共生芽孢杆菌NG16联合代谢1NAP可以通过代谢途径的互补实现易积累中间产物的减少, 从而使体系中TOC值加速降低.
Bandowe B A M, Sobocka J, Wilcke W. 2011. Oxygen-containing polycyclic aromatic hydrocarbons (OPAHs) in urban soils of Bratislava, Slovakia:patterns, relation to PAHs and vertical distribution[J]. Environmental Pollution, 159(2): 539–549.
DOI:10.1016/j.envpol.2010.10.011
|
Bandowe B A M, Wilcke W. 2010. Analysis of polycyclic aromatic hydrocarbons and their oxygen-containing derivatives and metabolites in soils[J]. Journal of Environmental Quality, 39: 1349–1358.
DOI:10.2134/jeq2009.0298
|
高晋云.2015.生物降解萘和1-萘酚的研究[D].太原: 太原理工大学
|
高珊珊.2007.水环境中α-萘酚和β-萘酚的免疫检测方法的研究[D].上海: 东华大学
http://cdmd.cnki.com.cn/Article/CDMD-10255-2008045349.htm |
吉云秀, 邵秘华. 2003. 多环芳烃的污染及其生物修复[J]. 交通环保, 2003, 24(5): 33–36.
|
Haritash A K, Kaushik C P. 2009. Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):A review[J]. Journal of Hazardous Materials, 169: 1–15.
DOI:10.1016/j.jhazmat.2009.03.137
|
Lemieux C L, Lambert A B, Lundstedt S, et al. 2008. Mutagenic hazards of complex polycyclic aromatic hydrocarbon mixtures in contaminated soil[J]. Environmental Toxicology and Chemistry, 27: 978–990.
DOI:10.1897/07-157.1
|
Lundstedt S, White P A, Lemieux C L, et al. 2007. Sources, fate, and toxic hazards of oxygenated polycyclic aromatic hydrocarbons (PAHs) at PAH-contaminated sites[J]. AMBIO:A Journal of the Human Environment, 36(6): 475–485.
DOI:10.1579/0044-7447(2007)36[475:SFATHO]2.0.CO;2
|
李峰.2014.表面活性剂对柠檬酸杆菌SA01和节杆菌SA02降解菲微界面行为的影响[D].杭州: 浙江大学
http://cdmd.cnki.com.cn/article/cdmd-10335-1014361572.htm |
李静. 2011.含氧芳香烃降解机理及其加氧酶的诱导研究[D].西安: 西安建筑科技大学
http://cdmd.cnki.com.cn/Article/CDMD-10703-1011297066.htm |
李娟, 冷艳, 张晓华, 等. 2017. 节杆菌属细菌处理有机物和重金属污染物的研究进展[J]. 环境科学与技术, 2017, 40(10): 89–97.
|
李宗霖, 麻纪斌, 曲秦, 等. 2014. 用HPLC测定羟基苯乙酸-N, N-二甲氨基甲酰甲酯含量的研究[J]. 应用化工, 2014, 43(10): 1922–192.
|
梁晓辉. 2014.细菌菌株Pseudomonas sp.Y2的鉴定及其降解1-萘酚条件研究[A]. 2014中国环境科学学会学术年会(第十二章)[C].中国环境科学学会
|
罗永宏, 宋超, 陈家长. 2012. 氨基甲酸酯类农药甲萘威的毒理学及环境归趋研究进展[J]. 江苏农业科学, 2012, 40(1): 316–318.
DOI:10.3969/j.issn.1002-1302.2012.01.120 |
Nie M, Nie H, Cao W, et al. 2016. Phenanthrene metabolites from a new polycyclic aromatic hydrocarbon-degrading bacterium aeromonas salmonicida subsp. Achromogenes Strain NY4[J]. Polycyclic Aromatic Compounds, 36(2): 132–151.
|
Wen Z D, Gao D W, Wu W M. 2014. Biodegradation and kineticanalysis of phthalates by an Arthrobacter strain isolatedfromconstructed wetland soil[J]. Applied Microbiology and Biotechnology, 98(10): 4683–4690.
|
Wu X L, Liang R X, Dai Q Y, et al. 2009. Complete degradation of di-n-octyl phthalate by biochemical cooperation between Gordonia sp. strain JDC-2 and Arthrobacter sp. strain JDC-32 isolated from activated sludge[J]. Journal of Hazardous Materials, 176(1/3): 262–268.
|
王菲. 2013.施氏假单胞菌N2对含氧多环芳烃的生物降解特性研究[D].西安: 西安建筑科技大学
http://cdmd.cnki.com.cn/Article/CDMD-10703-1014010750.htm |
王琰, 聂麦茜, 王菲, 等. 2017. 施氏假单胞菌N2降解1-羟基-2萘甲酸的特性及机理研究[J]. 西安建筑科技大学学报(自然科学版), 2017, 49(1): 135–140.
|
温洪宇, 廖银章, 李旭东. 2005. 微生物降解多环芳烃的研究进展[J]. 微生物学杂志, 2005, 25(6): 73–75.
DOI:10.3969/j.issn.1005-7021.2005.06.020 |
Yu H. 2002. Environmental carcinogenic polycyclic aromatic hydrocarbons:photochemistry and phototoxicity[J]. Environment Science Health, 20: 149–183.
DOI:10.1081/GNC-120016203
|
Zang S Y, Lian B, Wang J, et al. 2010. Biodegradation of 2-naphthol and its metabolites by coupling Aspergillus niger with Bacillus subtilis[J]. Journal of Environmental Sciences, 22(5): 669–674.
DOI:10.1016/S1001-0742(09)60161-3
|
Zang S Y, Lian B. 2008. Synergistic degradation of 2-naphthol by Fusarium proliferatum and Bacillus subtilis in wastewater[J]. Journal of Hazardous Materials, 166(1): 33–38.
|
张心意, 聂麦茜, 赵静, 等. 2015. 共存碳源对施氏假单胞菌N2裂解苯酚的作用[J]. 安全与环境学报, 2015, 15(5): 239–243.
|
郑星泉. 1988. 化妆品卫生检验[M]. 天津: 天津大学出版社.
|
 2019, Vol. 39
2019, Vol. 39


