2. 福建师范大学地理科学学院, 福州 350007;
3. 华东师范大学河口海岸学国家重点实验室, 上海 200062;
4. 华东师范大学地理科学学院, 地理信息科学教育部重点实验室, 上海 200241
2. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007;
3. State Key Laboratory of Estuarine and Costal Research, East China Normal University, Shanghai 200062;
4. Key Laboratory of Geographic Information Science of the Ministry of Education, School of Geographic Sciences, East China Normal University, Shanghai 200241
甲烷(CH4)是一种重要的温室气体, 其100年尺度的增温潜势为CO2的28~32倍(Swart et al., 2018), 且贡献了全球温室效应的22%(Knittel et al., 2009).此外, 甲烷还能与一些大气污染物发生一系列化学反应, 产生臭氧、CO和CO2等其他温室气体, 会进一步加剧温室效应(Lelieveld et al., 1993; Feldman et al., 2018).近年来, 由于全球变化的影响, 大气中的甲烷浓度达到了1.84 ppm, 是工业革命以前水平的2.6倍(Feldman et al., 2018), 且仍以每年1%的速度升高(Simpson et al., 2002; Borrel et al., 2011; Nisbet et al., 2014).大气环境中的甲烷来源主要为自然源和人为源, 其中, 自然源贡献了40%的排放总量(Feldman et al., 2018).河口环境是大气甲烷的重要来源, 贡献了全球甲烷排放的7%~30%(Holler et al., 2011; Segarra et al., 2013).因此, 开展河口环境甲烷生物地球化学循环研究具有重要的科学意义, 也有助于深入认识全球变化响应.
甲烷排放是甲烷产生、氧化和传输等代谢过程的结果, 因此, 甲烷的产生与排放机制一直都受到人们的广泛重视(Chowdhury et al., 2013; 翟俊等, 2017; 顾航等, 2018).盐度是影响河口沉积物孔隙水中甲烷浓度的一个重要因素, 这是因为孔隙水甲烷浓度会随着盐度的升高而降低(Wilson et al., 2015).河口环境中甲烷的排放表现出季节变化特征, 其原因在于温度决定着产甲烷过程和甲烷氧化过程(Wilson et al., 2015; Sawicka et al., 2017).此外, 河流的调水调沙也会影响河口甲烷排放, 且河口水动力环境条件也影响着甲烷的排放(顾培培等, 2011).目前, 大量的研究揭示出河口与海洋环境中嗜甲烷微生物能够利用电子受体, 如硝酸盐/亚硝酸盐、硫酸盐和铁锰氧化物, 实现甲烷的代谢过程, 从而大大地减少甲烷向大气排放的总量(Reeburgh, 2007; Egger et al., 2014; Segarra et al., 2015; Sawicka et al., 2017).然而, 仝川等(2010)通过对闽江口潮滩原位添加硫酸盐进行研究, 发现硫酸盐添加对甲烷排放并无显著性影响, 其原因为非竞争途径甲烷产生基质甲醇和三甲胺能够显著促进甲烷的产生.由于微生物贡献了80%~90%的甲烷排放(顾航等, 2018), 河口环境甲烷代谢循环的微生物群落也因此引起了广泛的关注(Tong et al., 2015; She et al., 2016).目前, 大多数研究仅就物理和化学因素影响甲烷产生和排放进行了报道, 而忽略了微生物在甲烷循环过程的重要作用.此外, 关于富营养化和缺氧过程对甲烷代谢循环影响的认识仍不是很清楚(Gelesh et al., 2016).河口会因富营养化和缺氧过程导致化学与生物因子发生明显改变, 势必影响甲烷代谢循环过程(Yamamoto et al., 2014).然而, 有关河口缺氧过程的沉积物产甲烷潜力与产甲烷菌群落的研究鲜见报道, 且相互影响关系也尚不明确.因此, 系统研究河口沉积物产甲烷潜力及其与产甲烷菌群落的关系, 对于认识甲烷代谢循环的微生物学机制等问题具有重要的科学价值.
基于此, 本文以长江口为典型研究区, 开展厌氧和丰氧沉积物甲烷产生潜力与产甲烷菌群落组成研究, 并探讨缺氧过程对沉积物产甲烷与产甲烷菌群落组成的影响, 以期深化对河口甲烷生物地球化学循环的微生物作用机制的认识, 并为准确评估河口环境甲烷排放提供重要的参考依据.
2 材料与方法(Materials and methods) 2.1 研究区概况与样品采集长江口为我国最大的河口, 位于我国东部滨海岸, 其气候类型为亚热带季风气候.近几十年来, 富营养化与赤潮爆发致使长江口缺氧区日益扩大, 厌氧程度不断加重, 并且水体含氧量低于2 mg·L-1(李道季等, 2002; Wang et al., 2016; 胡静文等, 2016).此外, 由于特殊的地理位置, 长江淡水及寒暖流都加剧了长江口低氧缺氧区的形成(韦钦胜等, 2015).有研究报道,长江口缺氧从春季3月开始发生, 夏季7、8月的程度最为严重且范围最广(韦钦胜等, 2015).此外, 长江径流携带的氮、磷输入不断增加(胡晓婷等, 2016), 加剧了长江口水域浮游植物的生长, 从而消耗了水中大量的溶解氧, 进一步导致该水体缺氧严重(刘海霞等, 2012; 汤新武等, 2015).因此, 长江口的缺氧过程对生物地球化学循环的影响逐渐引起了众多研究者的关注.本研究对长江口厌氧核心区和丰氧区进行了调查与采样, 其中, 厌氧区的样点包括A52和A53, 丰氧区包括A71和A72(图 1).于2015年7月, 对采样点沉积物采用箱式重力采集, 然后再用有机玻璃柱(长度10 cm, 直径8 cm)进行0~5 cm深度的沉积物柱样采集, 且每个站位采集3个平行样, 于4 ℃环境下避光保存.同时, 采用深温盐仪(CTD 48M, Germany)现场记录采样点处的深度、盐度和溶解氧.同时, 采集采样点底层的原位水, 用于后续的泥浆培养.样品带回实验室后, 选取柱样的中间部分, 在厌氧手套袋中混匀, 并分成3部分, 一部分立即进行甲烷产生潜力分析, 一部分保存于4 ℃环境下用于理化因子分析, 另一部分保存于-80 ℃环境下用于产甲烷菌微生物群落组成分析.
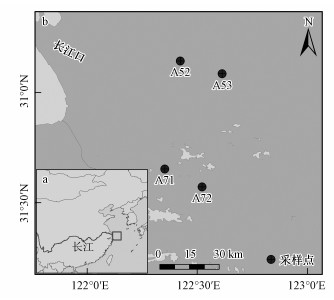 |
| 图 1 长江口位置(a)与采样点的空间分布(b) Fig. 1 Location of the Yangtze Estuary(a) and the sampling sites in the study area(b) |
沉积物粒径采用马尔文激光粒度仪测定(Mastersizer 2000, England), 密度采用环刀法测定.沉积物按土水比1:2.5混匀后, pH采用pH计测定.沉积物中NH4+、NO3-和NO2-用2 mol·L-1的氯化钾溶液浸提, 并采用0.45 μm滤头过滤后, 采用连续流动仪测定(SAN plus, Skalar, Netherlands).采用1 mol·L-1盐酸去除沉积物中的无机碳后, 采用元素分析仪测定(MaxCNOHS, Germany)有机碳和总氮.沉积物中总活性铁和二价铁分别采用1 mol·L-1盐酸-盐酸羟胺和1 mol·L-1盐酸浸提后, 采用邻菲罗啉比色法测定(Lovley et al., 1987), 三价铁含量为总铁与二价铁含量的差值.沉积物硫化物采用亚甲基蓝分光光度法测定(Deng et al., 2015).样品分析过程中, 每个理化性质进行3个重复测定, 结果取平均值.
2.3 甲烷排放速率、产生潜力测定和排放总量估算沉积物甲烷排放速率采用泥浆厌氧培养分析.将沉积物和原位水按照1:7的比例混合, 随后转移至经高纯氮气吹洗的12 mL顶空瓶中, 立即密封; 将培养瓶分成4组, 在培养箱中25 ℃条件下进行水浴培养, 其中一组培养瓶立即用0.2 mL 50%的ZnCl2终止微生物活性, 另外3组分别在培养的2、4和8 h终止微生物活性; 利用顶空平衡-气相色谱法测定水溶性甲烷的浓度(Minamikawa et al., 2010).培养结束后的样品, 采用气密性注射器, 用5 mL高纯氮气置换出等体积的水样, 使培养瓶内形成顶空.在室温下将培养瓶剧烈振荡30 min, 静置5 min使其达到气-液两相平衡, 随后采用气密针抽取3 mL顶空气体, 采用气相色谱仪(GC—2014, Shimadzu, Japan)测定甲烷的浓度.培养瓶中溶解性甲烷浓度的计算公式如下:
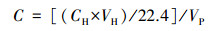
|
(1) |
式中, C为溶解性甲烷浓度(μmol·L-1), CH为顶空瓶上部空间气体甲烷浓度(μL·L-1), VH为顶空瓶上部空间体积(mL), VP为顶空瓶水体积(mL).
沉积物甲烷产生速率根据培养瓶中甲烷含量随培养时间变化进行计算, 具体计算公式如下:

|
(2) |
式中, P为沉积物甲烷产生速率(μmol·g-1·h-1), C为培养瓶中溶解性甲烷浓度(μmol·L-1), V为培养瓶体积(mL), W为沉积物质量(g), t为培养时间(h).
此外, 为了分析沉积物的甲烷产生潜力, 对原位沉积物进行厌氧培养.采用注射器将10 g沉积物置于120 mL培养瓶中, 并用注射器少量多次将原位水加入到沉积物表面, 保证沉积物刚好被淹没.采用高纯氮气将培养瓶冲洗3~5 min, 赶走培养瓶内的空气, 使培养瓶形成厌氧环境.随后, 采用卡口铝帽橡胶盖进行密封, 并在培养箱中25 ℃条件下连续培养46 d.在培养的第1、3、5、8、11、13、16、19、23、27、34和46 d共计12次用气密性注射器从培养瓶中抽取气体2 mL, 利用色相色谱仪测定甲烷浓度, 监测沉积物产甲烷的潜力变化过程.在抽取2 mL气体后, 立即向培养瓶中注入等体积的高纯氮气以使培养瓶中气压始终保持一致.
根据研究区面积、沉积物密度和所测得的甲烷排放速率, 对研究区甲烷排放总量采用以下公式进行估算:

|
(3) |
式中, F为研究区甲烷排放总量(t·a-1), P为沉积物甲烷产生速率(μmol·g-1·h-1), ρ为研究区沉积物密度(g·cm-3), h为研究的沉积物深度(5 cm), 16为甲烷的摩尔质量(g·mol-1), S为研究区长江口的面积(2700 km-2, Yin et al., 2017).
2.4 DNA提取、PCR扩增及高通量测序取0.25 g沉积物, 采用土壤DNA试剂盒(MOBIO, USA)按照所提供的操作步骤进行DNA提取.提取的DNA采用微量分光光度计(Thermo, USA)进行DNA纯度和浓度测定, 并用1%琼脂糖进行电泳, 以确保所提DNA的质量.利用产甲烷菌的16S rRNA特异性引物1106F(5′-TTWAGTCAGG CAACGAGC-3′)和1378R(5′-TGTGCAAGGAGCA GGGAC-3′), 并各自添加不同的Barcode序列进行PCR扩增.PCR扩增反应程序为:94 ℃预变性90 s; 95 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸90 s, 共33个循环; 最后72 ℃延伸3 min.PCR扩增结束后, 产物使用1%琼脂糖进行凝胶电泳, 对其进行纯化, 并将纯化后的产物送至北京诺禾致源科技有限公司在Illumina-Hiseq平台上进行高通量测序(2×300 bp).
2.5 数据处理与分析对所测得的原始序列数据进行质量控制, 去除低质量及嵌合体序列, 获取有用的序列信息, 并利用QIIME软件进行分析.采用邻近算法, 以97%的相似水平进行古菌操作分类单元(OTU)分类.采用MOTHUR计算每个样本产甲烷菌Shannon指数、Simpson指数、Chao1指数、ACE指数和覆盖度(Coverage).采用SPSS(19.0)和Origin(8.0)软件分别进行统计分析和制图.厌氧区和丰氧区显著性差异采用单因素方差分析, 进行独立样本t检验(p < 0.05).
3 结果与分析(Results and analysis) 3.1 沉积物理化性质特征从表 1可以看出, 采样点底层水盐度为19.3‰~28.5‰; 溶解氧(DO)在样点A52和A53较低, 而在样点A71和A72较高.沉积物密度为0.76~1.51 g·cm-3, 其中, A72样点密度最低.沉积物粒径组成以粘粒和粉粒为主, 其组成分别占18.61%~36.46%和63.28%~73.7%, 而砂粒仅占0.05%~7.12%.沉积物中NH4+和NOx-的含量分别为4.42~6.82 μg·g-1和0.21~1.90 μg·g-1.厌氧区沉积物NOx-含量显著低于丰氧区沉积物(p < 0.05, t-test).TOC的含量为4.60~7.74 mg·g-1, TN的含量为0.42~0.78 mg·g-1, C/N比值为9.25~10.04.沉积物硫化物含量为2.43~4.46 μg·g-1, 三价铁含量为18.69~34.83 mg·g-1.
| 表 1 采样点上覆水和沉积物理化学性质 Table 1 Physiochemical properties in overlying water and sediments of sampling sites |
从图 2可以看出, 研究区甲烷排放速率为4.15~7.12 nmol·g-1·d-1, 且表现出明显的空间差异.样点A52和A53的甲烷排放速率显著高于样点A71和A72(p < 0.05, t-test), 表明厌氧区沉积物的甲烷排放速率要高于丰氧区.通过对沉积物连续性培养, 研究其产甲烷潜力变化, 结果见图 3.从图 3a可以看出, 培养瓶中甲烷浓度随着培养时间而升高, 并在培养的第19 d达到峰值, 然后逐渐降低.此外, 样点A72的产甲烷潜力最大, A71次之, A52和A53的产甲烷潜力最小.统计分析表明, 培养期内, 样点A71和A72的产甲烷潜力均显著高于样点A52和A53(p < 0.05), 表明样点A71和A72具有较大的产甲烷潜力.此外, 从甲烷浓度累加趋势来看(图 3b), 也表现出丰氧区高于厌氧区(p < 0.05).
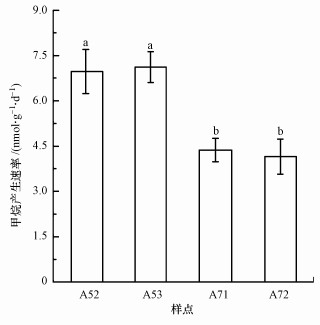 |
| 图 2 采样点沉积物甲烷产生速率 Fig. 2 Potential rates of methane production in the sediments |
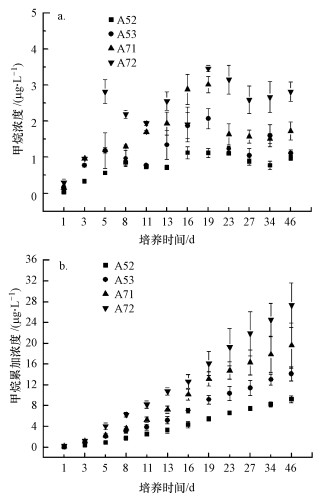 |
| 图 3 培养瓶中甲烷浓度(a)和累加浓度(b)随培养时间的变化特征 Fig. 3 Changes in the concentrations (a) and cumulative contents (b) and of methane during the incubation time |
A52、A53、A71和A72沉积物产甲烷菌OTUs数量分别为1472、1124、763和1183(表 2).样品测序文库覆盖率均为99.9%, 说明文库达到饱和, 所获得的OTUs能够代表样品的所有产甲烷菌总量.从表 2可以看出, 样点A52产甲烷菌OTUs数量、ACE指数和Chao 1指数最高, 而样点A71最低.Shannon指数和Simpson指数表示群落多样性.通过比较各样点沉积物产甲烷菌的Shannon指数和Simpson指数发现, 样点A52和A53的多样性高, 而样点A71和A72的多样性最低.
| 表 2 沉积物中产甲烷菌群落丰富度和多样性 Table 2 Richness and diversity of methanogens community in sediments |
沉积物产甲烷菌群落组成在属水平的相对丰度见图 4a.从群落组成结构看, 其组成表现出较大的差异.样点A52和A53以Methanococcoides(拟甲烷球菌属)为主要优势群落, 分别占0.76%和1.33%;此外, 样点A52中Methanosarcina(甲烷八叠球菌属, 0.16%)也是重要的产甲烷菌, 样点A53沉积物中Methanosarcina和Methanocella(甲烷胞菌属)也是重要的群落, 其相对丰度分别为0.58%和0.22%.样点A71中占优势的产甲烷菌群落为Methanocella和Methanosarcina, 相对丰度分别为1.33%和0.68%, 其次Methanococcoides(0.15%)也是重要的群落.样点A72沉积物中产甲烷菌群落Methanosarcina、Methanocella和Methanococcoides的相对丰度分别为0.49%、0.25%和0.23%;此外, Methanosaeta(甲烷鬃菌属)、Methanogenium(产甲烷菌属)和Methanoregula也是重要的产甲烷菌群落, 其相对丰度分别为0.24%、0.19%和0.18%.通过对产甲烷群落差异的NMDS分析, 发现产甲烷菌群落结构表现出较大的差异(图 5).厌氧区样点A52和A53的产甲烷菌群落组成具有较高的相似性, 且与丰氧区样点A71和A72差别较大, 表明环境差异会影响产甲烷菌群落组成.从产甲烷菌群落的热图分析可知, 沉积物产甲烷菌均属于广古菌门(Euryarchaeota), 且丰度差异较大, 进一步说明研究区产甲烷菌群落组成呈现出一定的差异(图 4b).
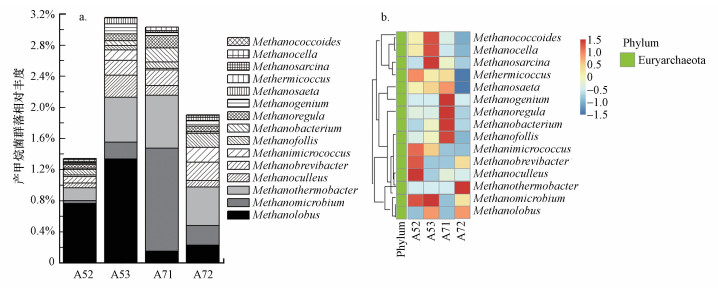 |
| 图 4 沉积物产甲烷菌群落相对丰度(a)和聚类热图(b) Fig. 4 Relative abundance of methanogens community (a) and heatmap of methanogens community (b) in the sediments |
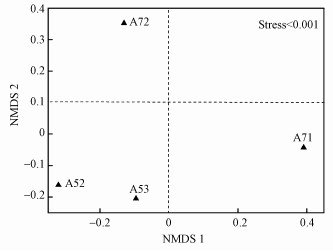 |
| 图 5 采样点沉积物产甲烷群落非度量多维尺度分析 Fig. 5 Non-metric multidimensional scaling analysis for archaeal community in the sediments |
不同环境中产甲烷速率存在较大的差异, 这是由于环境因子和产甲烷底物的不同影响了甲烷的产生和排放过程.产甲烷菌的底物是影响产甲烷途径和潜力的最主要因素, 底物的不同造成了产甲烷菌的活性和产生途径的差异(顾航等, 2018).本研究中, 在培养过程中分别添加了厌氧和丰氧水体, 甲烷产生速率的差异有可能是因为不同氧含量水体消耗产甲烷底物的不同导致.研究表明, 产甲烷底物在不同含氧量和环境条件下表现出一定的差异(Tong et al., 2015).在有氧环境下, 好氧微生物活动能够大大消耗产甲烷的底物, 从而降低甲烷的产生量(张坚超等, 2015; 翟俊等, 2017).甲烷的有氧代谢主要表现为氧化甲烷, 而厌氧代谢同时存在甲烷产生和甲烷厌氧氧化.因此, 本研究中厌氧区和丰氧区甲烷排放的差异, 也可能是甲烷的代谢途径存在较大差异导致的.有研究表明, 添加有机物能够大大促进沉积物产甲烷量, 说明充足的底物是影响甲烷产生的首要条件(Vizza et al., 2017).然而, 有些产甲烷菌群落只能利用一种底物, 而有些能利用多种底物产生甲烷, 表明底物不同, 甲烷的产生途径也不同(Lin et al., 2015).本研究从产甲烷菌群落组成来看, 不同采样点沉积物的优势群落利用底物存在差别, 从而导致其产甲烷能力具有一定的差异.产甲烷菌生活的pH范围为6.0~8.0, 且对pH的变化非常敏感.沉积物pH也是影响产甲烷菌活性和种类的重要因素, 当pH从4.8降到3.8时, 产甲烷菌由乙酸代谢途径转变为氢营养型, 且丰富度显著降低(Kotsyurbenko et al., 2007).研究区pH为8.28~8.32, 变化范围较小, 适宜产甲烷菌保持活性, 因而对产甲烷菌群落组成和活性的影响较小.硫酸盐、硝酸盐和金属氧化还原过程能够与产甲烷菌群落竞争乙酸、H2等底物, 从而抑制产甲烷菌的生长(顾航等, 2018).研究发现, 在湿地沉积物中添加有机碳和硝酸盐后, 其甲烷产量明显降低, 这是因为硫酸盐还原和反硝化增强而显著抑制了产甲烷菌的活性(Kim et al., 2015; Vizza et al., 2017).此外, 沉积物产甲烷菌对温度变化也非常敏感, 随着温度的升高, 产甲烷菌多样性和数量都增加, 随之产甲烷速率也提高(Høj et al., 2008).因此, 后续还应加强温度对产甲烷菌群落和产甲烷速率的影响研究, 这样才能深入揭示产甲烷菌代谢对温度的响应变化.
河口环境甲烷的排放因环境因子的差异表现出较大的空间变异性.与其他环境不同的是, 河口沉积物产生的甲烷, 需要经过上覆水的传输才能够释放到大气中.然而, 在甲烷传输的过程中, 大部分甲烷会被上覆水氧化, 从而降低了甲烷向大气的排放量(Reeburgh, 2007).有研究报道, 海洋环境中产生的甲烷, 超过90%都会被氧化, 说明甲烷的排放能力取决于甲烷传输过程(Knittel et al., 2009).甲烷的氧化分为有氧氧化和厌氧氧化, 其中, 有氧氧化指甲烷在有氧环境中被氧化, 而厌氧氧化一般指在缺氧环境中硝酸盐/亚硝酸盐、硫酸盐、铁锰氧化物等通过还原实现甲烷的代谢过程(翟俊等, 2017; 顾航等, 2018).有研究发现, 海洋产生的甲烷在海洋缺氧层中被快速消耗, 而在含氧层中却没有甲烷消耗, 因此, 甲烷的减少很可能是厌氧氧化造成的(Reeburgh, 1976).本研究中, 厌氧区沉积物的甲烷排放速率要显著高于丰氧区沉积物(p < 0.05), 而甲烷的产生潜力表现为丰氧区大于厌氧区(p < 0.05), 这可能是由厌氧区与丰氧区上覆水的含氧量和电子受体不同造成的.有研究表明, 甲烷的有氧氧化是甲烷氧化的主要过程, 水环境产生的甲烷大部分在传输释放过程被氧气所氧化(Bange et al., 2010).本研究中, 厌氧区上覆水的含氧量低于2 mg·L-1, 沉积物产生的甲烷在上覆水传输过程中的有氧氧化能力有限, 而丰氧区上覆水的含氧量达到了6.23~7.31 mg·L-1, 能够氧化大量的甲烷.因此, 丰氧区沉积物具有较大的甲烷产生潜力, 而表现为较小的甲烷排放速率, 这是由于沉积物产生的甲烷被上覆水的氧气所氧化.尽管pH对微生物有一定的影响, 但采样点pH变化较小, 因此, pH对甲烷产生和排放变化的作用程度较小.研究表明, 水环境中嗜甲烷微生物利用硫酸盐和硝酸盐为电子受体实现对甲烷的代谢, 是甲烷厌氧氧化的重要生态过程, 对调节甲烷排放发挥着重要的作用(Reeburgh, 2007; Egger et al., 2014; Segarra et al., 2015; Sawicka et al., 2017; 翟俊等, 2017).在河口与海洋中, 尽管嗜甲烷微生物以硫酸盐为电子受体是甲烷厌氧氧化的主导过程(Reeburgh, 2007), 但本研究中厌氧区和丰氧区上覆水盐度差异较小, 硫酸盐的含量差别也较小, 因而嗜甲烷微生物以硫酸盐为电子受体对甲烷代谢过程可能表现出较小的差别.近年来, 在河口与近海环境中也证明嗜甲烷微生物以硝酸盐为电子受体实现甲烷代谢消耗过程, 且能贡献一部分甲烷的消耗, 从而减少甲烷的排放量(Shen et al., 2016).因此, 研究区甲烷释放速率存在差别, 硝酸盐也可能是一个重要的影响因素.丰氧区沉积物中的硝酸盐浓度比厌氧区沉积物高, 甲烷释放培养过程中, 沉积物中的硝酸盐溶解于水而对甲烷产生氧化作用, 从而导致丰氧区沉积物表现出较低的甲烷排放速率.
甲烷产生与释放能力不仅与环境因素有关, 还与产甲烷菌群落密切相关(顾航等, 2018).甲烷产生是一个严格的厌氧过程, 一般由3种不同的产甲烷菌进行代谢产生, 分为乙酸型产甲烷古菌、氢型产甲烷古菌及同型产乙酸细菌(张坚超等, 2015; 顾航等, 2018).因此, 产甲烷菌群落也是影响沉积物甲烷产生与释放差异的重要因素.目前, 已发现的产甲烷菌属于广古菌门(Euryarchaeota), 包含了甲烷火球菌目(Methanopyrales)、甲烷球菌目(Methanococcales)、甲烷杆菌目(Methanobacteriales)、甲烷微菌目(Methanomicrobiales)、甲烷八叠球菌目(Methanosarcinales)、甲烷胞菌目(Methanocellales)和Methanoplasmatales/Methanomassiliicoccales 7个目(顾航等, 2018).有学者对青藏高原的泥炭沼泽产甲烷菌群落进行分析, 发现Methanosarcinales占到产甲烷菌总量的30%, 但产甲烷能力相对较弱(Zhang et al., 2008a).也有研究表明, 沼泽湿地不存在乙酸发酵型产甲烷菌, 而是利用H2/CO2还原产甲烷的Methanomicrobiales和Methanobacteriaceae群落(Horn et al., 2003).然而, 也有研究发现, 湿地产甲烷菌主要是乙酸发酵型产甲烷菌, 其产生的甲烷占到总量的67%(Conrad, 1999).本研究中, 厌氧区沉积物中产甲烷菌群落丰度较高的是Methanococcoides(拟甲烷球菌属)和Methanosarcina(甲烷八叠球菌属), 这些产甲烷菌产生甲烷的代谢方式为甲基营养途径, 即利用甲醇、甲基硫化物为底物产生甲烷(顾航等, 2018).样点A71沉积物中产甲烷菌优势群落为Methanocella(甲烷胞菌属)和Methanosarcina, Methanocella代谢产甲烷为氢营养还原CO2, 而Methanosarcina为利用甲基化合物产生甲烷.A72沉积物中产甲烷菌优势群落为Methanosarcina、Methanosaeta(甲烷鬃菌属)、Methanocella, 其中, Methanosaeta为利用乙酸产生甲烷, 因此, 样点A72的甲烷来源途径有H2/CO2还原型、乙酸发酵型和甲基营养型.然而, 有研究报道, Methanosarcina既可以利用甲醇和甲胺化合物, 也可以利用乙酸, 属于两型产甲烷途径(张坚超等, 2015).从以上结果来看, 厌氧区和丰氧区沉积物的甲烷产生途径存在差别, 其中, 厌氧区沉积物以利用甲基化合物产甲烷为主, 丰氧区以H2还原CO2产生甲烷为主.
随着人类活动影响的加剧, 大量的营养盐输入到河口环境, 导致该地区低氧缺氧现象频发, 已成为目前人们所关注的环境问题之一(李道季等, 2002; Wang et al., 2016; 胡静文等, 2016).河口水体缺氧不仅会导致沉积物生物地球化学循环过程发生变化, 还会改变微生物群落组成与多样性(Gelesh et al., 2016), 进而对生化地球化学循环过程产生重要的影响.因此, 河口环境缺氧过程影响着甲烷的代谢循环过程, 进而影响甲烷的排放量.近年来, 已有关于河口近海低氧厌氧对甲烷排放影响的报道, Bange等(2010)的研究表明, 甲烷浓度与溶解氧量没有相关性, 而只有浮游生物量与甲烷有显著的相关性, 说明水体中的氧不是直接影响甲烷排放的直接因素, 含氧量水平通过影响其他生物过程, 进而影响甲烷的产生和排放.因此, 本研究中丰氧区甲烷释放速率要显著低于厌氧区, 这是因为厌氧区水体浮游植物生长消耗了氧, 导致水体缺氧(汤新武等, 2015), 从而降低了对甲烷的氧化能力.此外, 本研究还发现沉积物产甲烷菌群落存在差异, 其中, 厌氧区产甲烷菌群落相似, 与丰氧区沉积物的产甲烷群落存在很大的差异(图 5), 进而说明缺氧过程很可能会对产甲烷菌群落产生重要的影响.有研究报道长江口为甲烷排放的净产生源, 且每年排放到大气的甲烷总量达到了2060~4054 t·a-1(Zhang et al., 2008b).本研究中, 根据研究区的面积、甲烷释放速率和沉积物密度, 采用公式(3)估算出长江口每年排放甲烷的量为2487~6819 t·a-1, 这与前人的研究结果相似(Zhang et al., 2008b).Zhang等(2008b)的研究结果基于两个站位的排放分析, 且所研究的时间为4月, 温度相比7月要低.甲烷产生对温度变化比较敏感(Zhang et al., 2008b), 7月温度明显高于4月, 因此, 本研究所估算的甲烷排放量高于之前的研究结果, 其中, 温度可能是一个重要的因素.此外, Zhang等(2008b)采用静态箱测定甲烷的排放通量, 而本研究采用厌氧培养顶空测定甲烷产生速率.静态箱近似于原位, 且不破坏沉积物结构; 而厌氧泥浆培养破坏了沉积物结构, 会改变甲烷产生过程, 故本研究的结果与之前的研究存在一定的差异.本文所估算的甲烷排放是基于少数几个样点的研究数据, 由于河口环境因子具有高度的时空变异性, 从而导致所估算的甲烷排放潜力具有一定的不确定性.此外, 甲烷排放存在很大的季节变化特征(Zhang et al., 2008b), 而本研究的结果未考虑温度对甲烷释放的影响.因此, 后续的研究还应对甲烷排放进行时间和空间变化的分析, 以此得到更加准确的甲烷排放估算值(Zhang et al., 2008b).
5 结论(Conclusions)1) 长江口沉积物甲烷释放速率为4.15~7.12 nmol·g-1·d-1, 且表现出厌氧区沉积物甲烷释放速率高于丰氧区沉积物的特征.此外, 沉积物产甲烷潜力表现出丰氧区大于厌氧区, 由此说明水体中甲烷氧化是减少甲烷排放的重要过程.
2) 厌氧区沉积物产甲烷菌优势群落为Methanococcoides(拟甲烷球菌属)、Methanosarcina(甲烷八叠球菌属)和Methanosaeta(甲烷鬃菌属), 丰氧区沉积物产甲烷菌优势群落为Methanosarcina、Methanosaeta和Methanocella(甲烷胞菌属).
3) 厌氧区和丰氧区沉积物的产甲烷潜力与产甲烷菌群落组成具有明显的差异, 表明河口缺氧过程可对甲烷的代谢循环产生重要的影响.通过估算, 长江口沉积物每年的甲烷排放量为2487~6819 t·a-1, 说明长江口是甲烷排放的净产生源.
Bange H W, Bergmann K, Hansen H P, et al. 2010. Dissolved methane during hypoxic events at the Boknis Eck time series station (Eckernf orde Bay, SW Baltic Sea)[J]. Biogeosciences, 7: 1279–1284.
DOI:10.5194/bg-7-1279-2010
|
Borrel Q, Jezequel D, Biderre-Petit C, et al. 2011. Production and consumption of methane in freshwater lake ecosystems[J]. Research in Microbiology, 162: 832–847.
DOI:10.1016/j.resmic.2011.06.004
|
Chowdhury T R, Dick R P. 2013. Ecology of aerobic methanotrophs in controlling methane fluxes from wetlands[J]. Applied Soil Ecology, 65(65): 8–22.
|
Conrad R. 1999. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments[J]. FEMS Microbiology Ecology, 28(3): 193–202.
|
Deng F Y, Hou L J, Liu M, et al. 2015. Dissimilatory nitrate reduction processes and associated contribution to nitrogen removal in sediments of the Yangtze Estuary[J]. Journal of Geophysical Research:Biogeosciences, 120(8): 1521–1531.
DOI:10.1002/2015JG003007
|
Egger M, Rasigraf O, Sapart C J, et al. 2014. Iron-mediated anaerobic oxidation of methane in Brackish coastal sediments[J]. Environmental Sciences and Technology, 49(1): 277–283.
|
Feldman D R, Collins W D, Biraud S C, et al. 2018. Observationally derived rise in methane surface forcing mediated by water vapour trends[J]. Nature Geoscience, 11(4): 238.
|
Gelesh L, Marshall K, Boicourt W, et al. 2016. Methane concentrations increase in bottom waters during summertime anoxia in the highly eutrophic estuary, Chesapeake Bay, USA[J]. Limnology and Oceanography, 61(S1): 253–266.
DOI:10.1002/lno.10272
|
顾航, 肖凡书, 贺志理, 等. 2018. 湿地微生物介导的甲烷排放机制[J]. 微生物学报, 2018, 58(4): 618–632.
|
顾培培, 张桂玲, 李佩佩, 等. 2011. 调水调沙对黄河口及邻近海域溶存甲烷的影响[J]. 中国环境科学, 2011, 31(11): 1821–1828.
|
Høj L, Olsen R A, Torsvik V L. 2008. Effects of temperature on the diversity and community structure of known methanogenic groups and other archaea in high Arctic peat[J]. The ISME Journal, 2(1): 37–48.
DOI:10.1038/ismej.2007.84
|
Holler T, Wegener G, Niemann H, et al. 2011. Carbon and sulfur back flux during anaerobic microbial oxidation of methane and coupled sulfate reduction[J]. Proceedings of the National Academy of Sciences, 108(52): 1484–1490.
DOI:10.1073/pnas.1106032108
|
Horn M A, Matthies C, Küsel K, et al. 2003. Hydrogenotrophic methanogenesis by moderately acid-tolerant methanogens of a methane-emitting acidic peat[J]. Applied and Environmental Microbiology, 69(1): 74–83.
DOI:10.1128/AEM.69.1.74-83.2003
|
胡静文, 张海龙, 李莉, 等. 2016. 长江口悬浮颗粒物中有机质来源及厌氧氨氧化活动的季节性变化[J]. 中国科学:地球科学, 2016, 46(6): 767–781.
|
胡晓婷, 程吕, 林贤彪, 等. 2016. 长江口及其邻近海域沉积物磷的赋存形态和空间分布[J]. 环境科学学报, 2016, 36(5): 1782–1791.
|
黄佳芳, 倪进治, 仝川, 等. 2015. 闽江口半咸水沼泽湿地土壤甲烷产生过程及硫酸盐还原对其抑制作用研究[J]. 环境科学学报, 2015, 35(3): 862–872.
|
Kim S Y, Veraart A J, Meima-Franke M, et al. 2015. Combined effects of carbon, nitrogen and phosphorus on CH4 production and denitrification in wetland sediments[J]. Geoderma, 259-260: 354–361.
DOI:10.1016/j.geoderma.2015.03.015
|
Knittel K, Boetius A. 2009. Anaerobic oxidation of methane:progress with an unknown process[J]. Annual Review Microbiology, 63: 311–334.
DOI:10.1146/annurev.micro.61.080706.093130
|
Kotsyurbenko O R, Friedrich M W, Simankova M V, et al. 2007. Shift from acetoclastic to H2-dependent methanogenesis in a west Siberian peat bog at low pH values and isolation of an acidophilic Methanobacterium strain[J]. Applied and Environmental Microbiology, 73(7): 2344–2348.
DOI:10.1128/AEM.02413-06
|
Lelieveld J, Crutzen P J, Brühl C. 1993. Climate effects of atmospheric methane[J]. Chemosphere, 26: 739–768.
DOI:10.1016/0045-6535(93)90458-H
|
李道季, 张经, 黄大吉, 等. 2002. 长江口外氧的亏损[J]. 中国科学:地球科学, 2002, 32(8): 686–694.
|
Lin Y X, Liu D Y, Ding W X, et al. 2015. Substrate sources regulate spatial variation of metabolically active methanogens from two contrasting freshwater wetlands[J]. Applied Microbiology and Biotechnology, 99(24): 10779–10791.
DOI:10.1007/s00253-015-6912-7
|
刘海霞, 李道季, 高磊, 等. 2012. 长江口夏季低氧区形成及加剧的成因分析[J]. 海洋科学进展, 2012, 30(2): 186–197.
DOI:10.3969/j.issn.1671-6647.2012.02.004 |
Lovley D R, Phillips E J P. 1987. Rapid assay for microbially reducible ferric iron in aquatic sediments[J]. Applied and Environmental Microbiology, 53: 1536–1540.
|
Minamikawa K, Nishimura S, Sawamoto T, et al. 2010. Annual emissions of dissolved CO2, CH4 and N2O in the subsurface drainage from three cropping systems[J]. Global Change Biology, 16(2): 796–809.
DOI:10.1111/gcb.2010.16.issue-2
|
Nisbet E G, Dlugokencky E J, Bousquet P. 2014. Methane on the rise-again[J]. Science, 343: 493–495.
DOI:10.1126/science.1247828
|
Reeburgh W S. 1976. Methane consumption in Cariaco Trench waters and sediments[J]. Earth & Planetary Science Letters, 28(3): 337–344.
|
Reeburgh W S. 2007. Oceanic methane biogeochemistry[J]. Chemical Reviews, 107(2): 486–513.
|
Sawicka J E, Brüchert V. 2017. Annual variability and regulation of methane and sulfate fluxes in Baltic Sea estuarine sediments[J]. Biogeosciences, 14(2): 325–339.
|
Segarra K E A, Comerford C, Slaughter J, et al. 2013. Impact of electron acceptor availability on the anaerobic oxidation of methane in coastal freshwater and brackish wetland sediments[J]. Geochimica et Cosmochimica Acta, 115: 15–30.
DOI:10.1016/j.gca.2013.03.029
|
Segarra K E A, Schubotz F, Samarkin V, et al. 2015. High rates of anaerobic methane oxidation in freshwater wetlands reduce potential atmospheric methane emissions[J]. Natural Communication, 6: 7477.
DOI:10.1038/ncomms8477
|
She C X, Zhang Z C, Cadillo-Quiroz H, et al. 2016. Factors regulating community composition of methanogens and sulfate-reducing bacteria in brackish marsh sediments in the Min River estuary, southeastern China[J]. Estuarine, Coastal and Shelf Science, 181: 27–38.
DOI:10.1016/j.ecss.2016.08.003
|
Shen L D, Hu B L, Liu S, et al. 2016. Anaerobic methane oxidation coupled to nitrite reduction can be a potential methane sink in coastal environments[J]. Applied Microbiology and Biotechnology, 100(16): 7171–7180.
DOI:10.1007/s00253-016-7627-0
|
Simpson I J, Chen T Y, Blake D R, et al. 2002. Implications of the recent fluctuations in the growth rate of tropospheric methane[J]. Geophysical Research Letter, 29: 1479.
|
Swart N C, Gille S T, Fyfe J C, et al.2018.Recent Southern Ocean warming and freshening driven by greenhouse gas emissions and ozone depletion[J].Nature Geoscience, DOI: https://doi.org/10.1038/s41561-018-0226-1.
https://www.nature.com/articles/s41561-018-0226-1 |
汤新武, 蔡德所, 陈求稳, 等. 2015. 三峡工程三期蓄水初期长江口水域春季浮游动物群落特征及其与环境的关系[J]. 环境科学学报, 2015, 35(4): 1082–1088.
|
Tong C, She C X, Yang P, et al. 2015. Weak correlation between methane production and abundance of methanogens across three brackish marsh zones in the Min River Estuary, China[J]. Estuaries and Coasts, 38(6): 1872–1884.
DOI:10.1007/s12237-014-9930-2
|
仝川, 柳铮铮, 曾从盛, 等. 2010. 模拟SO42-沉降对河口潮汐湿地甲烷排放通量的影响[J]. 中国环境科学, 2010, 30(3): 302–308.
|
Vizza C, West W E, Jones S E, et al. 2017. Regulators of coastal wetland methane production and responses to simulated global change[J]. Biogeosciences, 14(2): 431–446.
|
Wang H J, Dai M H, Liu J W, et al. 2016. Eutrophication-driven hypoxia in the East China Sea off the Changjiang Estuary[J]. Environmental Science Technology, 50: 2255–2263.
DOI:10.1021/acs.est.5b06211
|
韦钦胜, 王保栋, 陈建芳, 等. 2015. 长江口外缺氧区生消过程和机制的再认知[J]. 中国科学:地球科学, 2015, 45(2): 187–206.
|
Wilson B J, Mortazavi B, Kiene R P. 2015. Spatial and temporal variability in carbon dioxide and methane exchange at three coastal marshes along a salinity gradient in a northern Gulf of Mexico estuary[J]. Biogeochemistry, 123(3): 329–347.
DOI:10.1007/s10533-015-0085-4
|
Yamamoto A, Yamanaka Y, Oka A, et al. 2014. Ocean oxygen depletion due to decomposition of submarine methane hydrate[J]. Geophysical Research Letters, 41(14): 5075–5083.
DOI:10.1002/2014GL060483
|
Yin G Y, Hou L J, Liu M, et al. 2017. DNRA in intertidal sediments of the Yangtze Estuary[J]. Journal of Geophysical Research:Biogeosciences, 122(8): 1988–1998.
DOI:10.1002/jgrg.v122.8
|
翟俊, 马宏璞, 陈忠礼, 等. 2017. 湿地甲烷厌氧氧化的重要性和机制综述[J]. 中国环境科学, 2017, 37(9): 3506–3514.
DOI:10.3969/j.issn.1000-6923.2017.09.038 |
Zhang G S, Tian J Q, Jiang N, et al. 2008a. Methanogen community in Zoige wetland of Tibetan Plateau and phenotypic characterization of a dominant uncultured methanogen cluster ZC-I[J]. Environmental Microbiology, 10(7): 1850–1860.
DOI:10.1111/j.1462-2920.2008.01606.x
|
Zhang G L, Zhang J, Liu S M, et al. 2008b. Methane in the Changjiang (Yangtze River) Estuary and its adjacent marine area:riverine input, sediment release and atmospheric fluxes[J]. Biogeochemistry, 91(1): 71–84.
DOI:10.1007/s10533-008-9259-7
|
张坚超, 徐镱钦, 陆雅海. 2015. 陆地生态系统甲烷产生和氧化过程的微生物机理[J]. 生态学报, 2015, 35(20): 6592–6603.
|
 2019, Vol. 39
2019, Vol. 39


