2. 郑州大学化工与能源学院, 郑州 450001;
3. 黄河勘测规划设计有限公司环境工程设计研究院, 郑州 450003;
4. 黄河勘测规划设计有限公司水生态与景观艺术设计院, 郑州 450003;
5. 河南省城市水资源环境工程技术研究中心, 郑州 450003
2. School of Chemical Engineering and Energy, Zhengzhou University, Zhengzhou 450001;
3. Yellow River Engineering Consulting Co., Ltd., Environmental Engineering Design Institute, Zhengzhou 450003;
4. Yellow River Engineering Consulting Co., Ltd., Institute of City Environmental Hydraulic Planning and Designing, Zhengzhou 450003;
5. Henan Engineering Research Centre of Urban Water Resource and Environment, Zhengzhou 450003
短程硝化反硝化作为一种高效的脱氮工艺, 在好氧硝化阶段可节约25%的曝气量, 在缺氧反硝化阶段可减少40%的有机碳源投加量, 具有节省曝气能耗和碳源投加, 减少污泥产量和占地面积等优点(杨庆等, 2018), 且在工程应用中有多种实现形式.其中, 序批式反应器(Sequencing Batch Reactor, 简称SBR)具有操作方式灵活、设备投资省、出水水质稳定等优点, 已被广泛地应用于中小型污水处理设施(彭永臻, 2011).
短程硝化反硝化工艺稳定运行的关键是将硝化反应控制在亚硝态氮阶段, 促进氨氧化菌(AOB)的增殖并抑制亚硝酸氧化菌(NOB)的生长.采用适当的控制手段, 实现工艺过程中低溶解氧(DO)、高温、高pH、短污泥龄、高游离氨(FA)等条件, 有助于实现短程硝化(Kornaros et al., 2010; Pérez et al., 2014; 邢丽贞等, 2016), 其中, 曝气时间是实现和维持短程硝化的主要控制条件(刘宏等, 2018).因此, SBR过程控制技术的水平直接影响到短程硝化反硝化SBR的脱氮和运行效率.近年来, 对于短程硝化反硝化SBR的过程控制成为研究的热点.另外, 微生物在硝化过程中起着至关重要的作用, 深入研究污泥中微生物群落结构有助于加强对硝化过程机理的理解, 进而为工艺的优化控制和稳定运行提供更加全面的参考和依据.
本文通过对一个短程硝化-反硝化SBR进行研究, 以溶解氧(DO)和氧化还原电位(ORP)的一阶导数作为控制参数, 利用自主开发的控制系统调节好氧曝气和缺氧反硝化的时间, 实现低氨氮条件下短程硝化工艺的长期稳定运行.同时, 采用构建16S rDNA克隆文库的方法, 对SBR中不同阶段的微生物群落结构进行对比分析, 考察短程硝化SBR启动过程中微生物群落结构的变化, 以期为实现短程硝化SBR的实时控制提供理论依据.
2 材料与方法(Materials and methods) 2.1 试验装置本研究采用SBR反应器作为试验装置, 反应器为有机玻璃制成的圆柱体, 高为400 mm, 直径为200 mm, 实际工作体积为10 L(图 1).反应器的进水管、COD补加管、出水管、曝气管均从反应器顶部进入反应器, 并设有一个取样口.反应器采用鼓风曝气, 使用粘砂块作为微孔曝气器, 并以转子流量计调节曝气流量.反应器外壁缠有电热保温带, 使用温度传感器实时监测SBR内水温, 并由温度控制仪控制SBR内的温度保持在(30.0±0.5) ℃.反应器内置pH、DO和ORP在线监测探头, 并经过PLC控制柜与计算机相连, 使用自主研发的“污水生物脱氮智能控制系统”软件(软件著作权证书号:软著登字第2472076号)控制反应器的运行, 并实时显示在线监测数据并对数据进行处理计算.计算结果反馈给PLC控制系统, 根据预设的参数, 控制搅拌器、曝气机、进水泵和出水泵的开关, 实现对SBR的实时控制.每个运行周期包括预曝气、进水、好氧阶段、缺氧阶段、沉淀、排水等单元, 进水方式采用批次进水, 曝气方式采用连续曝气.
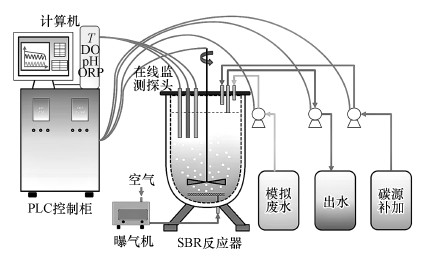 |
| 图 1 短程硝化-反硝化SBR试验装置 Fig. 1 Nitritation-denitrification SBR |
试验用水采用人工配置的模拟废水, 氮源、无机碳源和有机碳源分别使用(NH4)2SO4、NaHCO3和CH3COONa; 此外, 配水中还添加有微生物生长必需的营养元素和微量元素.试验所用的接种污泥取自河南省周口市莲花味精厂污水处理站, 对污泥的预处理包括洗泥和驯化两个部分.洗泥是取出一定量的污泥用自来水反复冲洗, 主要去除污泥中的COD.驯化是将污泥驯化为全程硝化污泥, 主要方法为以(NH4)2SO4为氮源, 进行充分的曝气, 当氨氮全部转化为NO3--N即表示驯化成功.
2.2 污水生物脱氮智能控制系统本研究中自主研发的“污水生物脱氮控制系统”是基于西门子SIMATIC WinCC (Windows Control Center)的系统进行开发, 可以用于生物脱氮工艺SBR反应器在线监测信号的检测与分析, 实现对短程硝化-反硝化生物脱氮SBR运行的实时控制.反应器使用梅特勒在线监测探头监测pH、DO、ORP, 探头的具体型号分别为:pH为EasySense pH 31, DO为EasySense O2 21, ORP为EasySense ORP 41.
系统对SBR反应器中安装的探头检测到的温度(T)、溶解氧(DO)、pH、氧化还原电位(ORP)等数据进行在线处理和记录, 并形成动态的曲线展示在电脑屏幕上.软件通过内置程序对在线检测的数据进行计算与处理, 判断该数据是否已经超过设定的阈值.如果超过设定的阈值, 软件将会实时做出反馈, 进行反应器的相应操作, 实现反应器在无人值守情况下的自动控制.根据研究需求, 软件设置了“时间控制”和“参数控制”两种控制模式, 这两种控制模式的控制逻辑如图 2所示.
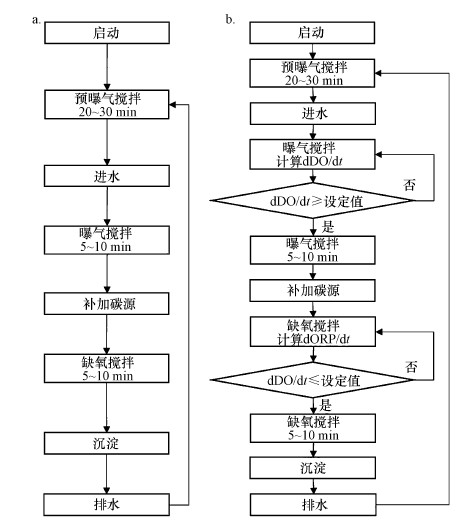 |
| 图 2 污水生物脱氮控制系统的控制逻辑 (a.时间控制; b.参数控制) Fig. 2 The control logic of control system for wastewater biological nitrogen removal (a.time-control; b. parameter-control) |
在时间控制模式下, 可在控制系统界面设定SBR反应器的预曝气、进水、好氧硝化、附加曝气、COD补加、缺氧反硝化、附加缺氧反硝化、沉淀、排水等各个阶段的运行时间, 并使用软件控制PLC控制柜, 进而实现自动控制进水泵、COD补加泵、出水泵、搅拌器、曝气设备的开关; 同时, 可对各个单元进行随意组合, 以实现不同的研究和运行目标.在参数控制模式下, 可在参数控制界面设定曝气搅拌阶段的dDO/dt的阈值, 以及缺氧搅拌阶段dORP/dt的阈值.软件通过对在线监测数据进行实时分析与计算, 通过动态图显示在电脑屏幕上, 当监测数据超过预先设定的阈值时, 软件通过控制SBR反应器上相应的泵、曝气设备和搅拌器的开关, 控制反应器的运行状态, 达到实时控制反应器的目标.
2.3 分析方法氨氮采用纳氏试剂分光光度法测定, NO2--N、NO3--N采用离子色谱测定, MLSS、MLVSS采用国标方法测定.短程硝化工艺的启动可以用亚硝化率(NAR)来检验, NAR值越接近于1证明短程硝化效果越好, 计算公式如下:

|
(1) |
式中, NAR为亚硝化率; [NO2--N]和[NO3--N]分别为硝化阶段曝气单元结束时, SBR内亚硝态氮和硝态氮的浓度(mg·L-1).
2.4 微生物取样及测序流程实验过程中分别取原泥(Seed)、驯化后的全程硝化污泥(NF)和稳定运行的短程硝化-反硝化污泥(NTD)3个阶段的泥水混合液于10 mL离心管中, 将离心管置于离心机中以8000 r·min-1的转速离心5 min, 然后将上清液弃去, 将微生物样品置于-22 ℃冰箱中保存.
样品测序时, 首先采用E.Z.N.A.® soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.), 根据说明书进行总DNA抽提, DNA浓度和纯度利用NanoDrop2000进行检测, 利用1%琼脂糖凝胶电泳检测DNA提取质量; 然后用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACH VGGGTWTCTAAT-3′)引物对V3~V4可变区进行PCR扩增(PCR仪:ABI GeneAmp® 9700型), 扩增程序为:95 ℃预变性3 min; 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s, 27个循环; 最后72 ℃延伸10 min.
使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, USA)进行纯化, Tris-HCl洗脱, 2%琼脂糖电泳检测.然后按照电泳初步定量结果, 利用QuantiFluorTM-ST(Promega, USA)进行检测定量.用Illumina MiSeq系统(上海美吉生物医药科技有限公司)测序, 所得结果进行过滤处理, 得到优化序列; 对优化序列进行OTU聚类分析和物种分类学分析, 分析样品的多样性及群落结构.
3 结果与讨论(Results and discussion) 3.1 短程硝化-反硝化SBR运行结果SBR使用经过驯化的全程硝化-反硝化菌种进行接种, 成功地启动了短程硝化-反硝化SBR, 并保持两个月的稳定运行.根据反应器的运行条件, SBR的运行可分为表 1所示的3个阶段.
| 表 1 短程硝化-反硝化SBR运行阶段 Table 1 Operation stages of nitritation-denitrification SBR |
SBR在启动初期保持进水中氨氮浓度为500 mg ·L-1左右, 体积交换率为0.1, 在“污水生物脱氮控制系统”的控制下连续运行.图 3描述了试验期间反应器的氨氮去除情况, SBR对氨氮去除率维持在97%以上.在第1、2阶段运行期间, SBR出水的氨氮浓度始终低于1 mg·L-1, 第3阶段提高进水氨氮负荷后, SBR出水的氨氮浓度低于1.5 mg·L-1, 说明SBR具有较好的抗冲击负荷能力.由于SBR接种的是经过前期驯化的全程硝化污泥, 存在大量脱氮能力较强的硝化菌和反硝化菌, 因此, SBR启动的初期即表现出良好的好氧硝化和缺氧反硝化脱氮能力.
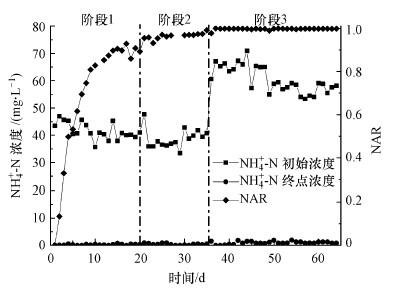 |
| 图 3 反应器氨氮初始浓度、出水浓度与NAR的变化 Fig. 3 Evolution of initial and terminal concentration of ammonium, and NAR |
在SBR运行过程中定期测定曝气单元结束时亚硝态氮和硝态氮的浓度, 根据公式(1)计算得到NAR值的变化情况, 结果如图 3所示.在SBR运行的第1阶段, 控制反应的起始pH为8.2, DO为0.3 mg·L-1左右, 之后随着时间进行逐步提高DO浓度至0.6 mg·L-1.在反应器运行的第6 d, NAR达到了61%, 可认为实现了短程硝化(张功良, 2014).随后NAR值持续升高, 第20 d的NAR值达到90%, 表明反应器已经稳定实现了短程硝化.在第3阶段提高进水氨氮浓度至750 mg·L-1, NAR仍然维持在98%左右的水平, 短程硝化效果稳定.短程硝化的建立需要控制SBR的反应条件有利于AOB的生长, 同时抑制NOB的生长.
本试验可以实现短程硝化快速启动的原因主要有4个方面:一是保持反应器温度为29~30 ℃, 当温度在30~35 ℃之间时, AOB的比增长速率明显高于NOB的比增长速率(Daverey et al., 2013; 刘宏等, 2017).在本研究的试验温度((30.0±0.5) ℃)下, 可以保持AOB较高的增长速率.二是维持反应器内较高的pH值, NOB在pH为7.9时具有最大的生长速率, 随着pH的升高和降低, 将会逐步抑制NOB的生长.由于pH>8时, AOB的生长不会受到抑制, 因此, 本试验SBR的初始pH选择为8.2左右(Hulle et al., 2007).Anthonisen等(1976)的研究表明, 游离氨(FA)对于AOB和NOB的抑制浓度不同, 其对AOB和NOB的活性抑制浓度分别为10~150 mg·L-1和0.1~1 mg·L-1.因此, 在低FA条件下可以促进AOB的生长, 而在高FA条件下则会抑制NOB的生长(徐婷等, 2016).因此, 利用FA对AOB和NOB抑制浓度的不同可以较快地启动短程硝化-反硝化SBR, 这也是本试验可以快速启动反应器的一个原因.三是在好氧单元避免过度曝气, 在SBR的连续运行中, AOB和NOB在缺氧条件下都处于饥饿期, 但AOB细胞内的核糖体并没有发生明显的变化, 并能维持有机体征的一般功能.这种独特的生理机制可以使AOB应付营养物质短缺的饥饿期, 使细胞处于一种预备的状态, 当环境适宜细胞生长时可以快速激活细胞, 产生细胞生长所需的酶.因此, 当反应条件从缺氧切换至好氧时, AOB会先于NOB恢复活性(刘文龙等, 2015).所以在硝化反应阶段可以观察到硝态氮的积累晚于亚硝态氮的积累.根据这个原理, 可以在氨氮完全转化为亚硝态氮时, 及时停止曝气, 阻止更多的亚硝态氮被转化为硝态氮, 有效地抑制NOB的生长(丁文川等, 2012; 吴军等, 2016).四是通过定期排泥保持合适的SRT.因为AOB的世代周期比NOB的世代周期短, 并且现在许多关于短程硝化反硝化的研究都是在长泥龄(大于12 d)的条件下获得的(祝贵兵等, 2008).本研究中SBR在运行过程中保持SRT为14 d, 因此, 通过定期排泥可以将NOB逐步排出SBR(Regmi et al., 2014).
3.2 参数控制机理在SBR运行的前两个阶段, 对SBR内的DO和ORP值进行了长期的在线监测, 结果如图 4所示.由图可知, DO和ORP值随着反应的循环进行显示出周期性的变化规律, 并且分别在短程硝化和反硝化单元结束时出现明显的转折点.在预曝气阶段, DO先维持在一个较低的水平, 然后会突然上升并到达一个峰值, 随后进入好氧硝化阶段.SBR进水后DO迅速降低, 并长期维持在一个较低的水平, 然后呈现缓慢上升的趋势.当氨氮被降解至极低的浓度时, DO开始迅速上升.另外, ORP与DO的变化规律呈现同向性, 主要是因为ORP反映的是反应器内氧化态物质量的多少.在好氧阶段, ORP的升高是由于SBR内氧化态物质增多(周露等, 2012; 高大文等, 2003); 在缺氧阶段, ORP的降低是由于SBR内氧化态物质减少(高景峰等, 2001).因此, DO和ORP在整个实验过程中呈现出的规律性变化, 可以用来控制SBR的运行.
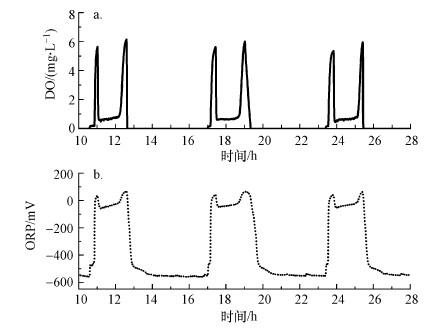 |
| 图 4 SBR运行期间DO(a)和ORP(b)的变化趋势 Fig. 4 Evolution of DO(a) and ORP(b) during the SBR operation |
图 5显示了单个周期内DO和ORP的测定值及一阶导数的变化趋势与氨氮、亚硝态氮、硝态氮浓度变化的对应关系.在预曝气阶段, DO和ORP会短暂地维持在一个较低的水平, 之后突然升高并出现第1个峰值, 此峰值表示上一个反硝化单元残留的COD基本被消耗完毕.进水后反应器内初始氨氮浓度为54.9 mg·L-1, 由于AOB的氨氧化作用, DO迅速减少并维持在0.7~0.8 mg·L-1左右, 此阶段的DO和ORP随着时间缓慢的升高.当短程硝化反应进行至1.5 h左右, SBR中的氨氮浓度小于4.8 mg·L-1时, DO和ORP会迅速升高并出现第2个峰值, 但DO的上升趋势更明显, 一阶导数在此时出现了一个极大值, 此处DO一阶导数的极大值可以作为短程硝化结束的控制参数, 用来指示短程硝化反应的终点.关闭曝气并加入有机碳源后, DO和ORP会迅速下降并维持在非常低的水平.在反硝化阶段, DO为0并保持不变, 而ORP在亚硝态氮还原为N2的过程中急速下降.在ORP下降的过程中, 其变化速率呈现出先快后慢的特点.在反应进行到2 h左右时, ORP的一阶导数出现极小值, 此时反应器内剩余NO2--N浓度为10 mg·L-1, 反硝化已经完成82%.因此, 此处ORP一阶导数的极小值可以作为指示反硝化即将完成的控制参数.直至下一周期开始, DO和ORP的测定值及一阶导数呈现相同的变化规律.
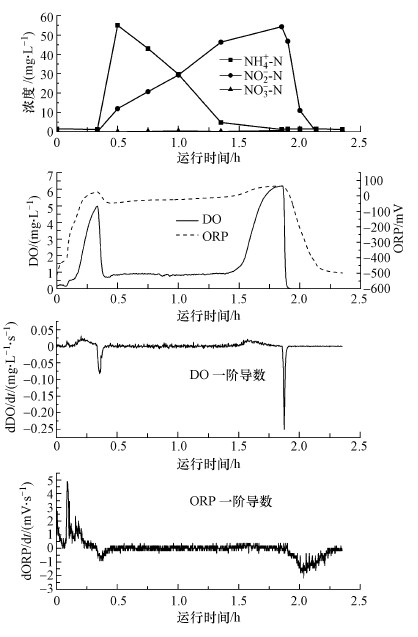 |
| 图 5 一个SBR周期内NH4+-N、NO2--N、NO3--N、DO和ORP的变化趋势 Fig. 5 Evolution of NH4+-N, NO2--N, NO3--N, DO and ORP during one SBR cycle |
利用DO的一阶导数指示短程硝化终点的原因是:在好氧短程硝化过程中, AOB氧化氨氮会消耗溶解氧, 当曝气增加的溶解氧与AOB的耗氧量达到动态平衡时, DO即维持相对恒定并保持在一个较低的水平.由于AOB氧化氨氮的速率会随着SBR内氨氮含量的减少而不断降低, 所以好氧速率小于供氧速率时, 会造成DO的上升.当接近反应终点时, 由于氨氮接近消耗完毕, AOB的耗氧速率几乎接近于零, 此时造成DO的实测值迅速升高.因此, DO突然升高会导致DO一阶导数达到一个峰值, 这个转折点可以看作是短程硝化反应进行完全的标志(Guo et al., 2009; Zanetti et al., 2012).在缺氧反硝化阶段, ORP快速下降的原因是由于反硝化菌利用外加有机碳源, 将系统内氧化态物质如NO2--N、NO3--N还原为N2, 氧化态物质迅速减少导致了ORP的下降(Yang et al., 2016).反硝化接近终点时, 氧化态物质减少的速率逐步降低, 导致ORP的减少趋势减缓, 因此, 会出现ORP的一阶导数达到一个最小值(Claros et al., 2012).
试验使用的控制系统根据DO和ORP一阶导数的实时曲线变化, 可以准确控制短程硝化-反硝化脱氮的反应过程.通过实时监测DO和ORP一阶导数的转折点, 在短程硝化阶段及时停止曝气, 避免将生成的NO2--N进一步氧化为NO3--N, 有效地抑制NOB的生长.在反硝化阶段及时地结束反硝化反应, 可以有效地缩短反应周期, 提高SBR的处理负荷.此外, 预曝气阶段的设置有利于维持短程硝化/反硝化工艺的长期稳定运行.由于SBR为长期连续的运行, 在反硝化阶段结束后, 亚硝态氮和硝态氮几乎被完全去除, 而在反硝化单元添加的有机碳源会有剩余, 并且会紧接着进入下一个SBR周期的好氧硝化单元.如果对于反硝化单元结束后剩余的有机碳源进行处置, SBR内积累的有机碳源会逐渐增加, 并且会对短程硝化的稳定运行造成影响, 还会导致反应器中产生大量泡沫, 影响出水的水质.因此, 预曝气的设置会除掉上一周期剩余的有机碳源, 避免对SBR的脱氮效率产生影响.
3.3 进水浓度对反应器的影响在进水浓度对反应器的影响试验中, 进水氨氮浓度分别为250、500、750、1000 mg·L-1, 并维持反应器的体积交换率为0.1.具体试验结果如图 6所示, 在4种进水浓度下, 反应器的氨氮去除效率没有受到较大影响, 出水氨氮浓度均低于1 mg·L-1, 短程硝化效果稳定, NAR均保持在98%以上, NO3--N浓度在整个反应过程中均无明显积累.随着进水氨氮浓度的升高, 4种进水浓度下的氨氧化速率分别为25.35、35.25、37.24和44.58 mg·L-1·h-1.说明随着进水浓度的提高, 反应器的氨氧化速率呈现上升的趋势, AOB氧化氨氮的速率与基质浓度有关, 在试验进水氨氮浓度变化范围内, 基质浓度越高, 其氧化氨氮的速率越快.
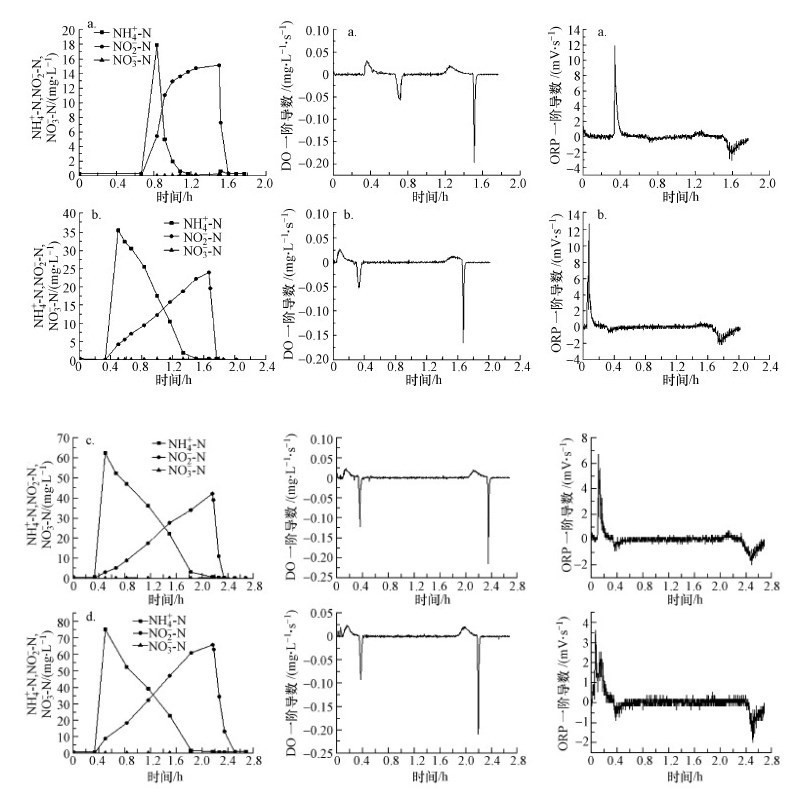 |
| 图 6 进水氨氮浓度对反应器的影响 Fig. 6 The effect of influent concentration on reactor (a.250 mg·L-1, b.500 mg·L-1, c.750 mg·L-1, d.1000 mg·L-1) |
在4种不同的进水浓度条件下, DO和ORP的一阶导数都呈现出相同的变化规律, 说明实验设置的进水浓度梯度变化不会对DO与ORP的一阶导数变化规律产生严重的影响.在短程硝化终点和反硝化终点处, DO与ORP的一阶导数均出现了极值, 并且在4种进水浓度条件下, 极值基本维持稳定.如表 2所示, DO和ORP的一阶导数不随进水浓度的变化剧烈波动.因此, 利用DO和ORP的一阶导数极值作为控制阈值是稳定可行的.
| 表 2 进水氨氮浓度对控制参数的影响 Table 2 The effect of influent concentration on control parameters |
SBR在第3阶段使用参数控制维持短程硝化的稳定运行, 主要是对曝气时间进行实时控制, 抑制NOB的生长.为了验证过度曝气对短程硝化稳定性的影响, 在SBR运行的第57 d进行了过度曝气试验(图 7), 检验在过度曝气的运行条件下氨氮、亚硝态氮、硝态氮浓度的变化情况, 以间接反映NOB的抑制效果.
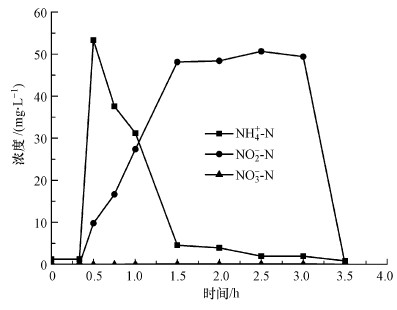 |
| 图 7 过度曝气对短程硝化的影响 Fig. 7 The influence of excessive aeration on nitritation |
在所示的试验周期内, 关闭参数控制模式, 设定好氧曝气的时间为2.5 h.SBR进水后, 氨氮初始浓度为55 mg·L-1, 经过约1 h的反应, 氨氮浓度降至4.5 mg·L-1, NO2--N浓度升高至48.1 mg·L-1, 短程硝化反应基本进行完毕.此时没有关闭曝气, 继续维持曝气1.5 h, 在此期间内, 氨氮浓度继续下降, 但幅度很小, 在关闭曝气时氨氮浓度降至1.9 mg·L-1, 基本反应完全, NO2--N浓度基本维持不变, 没有出现被NOB消耗而浓度减小的趋势.同样, NO3--N浓度仍然维持较低水平, 保持在1 mg·L-1以下, 没有出现NO3--N积累的现象.这说明反应器在短暂的过度曝气条件下, 仍然可以维持短程硝化反应, 不会失稳而发生全程硝化反应.
3.5 主要菌群分析本研究中, SBR对氨氮的平均去除率达到97%以上, 良好氨氮去除性能主要与系统内优势微生物菌群的构成密切相关.为了进一步深入了解短程硝化-反硝化工艺表现出良好的脱氮效果的微生物学机理, 本文对接种污泥(1#)、驯化的全程硝化-反硝化污泥(2#)、反应器运行期间排出的污泥(3#)和短程硝化-反硝化SBR反应器内稳定期间的污泥(4#)进行了16S rDNA分析.变形菌门菌群(Proteobacteria)是废水生物处理系统中常见的主要种群, 包含多种代谢种类, 在降解有机物的同时完成脱氮的功能(信欣等, 2016; 毛巍等, 2014).基于16S rDNA基因序列同源性的系统发育分析表明, 所有的AOB系统发育都比较单一, 均属于变形菌门(Proteobacteria)的β和γ亚纲(毛巍等, 2014; 李彭等, 2014; 李嘉懿等, 2018).此外, 涉及到脱氮的菌群还包括Nitrospirae门, 参与硝化反应的NOB属于Nitrospirae门(Wang et al., 2016).
Heatmap图是根据物种或样本间丰度的相似性进行聚类, 以颜色梯度来表征二维矩阵或表格中的数据大小, 并呈现SBR中群落物种组成信息, 可使高丰度和低丰度的物种分块聚集, 通过颜色变化与相似程度来反映不同分组(或样本)在各分类水平上群落组成的相似性和差异性.根据群落Heatmap图分析结果(图 8)在属的级别上对微生物进行分类和对比, 实验过程中不同阶段的污泥样品(1#、2#和4#)的微生物构成有不同程度的差异性.图中横坐标为样本名, 纵坐标为物种名, 绿色说明物种所占的丰度低, 红色表明物种所占的丰度高, 图中矩阵中的数字为该物种的丰度.试验中重点研究的AOB属于Nitrosomonas属, NOB属于Nitrospira属.从图 8结果可以看出, 接种的原泥(1#)和驯化的全程硝化污泥(2#)中均含有AOB和NOB, 在短程硝化-反硝化SBR中(4#)可以检测到AOB, 但NOB的含量极少.检测结果说明了原泥经过好氧驯化为全程硝化反硝化污泥后, AOB的丰度有了大幅度提高, NOB几乎保持不变.随后, 通过对SBR运行条件的抑制, SBR中的污泥被驯化为短程硝化反硝化污泥后, AOB的丰度进一步提高, 而NOB几乎完全被淘汰出SBR, 证明了试验操作条件对NOB抑制的有效性.
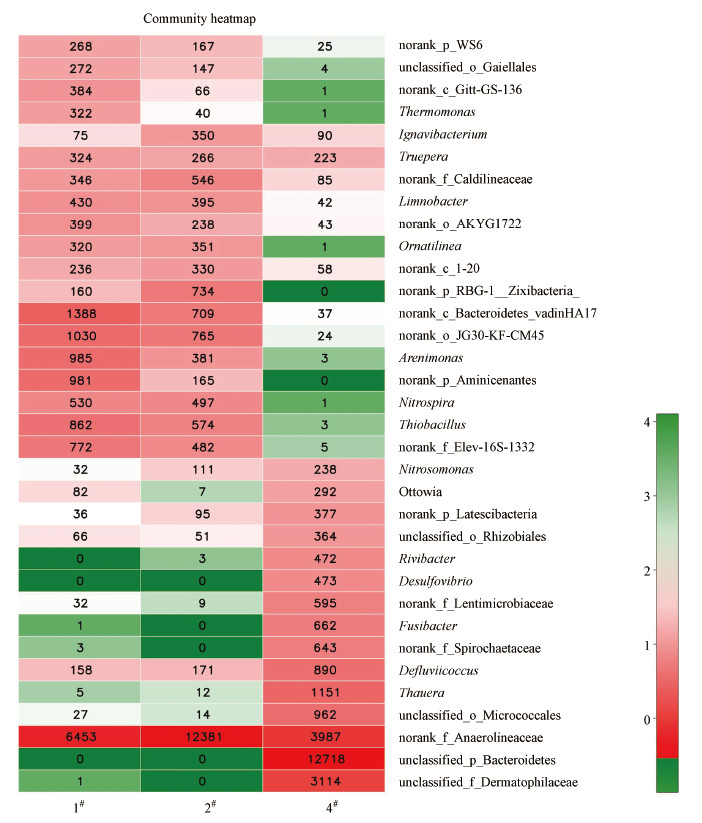 |
| 图 8 污泥样品微生物菌群的heatmap图 (属水平; 接种污泥(1#)、全程硝化-反硝化污泥(2#)和短程硝化-反硝化污泥(4#)) Fig. 8 Relative abundance of bacterial community of sludge samples at genus levels (seed sludge (1#), nitrification-denitrification sludge (2#) and nitritation-denitrification sludge (4#)) |
根据检测结果, 为了统计各样本OTU聚类情况和对应物种分类学谱系, 可以进行OTU物种分类统计, 量化各个物种在微生物样品中的含量.本试验中样品的OUT物种分类统计结果如表 3所示.从表中数据可以看出, 接种的原泥中含有大量的NOB和少量的AOB.但经过好氧驯化培养, 在全程硝化污泥中, NOB仍然是优势菌种.而经过严格的条件控制和一段时间的驯化, 在短程硝化-反硝化SBR中, AOB的丰度大幅度提高, 而NOB的丰度几乎为0.通过对微生物群落的分析, 证明利用本研究中的控制方法, 可以快速启动短程硝化SBR, 并保证稳定的脱氮效果.
| 表 3 污泥样品OUT物种分类统计 Table 3 OTU analysis of sludge samples at species levels |
1) 在SBR的连续培养工艺中, 保持反应器温度为29~30 ℃, 维持好氧阶段的初始pH>8.2, 使SBR在反应过程中具有较高的FA, 可以有效地抑制NOB的生长, 并且通过定期排泥保持合适的SRT, 将NOB逐步排出反应器, 最终实现快速启动短程硝化-反硝化SBR.整个实验期间, SBR对氨氮的去除率维持在97%以上, NAR值可长期稳定在98%以上.
2) 在短程硝化-反硝化的反应进程中, DO与ORP都表现出周期性的变化规律, 它们的一阶导数分别在短程硝化和反硝化结束前出现一个转折点, 可以用来实时控制SBR的运行.一方面可以避免短程硝化阶段的过度曝气, 抑制NOB的生长; 另一方面可以有效地缩短SBR的运行周期, 提高氨氮的处理负荷.
3) 通过对试验不同阶段污泥种群构成的分析, 证明在本试验条件下, 原泥中AOB的丰度逐步提升, NOB逐渐被淘汰出SBR.因此, 可利用参数控制模式快速启动短程硝化SBR, 并保证稳定的脱氮效果.
Anthonisen A C, Loehr R C, Prakasam T B, et al. 1976. Inhibition of nitrification by ammonia and nitrous acid[J]. Journal-Water Pollution Control Federation, 48(5): 835–852.
|
Claros J, Serralta J, Seco A, et al. 2012. Real-time control strategy for nitrogen removal via nitrite in a SHARON reactor using pH and ORP sensors[J]. Process Biochemistry, 47(10): 1510–1515.
DOI:10.1016/j.procbio.2012.05.020
|
丁文川, 吴丹, 曾晓岚, 等. 2012. 不同曝气量对SBBR短程硝化微生物特性及氮转化的影响[J]. 环境科学学报, 2012, 32(9): 2112–2118.
|
Daverey A, Su S H, Huang Y T, et al. 2013. Partial nitrification and anammox process:a method for high strength optoelectronic industrial wastewater treatment[J]. Water Research, 47(9): 2929–2937.
DOI:10.1016/j.watres.2013.01.028
|
高大文, 彭永臻, 杨庆, 等. 2003. 应用实时控制实现和稳定短程硝化反硝化[J]. 中国给水排水, 2003, 19(12): 1–5.
DOI:10.3321/j.issn:1000-4602.2003.12.001 |
高景峰, 彭永臻, 王淑莹, 等. 2001. 以DO、ORP、pH控制SBR法的脱氮过程[J]. 中国给水排水, 2001, 17(4): 6–11.
DOI:10.3321/j.issn:1000-4602.2001.04.002 |
Guo J H, Peng Y Z, Wang S Y, et al. 2009. Effective and robust partial nitrification to nitrite by real-time aeration duration control in an SBR treating domestic wastewater[J]. Process Biochemistry, 44(9): 979–985.
DOI:10.1016/j.procbio.2009.04.022
|
Hulle S W V, Volcke E I, Teruel J L, et al. 2007. Influence of temperature and pH on the kinetics of the Sharon nitritation process[J]. Journal of Chemical Technology & Biotechnology Biotechnology, 82(5): 471–480.
|
Kornaros M, Dokianakis S N, Lyberatos G. 2010. Partial nitrification/denitrification can be attributed to the slow response of nitrite oxidizing bacteria to periodic anoxic disturbances[J]. Environmental Science & Technology, 44(19): 7245.
|
李嘉懿, 杜青平, 刘嵩, 等. 2018. 有机负荷对垃圾沥滤液短程硝化系统影响及微生物相探析[J]. 环境科学学报, 2018, 38(6): 2334–2341.
|
李彭.2014.不同电子供体深度脱氮工艺及微生物群落特征研究[D].北京: 清华大学
|
刘宏, 南彦斌, 李慧, 等. 2018. 间歇曝气模式下曝气量对短程硝化恢复的影响[J]. 环境科学, 2018, 39(2): 865–871.
|
刘宏, 彭永臻, 卢炯元, 等. 2017. 温度对间歇曝气SBR短程硝化及硝化活性的影响[J]. 环境科学, 2017, 38(11): 4656–4663.
|
刘文龙, 彭永臻, 苗圆圆, 等. 2015. 好氧饥饿对膨胀污泥硝化性能及污泥特性的影响[J]. 化工学报, 2015, 66(3): 1142–1149.
|
毛巍.2014.短程硝化工艺的实现与耐盐驯化及其微生物群落结构变化研究[D].杭州: 浙江大学
|
彭永臻. 2011. SBR法污水生物脱氮除磷及过程控制[M]. 北京: 科学出版社.
|
Pérez J, Lotti T, Kleerebezem R, et al. 2014. Outcompeting nitrite-oxidizing bacteria in single-stage nitrogen removal in sewage treatment plants:a model-based study[J]. Water Research, 66: 208.
DOI:10.1016/j.watres.2014.08.028
|
Regmi P, Miller M W, Holgate B, et al. 2014. Control of aeration, aerobic SRT and COD input for mainstream nitritation/denitritation[J]. Water Research, 57(5): 162–171.
|
Wang B, Peng Y, Guo Y, et al. 2016. Illumina MiSeq sequencing reveals the key microorganisms involved in partial nitritation followed by simultaneous sludge fermentation, denitrification and anammox process[J]. Bioresource Technology, 207: 118.
DOI:10.1016/j.biortech.2016.01.072
|
吴军, 张悦, 徐婷, 严刚. 2016. AOB溶解氧亲和力低于NOB条件下序批反应器中NOB淘汰的实现机制[J]. 中国环境科学, 2016, 36(12): 3583–3590.
DOI:10.3969/j.issn.1000-6923.2016.12.008 |
信欣, 管蕾, 姚艺朵, 等. 2016. 低DO下AGS-SBR处理低COD/N生活污水长期运行特征及种群分析[J]. 环境科学, 2016, 37(6): 2259–2265.
|
邢丽贞, 郑德瑞, 孔进, 等. 2016. 高氨氮废水短程硝化过程中N2O释放试验研究[J]. 环境科学学报, 2016, 36(4): 1260–1265.
|
徐婷, 王丽, 吴军. 2016. 不同pH条件下短程硝化序批实验和数学模拟[J]. 环境工程学报, 2016, 10(6): 2840–2846.
|
杨庆, 杨玉兵, 杨忠启, 黄斯婷, 周薛扬, 刘秀红. 2018. 溶解氧对短程硝化稳定性及功能菌群的影响[J]. 中国环境科学, 2018, 38(9): 3328–3334.
DOI:10.3969/j.issn.1000-6923.2018.09.016 |
Yang J, Trela J, Plaza E, et al. 2016. Oxidation-reduction potential (ORP) as a control parameter in a single-stage partial nitritation/anammox process treating reject water[J]. Journal of Chemical Technology & Biotechnology, 91(10): 2582–2589.
|
张功良, 李冬, 张肖静, 等. 2014. 低温低氨氮SBR短程硝化稳定性试验研究[J]. 中国环境科学, 2014, 34(3): 610–616.
|
周露, 郎建, 李桥. 2012. 短程硝化反硝化快速启动及稳定运行研究[J]. 土木建筑与环境工程, 2012, 34(5): 132–135.
|
祝贵兵, 彭永臻, 郭建华. 2008. 短程硝化反硝化生物脱氮技术[J]. 哈尔滨工业大学学报, 2008, 1(10): 1552–1557.
DOI:10.3321/j.issn:0367-6234.2008.10.009 |
Zanetti L, Frison N, Nota E, et al. 2012. Progress in real-time control applied to biological nitrogen removal from wastewater:A short-review[J]. Desalination, 286(1): 1–7.
|
 2019, Vol. 39
2019, Vol. 39


