2. 贵州师范大学, 地理与环境科学学院, 贵阳 550001
2. Department of Geography and Environmental Science, Guizhou Normal University, Guiyang 550001
锑(Sb)是位于第五周期第ⅣA族的类金属元素, 其化学性质与砷(As)类似, 已被广泛应用于工业产品中, 如阻燃剂、电池、合金和催化剂等(Filella et al., 2002).锑污染主要来源于采矿、冶炼和工业排放等过程, 且常常伴随着砷污染.随着人们对锑的潜在毒性的认识, 土壤中锑元素的含量、污染特征和赋存形态越来越受到重视.美国环境保护署和欧共体均把锑视为潜在致癌物和优先污染物(Fu et al., 2016; Xiao et al., 2017).我国已发现的锑储备量和开采量都为世界之最, 其中位于18个省或自治区的114个锑矿的锑产量占全球的53%(He et al., 2012), 由锑矿开采和冶炼带来的土壤污染问题已不容忽视.如刘灵飞等(2013; 2014)对锑矿冶炼厂周边农田土壤的研究发现, 土壤耕作层均属于重度污染且对作物种植存在一定风险.
土壤微生物在土壤生态系统中属于优势物种, 在生物地球化学循环中起着关键性的作用.土壤微生物的多样性、群落结构组成及数量受到多种因素的影响而发生改变, 如pH、温度、有机质、海拔等.特别地, 金属和类金属的污染极易影响微生物群落结构的组成、分布和丰度(Liu et al., 2015; Kaci et al., 2016; Merlin et al., 2016; Wang et al., 2016), 如Pb、Zn可以影响微生物群落多样性指数(Fan et al., 2016), Cr和Cd则可以改变细菌群落结构(Zhang et al., 2016).目前,锑污染对微生物群落结构的影响也逐渐被人们重视起来, 如Wang等(2016)对湖南省锡矿山锑矿周边Sb和As污染土壤细菌群落的研究发现, 较高浓度的Sb和As对细菌群落组成和多样性有显著影响.据报道, 半坡锑矿和锑矿冶炼厂周边不同环境介质中Sb和As含量较高且不同污染组分分布差异较大(宁增平等, 2009; Zhang et al., 2016; 王丽等, 2017).前人对半坡锑矿周边土壤表层、尾矿、河流和沉积物等环境介质与微生物间的关系进行了较多研究.如Xiao等(2016)研究了独山某锑矿冶炼厂周边河流、沉积物中微生物群落特征及其对Sb和As污染的响应;Sun等(2017)研究了半坡锑矿周边不同浓度Sb污染土壤对微生物群落组成和多样性的影响, 结果表明, 高浓度Sb和As对微生物多样性指数存在负面影响, 当As含量超过300 mg·kg-1时对多样性指数影响较小.而针对土壤垂直剖面Sb和As分布特征及其与土壤微生物关系的研究目前报道较少, 如Xiao等(2017)对锑矿周边两种不同类型土壤剖面微生物进行了部分研究.
半坡锑矿是我国大型锑矿之一, 位于贵州省独山县, 处在湘黔锑矿带上.长期的开采使周边土壤产生了严重的锑污染, 而稻田土壤Sb的地球化学行为及微生物对于Sb污染的适应机制是锑污染下微生物生态修复的关键.因此, 本文以独山县半坡锑矿和小河村某锑矿冶炼厂周边的农田土壤为研究对象, 通过MiSeq高通量测序结合数量生态学方法, 探讨锑矿采冶区周边稻田土壤剖面微生物多样性, 并通过数量生态学的方法分析不同形态Sb和As在稻田土壤剖面的地球化学行为及其对微生物群落结构的影响, 以进一步了解稻田土壤剖面微生物对于Sb和As污染的适应机制, 为Sb和As污染稻田土壤的微生物生态修复提供参考依据.
2 材料与方法(Materials and methods) 2.1 研究区域概况贵州半坡锑矿位于贵州省独山县, 距城东约为14 km, 矿区面积2 km2, 锑矿资源丰富, 锑矿生产规模为1.50×104 t·a-1.锑矿冶炼厂位于城关镇小河村, 距县城约4 km处.区内地势南低北高, 相对高差约100~300 m.研究样地位于独山县小河(107°33′14″~107°33′22″E, 25°48′4″~25°48′11″N)和半坡(107°36′50″~107°37′41″E, 25°47′42″~25°48′44″N)两个区域.研究区属中亚热带湿润季风性气候, 四季分明, 雨量充沛, 年平均气温在15 ℃左右, 年降雨量1346 mm, 集中分布于4—8月.区内水资源分布不均, 洪、枯水季节变化性大, 常导致干旱发生(卢云祥, 1997).
2.2 采样方法与指标测定 2.2.1 土壤样品采集及其理化性质测定于2018年3月对独山县半坡锑矿和小河村某锑矿冶炼厂周边的农田进行土壤样品采集, 共挖取了5个宽、深各为1 m的土壤剖面.按照稻田土壤剖面分层的不同, 对水耕熟化层(tc1)、渗育层(tc2)、犁底层(tc3)和水耕淀积层(tc4)等土样进行自下而上分层采集.同层土样采用“S”型取样方法将土壤混合成1个土样, 另外有2个剖面仅含有3个土层, 5个剖面共18个土壤样品.现场采集的土样分为两份:一份取约5 g装入无菌采样袋, 放入含生物冰袋的泡沫箱内, 用于16S rRNA测序;另一份取约2 kg带回实验室分两份进行处理:一份自然风干过筛后, 用于土壤理化性质的测定, 另一份储存于4 ℃冰箱备用.
土壤总碳、总氮、总氢和总硫采用元素分析仪Vario microcube(Elementar)测定;pH采用玻璃电极法(水土比2.5:1)测定;土壤水分含量采用烘箱(105±2) ℃烘干法测定;SOM采用浓硫酸-重铬酸钾外加热法(鲍士旦, 2000)测定;总Fe和Fe(Ⅱ)采用盐酸浸提-邻菲罗啉比色法(Tamura et al., 2015; Liu et al., 2015)测定;总Sb和总As采用氢化物原子荧光法(AFS-933, 北京吉天)测定;Sb(Ⅲ)和As(Ⅲ)采用柠檬酸浸提氢化物原子荧光仪测定(Fuentes et al., 2003; 唐敏等, 2010; Ge et al., 2013), Sb(Ⅴ)和As(Ⅴ)的含量分别为总量减去Sb(Ⅲ)和As(Ⅲ)的量.
2.2.2 土壤微生物分析DNA提取及质量控制:根据E. Z. N. AⓇ soil试剂盒(Omega Bio-tek, Norcross, GA, U.S)说明书进行总DNA抽提, DNA浓度和纯度利用NanoDrop2000进行检测, 利用1%琼脂糖凝胶电泳检测DNA提取质量.
文库制备:用338F(ACTCCTACGGGAGGC AGCAG)和806R(GGACTACHVGGGTWTCTAAT)引物对V3~V4可变区进行PCR扩增(ABIGeneAmpⓇ 9700型PCR仪), 扩增程序为:95 ℃预变性3 min;95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s, 27个循环;最后72 ℃延伸10 min.扩增体系为20 μL, 包括4 μL 5×FastPfu缓冲液, 2 μL 2.5 mmol·L-1 dNTPs, 0.8 μL引物(5 mmol·L-1), 0.4 μL FastPfu聚合酶;10 ng DNA模.
Illumina Miseq测序:使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA GelExtractionKit(Axygen Biosciences, Union City, CA, USA)进行纯化, Tris-HCl洗脱, 2%琼脂糖电泳检测.利用QuantiFluorTM-ST(Promega, USA)进行检测定量.根据Illumina MiSeq平台(Illumina, SanDiego, USA)标准操作规程将纯化后的扩增片段构建PE2×300的文库.构建文库步骤如下:①连接“Y”字形接头;②使用磁珠筛选去除接头自连片段;③利用PCR扩增进行文库模板的富集;④氢氧化钠变性, 产生单链DNA片段.利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司).
2.3 数据处理与分析 2.3.1 微生物数据处理原始测序序列使用Trimmomatic软件质控, 使用FLASH软件进行拼接:①设置50 bp的窗口, 如果窗口内的平均质量值低于20, 从窗口开始截去后端碱基, 去除质控后长度低于50 bp的序列;②barcode需精确匹配, 引物允许2个碱基的错配, 去除模糊碱基;③根据重叠碱基overlap将两端序列进行拼接, overlap需大于10 bp.去除无法拼接的序列.使用UPARSE软件(version7.1http://drive5.com/uparse/), 根据97%的相似度对序列进行OTU聚类;使用UCHIME软件剔除嵌合体.利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释, 比对Silva数据库, 设置比对阈值为70%.
2.3.2 数据分析采用R语言中的最小显著差异法(LSD)检验土壤理化因子在不同深度土壤中的差异情况, 利用单因素分析方法(One-Way ANOVA)分析不同样点之间各指标的差异显著性, 各个指标之间采用Pearson相关系数法进行相关分析.利用R语言ape包、vegan包、psych包和reshape2包对细菌门水平进行主坐标分析(Principal Co-ordinates Analysis, PCoA)、冗余分析(Redundancy Analysis, RDA), 用relaimpo包进行相对重要性分析.利用Python2.7软件对细菌属进行水平的LEfSe分析(LDA Effect Size).利用Gephi 0.9.2软件进行共生网络图的绘制.
3 结果与分析(Results and analysis) 3.1 不同土层土壤剖面理化性质差异分析由表 1可知, 土壤有机碳、总碳、总氮、总氢和总硫含量均随着土壤剖面深度的加深而减少.土壤pH随土壤深度的加深逐渐由弱酸性、中性变化到弱碱性.5个采样点水耕熟化层有机碳的含量为42.68 g·kg-1, 较渗育层含量增加了20.12%, 较犁底层增加了202.48%.土壤全氮的变化规律与有机碳一致.所有样点的总锑含量在2.94~89.40 mg·kg-1之间, Sb(Ⅲ)含量为0.13~1.05 mg·kg-1, Sb(Ⅴ)含量最低为0.13 mg·kg-1, 最高为4.56 mg·kg-1, Sb(Ⅲ)和Sb(Ⅴ)作为生物可利用部分仅占总锑含量的很少一部分, 且总Sb、Sb(Ⅲ)和Sb(Ⅴ)均随着土层深度加深而逐渐降低.总砷含量为1.15~9.85 mg·kg-1, As(Ⅲ)含量部分未检出, 最高达0.51 mg·kg-1;As(Ⅴ)含量最低为0.32 mg·kg-1, 最高为1.15 mg·kg-1, 且随着深度的加深基本不变.Fe(Ⅱ)含量在10.5~85.4 mg·kg-1之间, 在各土层差异较为显著, 总铁含量在101.1~504.4 mg·kg-1之间, 总Fe和Fe(Ⅱ)含量均随着土层深度加深逐渐下降.
| 表 1 稻田土壤垂直剖面的和理化特征 Table 1 Physicochemical factors of vertical section of paddy soil |
在97%分类水平下, 不同土层Sobs指数、Chao指数和Shannon指数存在差异, 但均未达到显著水平(表 2).Sobs指数表示观察到的物种数目, 均在tc1达到最大值, 在tc3达到最小值.Chao指数可以反映群落丰富度, 5个剖面的Chao指数均在tc1达到最大值, 在tc3达到最小值, 具体表现为:tc1>tc4>tc2>tc3.Shannon指数作为评价物种丰富度和均匀度的指数, 其值均在tc1处最大, 剖面2的最小值出现在tc2处, 其余剖面均在tc3处最小.Simpson指数可表现群落的优势种突出情况, 其值在剖面2的tc2处最大, 在剖面3的tc1处最小, 平均值在tc2和tc3处较大, 在tc1和tc4处较小.
| 表 2 不同土层群落丰度和多样性指数 Table 2 Community abundance and diversity index of different soil layers |
18个土壤样品中共检测到42门、93纲、211目、378科、583属、1181种.垂直剖面土壤样品在门水平的主要优势菌门有(图 1a):变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、热袍菌门(Thermotogae)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)等.丰度最高的前8个菌门在细菌群落中占主导地位, 占所有菌门的93.5%以上.另外, 对前10个优势菌门进行主坐标分析(图 1b), 发现变形菌门、浮霉菌门、厚壁菌门、芽单胞菌门、拟杆菌门、酸杆菌门和放线菌门主要分布在tc1和tc2处, 其中, 变形菌门、酸杆菌门和放线菌门为优势菌门;绿弯菌门、硝化螺旋菌门和热袍菌门则主要分布tc3和tc4两层, 绿弯菌门为优势菌门.
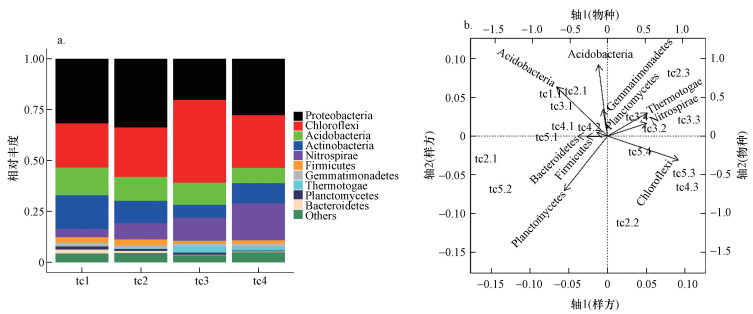 |
| 图 1 稻田土壤细菌门水平相对丰度(a)和群落分布(b, tc2.3代表剖面2的第3层土壤, 其余类同) Fig. 1 Relative abundance of bacterial gate level in paddy soil(a) and community distribution(b) |
为了进一步分析细菌群落结构, 对583个属中相对丰度大于1%的属作LEfSe分析, 只显示满足线性判别分析(LDA)显著性阈值大于3.0的差异指示种(图 2).LEfSe分析表明, 4个土层共有28个差异指示种, 其中, tc1有13个, tc2有2个, tc3有8个, tc4有5个, 以tc1中差异指示种数量最多, 丰度最高.如tc1的差异指示种主要有:疣微菌门、α-变形菌纲、Subgroup_3目、棒杆菌目(Corynebacteriales)、微球菌目(Micrococcales)、丙酸杆菌目(Propionibacteriales)和红杆菌目(Rhodospirillales);tc2主要有:β-变形菌纲和单胞菌目(Nitrosomonadales);tc3主要有:热袍菌门、热袍菌纲、Subgroup_2目和栖热袍菌目(Thermotogales);tc4则主要有:硝化螺旋菌门和硝化螺旋菌纲.其中, tc1~tc4土层贡献最大的细菌种属分别为α-变形菌纲、β-变形菌纲、热袍菌科、硝化螺旋菌门.
 |
| 图 2 属分类水平线性判别分析(LDA)(a)及属水平LEfSe分析(b) Fig. 2 Classification level discriminant analysis (LDA)(a) and genus level LEfSe analysis(b) |
利用冗余(RDA)分析和相对重要性分析探讨土壤重金属及理化指标对细菌α多样性指数的影响大小和响应机制.由图 3a可知, 第一、第二主轴共解释细菌多样性指数方差变异的78.05%.Shannon指数与总As和As(Ⅲ)呈正相关, 与总Sb、Sb(Ⅲ)、Fe(Ⅱ)、总Fe和Sb(Ⅴ)等呈负相关.Simpson指数与总As和As(Ⅲ)呈正相关, 与其他理化因子均呈负相关.Chao指数与pH、总As和As(Ⅴ)呈正相关, 与Sb(Ⅲ)、As(Ⅲ)、Sb(Ⅴ)、总Sb、Fe(Ⅱ)、总Fe和SOM呈负相关.由图 3b可知, 总As对Shannon指数和Simpson指数影响最大, 相对重要性分别为0.22和0.21;Fe(Ⅱ)和TS对Chao指数影响最大, 相对重要性均为0.16.
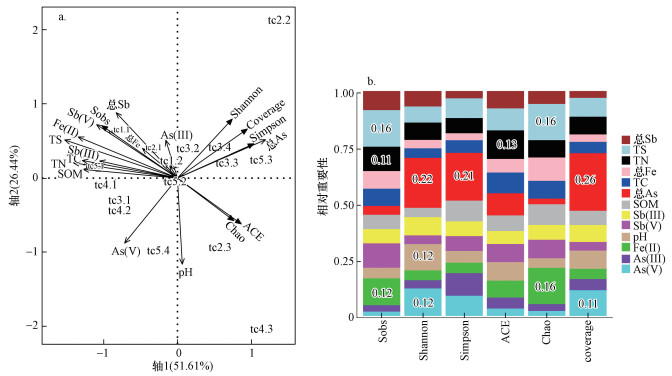 |
| 图 3 Alpha多样性指数与理化因子的冗余分析(a)和理化因子对各多样性指数的相对重要性(b, 图中仅对相对重要性大于10%的进行标注) Fig. 3 Redundancy analysis of alpha diversity index and physical and chemical factors(a) and the relative importance of physical and chemical factors to Alpha diversity index(b) |
为探究土壤理化因子对细菌群落结构的影响, 在门分类水平上进行RDA分析和相对重要性分析.由图 4a可知, RDA分析第一主轴和第二主轴共解释细菌门分类水平方差的61.71%.tc1和tc2的优势菌门变形菌门与As(Ⅲ)、Fe(Ⅱ)、总Fe、总Sb、Sb(Ⅴ)、Sb(Ⅲ)和SOM呈正相关, 与总As、As(Ⅴ)和pH呈负相关;酸杆菌门则与Sb(Ⅴ)、总Sb、Sb(Ⅲ)、As(Ⅴ)、总Fe及Fe(Ⅱ)呈正相关, 与pH、总As和As(Ⅲ)呈负相关;放线菌门与Sb(Ⅴ)、总Sb、Sb(Ⅲ)、Fe(Ⅱ)、总Fe、As(Ⅲ)和As(Ⅴ)均呈正相关, 与总As和pH呈负相关.tc3和tc4的优势菌门绿弯菌门则与总As和pH呈正相关, 与Sb(Ⅴ)、总Sb、Sb(Ⅲ)、Fe(Ⅱ)、总Fe、As(Ⅲ)和As(Ⅴ)均呈负相关.由图 4b可知, pH对变形菌门、绿弯菌门和浮霉菌门影响最大, 相对重要性分别为0.13、0.12和0.27;总Sb对酸杆菌门和浮霉菌门影响最大, 相对重要性均为0.15;Sb(Ⅴ)对酸杆菌门和芽单胞菌门影响最大, 相对重要性分别为0.15和0.17;总As对厚壁菌门、热袍菌门和拟杆菌门影响最大, 相对重要性分别为0.25、0.23和0.17;As(Ⅲ)对变形菌门、酸杆菌门和芽单胞菌门影响最大, 相对重要性分别为0.13、0.14和0.14.
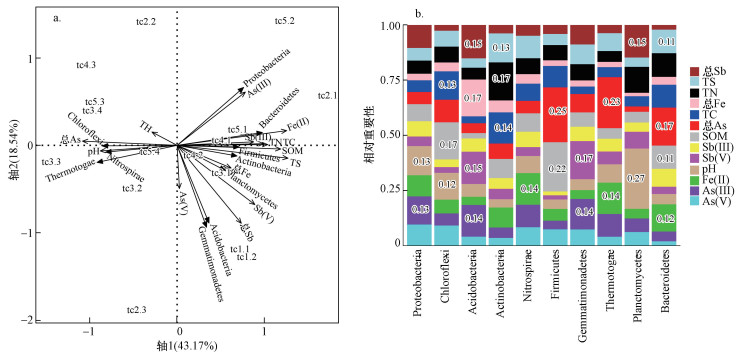 |
| 图 4 基于门水平优势菌门与土壤理化因子的冗余分析(a)和理化因子对优势菌门的相对重要性(b) Fig. 4 Redundancy analysis of soil-dominant phylum and physicochemical factors based on phylum level(a) and The relative importance of physical and chemical factors to dominant bacteria(b) |
利用介数中心性分析法(Betweenness Centrality, BC)进一步分析土壤理化因子对细菌群落的影响.筛选出相对丰度大于1%且与各理化因子具有显著相关性的OTU类群, 绘制共生网络图(Co-occurrence network).如图 5所示, 网络图共有9个模块、53个节点、85条边, 其平均度系数为3.208, 模块化系数为1.181, 平均路径长度为3.844.其中, 模块Ⅰ (紫色)主要由27个OTU及As(Ⅲ)组成;模块Ⅱ(灰色)主要由pH、TC、TN、TS、SOM、Fe(Ⅱ)和总Fe及6个OTU组成;模块Ⅲ(绿色)由4个OTU组成.由共生网络图可知, OTU822、1295、3422、712、1221、3363、452、1742和839与pH呈正相关, 而OTU3095、2658和2440则与pH呈负相关.Sb相关污染组分中Sb(Ⅲ)与OTU874和2920存在显著正相关性, 与OTU2920呈负相关;而Sb(Ⅴ)与OTU1932呈正相关, 与OTU3467呈负相关;As相关污染组分中, As(Ⅴ)与OTU3269和535呈正相关, As(Ⅲ)与OTU3377呈负相关, 而总As与OTU2803呈正相关, 与OTU1326、1327、2405和1474呈负相关;总Fe与OTU1295、1670、1473、1321、1330和3274均呈负相关, Fe(Ⅱ)与OTU1433和3377呈负相关, 与OTU1912、336、1614、2502、1484、2998、2967、2320和1932呈正相关.
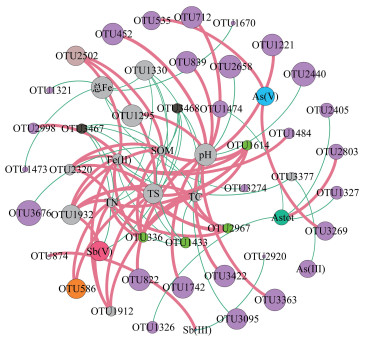 |
| 图 5 理化因子与OTUs间的共生网络图 Fig. 5 Co-occurrence network between physicochemical factors and OTUs |
Sb广泛存在于岩石圈, 且往往与As伴生形成复合污染, 土壤中Sb和As的地球化学行为往往还受其他因素的影响, 如pH、有机质及铁锰氧化物等.本研究中, 稻田土壤剖面不同土层间的理化因子存在差异且对各土层影响各不相同, 从而使各土层Sb和As的形态变化和迁移转化规律存在着较大的差异.在土壤剖面不同土层总Sb含量显著高于中国土壤的背景值(0.38~2.98 mg·kg-1)(He et al., 2012).虽然农业活动对表层土壤重金属等的迁移影响很大, 但总Sb及各形态Sb含量均随着土层深度的加深而减少, 可见表层土壤主要来源于大气沉降或者人类活动排入, 表层以下土壤由于机械截留、土壤胶体吸附等过程阻滞Sb的迁移转化, 使得Sb含量逐渐减少(项萌等, 2012).总As和As(Ⅴ)的含量在各土层分布相对稳定, 说明As可能来源于成土母岩, 这与Xiao等(2017)对锑矿周边不同类型土壤的研究结果类似.而As(Ⅲ)的含量则随着土层深度的增加而减少, 这可能是参与As(Ⅲ)的代谢和氧化微生物所引起.另外, 本研究中pH在垂直剖面各土层随着土层的加深而升高, 这可能是影响土壤Sb和As的迁移转化和生物可利用性等的重要原因(Cai et al., 2015).有研究表明, 土壤中铁的氧化物对Sb和As具有强烈的吸附力(Xi et al., 2011);另外, 酸性条件下, Sb的迁移转化相对稳定, 而弱碱性条件下, Fe(Ⅱ)和Fe(Ⅲ)的氢氧化物对Sb(Ⅴ)有很强的吸附性, 并且还能够促进Sb(Ⅴ)的还原(Sun et al., 2017).而本研究中不同土层Fe(Ⅱ)的分布具有显著性差异, 这可能是影响Sb和As地球化学行为的重要因素(Wang et al., 2012).
4.2 土壤剖面Sb和As对微生物α多样性指数的影响土壤微生物群落组成和多样性是土壤生态功能的基础, 它通过参与土壤有机质分解等过程影响土壤养分循环, 调节和指示土壤功能(Romaniuk et al., 2011).本研究中, 各土层细菌群落的α多样性指数总体上呈现出一致规律.通过相对重要性和RDA分析发现, 总As、Fe(Ⅱ)、TS、TN、As(Ⅴ)和pH是影响多样性指数的主要环境因子.高pH土壤抑制细菌生长, 本研究中pH随着土层深度的增加使得土壤由弱酸性变成弱碱性进而影响了微生物多样性.总As对Shannon和Simpson指数均具有正面影响, 这与Sun等(2017)的研究结果不一致, 这可能是土壤类型和质地不同造成的.虽然Sb(Ⅲ)、Sb(Ⅴ)及总Sb与Shannon指数、Simpson指数和Chao指数都存在负相关性, 但相对重要性均不超过10%.另外, He等(2017)研究发现, 低剂量(50 mg·kg-1)的Sb(Ⅲ)和Sb(Ⅴ)对细菌群落结构组成影响较小, 高剂量(1600 mg·kg-1)则影响较大且会显著抑制细菌群落丰度.本研究中Sb(Ⅲ)和Sb(Ⅴ)的含量均低于50 mg·kg-1, 这说明Sb(Ⅲ)、Sb(Ⅴ)和总Sb对细菌多样性指数的影响较小.
4.3 土壤剖面Sb和As对稻田土壤微生物群落结构的影响土壤微生物群落是反映土壤生态机制和稳定性的重要指标, 良好的微生物群落对维持土壤肥力和外界因素有更好的适应性(刘沙沙等, 2018).通过LEfSe分析发现, 土壤剖面不同土层微生物的分布具有显著的差异, 这种差异在一定程度上可以反映各土层的基本特征.相对重要性分析发现, As(Ⅲ)和pH对变形菌门的影响最大, RDA分析表明, 变形菌门与As(Ⅲ)呈正相关, 与pH呈负相关, 绿弯菌门与pH呈正相关.本研究中tc1和tc2的pH普遍低于tc3和tc4, 可见随着土层的加深, pH升高到一定值时会抑制变形菌门的生长, 促进绿弯菌门的生长.通过共生网络分析进一步表明, 与pH显著相关的OTU822主要存在低pH(5.96~7.42)环境中, 当土壤偏碱性时可能会抑制变形菌门黄杆菌科(Xanthobacteraceae)进而促进绿弯菌门厌氧绳菌科的生长.
微生物对Sb的相互作用主要有富集、外排、甲基化及氧化还原.目前, 有60多种Sb(Ⅲ)氧化菌株在锑矿区土壤和沉积物等环境中被分离出来并被划分到17个属水平上(Luo et al., 2011; Hamamura et al., 2013; Terry et al., 2015).在本研究中主要含有这17个属中的节杆菌属(Arthrobacter)、鞘氨醇单胞菌(Sphingomonas)、硫杆菌属(Thiobacillus)、假单胞菌属(Pseudomonas)、锰氧化菌属(Aminobacter)和不动杆菌属(Acinetobacter).此外, 还发现了未被列入这17个属的Defluviicoccus, 这值得进一步的研究验证.在本研究中Sb(Ⅲ)和Sb(Ⅴ)与细菌不同分类水平的群落间存在显著相关性, 通过相对重要性和RDA分析发现, Sb(Ⅴ)对酸杆菌门和芽单胞菌门呈正面影响, 共生网络分析进一步表明, Sb(Ⅴ)与OTU1932呈正相关, 与OTU3467和3468呈负相关, 这可能是在tc1有氧环境中分支杆菌属(Mycobacterium)的OTU1932参与了Sb(Ⅲ)的氧化, 而在tc3厌氧环境中GAL15属的OTU3467和3468则会抑制Sb(Ⅴ)的迁移转化或代谢功能.Sb(Ⅲ)虽然在门水平上对各优势菌门的相对重要性均未超过10%, 但在OTU分类水平上却有着显著相关性.例如, Defluviicoccus属的OTU874与Sb(Ⅲ)显著正相关, 这可能是因为Sb具有强烈的亲硫性和一定的亲氧性, 更易结合硫化物形成Sb2S3使得Sb(Ⅲ)相关微生物代谢更加活跃, 进而影响特征性微生物群落结构.可见, Sb(Ⅴ)在门水平上对群落结构影响较大, 而Sb(Ⅲ)虽然对群落结构影响相对较小, 但对特征微生物存在显著的相关性.
稻田土壤As的迁移转化与微生物介导的氧化还原等过程有关.有研究发现, 细菌引起As(Ⅲ)氧化的分子机制可能与Sb(Ⅲ)不同(Li et al., 2015).相对重要性和RDA分析表明, As(Ⅲ)对变形菌门呈正面影响, 对酸杆菌门和芽单胞菌门呈负面影响.通过共生网络分析发现, 总As及不同形态As均与微生物之间存在显著的相关性, As(Ⅲ)与OTU3377呈负相关, As(Ⅴ)与OTU535和OTU3269呈负相关性, OTU3377属于绿弯菌门S085纲,主要在tc3处富集, 目前还未见相关研究表明其参与As的代谢活动, 值得进一步研究.OTU3269属于β-变形菌纲并在tc2处富集, 其亚类的微生物对As(Ⅲ)具有较高的氧化速率(Li et al., 2013), 可见β-变形菌纲对As(Ⅴ)影响较为显著.另外, 有研究表明, 根瘤菌目慢生根瘤菌属(Bradyrhizobium)对As的生物有效性有重要影响(蔡林等, 2009), 而OTU1326、1327和2405均属于α-变形菌纲根瘤菌目且为tc1的差异指示种, 进一步说明这些OTUs参与了As的代谢或生物地球化学循环.可见, As(Ⅲ)在门水平上对群落结构影响较大, 而As(Ⅴ)虽然对群落结构影响相对较小, 但与特征性微生物却存在显著相关性.
土壤细菌群落是影响土壤生物功能的重要因素之一, 稻田土中铁循环过程相当活跃, 表层土壤主要有光合型铁氧化微生物, 表面下层为微氧型亚铁氧化微生物, 更深层的为硝酸盐依赖型亚铁氧化微生物(牟山, 2017).另外, 微氧型亚铁氧化菌、锑氧化菌与砷氧化菌都主要属于α-、β-和γ-变形菌纲(Edwards et al., 2003; Sobolev et al., 2014; 王年等, 2017).据报道, 羟基氧化铁是Sb的主要载体相, Sb(Ⅲ)易与不定形铁的氧化物形成联合氧化(Ashley et al., 2003).在铁还原细菌的主要类群中, 地杆菌属(Geobacter)能够通过还原铁的氧化物使吸附在表面的Sb和As发生迁移转化, 红育菌属(Rhodoferax)不仅能够异化Fe(Ⅲ)还原, 其亚类还包含了As的代谢基因, 能参与Sb和As的迁移转化过程(Xiao et al., 2016).共生网络分析发现, OTU2998与Fe(Ⅱ)和Sb(Ⅲ), OTU3377与Fe(Ⅱ)和As(Ⅲ), OTU2967与S和Sb, OTU1912与TC、TN、TS和Fe(Ⅱ)都存在显著相关性.可见Sb和As对群落结构的影响不是单一的, 而是由不同形态的Sb和As及其他理化因子共同决定的.
5 结论(Conclusions)锑矿的开采和冶炼污染了周边稻田土壤, 其垂直剖面理化因子对微生物群落具有较大的影响.总体来说, 稻田土壤垂直剖面Sb和As的来源不同, Sb主要来源于大气沉降, As主要来源于成土母岩;不同土层呈现出相应的差异指示种;Sb对多样性指数影响较小, As的影响则相对较大.另外, Sb和As对群落结构的影响不是单一的, 而是由不同形态的Sb和As及其他理化因子共同决定的.具体而言, 总As、As(Ⅴ)、TS和Fe(Ⅱ)对多样性指数有较大影响, 而总As、As(Ⅲ)、Sb(Ⅴ)、总Sb和pH则为影响细菌门水平的主要因子.Sb(Ⅲ)和As(Ⅴ)虽然对群落结构的影响相对较小, 但对特征性微生物却存在显著相关性.
Ashley P M, Craw D, Graham B P, et al. 2003. Environmental mobility of antimony around mesothermal stibnite deposits, New South Wales, Australia and southern New Zealand[J]. Journal of Geochemical Exploration, 77(1): 1–14.
DOI:10.1016/S0375-6742(02)00251-0
|
鲍士旦. 2000. 土壤农化分析(第3版)[M]. 北京: 中国农业出版社.
|
蔡林, 王革娇. 2009. 抗砷性微生物及其抗砷分子机制研究进展[J]. 微生物学通报, 2009, 36(8): 1253–1259.
|
Cai Y, Li L, Zhang H. 2015. Kinetic modeling of pH-dependent antimony(Ⅴ) sorption and transport in iron oxide-coated sand[J]. Chemosphere, 138: 758–764.
DOI:10.1016/j.chemosphere.2015.07.067
|
杜璨, 许晨阳, 王强, 等. 2017. 秦岭红桦林土壤细菌群落剖面分布特征及其影响因素[J]. 环境科学, 2017, 38(7): 3010–3019.
|
Edwards K J, Rogers D R, Wirsen C O, et al. 2003. Isolation and characterization of novel psychrophilic, neutrophilic, Fe-Oxidizing, chemolithoautotrophic α-and γ-proteobacteria from the deep sea[J]. Applied and Environmental Microbiology, 69(5): 2906–2913.
DOI:10.1128/AEM.69.5.2906-2913.2003
|
Fan M C, Lin Y B, Huo H B, et al. 2016. Microbial communities in riparian soils of a settling pond for mine drainage treatment[J]. Water Research, 96: 198–207.
DOI:10.1016/j.watres.2016.03.061
|
Filella M, Belzile N, Chen Y W. 2002. Antimony in the environment:a review focused on natural waters:Ⅱ.Relevant solution chemistry[J]. Earth-Science Reviews, 59(1/4): 265–285.
|
Fu Z, Wu F, Mo C, et al. 2016. Comparison of arsenic and antimony biogeochemical behavior in water, soil and tailings from Xikuangshan, China[J]. Science of the Total Environment, 539: 97–104.
DOI:10.1016/j.scitotenv.2015.08.146
|
Fuentes E, Pinochet H, Gregori I D, et al. 2003. Redox speciation analysis of antimony in soil extracts by hydride generation atomic fluorescence spectrometry[J]. Spectrochimica Acta Part B:Atomic Spectroscopy, 58(7): 1279–1289.
DOI:10.1016/S0584-8547(03)00036-3
|
Ge Z F, Wei C Y. 2013. Simultaneous analysis of SbⅢ, SbV and TMSb by high performance liquid chromatography-inductively coupled plasma-mass spectrometry detection:Application to antimony speciation in soil samples[J]. Journal of Chromatographic Science, 51(5): 391–399.
DOI:10.1093/chromsci/bms153
|
Hamamura N, Fukushima K, Itai T. 2013. Identification of antimony-and arsenic-oxidizing bacteria associated with antimony mine tailing[J]. Microbes and Environments, 28(2): 257–263.
DOI:10.1264/jsme2.ME12217
|
He M C, Wang X Q, Wu F C, et al. 2012. Antimony pollution in China[J]. Science of the Total Environment, 421: 41–50.
|
He M, Wang N, Long X, et al. 2019. Antimony speciation in the environment:Recent advances in understanding the biogeochemical processes and ecological effects[J]. Journal of Environmental Sciences, 75: 14–39.
DOI:10.1016/j.jes.2018.05.023
|
Kaci A, Petie F, Fournier M, et al. 2016. Diversity of active microbial communities subjected to long-term exposure to chemical contaminants along a 40-year-old sediment core[J]. Environmental Science and Pollution Research, 23(5): 4095–4110.
DOI:10.1007/s11356-015-4506-7
|
Li J X, Wang Q, Li M S, et al. 2015. Proteomics and genetics for identification of a bacterial antimonite oxidase in agrobacterium tumefaciens[J]. Environmental Science & Technology, 49(10): 5980–5989.
|
Li J, Wang Q, Zhang S Z, et al. 2013. Phylogenetic and genome analyses of antimony-oxidizing bacteria isolated from antimony mined soil[J]. International Biodeterioration & Biodegradation, 76: 76–80.
|
Liu C P, Yu H Y, Liu C S, et al. 2015. Arsenic availability in rice from a mining area:is amorphous iron oxide-bound arsenic a source or sink?[J]. Environmental Pollution, 199: 95–101.
DOI:10.1016/j.envpol.2015.01.025
|
Liu J, He X X, Lin X R, et al. 2015. Ecological effects of combined pollution associated with E-waste recycling on the composition and diversity of soil microbial communities[J]. Environmental Science & Technology, 49(11): 6438–6447.
|
Luo G S, Shi Z J, Wang H, et al. 2011. Skermanella stibiiresistens sp.nov., a highly antimony-resistant bacterium isolated from coal-mining soil, and emended description of the genus Skermanella[J]. International Journal of Systematic and Evolutionary Microbiology, 62(6): 1271–1276.
|
刘灵飞, 李娟, 龙健, 等. 2014. 喀斯特山区晴隆锑矿不同介质砷锑铋污染特征研究[J]. 贵州师范大学学报(自然科学版), 2014, 32(4): 83–87.
DOI:10.3969/j.issn.1004-5570.2014.04.018 |
刘灵飞, 龙健, 万洪富, 等. 2013. 贵州喀斯特山区锑冶炼厂对农业土壤污染特征的影响及风险评价[J]. 土壤, 2013, 45(6): 1036–1047.
|
刘沙沙, 付建平, 蔡信德, 等. 2018. 重金属污染对土壤微生物生态特征的影响研究进展[J]. 生态环境学报, 2018, 27(6): 1173–1178.
|
卢云祥. 1997. 独山岩溶地下水开发利用初探[J]. 人民珠江, 1997(5): 9–11.
|
Merlin C, Devers M, Béguet J, et al. 2016. Evaluation of the ecotoxicological impact of the organochlorine chlordecone on soil microbial community structure, abundance, and function[J]. Environmental Science and Pollution Research, 23(5): 4185–4198.
DOI:10.1007/s11356-015-4758-2
|
牟山.2017.水稻土中性微氧型亚铁氧化机制研究[D].成都: 电子科技大学
http://cdmd.cnki.com.cn/Article/CDMD-10614-1017079658.htm |
宁增平, 肖唐付, 周连碧, 等. 2009. 锑矿区土壤污染初探与土壤环境质量风险评估[J]. 矿物学报, 2009, 29(S1): 402–404.
|
Romaniuk R, Giuffré L, Costantini A, et al. 2011. Assessment of soil microbial diversity measurements as indicators of soil functioning in organic and conventional horticulture systems[J]. Ecological Indicators, 11(5): 1345–1353.
DOI:10.1016/j.ecolind.2011.02.008
|
Sobolev D, Roden E. 2014. Characterization of a neutrophilic, chemolithoautotrophic Fe(Ⅱ)-Oxidizing β-proteobacterium from freshwater wetland sediments[J]. Geomicrobiology Journal, 21(1): 1–10.
|
Sun W M, Xiao E Z, Xiao T F, et al. 2017. Response of soil microbial communities to elevated antimony and arsenic contamination indicates the relationship between the innate microbiota and contaminant fractions[J]. Environmental Science Technology, 51(16): 9165–9175.
DOI:10.1021/acs.est.7b00294
|
Tamura H, Goto K, Yotsuyan T, et al. 1974. Spectrophotometric determination of iron(Ⅱ) with 1, 10-phenanthroline in the presence of large amounts of iron(Ⅲ)[J]. Talanta, 21(4): 314–318.
DOI:10.1016/0039-9140(74)80012-3
|
Terry L R, Kulp T R, Wiatrowski H, et al. 2015. Microbiological oxidation of antimony(Ⅲ) with oxygen or nitrate by bacteria isolated from contaminated mine sediments[J]. Applied Environmental Microbiology, 81(24): 8478–8488.
DOI:10.1128/AEM.01970-15
|
唐敏, 张焕祯, 李亮. 2010. 砷污染土壤柠檬酸萃取修复技术研究[J]. 环境污染与防治, 2010, 32(12): 31–34.
DOI:10.3969/j.issn.1001-3865.2010.12.007 |
Wang N N, Zhang S H, He M C. 2016. Bacterial community profile of contaminated soils in a typical antimony mining site[J]. Environmental Science & Pollution Research International, 25(6): 1–12.
|
Wang X Q, He M C, Lin C Y, et al. 2012. Antimony(Ⅲ) oxidation and antimony(Ⅴ) adsorption reactions on synthetic manganite[J]. Chemie Der Erde-Geochemistry, 72: 41–47.
DOI:10.1016/j.chemer.2012.02.002
|
王丽, 杨爱江, 邓秋静, 等. 2017. 贵州独山锑矿区土壤-头花蓼系统中重金属的分布特征[J]. 生态学杂志, 2017, 36(12): 3545–3552.
|
王年, 鲁小璐, 邬梦晓俊, 等. 2017. 微生物氧化As(Ⅲ)和Sb(Ⅲ)的研究进展[J]. 微生物学通报, 2017, 44(3): 689–700.
|
项萌, 张国平, 李玲, 等. 2012. 广西铅锑矿冶炼区土壤剖面及孔隙水中重金属污染分布规律[J]. 环境科学, 2012, 33(1): 266–272.
|
Xi J H, He M C, Lin C Y. 2011. Adsorption of antimony(Ⅲ) and antimony(Ⅴ) on bentonite:Kinetics, thermodynamics and anion competition[J]. Microchemical Journal, 97(1): 85–91.
DOI:10.1016/j.microc.2010.05.017
|
Xiao E Z, Krumins V, Tang S, et al. 2016. Correlating microbial community profiles with geochemical conditions in a watershed heavily contaminated by an antimony tailing pond[J]. Environmental Pollution, 215: 141–153.
DOI:10.1016/j.envpol.2016.04.087
|
Xiao E Z, Krumins V, Xiao T F, et al. 2017. Depth-resolved microbial community analyses in two contrasting soil cores contaminated by antimony and arsenic[J]. Environmental Pollution, 221: 244–255.
DOI:10.1016/j.envpol.2016.11.071
|
Zhang C, Nie S, Liang J, et al. 2016. Effects of heavy metals and soil physicochemical properties on wetland soil microbial biomass and bacterial community structure[J]. Science of the Total Environment, 557: 785–790.
|
 2019, Vol. 39
2019, Vol. 39


