2. 北京大学城市与环境学院, 北京 100871
2. College of Urban and Environmental Sciences, Peking University, Beijing 100871
环境内分泌干扰物(Endocrine-disrupting chemicals, EDCs)又被称作环境激素或环境荷尔蒙, 是指由于人类的生产生活而释放到环境中并可以模拟或拮抗体内天然激素作用从而影响内源激素的合成、释放、分泌、转运、结合、代谢等生物学过程的外源性物质, 其广泛存在于土壤、水、空气及食品中.大多数EDCs具有不易降解、亲脂疏水、残留期长等特点(张慧珠, 2014).流行病学调查结果显示, EDCs与人体的生殖障碍、发育异常及某些癌症如乳腺癌、睾丸癌、卵巢癌等密切相关.例如曾被广泛用于塑料生产中的双酚A(BPA), 被证明能使小鼠子宫内膜增厚, 妊娠糖尿病等(Paloma et al., 2010);己烯雌酚暴露妇女后其女性后代会出现卵子受精率降低、子宫外孕、流产、早产等症状, 男性后代则出现隐睾症、尿道下裂、精液异常等症状(Herbst et al., 1999);妊娠期妇女暴露多氯联苯(PCBs)后会抑制后代儿童运动和心理的正常发育, 产前PCBs暴露会导致后代容易冲动, 注意力差, 语言、图像、听觉能力差等(Walkowiak et al., 2002; Jacobson and Jacobson, 2003);壬基酚(NP)暴露鱼类可以造成雌雄同体(李祥军等, 2009), 暴露小鼠可以增加小鼠CD4+ T细胞中IL-4分泌及血清中IgE水平, 从而增强过敏反应(Lee et al., 2003);此外有机氯农药残留与人类牙周疾病、肥胖、糖尿病、乳腺癌、前列腺癌等疾病的发生呈显著正相关(Lee, 2002; Nadal et al., 2009; Durando et al., 2007; Keri et al., 2007).烷基酚类物质是一类被广泛证实的具有雌激素活性的物质(Kochukov et al., 2009), 对烷氧基苯酚(p-alkoxyphenols, p-AOPs)与烷基酚类物质结构相似, 但关于p-AOPs内分泌干扰活性的研究缺乏文献报道, 所以本文对p-AOPs的雌激素活性进行初步探究.
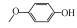
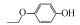
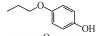
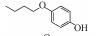
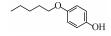
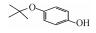
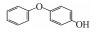
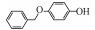
p-AOPs类物质的结构式为RO-C6H4-OH, 既属于苯酚类物质又属于醚类物质.它们是重要的工业原料, 用作合成液晶的中间体, 有机合成的中间体及医药中间体; 还可用作调味剂、抗氧化剂、化妆品等, 因此可以与人体密切接触.例如, 4-乙氧基苯酚(EOP)广泛应用于食用香料(Yannai, 2003); 4-苄氧基苯酚(PBP)用于化妆品和医药或作为合成聚酯新型偶氮染料的原料(Njoo et al., 2000; Yousefi et al., 2013); 4-丙氧基苯酚(POP)用作乙烯基和丙烯酸单体的聚合抑制剂, 作为染料、药物和增塑剂的稳定剂等(Dsikowitzky et al., 2016); 4-甲氧基苯酚(MOP)用作抗氧化剂、聚合抑制剂、光敏材料的稳定剂, 或作为制药工业中的中间体(Hudnall, 2000). Moridani等(2005)研究了10种p-AOPs, 结果表明它们对细胞有较高的抑制活性, 被鉴定为潜在的抗铅黑素瘤化合物, 可用于治疗黑色素瘤, 其中p-AOPs的甲基衍生物已经在临床上用于抗黑色素瘤化疗(Lassmann and Ptsch, 1995).随着科学的发展, 此类物质的应用领域会进一步扩展, 它们在环境中的暴露量将逐渐增大.根据2012年美国化学品数据报告的信息, 仅MOP全国产量为100~1000万磅·年-1.据报道p-AOPs存在于污水、城市污泥等废弃物中: 1982年有研究发现美国伊利诺伊州7家污水处理厂的二级处理出水中有两家检测出POP (Ellis et al., 1982), 而2016年在印度尼西亚雅加达全面筛选都市地表水中的亲脂性有机污染物的研究中, 全市18个采样点有17个检测出POP (Dsikowitzky et al., 2016), 此外p-AOPs还是一些化学物质的降解产物:烷基醚类物质会被降解烷基醚的放线菌降解为p-AOPs(Kim et al., 2008), 很多研究报道倾向于把p-AOPs作为烷基酚类降解的产物或中间产物(Gabriel et al., 2010; Gabriel et al., 2007), 它们还是广泛应用于工业的非离子表面活性剂壬基酚聚乙氧基化物、氯化酚等的降解产物(Kohler et al., 2008; Matafonova et al., 2008).关于此类物质的毒性研究, 1996年有研究者就此类物质对四膜虫的毒性进行了测试, 结果表明它们的毒性随着烷基链长度增加而增加(Piršelová et al., 1996). Moridani等(2002)用离体小鼠肝细胞测试了31种苯酚的肝细胞毒性, 其中测试的4种p-AOPs都有不同程度的毒性.但到目前为止, 关于p-AOPs的雌激素活性还没有详细的文献报道.为此, 本文使用计算机模拟和实验相结合的方法, 较系统地评估了该类物质的雌激素活性, 为该类物质的潜在风险评估和毒理学研究打下基础.
2 材料和方法(Materials and methods) 2.1 化学物质4-甲氧基苯酚(>99%, MOP)购自上海麦克林, 4-乙氧基苯酚(>97%, EOP)、4-丁氧基苯酚(>99%, BOP)购自上海九鼎化学, 4-丙氧基苯酚(>97%, POP)购自上海毕得医药, 4-戊氧基苯酚(>97%, PeOP)、4-苯氧基苯酚(>98%, PhOP)、17β-雌二醇(>98.0%, E2)购自上海阿拉丁, 4-苄氧基苯酚(>98%, PBP)购自浙江诺倍威, 4-叔丁氧基苯酚(>98%, TBOP)购自美国Matrix, 双酚A(>99%, BPA)购自日本TCI.本研究测定的p-AOPs物质结构及其辛醇-水分配系数和水中溶解度见表 2.
2.2 方法 2.2.1 分子对接本研究利用Scigress (Ultra Version 3.0, Fujitsu, USA)软件进行半柔性分子对接实验(Zhang et al., 2012).从蛋白质结构数据库(http://www.rcsb.org/pdb)下载人雌激素受体α的配体结合域(hERα-LBD)的三维结构文件(PDB ID 1ERE).在Scigress workspace模块对晶体结构进行简化, 保留单体A, 去除水分子和甘油分子后加氢, 用于对接计算.绘制化学物质的分子结构并加氢, 通过PM3模式进行优化后定义为配体.对接计算使用15 Å×15 Å×15 Å网格框评估, 网格间距为0.375 Å, 程序设定为60000代, 初始种群大小为50, 精确度为5, 交叉率为0.8, 突变率为0.2. PMF值(Potential of mean force)用于评价化合物在活性位点中的结合亲和力, 其是一种从蛋白质数据库中包含的已知蛋白质-配体复合物的结构信息中提取成对原子势的经验值.通常PMF值越小, 亲和力越大.
2.2.2 重组蛋白表达与纯化具生物活性的带谷胱甘肽标签的人雌激素受体α配体结构域融合蛋白(GST-hERα-LBD)和带6×组氨酸标签的核受体转录共激活因子-细菌碱性磷酸酶融合蛋白(6×His-GRIP1-BAP)的制备主要参考以前文献使用的方法(Zhang et al., 2012).大体流程如下: GST-hERα-LBD融合蛋白在Escherichia coli (E. coli) BL21菌株中表达, 取20 μL GST-hERα-LBD菌液接入20 mL含100 μg·mL-1氨苄青霉素的LB培养基中, 37 ℃培养过夜, 按2%的比例转接到新鲜的LB培养基, 37 ℃培养至对数生长期(OD600=0. 4~0. 6), 加入1 mmol·L-1 IPTG诱导表达, 3 h后离心收菌.菌体沉淀用B1缓冲液(20 mmol·L-1 Tris, 10%甘油, 0. 1 mol·L-1 KCl, 5 mmol·L-1 MgCl2 (pH 7. 5))重悬, 细胞经溶菌酶裂解、超声破碎后离心, 收集上清, 此即为大肠杆菌粗提物, 使用AKTA pure蛋白纯化系统(GE公司, 美国)和亲和层析预装柱GSTrap HP 5 mL, 在含10 mmol·L-1还原型谷胱甘肽的洗脱液中洗脱目的蛋白.
6×His-GRIP1-BAP融合蛋白在E. coli BL21(DE3)菌株中表达, 取20 μL菌液接入20 mL含25 μg·mL-1卡那霉素的LB培养基, 细菌培养、收取及破碎过程如前所述, 使用AKTA pure蛋白纯化系统(GE公司, 美国)和亲和层析预装柱HisTrap HP 5 mL, 在含0. 2 mol·L-1咪唑的洗脱缓冲液中洗脱目的蛋白.纯化蛋白通过10% SDS-聚丙烯酰胺凝胶电泳分析(图 1), GST-hERα-LBD与6×His-GRIP1-BAP的分子量分别是68 kD和75 kD.所得蛋白经浓度测定后, 分管-80 ℃保存备用.
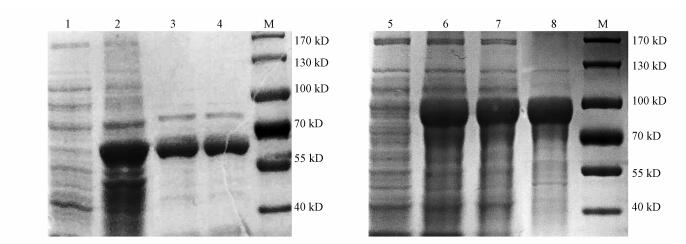 |
| 图 1 蛋白纯化SDS-PAGE电泳结果 (泳道1~4为GST-hERα-LBD蛋白跑胶结果, 1为诱导前、2为诱导后、3与4为纯化后目的蛋白(蛋白条带在55~70 kD之间, 分子量大小正确)、M为蛋白marker.泳道5~8为6 × His-GRIP1-BAP蛋白结果, 5为诱导前、6为诱导后、7为上清、8为纯化后目的蛋白(条带在70~100 kD之间, 分子量大小正确)、M为蛋白marker, 各条带大小在图右侧标出) Fig. 1 SDS-PAGE of purified proteins |
使用磷酸对硝基苯酚法测定p-AOPs的雌激素活性, 具体操作主要参考以前的文献方法(Kanayama et al., 2003), 大体过程如下:将化学物质溶于DMSO, 10倍稀释制备10 -4~10 -11 mol·L-1 8个浓度范围的待测样品.将GST-hERα-LBD受体蛋白提前在96孔高结合酶标板于4 ℃孵育过夜, 清洗3次洗掉未结合的受体蛋白, 加入6×His-GRIP1-BAP和配好的待测样品, 4 ℃孵育1 h后洗掉未结合的6×His-GRIP1-BAP, 加入显色剂NPP(p-nitrophenylphosphate)于37 ℃孵育30~90 min, 用酶标仪测试每孔405 nm的吸光度.使用只添加DMSO的孔作为阴性对照, 添加E2和BPA的孔作为阳性对照.使用Graphpad Prism 7软件计算每种测试化学品的S形剂量-效应曲线, 并根据S形剂量-效应曲线计算EC50和相对EC50(REC50), EC50表示与测试化学品最大活性的50%对应的浓度, REC50表示化学物质产生与BPA最大活性的50%时对应的的物质浓度.
3 结果(Results) 3.1 p-AOPs与hERα-LBD的相互作用晶体结构中E2的原始位点与分子对接计算的E2结合位点之间的均方根误差(RMSE)为0. 2678 Å(图 2a), 表明该分子对接方法可靠.图 2b、2c展现了p-AOPs与hERα-LBD(PDB ID 1ERE)分子相互作用预测结果.分析发现, p-AOPs与雌激素受体作用时, 每个p-AOPs物质的酚羟基都与受体的Glu353和Arg349形成稳定的氢键, 而烷氧基侧链与结合位点的疏水氨基酸如Met343、Leu346、Leu387、Leu391、Phe404、Met 421、Ile424、Leu525等形成疏水作用.比较PMF值发现, MOP(-42.565 kcal·mol-1) > EOP(-46.579 kcal·mol-1) >POP(-49.364 kcal·mol-1) >TBOP(-49.707 kcal·mol-1) >BOP(-52.562 kcal·mol-1) >PBP(-54.806 kcal·mol-1) >PeOP(-55.222 kcal·mol-1) >PhOP(-56.389 kcal·mol-1). PMF值与结合能成正比, PMF越小, 分子结合力越大, 雌激素活性也越大, 因此在1~5个碳原子数内, p-AOPs的烷基碳链越长, 雌激素活性越强, 而苯环替代碳链的p-AOPs物质, 如PhOP, 其雌激素活性高于直链烷基的p-AOPs. p-AOPs与E2形成氢键的键角、键长见表 1, 所有测试的p-AOPs物质的PMF值见表 2.
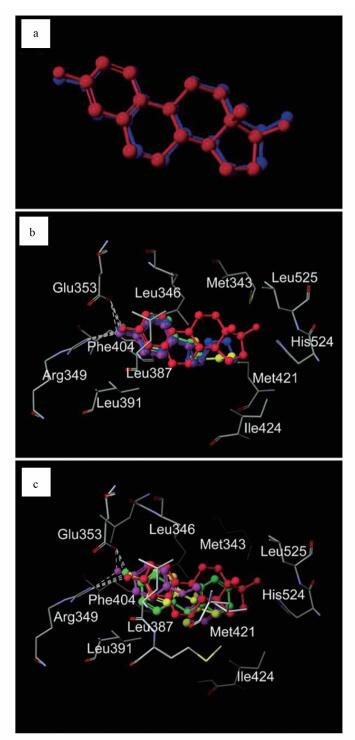 |
| 图 2 p-AOPs与hERα-LBD分子对接结果 (图 2a为验证1ERE与17β-雌二醇(E2)的对接结果, 对接配体(蓝色)和晶体结构配体(红色)在结合袋中的绝对位置.图 2b和2c为8种p-AOPs和E2在hERα-LBD对接模板1ERE(链A)上的预测位置, 活性位点氨基酸残基表示为根据元件类型着色的棒, 虚线显示为氢键.红色为原配体E2, 粉红色为MOP, 绿色为EOP, 紫色为POP, 黄色为BOP, 蓝色为PeOP.图 2c为另外3种物质在hERα-LBD对接模板1ERE(链A)上的预测位置, 红色为原配体E2, 绿色为PhOP, 粉红色为PBP, 黄色为TBOP.) Fig. 2 Molecular docking calculations of p-AOPs with hERα-LBD |
| 表 1 p-AOPs物质与Arg349、Glu353形成氢键的键角和键长 Table 1 Bond angle and bond length between p-AOPs and Arg349 or Glu353 |
| 表 2 p-AOPs物质的名称、CAS号、结构、PMF、EC50及REC50 Table 2 The names, CAS numbers, structures, PMF, EC50 and REC50 of the tested p-AOPs |
如图 3a所示, 阳性对照E2和BPA的EC50分别为9.03×10-9 mol·L-1和6.63×10-7 mol·L-1, 方法可靠.采用该方法对p-AOPs雌激素活性进行分析, 发现p-AOPs物质测试结果呈良好的S形剂量-效应曲线, 大部分物质(除MOP(0.753)、EOP(0.875)外)拟合的剂量-效应曲线R2值大于0.99.如图 3b所示, 在1~5个碳原子数内, p-AOPs的雌激素活性伴随烷基碳链增长而增强, 与分子对接预测结果相一致; 而图 3c展示了PhOP、PBP、TBOP 3种物质的较强雌激素活性.p-AOPs物质的EC50值见表 2.为了将p-AOPs物质与BPA的雌激素活性大小进行比较, 本文计算了与BPA最大活性的50%对应的p-AOPs的浓度, 即REC50(表 2). PhOP(3.55×10-7 mol·L-1)的REC50值是BPA(6.63×10-7 mol·L-1)的0.54倍, 其雌激素活性明显强于BPA. PBP(1.16×10-6 mol·L-1)和PeOP(1.31×10-6 mol·L-1)的REC50值分别是BPA的1.75倍和1.97倍, 最大雌激素活性与BPA接近.比较TBOP和BOP的EC50值发现, TBOP(1.02×10-5 mol·L-1)雌激素活性小于BOP(5.96×10-6 mol·L-1).
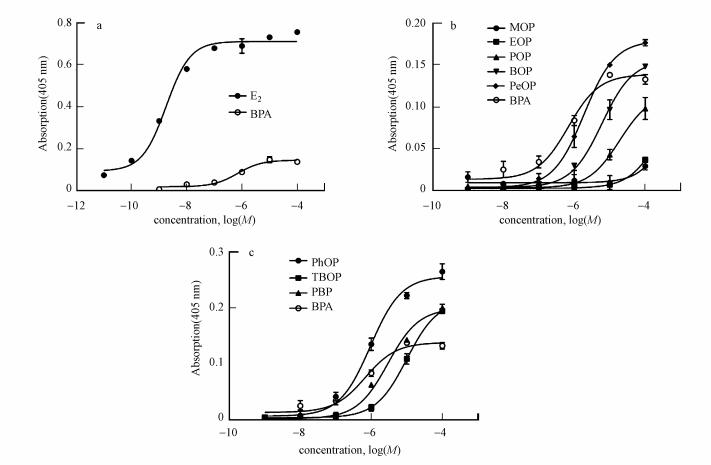 |
| 图 3 p-AOPs的hERα活性的剂量-效应曲线 (图 3为E2与BPA的雌激素活性对比, 图 3b和3c分别为各物质与BPA雌激素活性对比.物质通过磷酸对硝基苯酚法做出的剂量-效应曲线, 其数据表示为3次平行做出的平均值, BPA和E2作为阳性对照, 剂量-效应曲线是由Graphpad Prism7软件通过S形剂量效应方程拟合而来.) Fig. 3 Dose-effect curve of hERα activity of p-AOPs |
为了更好地评估分子对接的有效性, 本文简单计算了对接分数PMF与磷酸对硝基苯酚法得出的EC50的相关性, 结果如图 4所示, PMF和EC50显著相关(p < 0.01), 表明p-AOPs的雌激素活性可以通过分子对接进行简单评估.
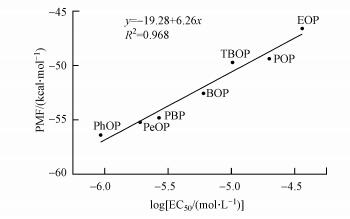 |
| 图 4 p-AOPs的分子对接分数与磷酸对硝基苯酚法EC50的相关分析 Fig. 4 Correlation analysis between the molecular docking scores and EC50 of p-AOPs |
p-AOPs是一类重要的工业原料, 广泛用作调味剂、抗氧化剂、化妆品、有机合成的中间体及医药中间体(Yannai and Shmuel, 2004; Njoo et al., 2000; Yousefi et al., 2013), 仅4-甲氧基苯酚(MOP)在美国的年产量就达到100×104~1000×104万磅.另外, 一些研究还发现, p-AOPs是一些常见化学品的降解产物. Piršelová等(1996)发现带支链的壬基酚可以降解形成对应的p-AOPs. Kim等(2008)发现二烷氧基苯酚在活性污泥中可以被降解成p-AOPs. Matafonova等(2008)也发现氯酚(CPs)紫外光解可以生成p-AOPs.因此, p-AOPs在生活污水和城市地表水中经常检出(Ellis et al., 1982; Dsikowitzky et al., 2016).特别值得注意的是, 一些研究认为烷基酚降解为p-AOPs可消除烷基酚的环境有害性, 其实本研究的结果表明这种想法并不正确, p-AOPs依然具有较高雌激素活性, 如相同碳链长度的PeOP的EC50值为1.89 × 10-6 mol·L-1, 与4-戊基苯酚的EC50 (1.68 × 10-6 mol·L-1)基本接近(表 2).
本研究采用了两种方法分析p-AOPs的雌激素活性, 即计算机模拟的分子对接法和磷酸对硝基苯酚法.通过Scigress软件模拟了p-AOPs与hERα的结合, 根据柔性配体对接到刚性蛋白质的活性位点的PMF值, 比较每个物质与hERα的结合亲和力. Scigress是由日本FUJITSU公司开发的一商业软件, 其整合了许多开源分子对接软件的优点, 在分子对接、分子动态等领域具有很好的应用, 目前在化学小分子-雌激素受体分子对接方面已有大量文献报道(Provenchermandeville et al., 2011; Hu et al., 2013; Zhang et al., 2017).另外, 在碳纳米颗粒与P-糖蛋白分子相互作用(Shityakov and Förster, 2013)、降胆固醇药物与靶蛋白的结合模式(Amandeep et al., 2010)、没食子酸衍生物与INFα-2、IL-6和IL-4等受体结合活性(Yadav et al., 2012)等领域也有一些文献报道.磷酸对硝基苯酚法常用来筛选化学物质与核受体的结合活性, 进而确定化学物质的内分泌干扰活性.目前已有很多研究证明此方法的可靠性(Kanayama et al., 2005;焦健等, 2010;Murk et al., 2013), Kanayama等(2005)使用磷酸对硝基苯酚法发现三苯基锡和三丁基锡是过氧化物酶体增殖剂激活受体γ(PPARγ)和类视黄醇X受体(RXR)的激动剂, 从而进一步发现有机锡化合物会促进脂肪细胞分化及标记基因的表达; 焦健等(2010)通过此方法证明了镉(CdCl2)和铅(PbAc2)与人维生素D受体的结合活性, 为阐明镉、铅导致骨质疏松和骨骼代谢异常的机制提供了依据. PMF值与磷酸对硝基苯酚法得出的EC50的相关分析也显示出显著的相关性.因此, 分子对接法和磷酸对硝基苯酚法结合的方法, 可以用作体外筛选此类物质内分泌干扰活性的有效方法.
烷基酚类物质(APs)是备受关注的环境雌激素, Sun等(2008)利用hERα介导的报告基因检测方法测定了多种APs的雌激素活性, 该研究发现, 利用测试的5种APs暴露转染的MCF7细胞均能诱导荧光素酶的表达, 并总结出规律:烷基侧链在3~6个碳原子内, 物质的雌激素活性随碳原子数的增加而增强.而本文研究的p-AOPs物质与APs结构相似, 得出的结论也相同(规律对比见表 3).所以p-AOPs的雌激素活性也不容忽视. Piršelová等(1996)研究了p-AOPs对四膜虫的毒性并进行了测试, 结果也表明它们的毒性随着烷基链长度增加而增加.通过化学物质的logP(表 2)可以对这一规律进行解释, 在1~5个碳原子内, p-AOPs的烷氧基链越长, logP越大, 疏水性越强, 因此与hERα结合形成的疏水作用力越强, 雌激素活性越大.除了化学物质的酚羟基与hERα的Glu353和Arg349形成氢键外, 疏水作用力也起了重要作用.
| 表 3 具有相同碳链长度的p-APs和p-AOPs的EC50对比 Table 3 Comparison of EC50 between p-APs and p-AOPs with same alkyl chain |
根据分子对接和磷酸对硝基苯酚法的结果, 当BOP、PeOP、PhOP、PBP暴露量在比较低的浓度(数量级在10-7 mol·L-1)时, 就会产生雌激素活性, 其中PhOP、PBP和PeOP的REC50分别为3.55×10-7、1.16×10-6和1.31 ×10-6 mol·L-1, 分别是BPA(EC50: 6.63×10-7 mol·L-1)的0.54、1.75和1.97倍, 表明PhOP的雌激素活性高于BPA, 而PBP和PeOP与BPA活性接近, 所以PhOP、PeOP和PBP在工业生产及日常生活中的应用值得人们充分重视.本研究中, MOP和EOP表现出低雌激素活性, 目前欧洲食品安全局(EFSA)评估结果认为这两种物质可以作为调味物质投放于市场, 有关这两种物质的安全性值得进一步关注.
5 结论(Conclusions)通过分子对接和磷酸对硝基苯酚法, 本文发现p-AOPs具有雌激素活性, 其中PhOP的雌激素活性高于BPA, 而PeOP、PBP与BPA的雌激素活性接近.在1~5个碳原子范围内, p-AOPs的烷氧基链越长, 雌激素活性越高.一些研究认为将烷基酚、氯酚等降解为p-AOPs可消除环境有害性, 本文结果说明该方法将造成新的环境问题.
Alonsomagdalena P, Vieira E, Soriano S, et al. 2010. Bisphenol a exposure during pregnancy disrupts glucose homeostasis in mothers and adult male offspring[J]. Environmental Health Perspectives, 118(9): 1243–1250.
DOI:10.1289/ehp.1001993
|
Dsikowitzky L, Sträter M, Dwiyitno, et al. 2016. First comprehensive screening of lipophilic organic contaminants in surface waters of the megacity Jakarta, Indonesia[J]. Marine Pollution Bulletin, 110(2): 654–664.
DOI:10.1016/j.marpolbul.2016.02.019
|
Durando M, Kass L, Piva J, et al. 2007. Prenatal bisphenol A exposure induces preneoplastic lesions in the mammary gland in Wistar rats[J]. Environmental Health Perspectives, 115(1): 80–86.
DOI:10.1289/ehp.9282
|
Ellis D D, Jone C M, Larson R A, et al. 1982. Organic constituents of mutagenic secondary effluents from wastewater treatment plants[J]. Archives of Environmental Contamination & Toxicology, 11(3): 373–382.
|
Gabriel F L, Cyris M, Giger W, et al. 2010. ipso-Substitution:A general biochemical and biodegradation mechanism to cleave α-quaternary alkylphenols and bisphenol A[J]. Chemistry & Biodiversity, 4(9): 2123–2137.
|
Gabriel Frédéric L P, Cyris M, Jonkers N, et al. 2007. Elucidation of the ipso-substitution mechanism for side-chain cleavage of α-quaternary 4-nonylphenols and 4-t-butoxyphenol in sphingobium xenophagum bayram[J]. Applied & Environmental Microbiology, 73(10): 3320.
|
Herbst A L, Ulfelder H, Poskanzer D C. 1999. Adenocarcinoma of the vagina. Association of maternal stilbestrol therapy with tumor appearance in young women[J]. American Journal of Obstetrics & Gynecology, 181(6): 1574–1575.
|
Hu Y, Zhang Z, Sun L, et al. 2013. The estrogenic effects of benzylparaben at low doses based on uterotrophic assay in immature SD rats[J]. Food & Chemical Toxicology, 53(3): 69–74.
|
Hudnall P M. 2000. Hydroquinone[M]. Ullmann's Encyclopedia of Industrial Chemistry
|
Jacobson J L, Jacobson S W. 2003. Prenatal exposure to polychlorinated biphenyls and attention at school age[J]. J Pediatr, 143(6): 780–788.
DOI:10.1067/S0022-3476(03)00577-8
|
焦健, 张照斌, 胡建英, 等. 2010. hVDR原核表达及其与重金属镉、铅的结合活性[J]. 环境科学, 2010, 31(10): 2469–2474.
|
Kanayama T, Kobayashi N, Mamiya S, et al. 2005. Organotin compounds promote adipocyte differentiation as agonists of the peroxisome proliferator-activated receptor gamma/retinoid X receptor pathway[J]. Molecular Pharmacology, 12(12): 1036–1047.
|
Kanayama T, Mamiya S, Nishihara T, et al. 2003. Basis of a high-throughput method for nuclear receptor ligands[J]. Journal of Biochemistry, 133(6): 791–797.
DOI:10.1093/jb/mvg101
|
Keri R, Ho S M, Hunt P A, et al. 2007. An evaluation of evidence for the carcinogenic activity of bisphenol A[J]. Reproductive Toxicology, 24(2): 240–252.
DOI:10.1016/j.reprotox.2007.06.008
|
Kim Y H, Cha C J, Engesser K H, et al. 2008. Degradation of various alkyl ethers by alkyl ether-degrading Actinobacteria isolated from activated sludge of a mixed wastewater treatment[J]. Chemosphere, 73(9): 1442–1447.
DOI:10.1016/j.chemosphere.2008.07.074
|
Kochukov M Y, Jeng Y J, Watson C S. 2009. Alkylphenol xenoestrogens with varying carbon chain lengths differentially and potently activate signaling and functional responses in GH3/B6/F10 somatomammotropes[J]. Environmental Health Perspectives, 117(5): 723–730.
DOI:10.1289/ehp.0800182
|
Kohler Hans-Peter E, Gabriel Frédéric L P, Giger W. 2008. ipso-substitution-A novel pathway for microbial metabolism of endocrine-disrupting 4-nonylphenols, 4-alkoxyphenols, and bisphenol A[J]. Chimia International Journal for Chemistry, 62(5): 358–363.
DOI:10.2533/chimia.2008.358
|
李祥军, 周忠良, 顾建华. 2009. 壬基酚对河川沙塘鳢性腺分化和发育影响的研究[J]. 水产科学, 2009, 28(1): 15–19.
|
Lassmann G, Pötsch S. 1995. Structure of transient radicals from cytostatic-active p-alkoxyphenols by continuous-flow EPR[J]. Free Radical Biology & Medicine, 19(5): 533.
|
Lee J W. 2002. Evaluation of the immune response following exposure of mice to bisphenol A:induction of Th1 cytokine and prolactin by BPA exposure in the mouse spleen cells[J]. Archives of Pharmacal Research, 25(6): 946–953.
DOI:10.1007/BF02977018
|
Lee M H, Chung S W, Kang B Y, et al. 2003. Enhanced interleukin-4 production in CD4+ T cells and elevated immunoglobulin E levels in antigen-primed mice by bisphenol A and nonylphenol, endocrine disruptors:involvement of nuclear factor-AT and Ca2+[J]. Immunology, 109: 76–86.
DOI:10.1046/j.1365-2567.2003.01631.x
|
Matafonova G, Christofi N, Batoev V, et al. 2008. Degradation of chlorophenols in aqueous media using UV XeBr excilamp in a flow-through reactor[J]. Chemosphere, 70(6): 1124–1127.
DOI:10.1016/j.chemosphere.2007.08.022
|
Moridani M Y, Moore M, Bartsch R A, et al. 2005. Structural toxicity relationship of 4-alkoxyphenols' cytotoxicity towards murine B16-F0 melanoma cell line[J]. Journal of Pharmacy & Pharmaceutical Sciences, 8(2): 348–360.
|
Moridani M Y, Siraki A, O'Brien P J. 2003. Quantitative structure toxicity relationships for phenols in isolated rat hepatocytes[J]. Chemico-Biological Interactions, 147(3): 297–307.
|
Murk A J, Rijntjes E, Blaauboer B J, et al. 2013. Mechanism-based testing strategy using in vitro approaches for identification of thyroid hormone disrupting chemicals[J]. Toxicology in Vitro, 27: 1320–1346.
DOI:10.1016/j.tiv.2013.02.012
|
Nadal A, Alonso-Magdalena P, Soriano S. 2009. The pancreatic beta-cell as a target of estrogens and xenoestrogens:Implications for blood glucose homeostasis and diabetes[J]. Molecular & Cellular Endocrinology, 304(1): 63–68.
|
Njoo M D, Vodegel R M, Westerhof W. 2000. Depigmentation therapy in vitiligo universalis with topical 4-methoxyphenol and the Q-switched ruby laser[J]. Journal of the American Academy of Dermatology, 42(5): 760.
DOI:10.1067/mjd.2000.103813
|
Piršelová K, Baláž Š, Schultz T W. 1996. Model-based QSAR for ionizable compounds:Toxicity of phenols against Tetrahymena pyriformis[J]. Archives of Environmental Contamination & Toxicology, 30(2): 170–177.
|
Provenchermandeville J, Debnath C, Mandal S K, et al. 2011. Design, synthesis and biological evaluation of estradiol-PEG-linked platinum(Ⅱ) hybrid molecules:comparative molecular modeling study of three distinct families of hybrids[J]. Steroids, 76(1): 94–103.
|
Sun H, Xu X L, Qu J H, et al. 2008. 4-Alkylphenols and related chemicals show similar effect on the function of human and rat estrogen receptor alpha in reporter gene assay[J]. Chemosphere, 71(3): 582–588.
DOI:10.1016/j.chemosphere.2007.09.031
|
Walkowiak J, Wiener J, Fastabend A, et al. 2002. Environmental exposure to polychlorinated biphenyls and quality of the home environment:Effects on psychodevelopment in early childhood[J]. Lancet, 358(9293): 1602–1607.
|
Yannai S. 2003. Dictionary of food compounds with CD-ROM: Additives, flavors, and ingredients[M]. Chapman and Hall/CRC
|
Yousefi H, Yahyazadeh A, Rufchahi E O Moradi, et al. 2013. Synthesis, spectral properties, biological activity and application of new 4-(benzyloxy)phenol derived azo dyes for polyester fiber dyeing[J]. Journal of Molecular Liquids, 180: 51–58.
DOI:10.1016/j.molliq.2012.12.030
|
Zhang Z B, Hu Y, Guo J L, et al. 2017. Fluorene-9-bisphenol is anti-oestrogenic and may cause adverse pregnancy outcomes in mice[J]. Nature Communications, 8: 14585.
DOI:10.1038/ncomms14585
|
Zhang Z B, Jia C X, Hu Y, et al. 2012. The estrogenic potential of salicylate esters and their possible risks in foods and cosmetics[J]. Toxicology Letters, 209(2): 146–153.
DOI:10.1016/j.toxlet.2011.12.004
|
张慧珠. 2014. 内分泌干扰物生物检测研究进展[J]. 环境科学导刊, 2014(33): 8–15.
|
 2019, Vol. 39
2019, Vol. 39