近年来, 抗生素在环境中的暴露及由此引起的细菌抗药性增强和抗性基因的扩散传播引起了人们的广泛关注(周启星等, 2007;Kummerer, 2009;Rizzo et al., 2013).大环内酯类抗生素是全球第二大用量的抗生素(Vione et al., 2009), 2013年, 我国大环内酯类抗生素的用量为4.22×104 t, 占抗生素总使用量的26%(Zhang et al., 2015).大环内酯类抗生素的大量使用导致其进入到污水处理厂出水、江河等地表水、甚至饮用水源水中(Gobel et al., 2005;Bu et al., 2013;严清等, 2013;朱婷婷等, 2014a).大环内酯类抗生素难以被生物降解(McArdell et al., 2003;Alexy et al., 2004), 光降解可能是其在水环境中的重要转化方式(Tong et al., 2011;Batchu et al., 2014a), 这直接影响了其环境归趋和生态风险.
溶解性有机质(DOM)普遍存在于地表水环境中, 在江河中的浓度可达7 mg·L-1(吴丰昌等, 2008).DOM对抗生素等有机污染物的光降解具有重要影响(Liang et al., 2015).一方面, DOM可作为光敏化剂, 在光照作用下, 能够产生一系列活性物种(如三重态有机物3DOM*, 羟基自由基·OH, 单态氧1O2等)(陈蕾等, 2013;刘雪石等, 2017), 促进有机污染物的光降解(Xu et al., 2011;Li et al., 2016);另一方面, DOM又能作为光屏蔽剂或活性物种的淬灭剂, 抑制有机污染物的光降解(Young et al., 2013;尉小旋等, 2015).已有研究表明, DOM能够促进大环内酯类抗生素的光降解(Tong et al., 2011;Batchu et al., 2014a), 但水环境中DOM的来源和特征复杂, 环境条件多变, 不同的DOM及环境因素如pH如何影响大环内酯类抗生素的光降解?哪种活性物种起关键作用?这些问题还有待于深入探究.
因此, 本文以典型大环内酯类抗生素罗红霉素为模型污染物, 以Pony湖富里酸(PLFA)、Suwannee河腐殖酸(SRHA)和天然有机质(SRNOM)为典型的DOM, 研究环境pH(6、7和8)条件下, 不同的DOM对罗红霉素光降解的影响及其机理, 为水环境中此类污染物的生态风险评估提供理论依据.
2 材料与方法(Methods and materials) 2.1 实验材料罗红霉素(纯度>99%)购于百灵威化学技术有限公司;PLFA(1S109F)、SRHA(3S101H)和SRNOM(2R101N)购于国际腐殖质协会;色谱纯甲醇和乙腈购于美国Tedia公司;乙酸铵和异丙醇购于阿拉丁化学试剂公司;磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4)购于国药集团化学试剂有限公司;孟加拉红、糠醇、糠醛和2, 2, 6, 6-四甲基-4-哌啶(TEMP)购于Sigma-Aldrich试剂公司;5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)购于TCI(上海)化成工业发展有限公司;超纯水(>18.2 MΩ)由Milli-Q Advantage A10超纯水系统(Millipore, 德国)制备.
2.2 实验方法 2.2.1 光降解实验罗红霉素的光降解实验在XPA-7型光化学反应仪(南京胥江机电厂)中进行, 通过500 W中压汞灯和大于290 nm的滤光片来模拟日光, 365 nm处的光强为6.53 mW·cm-2.
实验在50 mL的石英试管中进行.首先配制5 mmol·L-1的磷酸盐缓冲溶液, 使其pH为6、7和8;加入一定量的罗红霉素, 搅拌12 h, 使罗红霉素的初始浓度为10 mg·L-1.再加入一定量的SRHA、PLFA和SRNOM母液, 使DOM的浓度达到5 mg·L-1(以碳计).然后将反应溶液置于光化学反应仪中, 反应一段时间后(0、1、3、6、9、12、18、24、36 h), 取样测定罗红霉素的浓度.同时, 以未添加DOM的罗红霉素溶液为对照, 考察罗红霉素的直接光解行为.每个处理组设置3个平行.
2.2.2 主要活性物种的贡献实验·OH的贡献:在2.2.1节的反应体系中, 除了加入罗红霉素和DOM外, 同时加入100 mmol·L-1的异丙醇作为·OH的淬灭剂, 其他步骤相同.
1O2的稳态浓度:在5 mg·L-1的DOM溶液中, 加入糠醇作为1O2的分子探针, 糠醇的初始浓度为4.6 mmol·L-1.将反应溶液置于光化学反应仪中, 定时取样测定糠醇的浓度.同时, 在未添加DOM的磷酸盐缓冲溶液中, 加入相同浓度的糠醇, 并置于光化学反应仪中, 定时取样测定糠醇的浓度, 计算糠醇的直接光解反应速率常数.1O2的稳态浓度可根据公式(1)和(2)计算.
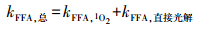
|
(1) |
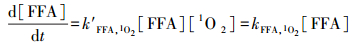
|
(2) |
式中, kFFA, 总为各DOM体系中糠醇的光降解速率常数;kFFA, 1O2为由于1O2氧化造成的糠醇的光降解反应速率常数;kFFA, 直接光解为糠醇的直接光降解反应速率常数;k′FFA, 1O2是FFA和1O2的二级反应速率常数, 为8.3×107 L·mol-1·s-1(Xu et al., 2011).
罗红霉素与1O2的二级反应速率常数k′ROX, 1O2:在pH为6、7和8的磷酸盐缓冲溶液中, 加入0.103 mmol·L-1孟加拉红作为1O2的来源, 然后加入罗红霉素和糠醛, 使其初始浓度分别为10 mg·L-1和1.6 mmol·L-1, 光照反应一定时间后取样测定罗红霉素和糠醛的浓度.k′ROX, 1O2可通过竞争反应动力学模型(方程(3))来计算.
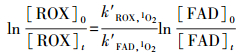
|
(3) |
式中, [ROX]0和[ROX]t为罗红霉素在反应时间0和t时刻的浓度;[FAD]0和[FAD]t分别为糠醛在反应时间为0和t时刻的浓度;k′ROX, 1O2为ROX与1O2的二级反应速率常数, k′FAD, 1O2为糠醛与1O2的二级反应速率常数, 为8.4×104 L·mol-1· s-1(Xu et al., 2011).
1O2贡献:根据公式(4), 1O2氧化降解罗红霉素的一级反应速率常数(kROX, 1O2)可通过罗红霉素与1O2的二级反应速率常数(k′ROX, 1O2)与1O2的稳态浓度[1O2]的乘积得到.1O2贡献可通过kROX, 1O2与DOM共存时罗红霉素光降解的一级反应速率常数的比值计算得到.
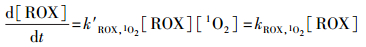
|
(4) |
在pH为7的磷酸盐缓冲溶液中, 分别加入罗红霉素和3种DOM, 使其浓度分别为10 mg·L-1和5 mg·L-1, 置于光化学反应仪中, 光照1 h后, 分别加入50 mmol·L-1的TEMP和80 mmol·L-1的DMPO作为1O2和·OH的特异性捕获剂, 继续光照1 min后, 取样, 在室温下用电子顺磁共振波谱仪(EMX-10/12, 德国Bruker公司)鉴定活性自由基.
2.3 分析测定方法采用高效液相色谱仪测定罗红霉素、糠醇和糠醛的浓度, 色谱柱为安捷伦Eclipse plus C18柱(150 mm × 4.6 mm, 5 μm), 柱温35 ℃.测定罗红霉素的流动相为乙腈和10 mmol·L-1乙酸铵(用乙酸调节pH至6)(45:55, v/v), 进样量为100 μL, 检测波长为210 nm.测定糠醇的流动相为1%甲酸和乙腈(85:15, v/v), 进样量为10 μL, 检测波长为219 nm.测定糠醛的流动相为水和甲醇(30:70, v/v), 进样量为1 μL, 检测波长为275 nm.流速均为1 mL·min-1.
3 结果与讨论(Results and discussion) 3.1 纯水中罗红霉素的光降解纯水中罗红霉素的光降解可能包括直接光解和自敏化光解两个过程, 其光解速率主要受其吸收光谱的影响.图 1a表明了不同pH条件下罗红霉素的紫外可见吸收光谱.罗红霉素在小于250 nm的紫外光区有较强吸收, 而在>290 nm的模拟日光照射下的吸光度则较小, 因此可以预期, 纯水中罗红霉素的光降解速率也较低.
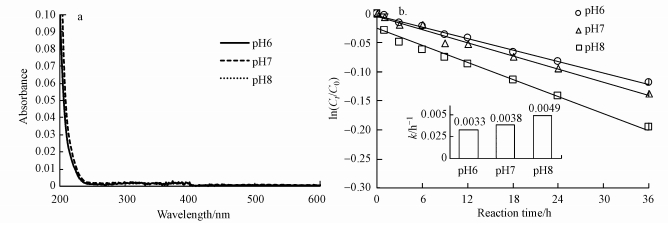 |
| 图 1 不同pH条件下罗红霉素的吸收光谱(a)和纯水中罗红霉素的光降解(b) (罗红霉素初始浓度为10 mg·L-1) Fig. 1 UV-vis absorbance spectra of roxithromycin at different pH (a) and Photodegradation of roxithromycin in pure water (b) |
纯水中罗红霉素的光降解符合一级反应动力学(图 1b), 且罗红霉素的光降解反应速率常数随pH从6增加到8略有增加.当pH为8时, 罗红霉素的光降解反应速率常数可达到0.0049 h-1.由于在不同pH条件下罗红霉素的吸光度没有明显差异, 而下文分析发现纯水中罗红霉素本身吸收光后可产生·OH和1O2发生自敏化光解.因此纯水中罗红霉素的光降解速率常数随pH增加而略有增加可能是由于不同pH条件下罗红霉素的解离形态不同(pKa=8.8)(Huber et al., 2003), 与活性物种的反应速率不同而造成的.
3.2 DOM共存时罗红霉素的光降解在pH为6、7和8的条件下, 不同DOM对罗红霉素光降解的影响如图 2所示.不同DOM共存时, 罗红霉素的光降解均符合一级反应动力学, 且罗红霉素的光降解反应速率常数均高于纯水中, 说明DOM促进了罗红霉素的光降解.不同的DOM对罗红霉素光降解的影响不同, 但罗红霉素的光降解反应速率常数都表现出随pH增加而增加的趋势.PLFA对罗红霉素光降解的促进作用最强, 当pH从6增加到8时, 罗红霉素光降解的一级反应速率常数从0.0266 h-1增加到了0.0577 h-1.在pH 6和7条件下, SRNOM对罗红霉素光降解的促进作用要高于SRHA, 而在pH 8的条件下, SRHA共存时罗红霉素的光降解反应速率常数(0.0284 h-1)略高于SRNOM共存时(0.0273 h-1).
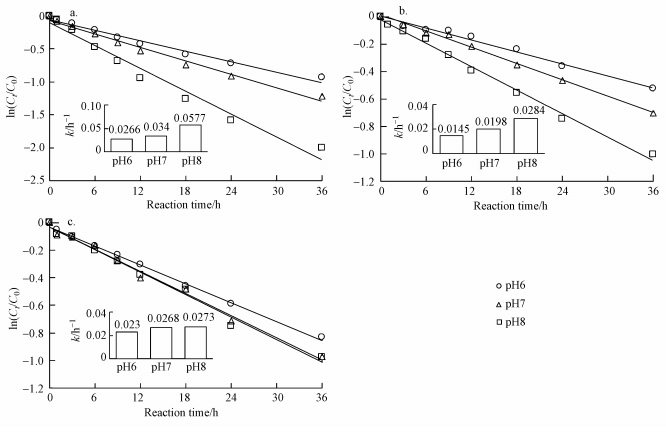 |
| 图 2 不同DOM对罗红霉素光降解的影响 (a.PLFA, b.SRHA, c.SRNOM)(DOM浓度为5 mg·L-1) Fig. 2 Effect of different DOM on the photodegradation of roxithromycin (a.PLFA, b. SRHA, c. SRNOM) |
总体上, 在环境pH条件下, 罗红霉素光降解的表观反应速率常数在0.0145~0.0577 h-1范围内, 与Batchu等(2014a)研究发现渠道水中罗红霉素光降解的反应速率常数0.0212 h-1吻合.和其它抗生素相比, 罗红霉素的光降解速率相对较慢, 如在模拟日光照射和1 mg·L-1的腐殖酸存在条件下, 氟喹诺酮类抗生素恩氟沙星、环丙沙星和诺氟沙星光解的表观反应速率常数分别为17.3、12.7和12.8 h-1(Babic et al., 2013).在自然阳光照射和污水处理厂二级出水中, 环丙沙星、恩氟沙星、马波沙星、左氧氟沙星和达氟沙星光解的表观反应速率常数分别为6.6、4.62、3.66、0.6和18.6 h-1(Sturini et al., 2015).在模拟日光照射和pH为8并含有10.4 mg·L-1的DOM的地表水中, 磺胺类抗生素磺胺嘧啶、磺胺噻唑、磺胺甲基嘧啶、磺胺二甲基嘧啶光解的表观反应速率常数分别为0.1199、0.5727、0.1889和0.1720 h-1, 而最难光降解的磺胺类抗生素磺胺甲唑光解的表观反应速率常数为0.0347 h-1(Batchu et al., 2014b).在模拟日光照射下和环境pH条件下, 纯水中四环素类化合物光降解速率常数在0.24~1.56 h-1范围内;在实际太阳光照射下, 地表水体中四环素光解的反应速率常数与光强成正比, 在1.98~7.08 h-1之间(胡学香等, 2012;Jin et al., 2017).在实际环境中, 自然光照的强度肯定要低于本研究中的光照强度, 再加上复杂的水质特点, 罗红霉素光降解的速率可能更低.因此, 环境中的罗红霉素具有较高的持久性.
3.3 主要活性物种对罗红霉素光降解的贡献DOM对抗生素等有机污染物光降解的促进作用, 主要是由于DOM吸收光能后产生一系列活性氧物种, 如·OH、1O2、3DOM*、O2·-/HO2·及H2O2等, 其中·OH、1O2和3DOM*这3种活性物种的作用更显著(陈蕾等, 2013;Yan et al., 2014;Cawley et al., 2015;Zhou et al., 2017).本文主要探讨·OH和1O2对罗红霉素光解的贡献.
3.3.1 ·OH的贡献加入异丙醇作为·OH的捕获剂后, 罗红霉素的光降解反应动力学如图 3所示.由图 3可见, 加入异丙醇后, 罗红霉素的光降解反应速率常数大大降低, 说明·OH在罗红霉素的光降解过程中起着重要作用.
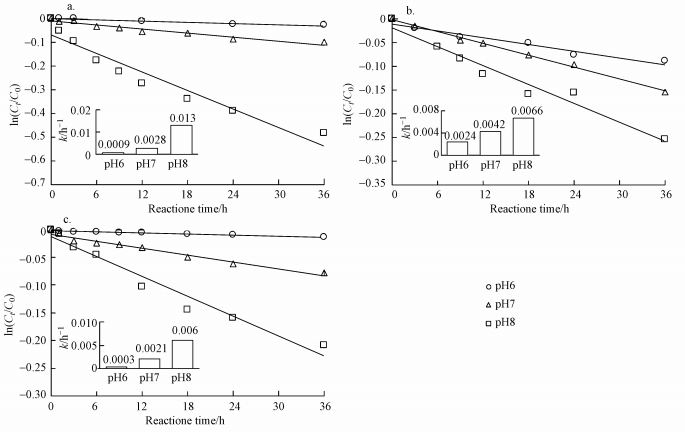 |
| 图 3 加入异丙醇时不同DOM对罗红霉素光降解的影响 (a.PLFA, b.SRHA, c. SRNOM)(DOM浓度为5 mg·L-1) Fig. 3 Effect of DOM on the degradation of roxithromycin with the addition of isopropanol (a. PLFA, b. SRHA, c. SRNOM) |
根据公式(5)计算·OH对罗红霉素光降解的贡献, 结果如表 1所示.
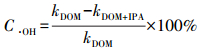
|
(5) |
| 表 1 直接光解/自敏化光解、·OH和1O2对罗红霉素光降解的贡献 Table 1 Contribution of direct photodegradation/self-sensitization photodegradation, ·OH and 1O2 to the photodegradation of roxithromycin |
式中, C·OH为·OH对罗红霉素光降解的贡献, kDOM为不同DOM体系中, 罗红霉素光降解的一级反应速率常数, 见图 2;kDOM+IPA为添加异丙醇后, 不同DOM体系中罗红霉素光降解的一级反应速率常数, 见图 3.
由表 1可知, 在不同DOM共存时, ·OH对罗红霉素光降解的贡献都随着pH的增加而降低.在pH为6时, ·OH的贡献在83.45%~98.70%之间, 而当pH增加到8时, ·OH的贡献降低至76.76%~78.02%.这可能是由于不同pH条件下罗红霉素与·OH的反应速率不同造成的.在环境pH条件下, SRNOM共存时·OH对罗红霉素光降解的贡献略大于PLFA, SRHA共存时·OH对罗红霉素光降解的贡献最小, 这主要是由于不同DOM的·OH产率和稳态浓度不同.Dong和Rosario-Ortiz(2012)研究发现PLFA的·OH量子产率略高于SRNOM, 但由于本研究中PLFA共存时罗红霉素的光降解反应速率常数高于SRNOM共存时, SRNOM共存时·OH的贡献率反而略高于PLFA共存时.而PLFA和SRNOM的·OH量子产率均高于SRHA, Zhang等(2014)研究表明, 在模拟日光照射下, PLFA产生的·OH稳态浓度约为6.5×10-17 mol·L-1, 明显高于SRHA的·OH稳态浓度(3.4×10-17 mol·L-1), 这和本研究中PLFA体系中·OH贡献率高于SRHA体系是一致的.
理论上, DOM共存时罗红霉素的光降解速率应等于其直接光解/自敏化光解(即纯水中罗红霉素的光降解)与DOM敏化产生的·OH和1O2等活性物种造成的罗红霉素的间接光解之和, 即直接光解/自敏化光解的贡献与DOM产生的·OH的贡献之和应小于等于100%.但在pH为6, 3种DOM共存条件下和pH为7, PLFA和SRNOM共存条件下, 纯水中罗红霉素的光降解的贡献率与·OH的贡献率之和均超过了100%(表 1), 这说明反应体系中的·OH不止来源于DOM, 还可能来源于罗红霉素, 即罗红霉素本身吸收光后, 也产生了·OH等活性物种, 这也被下文中的核磁共振波谱图所证实.因此, 纯水中罗红霉素必然发生了自敏化光降解.
3.3.2 单态氧的贡献纯水中和不同DOM共存时, 糠醇的光解均符合一级反应动力学, 其表观反应速率常数见表 2.根据表 2的数据和公式(1)和(2), 计算得到不同DOM反应体系产生的1O2的稳态浓度如表 3所示.由表 3可知, 3种DOM体系产生的1O2的稳态浓度均随pH从6增加到8而有所降低.SRHA产生的1O2的稳态浓度最高, 其次是PLFA, SRNOM产生的1O2的稳态浓度最低.Mostafa和Rosario-Ortiz(2013)报道称, SRHA和PLFA产生的1O2的稳态浓度分别为9.4×10-14 mol·L-1和3.9×10-14 mol·L-1, 与本研究中的1O2稳态浓度处于同一数量级上.
| 表 2 纯水和不同DOM共存时糠醇的光降解速率常数 Table 2 Photodegradation rate constant of furfuryl alcohol in ultrapure water and different DOM solution |
| 表 3 不同DOM体系产生的1O2的稳态浓度 Table 3 Steady state concentration of 1O2 generated in different DOM system |
以孟加拉红为1O2的来源, 根据罗红霉素和糠醛的竞争反应动力学模型(方程(3)), 可得ln(FAD0/FADt)与ln(ROX0/ROXt)的关系图(图 4), 所得回归方程的斜率即为k′ROX, 1O2与k′FAD, 1O2的比值.因此, 根据不同pH条件下方程的斜率和已知的k′FAD, 1O2值(8.4×104 L·mol-1·s-1), 即可求出在pH为6、7和8时, 罗红霉素与1O2的二级反应速率常数k′ROX, 1O2分别为2.27×105、1.96×106和1.51×107 L·mol-1·s-1.
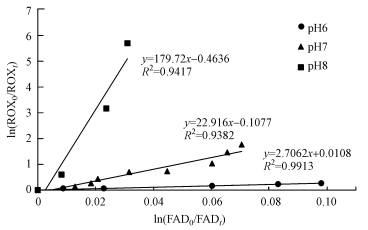 |
| 图 4 不同pH条件下ln(ROX0/ROXt)与ln(FAD0/FADt)的关系 Fig. 4 Correlation of ln(ROX0/ROXt) and ln(FAD0/FADt) under different pH |
将单态氧的稳态浓度(表 3)乘以罗红霉素与1O2的二级反应速率常数k′ROX, 1O2(方程(4)), 可求出在不同pH和DOM共存条件下, 1O2引起罗红霉素光降解的一级反应速率常数, 再除以DOM共存时罗红霉素光降解的一级反应速率常数(图 2), 即可求得1O2对罗红霉素光降解的贡献, 见表 1.由表 1可知, 在pH 6, 3种DOM共存时, 1O2对罗红霉素光降解的贡献率为0.21%~0.43%, 当pH增加到8时, 1O2对罗红霉素光降解的贡献率为4.85%~11.33%, 这主要是因为在pH 8时, 罗红霉素与1O2的反应速率较高造成的.SRHA共存时, 1O2对罗红霉素的贡献最高, 几乎是PLFA共存时贡献的2倍, 这主要是因为SRHA产生的单态氧的稳态浓度最高.
3.3.3 活性物种的确证分别以DMPO和TEMP作为·OH和1O2的捕获剂, 测定罗红霉素和不同DOM反应体系的电子自旋共振波谱, 如图 5所示.在罗红霉素的纯水溶液和不同DOM溶液中, 都检出了属于·OH的1:2:2:1的特征信号和属于1O2的1:1:1的特征信号(Wang et al., 2016).这证实了纯水中罗红霉素的自敏化光解以及DOM体系中·OH和1O2的产生.值得注意的是, 罗红霉素的纯水溶液中产生的·OH的量较少, 产生的1O2的量相对较高, 但是由于1O2与罗红霉素的反应速率常数较低, 因此, 纯水中罗红霉素光解的反应速率常数均较低.
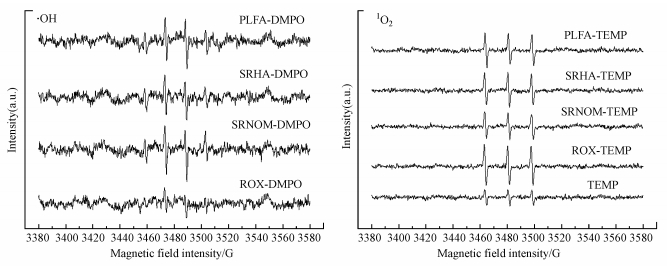 |
| 图 5 罗红霉素和3种DOM光照后的电子自旋共振波谱图 Fig. 5 ESR spectra of of roxithromycin and DOM solution after irradiation |
1) 纯水中罗红霉素吸收光后可发生自敏化光解, 其光解速率常数随pH增加而略有增加, 在pH 8时可达到0.0049 h-1.
2) DOM促进了罗红霉素的光降解, 其促进效果从大到小为PLFA>SRNOM>SRHA.罗红霉素光降解的反应速率常数随pH增加而增加, 在pH 6时为0.0145~0.0266 h-1, 在pH 8时为0.0273~0.0577 h-1.
3) DOM共存时, ·OH和1O2对罗红霉素的光降解具有重要贡献.·OH对罗红霉素光降解的贡献随pH增加而降低, 在pH 6时为83.45%~98.70%, 在pH 8时降低至76.76%~78.02%;1O2对罗红霉素的光降解的贡献随pH升高而升高, 在pH 6时为0.21%~0.43%, 在pH 8时为4.85%~11.33%.
Alexy R, Kumpel T, Kummerer K. 2004. Assessment of degradation of 18 antibiotics in the Closed Bottle Test[J]. Chemosphere, 57(6): 505–512.
DOI:10.1016/j.chemosphere.2004.06.024
|
Babic S, Perisa M, Skoric I. 2013. Photolytic degradation of norfloxacin, enrofloxacin and ciprofloxacin in various aqueous media[J]. Chemosphere, 91(11): 1635–1642.
DOI:10.1016/j.chemosphere.2012.12.072
|
Batchu S R, Panditi V R, O'Shea K E, et al. 2014a. Photodegradation of antibiotics under simulated solar radiation:Implications for their environmental fate[J]. Science of the Total Environment, 470-471(2): 299–310.
|
Batchu S R, Panditi V R, Gardinali P R. 2014b. Photodegradation of sulfonamide antibiotics in simulated and natural sunlight:implications for their environmental fate[J]. Journal of Environmental Science and Health, Part B, 49(3): 200–211.
DOI:10.1080/03601234.2014.858574
|
Bu Q, Wang B, Huang J, et al. 2013. Pharmaceuticals and personal care products in the aquatic environment in China:A review[J]. Journal of Hazardous Materials, 262(22): 189–211.
|
Cawley K M, Korak J A, Rosario-Ortiz F L. 2015. Quantum yields for the formation of reactive intermediates from dissolved organic matter samples from the Suwannee River[J]. Environmental Engineering Science, 32(1): 31–37.
DOI:10.1089/ees.2014.0280
|
陈蕾, 沈超峰, 王郑, 等. 2013. 天然有机质对环境污染物的转化过程的介导作用[J]. 生态环境学报, 2013, 22(7): 1244–1249.
DOI:10.3969/j.issn.1674-5906.2013.07.026 |
Dong M M, Rosario-Ortiz F L. 2012. Photochemical formation of hydroxyl radical from effluent organic matter[J]. Environmental Science and Technology, 46(7): 3788–3794.
DOI:10.1021/es2043454
|
Gobel A, Thomsen A, Mcardell C S, et al. 2005. Occurrence and sorption behavior of sulfonamides, macrolides, and trimethoprim in activated sludge treatment[J]. Environmental Science and Technology, 39(11): 3981–3989.
DOI:10.1021/es048550a
|
胡学香, 陈勇, 聂玉伦, 等. 2012. 水中四环素类化合物在不同光源下的光降解[J]. 环境工程学报, 2012, 6(8): 2465–2469.
|
Hyber M M, Canonica S, Park G Y, et al. 2003. Oxidation of pharmaceuticals during ozonation and advanced oxidation processes[J]. Environmental Science and Technology, 37(5): 1016–1024.
DOI:10.1021/es025896h
|
Jin X, Xu H, Qiu S, et al. 2017. Direct photolysis of oxytetracycline:Influence of initial concentration, pH and temperature[J]. Journal of Photochemistry and Photobiology A:Chemistry, 332: 224–231.
DOI:10.1016/j.jphotochem.2016.08.032
|
Kummerer K. 2009. Antibiotics in the aquatic environment-A review, part Ⅰ[J]. Chemosphere, 75(4): 417–434.
DOI:10.1016/j.chemosphere.2008.11.086
|
Li Y, Chen J, Qiao X, et al. 2016. Insights into photolytic mechanism of sulfapyridine induced by triplet-excited dissolved organic matter[J]. Chemosphere, 147: 305–310.
DOI:10.1016/j.chemosphere.2015.12.115
|
Liang C, Zhao H, Deng M, et al. 2015. Impact of dissolved organic matter on the photolysis of the ionizable antibiotic norfloxacin[J]. Journal of Environmental Sciences, 27(1): 115–123.
|
刘雪石, 乔显亮, 刘远. 2017. DOM的光化学活性及其对污染物光解的影响[J]. 环境科学与技术, 2017, 40(1): 85–94.
|
McArdell C S, Molnar E, Suter M J F S, et al. 2003. Occurrence and fate of macrolide antibiotics in wastewater treatment plants and in the glatt valley watershed, switzerland[J]. Environmental Science and Technology, 37(24): 5479–5486.
DOI:10.1021/es034368i
|
Mostafa S, Rosario-Ortiz F L. 2013. Singlet oxygen formation from wastewater organic matter[J]. Environmental Science and Technology, 47(15): 8179–8186.
DOI:10.1021/es401814s
|
Rizzo L, Manaia C, Merlin C, et al. 2013. Urban wastewater treatment plants as hotspots for antibiotic resistant bacteria and genes spread into the environment:A review[J]. Science of the Total Environment, 447(9): 345–360.
|
Sturini M, Speltini A, Maraschi F, et al. 2015. Sunlight-induced degradation of fluoroquinolones in wastewater effluent:Photoproducts identification and toxicity[J]. Chemosphere, 134: 313–318.
DOI:10.1016/j.chemosphere.2015.04.081
|
Tong L, Eichhorn P, Perez S, et al. 2011. Photodegradation of azithromycin in various aqueous systems under simulated and natural solar radiation:kinetics and identification of photoproducts[J]. Chemosphere, 83(3): 340–348.
DOI:10.1016/j.chemosphere.2010.12.025
|
Vione D, Feitosa-Felizzola J, Minero C, et al. 2009. Phototransformation of selected human-used macrolides in surface water:kinetics, model predictions and degradation pathways[J]. Water Research, 43(7): 1959–1967.
DOI:10.1016/j.watres.2009.01.027
|
Wang H, Wang M, Wang H, et al. 2016. Aqueous photochemical degradation of BDE-153 in solutions with natural dissolved organic matter[J]. Chemosphere, 155: 367–374.
DOI:10.1016/j.chemosphere.2016.04.071
|
吴丰昌, 王立英, 黎文, 等. 2008. 天然有机质及其在地表环境中的重要性[J]. 湖泊科学, 2008, 20(1): 1–12.
DOI:10.3321/j.issn:1003-5427.2008.01.001 |
尉小旋, 陈景文, 王如冰, 等. 2015. 氧氟沙星和诺氟沙星的水环境光化学转化:pH值及溶解性物质的影响[J]. 环境化学, 2015, 34(3): 448–454.
|
Xu H, Cooper W J, Jung J, et al. 2011. Photosensitized degradation of amoxicillin in natural organic matter isolate solutions[J]. Water Research, 45(2): 632–638.
DOI:10.1016/j.watres.2010.08.024
|
严清, 訾成方, 张怡昕, 等. 2013. 重庆主城区水域典型PhACs污染水平及生态风险评估[J]. 环境科学研究, 2013, 26(11): 1178–1185.
|
Yan S, Song W. 2014. Photo-transformation of pharmaceutically active compounds in the aqueous environment:a review[J]. Environmental Science:Processes and Impacts, 16: 697–720.
DOI:10.1039/C3EM00502J
|
Young R B, Latch D E, Mawhinney D B, et al. 2013. Direct photodegradation of androstenedione and testosterone in natural sunlight:inhibition by dissolved organic matter and reduction of endocrine disrupting potential[J]. Environmental Science and Technology, 47(15): 8416–8424.
|
Zhang Q Q, Ying G G, Pan C G, et al. 2015. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source Analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science and Technology, 49(11): 6772–6782.
DOI:10.1021/acs.est.5b00729
|
Zhang D, Yan S, Song W. 2014. Photochemically induced formation of Reactive Oxygen Species (ROS) from effluent organic matter[J]. Environmental Science and Technology, 48(21): 12645–12653.
DOI:10.1021/es5028663
|
Zhou H, Lian L, Yan S, et al. 2017. Insights into the photo-induced formation of reactive intermediates from effluent organic matter:The role of chemical constituents[J]. Water Research, 112: 120–128.
DOI:10.1016/j.watres.2017.01.048
|
周启星, 罗义, 王美娥. 2007. 抗生素的环境残留、态毒性及基因污染[J]. 生态毒理学报, 2007, 2(3): 243–251.
|
朱婷婷, 段标, 宋战锋, 等. 2014. 深圳铁岗水库体中抗生素污染特征分析及生态风险评价[J]. 生态环境学报, 2014, 23(7): 1175–1180.
DOI:10.3969/j.issn.1674-5906.2014.07.013 |
 2019, Vol. 39
2019, Vol. 39


