2. 环境保护部南京环境科学研究所, 南京 210042
2. Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042
浅水湖泊水生植物生命周期中的生长、衰亡、演替阶段都参与了湖泊生态系统生物地球化学循环(苏胜齐等, 2002), 在水生态系统牧食食物链中扮演着生产者角色, 同时衰亡后为碎屑食物链提供有机质(张奋清等, 2004), 因此水生植物在维持湖泊水生态系统平衡方面发挥着重要作用.不仅如此, 水生植物在生长过程中可以通过吸收、过滤、截留等作用, 降低水环境中的有机物、无机物含量, 减轻水体营养盐负荷(Gopal, 1999), 所以通常利用其在时间空间上的镶嵌优化组合进行净化水质(王国祥等, 1998; Wang et al., 2009).但在富营养化湖泊中, 过量繁殖的水生植物在冬天死亡到第二年回春时, 腐烂分解释放的各种营养盐物质会加剧水体富营养化程度, 形成内源污染(Wu et al., 2017), 因此, 研究水生植物腐烂分解对水体中营养物质的影响可为湖泊水生植被系统的形成或重建过程中植物种类的筛选、以及后期的收割管理提供理论依据.
水生植物腐烂分解过程十分复杂, 其植物组织衰减主要受水环境中的生物活动及自身沉降、吸附等物化作用的影响, 其中底泥与上覆水组成的泥水界面可以控制底泥与水中磷营养物质的交换(Brigolin et al., 2011), 而湖泊中大量输入的营养盐不仅造成水生植物的过量生长, 来不及收割的水生植物腐解向水体释放磷, 而且也造成了泥-水界面物理化学性质的改变, 最终影响了泥-水界面的磷生物循环(Han et al., 2015; Sulu-Gambari et al., 2015).因此为进一步探究水生植物腐解过程中磷营养物质在底泥-水-植物体系内的迁移、转化规律, 本研究选取太湖流域常见的3种生态型水生植物, 室内模拟其在5.7 g · L-1初始生物量密度下的腐解过程, 并用与图形结合的科学的统计学分析方法对这一规律做出解释.
2 材料与方法(Materials and methods) 2.1 样品采集与预处理根据文献(汪院生, 2013; 耿荣妹等, 2016; 樊海川等, 2018)及常州市滆湖湖中区域植物生物量密度调查, 将腐解试验初始生物量密度设置成5.7 mg · L-1, 并于常州滆湖水域采集狐尾藻(Myriophyllum verticillatum L)、菱角(Trapa bispinosa Roxb)及荷花(Lotus flower)3种类型,分别表示沉水、浮水及挺水植物, 去根、用自来水冲洗干净并去除杂质, 然后晾干、于65 ℃烘干至恒重、剪碎.武南河采集实验用泥, 加水混匀、过筛、去除砂石颗粒、备用, 最后准备35 cm × 30 cm × 20 cm玻璃水槽若干.
2.2 实验设计实验分A、B、C 3组分别代表狐尾藻、菱角、荷花试验组, 每组设置3组平行, 各平行组以一个玻璃水槽为腐解容器, 倒入底泥悬浮液7 L、加入自来水至30 cm高, 静置一个星期, 监测并微调各实验组初始水质至相同营养水平.将烘干、剪碎后的狐尾藻、菱角、荷花3种植物选取10 g各自装入80目加密分解袋中(15 cm × 10 cm), 分别投入A、B、C组腐解容器中, 每个水槽一次性重复投加12个, 腐解初始生物量密度均为5.7 g · L-1, 试验过程中水位保持在30 cm高, 蒸发水分用自来水补充.
试验在温室中进行, 于2017-8-7—2017-12-5, 水温15~35 ℃; 实验周期120 d, 分别在第2、5、8、16、25、35、45、60、75、90、105和120 d于各腐解容器中随机取回一个分解袋, 用蒸馏水洗净、于65 ℃烘干至恒重并记录其重量, 用于分析植物不同腐解阶段的腐解速率; 根据取回的腐解袋, 测定植物不同腐解阶段w(TP); 另外同时采集腐解水样和底泥样, 测定水体ρ(DO)、ρ(CODMn)、ρ(PO43--P)、ρ(TP)、ρ(DOC)和底泥w(TP).
2.3 实验样品分析和数据处理水样指标测定方法:pH采用上海雷磁METTLER TOLEDO型pH计测定; 溶解氧(DO)采用便携式哈希LDO101型溶氧仪测定; 磷酸盐(PO43--P)采用上分L5S型紫外分光光度计钼锑抗比色法测定; 总磷(TP)采用碱性过硫酸钾消解, 上分L5S型紫外分光光度计钼锑抗比色法测定; 溶解性有机碳(DOC)采用日本岛津TOC-L型总有机碳分析仪分析测定; 高锰酸盐指数(CODMn)采用酸性高锰酸钾氧化法测定.
植物样指标测定方法:总有机碳(TOC)采用重铬酸钾-硫酸氧化法测定; 总磷(TP)采用浓H2SO4-H2O2消解, 上分L5S型紫外分光光度计钼锑抗比色法测定.
底泥样指标测定方法:总磷采用NaOH熔融, 上分L5S型紫外分光光度计钼锑抗比色法测定.
分解速率估算采用Olson指数衰减模型(Olson, 1963):

|
(1) |
式中, Mt为植物在t时间的质量; M0为初始质量; k是分解速率常数(d-1), t是分解时间(d).
图表绘制采用Origin Pro v7.5, 数据分析采用SPSS v20.0软件完成.
3 结果与分析(Results and analysis) 3.1 腐解速率变化根据表 1可知, 整个试验过程中腐解速率常数K1、K2值大小依次为菱角>狐尾藻>荷花; 另外图 1中, 3种植物腐解速率在整个腐解过程中出现阶段性变化, 总体趋势在腐解进行第2 d上升至最大值后逐渐减小; 其中第2~60 d腐解速率处于相对较高水平但不稳定, 而在此之后的腐解过程中则维持在较低水平直至试验结束.
| 表 1 3种水生植物腐烂分解过程动力学特征 Table 1 Characteristics of decomposition dynamic process for three aquatic plants |
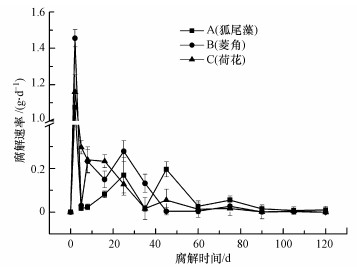 |
| 图 1 3种植物腐解速率变化 Fig. 1 Changes of rate of decomposition of three aquatic plants |
与此同时, 整个腐解周期内3种植物腐解速率之间差异性显著(p<0.01), 其中第2 d最大值差异明显且分别为菱角>荷花>狐尾藻; 而在快速腐解阶段中荷花、菱角分别于第8、25 d上升, 之后分别于第35、45 d进入稳定较低水平, 而狐尾藻则先后于第25、45 d两次到达峰值, 最后于第60 d进入稳定较低水平.这说明不同植物腐解过程中腐解速率变化趋势虽一致, 但对于腐解不同阶段则存在种间差异, 这种差异累积到试验结束时, 狐尾藻、菱角、荷花腐解率分别达到83.8%、94.5%、81%.
3.2 水体ρ(DO)、ρ(CODMn)变化3种植物腐解对水体溶解氧(DO)产生剧烈影响, 首先水体在腐解第2 d出现极度缺氧现象, ρ(DO)降低到最低值0.05 ~0.12 mg · L-1, 之后没有立即恢复并且维持这一浓度值范围(小于0.33 mg · L-1)至腐解第45 d, 随后逐渐上升直至试验结束.
高锰酸盐指数(CODMn)可以指示水体中还原性物质量的多少, 研究3种植物腐解过程中, 水体ρ(CODMn)于腐解第2 d上升至最大值, 其中菱角>狐尾藻>荷花, 之后在逐渐减小的趋势下先后于第8、45 d有所回升, 最后在第60 d降低至稳定水平; 另外Person相关性检验发现, 水体ρ(CODMn)与腐解速率显著正相关(p<0.01).
3.3 水体ρ(DOC)变化溶解性有机碳(DOC)是评价水体有机物污染程度的重要指标, 如图 2所示在3种植物腐解过程中水体ρ(DOC)在第2 d达到最大值且区分明显为菱角>荷花>狐尾藻, 之后总体变化趋势下降; 其中B组先后在第8、35 d上升, C组在第8 d上升, 其余腐解阶段A、B、C组下降.另外, Person相关性检验发现, 3种植物腐解过程中水体ρ(DOC)与ρ(CODMn)及腐解速率显著正相关(p<0.01).
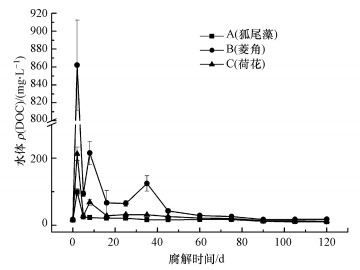 |
| 图 2 3种水生植物腐解过程中水体DOC浓度变化 Fig. 2 Concentration of DOC in water of three aquatic plants during the decomposition |
根据图 3a所示, 植物腐解过程中w(TP)存在下降-上升-下降的阶段, 但总体趋势下降, 其间A、B、C 3组植物w(TP)在腐解开始进行16 d内表现各异, 其中C组一直上升, A、B两组则一直下降; 之后的腐解过程中3组植物w(TP)同步上升至45 d, 剩下的75 d基本上同步下降, 其中45~75 d的下降速率较75 d至试验结束快.试验结束时, A、B、C 3组植物w(TP)与初始值相比分别下降58.53%、52.31%、71.74%.
 |
| 图 3 3种水生植物腐解过程中植物TP含量(a)、水体TP (b)、水体PO43--P (c)和底泥TP含量(d)变化 Fig. 3 Concents of P of three aquatic plants (a), concentration of TP in water (b), PO43--P in water (c) and TP of soil (d) of three aquatic plants during the decomposition |
另外根据3种植物腐解始末的总磷含量并结合当时的腐解剩余质量计算得出, 整个腐解过程中3种植物平均磷释放速率分别为:菱角(0.670 mg · g-1)>荷花(0.537 mg · g-1)>狐尾藻(0.456 mg · g-1).
3.4.2 水体ρ(TP)、ρ(PO43--P)变化研究3种植物腐解过程中(图 3b), 水体ρ(TP)与植物腐解速率显著正相关(p<0.01), 总体变化趋势为先上升后下降.其中A、C组在第2 d上升至最大值, 第2~8 d下降-上升, 之后以较快速率下降; B组则在第2天d上升至较大值后继续上升, 第5 d达到最大值, 之后以较快速率下降并与A、C两组一起在第60 d达到稳定较低水平, 此时A、B、C组水体ρ(TP)相比最大值分别下降83.73%、89.19%、90.42%.
另外, A、B、C 3组水体ρ(TP)在腐解进行60 d内的大小顺序均为菱角>狐尾藻>荷花, 而这一顺序与水生植物在此之前的磷释放关系有关, 根据此前3种植物腐解各阶段的腐解速率及w(TP)值的大小进行分析, 植物腐解前中期(60 d内)各阶段中磷释放关系基本吻合菱角>狐尾藻>荷花.与此同时, 3种植物腐解周期内水体ρ(PO43--P)变化趋势与ρ(TP)一致, Person相关性检验发现两者之间显著正相关(p<0.01), 且狐尾藻、菱角、荷花腐解各阶段水体ρ(PO43--P)/ρ(TP)平均值分别为0.715、0.762、0.821, 说明腐解过程中水槽上覆水总磷主要由无机磷酸盐构成.
3.4.3 底泥w(TP)变化图 3d中A、B、C组底泥w(TP)在整个腐解过程中发生显著变化, 其间在腐解开始进行60 d内除了在第35 d下降外, 其余腐解阶段上升, 并于第60 d上升至最大值; 而在此之后的腐解过程中, 底泥w(TP)下降-上升, 且实验结束时A、B、C组底泥w(TP)相比初始值分别增加247%、284%、303%.
底泥w(TP)这一变化趋势表明, 植物腐解过程中水体磷营养物质与底泥之间发生明显交换, 磷的生物循环以及自身吸附沉降等物化作用不仅使底泥总磷含量上升, 其间也存在下降阶段, 但最终底泥总磷发生明显累积.
4 讨论(Discussion) 4.1 植物腐解过程水生植物腐烂分解过程十分复杂(李文朝等, 2001), 包含了植物组织的水解、矿质成分及溶解性有机物的溶解、各类有机成分的酶解和生物降解、微小颗粒的逸散等.根据其腐解速率的快慢及难易程度, 可以将该过程分为3个阶段:①淋溶性物质如有机酸、蛋白质、糖类等的快速淋溶释放, 此阶段植物重量的减少非常迅速; ②易分解物质受微生物快速分解阶段; ③难分解物质木质素、纤维素等在微生物及其胞外酶作用下的缓慢分解阶段(顾久君, 2008; Eliška et al., 2007).
本研究中, 3种植物腐解速率呈阶段性变化, 均在腐解第2 d达到最大值后以相对较高水平继续腐解, 之后C、B、A试验组分别于第35、45、60 d进入低速缓慢腐解阶段, 直至试验结束.在此, 将3种植物在开始进行2 d的腐解过程看做以淋溶释放为主, 植物重量迅速减少, 而快速分解阶段持续时间则存在种间差异, 其中荷花持续时间最短, 菱角次之, 狐尾藻最后, 并且整个腐解过程的Olson指数衰减拟合结果为菱角>狐尾藻>荷花(K1、K2), 这跟研究(曹培培等, 2014)中6种水生植物腐解速率大小根据植物生态型种类依次为浮水植物>沉水植物>挺水植物的结论一致, 该研究并且发现, 植物腐解后期挺水植物木质素含量显著高于沉水植物和浮水植物.另有研究(Wang et al., 2001)认为植物组织N、木质素含量在指示植物分解速率的快慢方面起着核心作用, 特别是在腐解后期中高含量的木质素将制约植物的分解速率, 因此综合来看, 快速腐解阶段中荷花木质素积累最快也许是该植物最早进入缓慢腐解阶段的原因.
4.2 腐解对水体ρ(DO)、ρ(CODMn)、ρ(DOC)的影响水体ρ(DO)是衡量水生态活性的重要指标, 植物腐解过程中它可以通过影响微生物新陈代谢方式来改善水-植物-底泥体系内营养物质循环速率.本研究中, 植物腐解前期向水体淋溶释放大量有机、无机物, 导致水体ρ(CODMn)、ρ(DOC)突然上升至最大值, 水环境极度厌氧, 之后在其他因素影响下这两种指标下降-上升-下降.其中, 水体ρ(DOC)在腐解初期快速上升-下降这一变化趋势和姚佳研究黑藻叶、茎腐解释放溶解性有机质中缓慢上升-下降的特性不同(姚佳等, 2017), 可能是本研究中水生植物初始生物量密度相比较大, 腐解前期淋溶释放的有机物含量较高, 水体ρ(DOC)上升较快, 而这些溶解性有机碳通过吸附沉淀等方式向底泥或者水槽器壁转移, 同时适应环境改变的厌氧微生物在获得大量有机碳源后进行快速繁殖, 共同承担起减轻水体DOC负荷的作用; 另外, 第8 d ρ(CODMn)、ρ(DOC)上升出现峰值则可能是由于有机碳自身吸附沉淀与解吸附尚未达成平衡, 加上底泥中的有机碳在微生物作用下发生矿化作用失稳, 再次向水体释放; 而在进入缓慢腐解阶段前, 随着植物腐解速率变慢, 腐解释放DOC的速率也随之变慢, 加上微生物自身新陈代谢作用将水中的碳源以CH4、CO2等气体形式产生损失(李雪英等, 2011)或通过自身吸附沉降方式向底泥转移等, 因此, 水体ρ(DOC), ρ(CODMn)继续下降.
当腐解进入到第60 d时, 3种植物腐解主要以木质素、纤维素等难降解物质为主, 水体ρ(DO)逐渐上升, 参与降解有机质的微生物以异养好氧型为主进行繁殖, 水体ρ(DOC)继续下降, 最后接近或恢复初始水平.
4.3 水-植物-底泥体系内磷营养物质迁移、转化过程一般而言, 植物腐解过程中大部分营养物质被释放向水体, 剩余部分随植物残体沉向水底, 其中被释放的磷营养物质中很少以化合物的形式滞留在水中, 更多的是以沉积物的形式贮存在水底(Pettit et al., 2012).本研究结束时, 3种植物腐解率达80%以上, w(TP)下降50%以上, 而水体ρ(PO43--P)、ρ(TP)终末值与初始值相差不大, 并且底泥w(TP)上升240%以上, 因此植物通过腐解向水体释放的磷营养物与底泥之间发生明显交换(Zhang et al., 2018).
有研究(陈永川等, 2005)认为水-植物-底泥体系内的磷营养物质迁移、转化的过程十分复杂, 包括磷的生物循环、含磷颗粒的沉降与再悬浮过程、溶解态磷的吸附与解吸附作用、磷酸盐的沉积与溶解等.而本研究中, 3种植物(除了荷花)以相对较高水平速率进行腐解16 d内, w(TP)基本上单调下降, 水体ρ(PO43--P)、ρ(TP)大小依次为菱角>狐尾藻>荷花, 这是因为沉水植物狐尾藻和浮水植物菱角腐解过程中含磷易分解活性物质较挺水植物荷花多(李小龙, 2006), 并且荷花在此腐解阶段中含磷化合物分解速率较非磷化合物慢, 磷释放量相比较少; 而水体ρ(PO43--P)、ρ(TP)在上升至最大值后出现明显下降, 这可能是因为随着腐解的进行, 水中悬浮的腐解溢散颗粒明显增多, 其对水中有机、无机磷的吸附沉淀作用增强(厉恩华, 2006), 加上微生物在碳源充足的情况下迅速繁殖, 水中存在大量的磷向底泥迁移; 而之后16~45 d内, 虽然植物仍旧以相对较高速率进行腐解, 但植物w(TP)上升, 两者之间得以抵消(Davis, 1991), 加上底泥对磷营养物质的吸附及其自身的沉降作用, 水体ρ(PO43--P)、ρ(TP)继续下降.当腐解进行至第60 d时, 由于水体溶氧逐渐恢复, 底泥中的聚磷菌大量吸收水中的磷, 水体ρ(PO43--P)、ρ(TP)下降至较低水平, 底泥w(TP)达到最大值.
5 结论(Conclusions)1) 本腐解试验研究中, 狐尾藻、菱角、荷花3种水生植物腐解速率符合腐解三阶段理论, 并在各腐解阶段内存在种间差异, 其中第2 d达到最大值, 后分别于第60、45、35 d不同时间内进入缓慢分解阶段, 最后试验结束时3种植物腐解率分别达到83.8%、94.5%、81%.
2) 由于本腐解试验研究中水生植物初始生物量密度较大, 腐解释放有机质对水体的影响亦较大, 其中ρ(DOC)、ρ(CODMn)均与植物腐解速率极显著正相关(p<0.01), 但最终试验结束时, 水质恢复或接近初始水平.
3) 狐尾藻、菱角、荷花在整个腐解周期内平均磷释放速率分别为0.456、0.670、0.537 mg · g-1, 其中主要以无机磷酸盐为主, 并且向底泥之间发生明显的迁移、转化.
因此在协调水生植物与湖泊之间的生态平衡时, 一定要注意控制水生植物优势种生物量密度, 防止底泥有机质过量累积, 造成潜在的二次污染.
Brigolin D, Lovato T, Rubino A, et al. 2011. Coupling early-diagenesis and pelagic biogechemical models for estimating the seasonal variability of N and P fluxes at the sediment-water interface:Application to the northwestern Adriatic coastal zone[J]. Jouranl of Marine Systems, 87: 239–255.
DOI:10.1016/j.jmarsys.2011.04.006
|
曹培培, 刘茂松, 唐金艳, 等. 2014. 几种水生植物腐解过程的比较研究[J]. 生态学报, 2014, 34(14): 3848–3858.
|
陈永川, 汤利. 2005. 沉积物-水体界面氮磷的迁移转化规律研究进展[J]. 云南农业大学学报, 2005, 20(4): 527–531.
DOI:10.3969/j.issn.1004-390X.2005.04.016 |
Davis S M. 1991. Growth, decomposition, and nutrient retention of Cladium jamaicense Crantz and Typha domingensis Pers. in the Florida Everglades[J]. Aquatic Botany, 40(3): 203–224.
DOI:10.1016/0304-3770(91)90059-E
|
Eliška R, Dagmara S. 2007. Wetland macrophyte decomposition under different nutrient condititions:Relationships between decompositon rate, enzyme activites and microbial biomass[J]. Soil Biology&Biochemistry, 39: 526–538.
|
樊海川, 周林飞, 白庚沐. 2018. 石佛寺人工湿地不同水生植物区域磷的沉积特征分析[J]. 水电能源科学, 2018, 36(5): 39–42.
|
Gopal B. 1999. Natual and constructed wetlands for wastewater treatment:potentials and problems[J]. Water Science and Technology, 40(3): 27–35.
DOI:10.2166/wst.1999.0130
|
耿荣妹, 胡小贞, 许秋瑾, 等. 2016. 太湖东岸湖滨带水生植物特征及影响因素分析[J]. 环境科学与技术, 2016, 39(12): 17–22.
|
顾久君, 金朝晖, 刘振英. 2008. 乌梁素海沉水植物腐烂分解试验研究[J]. 干旱区资源与环境, 2008, 22(4): 181–184.
DOI:10.3969/j.issn.1003-7578.2008.04.034 |
Han C, Ding S M, Yao L, et al. 2015. Dynamics of phosphorus-iron-sulfur at the sediment-water interface influenced by algae blooms decomposition[J]. Journal of Hazardous Materials, 300: 329–337.
DOI:10.1016/j.jhazmat.2015.07.009
|
厉恩华, 刘贵华, 李伟. 2006. 洪湖三种水生植物的分解速率及氮、磷动态[J]. 中国环境科学, 2006, 26(6): 667–671.
DOI:10.3321/j.issn:1000-6923.2006.06.007 |
李文朝, 陈开宁, 吴庆龙, 等. 2001. 东太湖水生植物生物质腐烂分解实验[J]. 湖泊科学, 2001, 13(4): 331–336.
DOI:10.3321/j.issn:1003-5427.2001.04.006 |
李小龙. 2006.铜绿微囊藻(Microcystis aeruginoss)和玫瑰拟衣藻(Chloromonasrosae)光合作用特征、营养生长动力学及相互竞争研究[D].北京: 中国科学院研究生院
|
李雪英, 骆敏聪, 孙省利. 2011. 湛江特呈岛红树林区底泥TOC的释放研究[J]. 环境科学与技术, 2011, 34(1): 34–37.
|
Olson J S. 1963. Energy storage and the balance of producers and decomposers in ecological systems[J]. Ecology, 44(2): 322–331.
DOI:10.2307/1932179
|
Pettit N, Davies T, Fellman J. 2012. Leaf litter chemistry, decomposition and assimilation by macroinvertebrates in two tropical streams[J]. Hydrobiologia, 680(1): 63.
DOI:10.1007/s10750-011-0903-1
|
苏胜齐, 姚维志. 2002. 沉水植物与环境关系评述[J]. 农业环境保护, 2002, 21(6): 570–573.
|
Sulu-Gambari F, Seitaj D, Meysman F J R, et al. 2015. Cable bacteria control iron-phosphorus dynamics in sediments of a coastal hypoxic basin[J]. Environmental Science & Technology, 50: 1227–1233.
|
Wu S Q, He S B, Zhou W L, et al. 2017. Decomposition characteristics of three different kinds of aquatic macrophytes and their potential application as carbon resource in constructed wetland[J]. Environmental Pollution, 231(1): 1122–1133.
|
王国祥, 濮培民, 张圣照, 等. 1998. 用镶嵌组合植物群落控制湖泊饮用水源区藻类及氮污染[J]. 植物资源与环境, 1998, 7(2): 35–41.
|
Wang G X, Zhang L M, Chua H, et al. 2009. A mosaic community of macrophytes for the ecological remediation of eutrophic shallow lakes[J]. Ecological Engineering, 35(4): 582–590.
DOI:10.1016/j.ecoleng.2008.06.006
|
Wang J, Huang J H. 2001. Comparison of major nutrient release patterns in lesf litters decomposition in warm temperate zone of China[J]. Acta Phytoecologica Sinica, 25(3): 375–380.
|
汪院生. 2013. 滆湖水环境演变及其原因分析[J]. 水利规划与设计, 2013, 8: 37–40.
|
姚佳, 杨飞, 张毅敏, 等. 2017. 黑藻叶、茎腐解释放溶解性有机物的特性[J]. 中国环境科学, 2017, 37(11): 4294–4303.
DOI:10.3969/j.issn.1000-6923.2017.11.035 |
张奋清, 王丽敏, 吴利斌, 等. 2004. 乌梁素海氮循环转化过程的初探[J]. 内蒙古农业大学学报, 2004, 25(2): 31–34.
|
Zhang W Q, Jin X, Meng X, et al. 2018. Phosphorus transformations at the sediment-water interface in shallow freshwater ecosystems caused by decomposition of plant debris[J]. Chemosphere, 201: 328–334.
DOI:10.1016/j.chemosphere.2018.03.006
|
 2019, Vol. 39
2019, Vol. 39


