2. 91053部队, 北京 100000
2. 91053 Troops, Beijing 100000
饮用水供水及贮存过程中存在微生物的再生长现象, 进而导致饮用水卫生安全隐患、感官性状恶化及供水管网与设备的微生物腐蚀等诸多问题(Prest et al., 2016).可同化有机碳(AOC)作为评价饮用水中微生物再生长潜力的一个重要指标, 是有机物中最容易被微生物直接利用同化为微生物体的部分(Chevallier et al., 1990).Van der Kooij等(1979; 1982)最早提出AOC的生物检测方法, 以荧光假单胞菌P17与螺旋菌NOX两种细菌作为检测所用菌种, 利用两种细菌浓度与乙酸碳浓度之间的产率关系, 将培养后水样中的细菌浓度转换为水样AOC浓度.
Van der Kooij提出的检测方法是目前AOC检测方法的基础, 之后国内外科研人员对其进行了不同程度的改进与优化(Hammes et al., 2010; Sharp et al., 2001).但AOC作为一个新兴的水质指标, 现行的通用方法仍有待优化, 不同研究人员在测定过程中对水样的接种方式不一, 且产率对照组标准乙酸碳溶液浓度的选取缺乏相关的理论依据, 大多直接采用Van der Kooij所选的100 μg·L-1, 因而存在一定的缺陷.为了提高低浓度AOC水样的测定准确度, 本文进一步研究P17及NOX两种细菌浓度与水样AOC浓度之间的关系, 对AOC测定过程中产率系数的测定方法进行优化, 并对比3种不同接种方法测定结果之间的准确度, 以提出最佳的接种方案, 并采用最佳方案, 选取低浓度AOC水样对产率系数改进前后测定结果的准确度进行对比分析.
2 材料与方法(Materials and methods) 2.1 实验所需试剂0.1 mol·L-1磷酸盐缓冲溶液:称取8.0 g NaCl、0.2 g KCl、1.56 g Na2HPO4、0.2 g KH2PO4溶解于1000 mL超纯水中;400 mg·L-1储存溶液:称取1.3667 g CH3COONa溶于1000 mL超纯水中;矿物盐溶液:称取85.5 mg KH2PO4、383.5 mg NaCl、722 mg KNO3溶于500 mL超纯水中;LLA固体培养基:称取5.0 g蛋白胨、3.0 g牛肉浸膏、5.0 g NaCl、15.0 g琼脂粉于1000 mL超纯水中, 加热沸腾溶解.
2.2 接种液的制备吸取50 mL 2000 μg·L-1乙酸碳溶液于锥形瓶中, 并向其中加入100 μL稀释一定倍数后的矿物盐溶液, 121 ℃湿式灭菌20 min.待灭菌后的溶液冷却后各加入100 μL实验室保存的菌种, 置于25 ℃恒温培养箱中培养.
2.3 水样的处理与接种当水样中存在余氯时, 需现场加入硫代硫酸钠溶液进行中和, 防止余氯对测试菌生长产生抑制作用.若水样浊度较高或AOC浓度较高, 应静沉后用矿物盐溶液稀释.若待测水样中悬浮物较多, 应先用0.45 μm的微滤膜过滤水样, 以去除颗粒物对测定结果的干扰.
水样在湿式灭菌后, 接种P17或NOX菌种, 接种后水样中细菌浓度为104 CFU·mL-1, 待接种水样体积为40 mL, 则所需接种液的体积按式(1)计算(Chevallier et al., 1993).

|
(1) |
式中, V为所需接种液的体积(mL);C为接种液的浓度(CFU·mL-1).
2.4 产率系数的测定产率系数即P17及NOX两种细菌在单位乙酸碳浓度下达到生长稳定期时的菌落数, 具体计算公式见式(2)、(3)(Van der Kooij et al., 1984).

|
(2) |
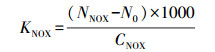
|
(3) |
式中, KP17及KNOX分别为P17及NOX的产率系数(CFU·μg-1);NP17及NNOX分别为P17及NOX产率对照组所测细菌浓度(CFU·mL-1);CP17及CNOX分别为P17及NOX产率对照所用标准乙酸碳的浓度(μg·L-1);N0为空白对照组所测细菌浓度(CFU·mL-1).
2.5 测定精度的控制与AOC的计算为避免测定过程中所用玻璃仪器造成的误差, 将水样培养所用锥形瓶在稀硝酸中浸泡24 h, 然后用自来水、蒸馏水各冲洗3遍, 最后放入400 ℃马弗炉中烘烤6 h进行无碳化处理.此外, 为消除接种液在保存过程中其细菌浓度及活性变化对水样测定结果的影响, 在不同组水样测定中都同步设置空白对照与产率对照水样, 进而计算该组水样的产率系数及水样AOC浓度.水样AOC浓度计算公式如式(4)~(6)所示(Van der Kooij et al., 1984).
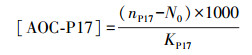
|
(4) |

|
(5) |
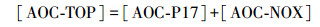
|
(6) |
式中, [AOC-P17]、[AOC-NOX]及[AOC-TOP]分别为水样中AOC-P17、AOC-NOX及AOC-TOP的浓度(μg·L-1);nP17及nNOX分别为接种培养后水样中P17及NOX的细菌浓度(CFU·mL-1).
3 结果与讨论(Results and discussion) 3.1 接种液制备中细菌生长特性每天同一时间对接种液中的细菌浓度进行测定, 以确定细菌生长的稳定期, 进而确定接种液培养所需时间.细菌浓度测定采用平板计数法, 并利用稀释后的磷酸盐溶液进行10倍稀释.本实验中所制备接种液浓度随培养时间的变化如图 1所示.
 |
| 图 1 P17接种液(a)及NOX接种液(b)浓度随时间变化曲线 Fig. 1 P17(a) and NOX (b) inoculum concentration curve over time |
由图 1a可以看出, 培养2 d后, 接种液中P17细菌浓度达到最大值, 在第2~6 d的培养时间内, 接种液中P17浓度基本保持稳定, 维持在1.20×107~1.40×107 CFU·mL-1范围内.表明在该时间段内, P17细菌生长处于稳定期, 细菌浓度较大且较稳定, 较宜作为接种液.当接种液培养时间超过6 d时, 接种液中细菌浓度逐渐下降, 细菌活性降低, 生长进入衰亡期.
由图 1b可知, NOX细菌生长速率较为缓慢, 培养8 d后, 细菌浓度不再有明显增长, 保持在3.50×107~4.00×107 CFU·mL-1之间, 即进入稳定期.且NOX细菌进入稳定期后, 其浓度在较长一段时间内保持恒定, 稳定期持续时间较P17细菌明显增加.在接种液的制备过程中, 为保证乙酸碳全部被细菌所利用, 接种液中细菌处于稳定期, 水样在接种过程中无外加碳源进入, P17细菌的培养时间应选择2~4 d, NOX细菌选择为7~8 d.
测定AOC所用接种液保存于4~6 ℃冰箱中, 最长保存期限为3个月且每个月必须对其浓度进行重新测定并修正水样接种体积, 以保证测定结果的准确度.
3.2 产率系数测定产率系数测定是AOC检测过程中的重要环节, 产率系数的大小受接种浓度、培养温度、培养时间等因素的影响.不同实验室、不同实验人员所测定的产率系数均不同.表 1总结了前人对P17与NOX细菌产率系数的测定结果.
| 表 1 P17及NOX产率系数 Table 1 P17 and NOX yield factor table |
本研究采用平板计数法测定两种细菌所对应的产率系数, 分别配制不同浓度的乙酸碳标准溶液并加入一定量的矿物盐溶液, 然后接种P17或NOX细菌并于25 ℃培养, 其中, P17细菌培养3 d, NOX细菌培养4 d(Van Der Kooij et al., 1979; 1982;Chevallier et al., 1993), 之后测定细菌浓度, 结果如图 2~3所示.
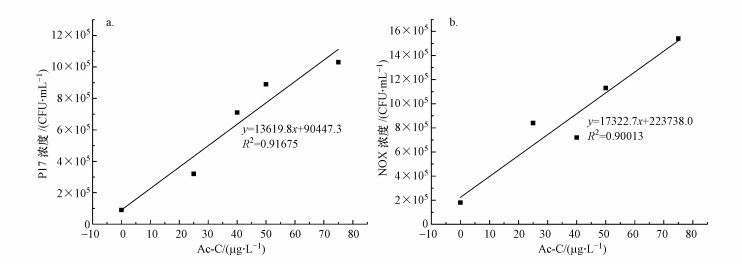 |
| 图 2 P17(a)及NOX(b)产率曲线(Ac-C浓度 < 75 μg·L-1) Fig. 2 P17(a) and NOX(b) yield curve |
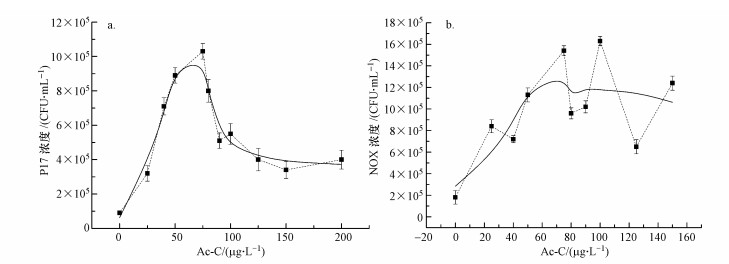 |
| 图 3 P17(a)及NOX(b)产率曲线(Ac-C浓度 > 75 μg·L-1) Fig. 3 P17(a) and NOX (b)yield curve |
由图 2可知, 当所用标准乙酸碳浓度低于75 μg·L-1时, P17及NOX细菌浓度与乙酸碳浓度呈现较好的线性关系(P17:R2=0.9168, NOX:R2=0.9001), 两种细菌的产率系数分别为1.36×107 CFU·μg-1(P17)、1.73×107 CFU·μg-1(NOX).利用水样中P17或NOX的细菌浓度可较好地反映水样AOC浓度.
由图 3可知, 当标准乙酸碳浓度大于75 μg·L-1时, 随着标准乙酸碳浓度的增加, P17细菌的浓度反而下降, 与标准乙酸碳浓度之间的线性关系变差.而当标准乙酸碳浓度大于75 μg·L-1时, NOX细菌浓度在一定范围内上下浮动, 其与标准乙酸碳浓度之间的线性关系也随之减弱.表明在低浓度AOC的测定过程中, 原方法直接采用100 μg·L-1的乙酸碳标准溶液作为产率对照是不恰当的, 当采用75 μg·L-1的乙酸碳标准溶液作为产率对照时测定结果更为准确.分析细菌浓度与乙酸碳浓度之间线性关系降低的原因主要有以下几点:①不同乙酸碳浓度下P17与NOX细菌生长达到稳定期所需的时间不同, 而本研究中P17及NOX细菌培养时间统一为3 d和4 d, 从而导致当乙酸碳浓度过大时, 细菌浓度与AOC浓度之间的线性关系下降;②当水样中乙酸碳浓度过大时, 细菌生长的限制因子已不再是碳, 可能是磷等其它元素限制细菌的生长(李伟英等, 2017;汤帅冰等, 2017);③水样中细菌浓度过大时, 细菌之间存在相互作用的影响.总体来说, 当标准乙酸碳浓度在75 μg·L-1范围内时, 可通过测定水样中P17或NOX两种细菌的浓度较准确地计算出水样中AOC浓度.
3.3 不同接种方法实验结果对比在AOC的测定过程中, 水样共有3种接种方式:①将P17和NOX分别接种于水样中;②将P17与NOX同时接种于水样中;③先将P17接种于水样中, 25 ℃培养3 d后平板计数, 再将水样经巴氏灭菌(70 ℃, 30 min)后接种NOX, 即先后接种法.为了对比以上几种方法之间的区别与准确度, 本研究利用实验室标准乙酸碳溶液及矿物盐溶液配制25、50、75 μg·L-1的乙酸碳溶液作为标准水样(刘文君等, 2000;方华等, 2006), 用3种接种方法对水样分别进行测定, 结果如表 2所示.
| 表 2 不同接种方法AOC测定结果对比 Table 2 Comparison of results of AOC determination by different inoculation methods |
由表 2可以看出, 当采用分别接种法进行测定时, 由于P17和NOX均可直接利用乙酸碳作为细菌生长繁殖所需碳源, 水样AOC-P17与AOC-NOX中有很大部分重复计算, 导致水样AOC所测结果偏差较大, 测定总AOC约为真实值的2倍.由表 3中AOC-NOX占水样总AOC的比例也可以看出, 与同时接种及先后接种相比, 分别接种所测得结果中AOC-NOX所占比例约为AOC-TOP的50%~60%, 而同时接种及先后接种AOC-NOX约占AOC-TOP的10%~40%.第2种方法即同时接种法在测定过程中, 由于P17与NOX两种细菌的生长周期不同, 达到稳定期所需的时间也不同, P17达到稳定期所需时间较短, 生长速率较快, 菌落较大(3~5 mm), 故在同一培养皿上进行平板计数时两种细菌之间存在掩蔽现象, 影响测定结果, 导致测定结果不稳定.此外, P17与NOX同时接种时, 两种细菌对碳源的利用是否存在相互影响尚不清楚(Liu et al., 2002).先后接种法较为符合NOX补充利用P17所不能利用的一些物质(如草酸等)的原理(Van der Kooij et al., 1984), 可较为准确、全面地反映水样中AOC实际浓度.
| 表 3 不同接种方法AOC-NOX占AOC-TOP比例 Table 3 AOC-NOX occupies AOC-TOP ratio of different inoculation methods |
在对不同接种方法测定结果进行对比的基础上, 本研究采用先后接种法, 利用实验室标准乙酸碳溶液及矿物盐溶液配制不同乙酸碳浓度的标准水样, 分别采用75 μg·L-1(改进方法)与100 μg·L-1(传统方法)作为测定AOC过程中的产率对照水样, 对其测定结果进行对比, 结果见表 4及图 4.由表 4及图 4中对比结果可知:对于低浓度AOC水样的测定, 当产率对照乙酸碳浓度选用75 μg·L-1时, AOC测定结果的偏差率为20%~40%, 明显低于100 μg·L-1时的偏差率(60%~80%).因此, 采用75 μg·L-1的乙酸碳标准溶液代替100 μg·L-1的乙酸碳标准溶液作为水样AOC测定过程中的产率对照时, 水样测定结果更接近真实值, 可更好地反映水样中AOC的实际浓度.
| 表 4 不同方法AOC测定结果对比 Table 4 Comparison of AOC measurement results by different methods |
 |
| 图 4 不同方法AOC测定结果偏差对比 Fig. 4 Deviation comparison of different AOC measurement methods |
1) 在接种液的制备过程中, P17细菌培养2~4 d, NOX细菌培养7~8 d时, 接种液中P17及NOX细菌浓度较高且维持稳定, 细菌生长处于稳定期, 较适宜用作接种液.
2) 当Ac-C浓度 < 75 μg·L-1时, 标准乙酸碳溶液的浓度与细菌浓度线性关系较强;当Ac-C浓度 > 75 μg·L-1, 两者的线性关系减弱.
3) 由分别接种法、同时接种法及先后接种法的对比分析可知, 分别接种法结果稳定但误差较大;同时接种法存在细菌的掩蔽现象, 测定结果不稳定;先后接种法测定结果较稳定且接近真实值.
4) 对两种细菌产率曲线及AOC测定过程中产率对照乙酸碳溶液浓度选取的研究表明, 在低浓度AOC的测定过程中, 将产率对照乙酸碳的浓度由传统的100 μg·L-1优化为75 μg·L-1后, 可更好地反映P17及NOX细菌浓度与水样AOC浓度之间的线性关系, AOC测定结果更为准确.
Aggarwal S, Jeon Y, Hozalski R M. 2015. Feasibility of using a particle counter or flow-cytometer for bacterial enumeration in the assimilable organic carbon (AOC) analysis method[J]. Biodegradation, 26(5): 387–397.
DOI:10.1007/s10532-015-9741-6
|
Chevallier M W L. 1990. Coliform regrowth in drinking water:a review[J]. Journal of the American Water Works Association, 82: 74–86.
DOI:10.1002/j.1551-8833.1990.tb07054.x
|
Chevallier M W L, Shaw N E, Kaplan L A, et al. 1993. Development of a rapid assimilable organic carbon method for water[J]. Applied & Environmental Microbiology, 59(5): 1526–1531.
|
方华, 吕锡武, 吴今明. 2006. 生物测定饮用水中可同化有机碳(AOC)方法优化[J]. 中国给水排水, 2006, 22(14): 75–79.
DOI:10.3321/j.issn:1000-4602.2006.14.023 |
方华.2006.饮用水生物稳定性和净水工艺对有机物去除的研究[D].南京: 东南大学
http://cdmd.cnki.com.cn/Article/CDMD-10286-2007030192.htm |
Hammes F, Berger C, Köster O, et al. 2010. Assessing biological stability of drinking water without disinfectant residuals in a full-scale water supply system[J]. Aqua, 59(1): 31–40.
|
Liu W, Wu H, Wang Z, et al. 2002. Investigation of assimilable organic carbon (AOC) and bacterial regrowth in drinking water distribution system[J]. Water Research, 36(4): 891–898.
DOI:10.1016/S0043-1354(01)00296-2
|
刘文君, 王亚娟, 张丽萍, 等. 2000. 饮用水中可同化有机碳(AOC)的测定方法研究[J]. 给水排水, 2000, 26(11): 1–5.
|
李伟英, 周艳彦, 张骏鹏, 等. 2017. 营养物质和氯对饮用水中细菌再生长的影响[J]. 哈尔滨工业大学学报, 2017, 49(2): 70–76.
|
Polanska M, Huysman K, Van K C. 2005. Investig-ation of assimilable organic carbon (AOC) in flemish drinking water[J]. Water Research, 39(11): 2259–2266.
DOI:10.1016/j.watres.2005.04.015
|
Prest E I, Hammes F, Loosdrecht M C M V, et al. 2016. Biological stability of drinking water:controlling factors, methods, and challenges[J]. Frontiers in Microbiology, 7(45): 45–69.
|
Sharp R R, Camper A K, Crippen J J, et al. 2001. Evaluation of drinking water biostability using biofilm methods[J]. Journal of Environmental Engineering, 127(5): 403–410.
DOI:10.1061/(ASCE)0733-9372(2001)127:5(403)
|
孙文俊.2010.饮用水紫外线消毒生物安全性研究[D].北京: 清华大学
|
汤帅冰, 李伟英, 周艳彦, 等. 2017. 城市给水管网细菌再生长营养元素的试验研究[J]. 净水技术, 2017(2): 19–25.
|
Van Der Kooij, Visser A, Hijnen W A M. 1982. Determining the Concentration of Easily Assimi lable Organic Carbon in Drinking Water[J]. Journal AWWA, 74(10): 540–545.
DOI:10.1002/j.1551-8833.1982.tb05000.x
|
Van Der Kooij. 1979. Characterization and classification of fluorescent pseudomonads isolated from tap water and surface water[J]. J Microbiol, 45: 225–240.
|
Van Der Kooij.1990.Assimilable Organic Carbon (AOC) in Drinking Water//Drinking Water Microbiology[M]. New York: Springer.57-87
|
Van der Kooij, Hijnen W A M. 1984. Substrate utilization by an oxalateconsuming spirillum species in relation to its growth in ozonated water[J]. ApplIed and Environmental Microbiology, 47(3): 551–559.
|
 2018, Vol. 38
2018, Vol. 38


