2. 上海海洋大学, 水产科学国家级实验教学示范中心, 上海 201306;
3. 上海海洋大学, 农业部淡水水产种质资源重点实验室, 上海 201306;
4. 上海海洋大学, 农业部鱼类营养与环境生态研究中心, 上海 201306
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306;
3. Key Laboratory of Freshwater Aquatic Genetic Resources, Shanghai Ocean University, Ministry of Agriculture, Shanghai 201306;
4. Centre for Research on Environmental Ecology and Fish Nutrion of the Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306
重金属常具有难降解、易被生物富集、低浓度就显出较强的毒性效应等特点, 其对水体造成的污染已严重威胁到人体和生态健康.从国家海洋局近5年(2011—2016)发布的《中国海洋环境质量公报》提供的数据可以看出, 我国海河流域中Zn污染严重, 位居金属污染物首位, 约占重金属污染物总量的75%;2016年监测显示, 在68条河流入海重金属污染物中Cu位居第2, 其在近1/3的排污口中不能满足所在海洋功能区沉积物质量要求, 甚至个别排污口生物体中的Cu、Zn含量超标.Cu、Zn作为动植物和人类所需的微量元素, 其水体重金属污染的去除研究相比其他重金属来说还较少.传统的重金属去除方法有物理法、化学法、生物法三大类, 物理法和化学法存在成本高、能耗大、易造成二次污染等缺点, 而生物法对重金属的处理周期过长(张亚南等, 2015).目前, 纳米技术在环境重金属污染修复中显示出独特的优势, 可通过氧化、还原、吸附、催化等方式将污染物去除(李钰婷等, 2012).随着纳米技术在环境治理中的应用, 纳米零价铁(nZVI)也应运而生, 其比表面积和反应活性远远大于普通铁屑和铁粉, 具有还原性强、反应速度快等特性(韩占涛等, 2013), 逐渐成为水体修复领域一种颇具潜力的新材料.有学者用nZVI对重金属废水进行吸附去除, 发现其对As、Cu的去除率都在99.5%以上(Li et al., 2017).
然而, 由于nZVI的活性较高, 表面易氧化, 会快速团聚为微粒尺度甚至更大的颗粒, 导致其反应活性和流动性降低.为解决nZVI发生团聚的问题, 人们普遍采用负载法或包覆法对nZVI进行修饰(母娜, 2015).目前, nZVI的负载物通常有活性炭(何桂春等, 2016)、蒙脱石(郭晶晶, 2014)、膨润土(殷齐贺, 2017)和海泡石(Fu et al, 2017)等.肖燕萍(2017)制备出Na-蒙脱石-nZVI并用于重金属的去除实验, 发现其对Cu(Ⅱ)的去除率在95%以上;Fu等(2017)用海泡石负载纳米零价铁(S-nZVI)进行Cr(Ⅵ)、Pb(Ⅱ)的去除实验, 发现S-nZVI对Cr(Ⅵ)、Pb(Ⅱ)的去除率在97%以上.
目前, 研究人员制备出S-nZVI材料并多将其用于多溴联苯醚(母娜, 2015)、六氯丁二烯(刘玉茹等, 2013)、Cr(Ⅵ)和Pb (Ⅱ)(Fu et al., 2017)的去除研究, 有关S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的去除研究极少有报道.基于此, 本研究采用操作简单、易于实现的液相还原法制备出S-nZVI材料, 并考察其对Cu(Ⅱ)、Zn(Ⅱ)的去除能力, 以期为实现水体中Cu(Ⅱ)、Zn(Ⅱ)污染物的高效去除提供新思路和新技术.
2 材料与方法(Materials and methods) 2.1 材料与仪器材料:海泡石(含量99.95%, 粒度325目)购自于河北地山矿产有限公司;化学药品购自国药集团化学试剂有限公司, 主要包括七水合硫酸亚铁(FeSO4·7H2O)、硼氢化钠(NaBH4)、氢氧化钠(NaOH)、盐酸(HCl)、无水乙醇(C2H6O)、硝酸(HNO3)、二水合氯化铜(CuCl2·2H2O)、氯化锌(ZnCl2).所用化学药品均为分析纯, 并用去离子水配制成所需溶液.
仪器:IKA C-MAG HS7磁性搅拌器、一恒DHG-9140A型鼓风干燥箱、广树GST-8-1000高温炉、JJ-1精密增力电动搅拌器、杰隆Blue Pard DZF-系列真空干燥箱、HRYSTAL IS-RSD3恒温振荡器、Metrohm 914 pH/Conductometer pH计、Quadrasopb SI BET比表面积仪(BET)、FEI Tecnai G2 F30场发射投射电镜(TEM)、BRUKER D8 X射线衍射仪(XRD)、GBC Avanta P型原子吸收分光光度计.
2.2 S-nZVI 制备方法海泡石负载型纳米零价铁(S-nZVI)材料的制备分为3步, 首先制备出改性海泡石(Asp), 再将二价铁离子负载于Asp上, 最后采用液相还原法制备出S-nZVI.反应方程式为:
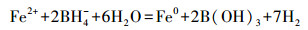
|
(1) |
在室温下用15%的HCl处理海泡石12 h, 固液比为1:5, 浸泡过程不断搅拌;过滤, 水洗至流出液为中性;然后置于干燥箱中120 ℃干燥过夜, 在高温炉中320 ℃焙烧4 h后研磨, 即可得到Asp(廖润华等, 2006;刘玉茹, 2013), 记为材料A.
在氮气保护的条件下, 在250 mL的三口烧瓶中用100 mL去离子水溶解5.6 g FeSO4·7H2O;加入4.48 g材料A, 搅拌吸附120 min;再加入50 mL无水乙醇, 搅拌均匀, 记为溶液B.
将50 mL去离子水的pH值调为9~10, 加入3 g NaBH4, 制成弱碱性NaBH4溶液, 记为溶液C;在2000 r·min-1的搅拌速度下, 全程氮气保护, 将新制的溶液C逐滴加入溶液B中, 控制滴速为每秒2~3滴, 待溶液C滴加完毕, 继续搅拌60 min;然后用真空抽滤泵过滤生成的黑色混合物, 无氧去离子水洗涤2次, 无水乙醇清洗3次后的黑色混合物在75 ℃真空干燥箱中干燥后即制得S-nZVI(刘玉茹等, 2013;肖燕萍, 2017).
2.3 实验方法用氯化铜(CuCl2·2H2O)和氯化锌(ZnCl2)配制Cu(Ⅱ)、Zn(Ⅱ)的储备液, 使Cu(Ⅱ)、Zn(Ⅱ)的浓度为1.0 g·L-1.然后用去离子水根据使用条件需要逐渐稀释, 分别取100 mL于250 mL的具塞三角烧瓶中, 放于恒温振荡器中振荡, 设定温度为25 ℃, 转速为200 r·min-1, 投加一定量的吸附材料(S-nZVI或Asp), 间隔一定时间取样, 水样经0.22 μm滤膜过滤后用原子吸收分光光度计进行测定, 做两组平行以校正可能存在的误差.其中, 材料对Cu(Ⅱ)、Zn(Ⅱ)的去除量Qt、去除率 η 的计算公式如下所示:

|
(2) |

|
(3) |
式中, Co为初始时刻Cu(Ⅱ)、Zn(Ⅱ)的浓度(mg·L-1);Ct为t时刻Cu(Ⅱ)、Zn(Ⅱ)的浓度(mg·L-1);V为溶液的体积(L);m为材料的投加量(g).
3 结果与分析(Results and analysis) 3.1 材料的表征 3.1.1 BET 分析为提高海泡石的比表面积和孔容, 将nZVI更好地负载, 对海泡石进行酸改性处理.由表 1可知, 经酸改性后的海泡石比表面积提高了约4.2倍, 孔容提高了约3倍, 孔的大小几乎没有发生明显的变化.这可能是由于酸与海泡石中的碳酸盐发生作用, 使得碳酸盐杂质被溶蚀, 从而导致海泡石中存在大量酸腐蚀的孔道, 提高了海泡石的比表面积和孔容;另一方面, H+又与海泡石中的Ca2+、Mg2+等离子发生取代反应, 改变了海泡石表面及孔腔特性, 进而增加了比表面积.此外, 研究表明, 在低于500 ℃的煅烧条件下, 海泡石孔道内的吸附水分子会消失且不会引起海泡石的结构变化(李琛等, 2013).以上都是可能导致海泡石比表面积和孔容增大的原因.
| 表 1 海泡石改性前后的BET表征结果 Table 1 BET characterization data of sepiolite before and after modification |
通过对S-nZVI表征发现, S-nZVI的比表面积较Asp有明显下降, 下降了约4.7倍, 甚至比酸未改性的海泡石还低.这可能是因为nZVI负载占据了孔结构的空间, 由于nZVI的尺寸在100 nm左右, 这个尺寸的nZVI会对改性海泡石的孔内部造成一定的堵塞, 进而导致S-nZVI的比表面积下降(孙国帅, 2015;何桂春等, 2016;).此外, S-nZVI材料的孔径明显增大, 可能是由于nZVI颗粒在海泡石表面孔道周围负载后, 堵塞了比较小的孔道, 而大的孔道并没有堵塞, 导致海泡石的孔径明显增大.
3.1.2 TEM 分析图 1所示为S-nZVI在不同放大倍数下的TEM照片.从图中可以清楚地看出S-nZVI在微观状态下的表面形貌, 即Asp具有较为光滑的表面, 呈片状结构;nZVI颗粒呈深黑色球状, 粒径约为100 nm, 大小均匀, 且较好地分散于载体改性海泡石表面.这与已报道的nZVI颗粒易聚集成念珠状的球状长链, 进而连接成树枝状的结果相反(Matheson et al., 1994), 即说明采用Asp作为载体可以很好地将nZVI颗粒分散.
 |
| 图 1 S-nZVI 在不同放大倍数下的 TEM 图 Fig. 1 The TEM image of S-nZVI at different magnification |
从图 2可以看出, 海泡石主要由SiO2和MgO组成.经酸改性后的海泡石XRD谱图显示, MgO的峰减弱, 这表明海泡石中有大量MgO被除去.S-nZVI材料的XRD谱图中, 在2θ=44.67°附近出现了一个明显的弱且宽化了的衍射峰, 对应于形成Fe0的衍射峰, 同时, 并没有看到任何铁的氧化物存在, 说明成功制备出Fe0且制备出的S-nZVI材料纯度较高, 这与已报道的文献(Fu et al., 2017)结果相同.
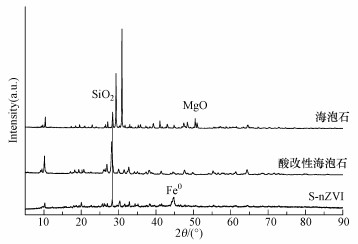 |
| 图 2 海泡石、酸改性海泡石及 S-nZVI 的 XRD 谱 Fig. 2 XRD pattern of sepiolite, acid modified sepiolite and S-nZVI |
溶液的初始pH是影响去除率的重要因素.设定Cu(Ⅱ)、Zn(Ⅱ)的初始浓度为20 mg·L-1, S-nZVI的投加量分别为0.030、0.050 g, 考察不同pH对Cu(Ⅱ)、Zn(Ⅱ)去除的影响.考虑到碱性条件下沉淀生成对去除研究可能造成的影响, 实验中pH设置为酸性及弱碱性条件(王昕等, 2008).
由图 3可知, S-nZVI材料对Cu(Ⅱ)、Zn(Ⅱ)的去除分为快速去除和慢速去除两个阶段, 在10 min以前为快速去除阶段, 去除率随时间的延长而迅速提高;随后去除速率下降, 在60 min左右达到平衡.在60 min时, 随着pH从2.50、3.50、4.50、5.50、6.50增至7.50, S-nZVI对Cu(Ⅱ)的去除率从16.87%、56.77%、86.91%、98.65%、98.73%增至99.08%, 去除量从11.24、37.85、53.94、65.76、65.82 mg·g-1增至66.05 mg·g-1;对Zn(Ⅱ)的去除率从10.35%、82.79%、90.90%、94.84%、98.99%增至99.47%, 去除量从4.14、33.12、36.36、37.94、39.60 mg·g-1增至39.79 mg·g-1.总体上, S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的去除率和去除量随着pH的升高而升高, pH越低越不利于去除反应的进行.有研究发现, nZVI对重金属离子的去除效果主要取决于溶液体系pH及重金属离子的标准还原电势的大小.低pH条件下(pH=2.50时), 溶液中产生大量的H+, 这些H+与nZVI发生反应生成Fe(Ⅲ), 导致nZVI被酸消耗, 抑制了Cu(Ⅱ)、Zn(Ⅱ)的去除;随着pH的升高, S-nZVI表面负电荷逐渐增多, 与Cu(Ⅱ)、Zn(Ⅱ)发生静电吸附, 考虑到铜的标准还原电势(E0(Cu2+/Cu)= 0.34 V)远高于铁的还原电势(E0(Fe2+/Fe) = -0.44 V), 锌的标准还原电势(E0(Zn2+/Zn)= -0.762 V)低于铁的还原电势, 所以Cu(Ⅱ)能够被nZVI还原进而被去除, 而Zn(Ⅱ)则不参与还原反应, 依靠吸附作用进行去除(张鑫, 2010).研究表明, S-nZVI对Cu(Ⅱ)的去除主要分为两步:首先S-nZVI将Cu(Ⅱ)吸附在其表面上, 其次nZVI还原Cu(Ⅱ)并在S-nZVI表面形成共沉淀(修瑞瑞等, 2018;陈健, 2016).此外, 由于nZVI为核-壳结构, 其表面主要的铁氧化物为FeOOH, 在水中FeOOH不但可以作为配位化合物离子, 而且作为配体形成配合物(季莹, 2013);而Zn(Ⅱ)的价层电子构型为3d106s0, 具有价层空轨道, 这种空轨道有利于孤对电子与配体形成配位键, 同时因其属于过渡元素, 有效核电荷较多而离子半径较小, 可以吸引配体(祝爱侠, 2012).因此, nZVI可以通过表面吸附配合机理对Zn(Ⅱ)进行吸附进而将Zn(Ⅱ)去除(张鑫, 2010), 这也与实验出现的Cu(Ⅱ)混合液变黄色而Zn(Ⅱ)混合液未变黄色的现象相一致.对Cu(Ⅱ)、Zn(Ⅱ)来说, 当溶液体系pH值分别大于5.92、7.30(根据溶度积公式计算)时, Cu(OH)2、Zn(OH)2沉淀开始生成, 此时Cu(Ⅱ)的去除是还原作用和Cu(OH)2沉淀生成共同作用的结果, Zn(Ⅱ)的去除是吸附作用和Zn(OH)2生成共同作用的结果.因此, 为了消除重金属离子Cu(Ⅱ)、Zn(Ⅱ)水解的影响, 后续实验均不调节pH, 平衡时间设为60 min.
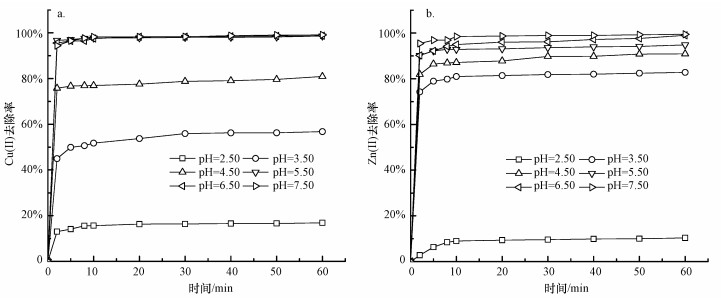 |
| 图 3 不同pH下Cu(Ⅱ)(a)、Zn(Ⅱ)(b)去除率随时间的变化 Fig. 3 The change of Cu(Ⅱ) (a) and Zn(Ⅱ)(b) removal rate with time under different pH |
| 表 2 S-nZVI实验前后重金属溶液pH的变化 Table 2 Change of pH of metal solution before and after experiment on S-nZVI |
设定Cu(Ⅱ)、Zn(Ⅱ)的初始浓度为20 mg·L-1, 考察不同S-nZVI投加量对Cu(Ⅱ)、Zn(Ⅱ)去除的影响.由图 4a可以看出, 在60 min时, 分别投加0.005、0.010、0.015、0.020、0.030和0.040 g的S-nZVI材料, Cu(Ⅱ)的去除率分别为49.02%、62.39%、84.87%、93.94%、98.98%和99.75%, 提高S-nZVI的投加量, Cu(Ⅱ)的去除率逐渐上升.这主要是由于Cu(Ⅱ)的还原反应主要发生在S-nZVI表面, 投加量的增加使得S-nZVI的有效比表面积随之增大, 进而增加了反应所需的活性位点, 提高了Cu(Ⅱ)的去除率(Xiao et al., 2015).当投加量从0.030 g增加到0.040 g时, 去除率仅增加0.77%, 而考虑到实际生产的经济性, 在投加量为0.030 g时, 整个反应已具有较好的去除效果, 因此, 后续实验中将S-nZVI材料的投加量设置为0.030 g, 此时去除量为65.98 mg·g-1.
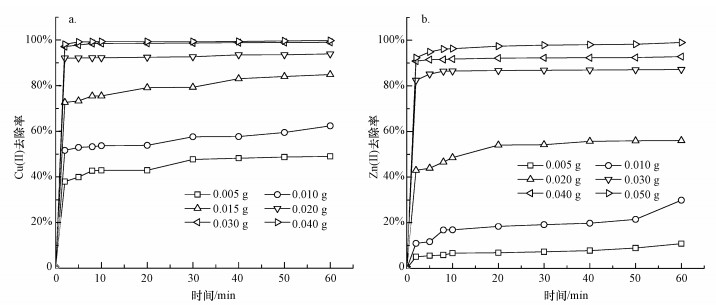 |
| 图 4 不同S-nZVI投加量下Cu(Ⅱ)(a)、Zn(Ⅱ)(b)去除率随时间的变化 Fig. 4 The change of Cu (Ⅱ)(a) and Zn (Ⅱ)(b) removal rate with time under different S-nZVI dosage |
S-nZVI投加量对Zn(Ⅱ)去除的影响如图 4b所示, 分别投加0.005、0.010、0.020、0.030、0.040和0.050 g的材料时, Zn(Ⅱ)在60 min时的去除率分别为10.86%、29.89%、56.06%、87.17%、92.79%和98.97%.与Cu(Ⅱ)一样, 其去除率也随着投加量的增加而提高.投加量的增加使得S-nZVI的吸附位点增加, 随着吸附的进行, 去除率提高逐渐放缓则是由于达到吸附平衡所致.在后续实验中将S-nZVI材料的投加量设置为0.050 g, 此时吸附量为39.59 mg·g-1.
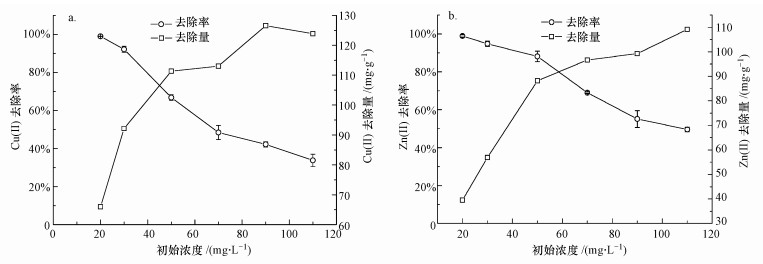
3.4 溶液初始浓度对去除率的影响设定Cu(Ⅱ)、Zn(Ⅱ)溶液中S-nZVI的投加量分别为0.030、0.050 g, 考察不同溶液初始浓度对Cu(Ⅱ)、Zn(Ⅱ)去除的影响.从图 5、6的实验结果可以看出, 重金属溶液的初始浓度是影响S-nZVI去除重金属离子的重要因素, 将直接影响到去除率和去除量.随着重金属离子的初始浓度从20、30、50、70 mg·L-1增加到90 mg·L-1, S-nZVI对Cu(Ⅱ)的去除率从98.98%、92.16%、66.81%、48.45%下降到42.19%, 去除量从65.98、92.16、111.35、113.04 mg·g-1增加到126.56 mg·g-1;对Zn(Ⅱ)的去除率从98.97%、94.83%、88.16%、69.04%下降到55.15%, 去除量从39.59、56.90、88.16、96.66 mg·g-1增加到99.27 mg·g-1.S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的吸附效果变化趋势在此浓度范围内相似, 即去除率呈下降趋势, 去除量呈上升趋势.当重金属离子溶液初始浓度增加到110 mg·L-1时, Cu(Ⅱ)的去除率为33.79%, 去除量略有降低, 为123.90 mg·g-1;Zn(Ⅱ)的去除率为49.61%, 去除量持续上升, 为109.13 mg·g-1.
 |
| 图 5 不同溶液初始浓度下Cu(Ⅱ)(a)、Zn(Ⅱ)(b)去除率随时间的变化 Fig. 5 The change of Cu(Ⅱ) (a) and Zn(Ⅱ) (b) removal rate with time under different initial concentration |
 |
| 图 6 不同溶液初始浓度下Cu(Ⅱ) (a)、Zn(Ⅱ) (b)的去除率和去除量 Fig. 6 The Cu(Ⅱ) (a) and Zn(Ⅱ) (b) removal rate and removed quantity under different initial concentration |
在S-nZVI投加量一定的情况下, 当溶液中Cu(Ⅱ)、Zn(Ⅱ)初始浓度较低时(实验中初始浓度范围在20~90 mg·L-1), 溶液中的Cu(Ⅱ)、Zn(Ⅱ)的数量小于S-nZVI表面活性位点的数量, 能被S-nZVI完全去除, 使其去除率接近于100%(郭晶晶, 2014;祝爱侠, 2012);随着Cu(Ⅱ)、Zn(Ⅱ)浓度的增加, 溶液中Cu(Ⅱ)、Zn(Ⅱ)的数量增加, 而S-nZVI表面的活性位点数量一定, 必然会出现去除率下降的现象(Bezbaruah et al., 2011;何元渊等, 2014).当溶液中离子浓度增加至110 mg·L-1时, Cu(Ⅱ)的去除量略有降低而Zn(Ⅱ)的去除量持续上升, 这可能是由于溶液中重金属离子的初始浓度过高会抑制nZVI的活性(Wu et al., 2013), 进而抑制Cu(Ⅱ)的氧化还原反应.因此, 在实际水体处理过程中需考虑重金属离子的初始浓度.
3.5 反应动力学为评价S-nZVI去除Cu(Ⅱ)、Zn(Ⅱ)的控速步骤和吸附机理, 设定Cu(Ⅱ)、Zn(Ⅱ)的初始浓度为20 mg·L-1, S-nZVI投加量分别为0.030、0.050 g, 将间隔时间取样测定的实验数据采用准一级动力学模型和准二级动力学模型进行模拟, 时间间隔分别为2、5、8、10、20、30、40、50、60 min, 准一级和二级动力学模型分别如式(4)和(5)所示.
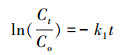
|
(4) |

|
(5) |
式中, t为吸附时间(min);Qt、Qe分别为在任意时间t和反应平衡时单位吸附量(mg·g-1);k1为准一级动力学速率常数(min-1);k2为准二级动力学速率常数(g·mg-1·min-1).对准二级动力学方程进行拟合, 可以计算出初始吸附速率h(式(6)).

|
(6) |
由图 7和表 3可知, 对S-nZVI去除Cu(Ⅱ)、Zn(Ⅱ)的过程用准一级动力学拟合得到的可决系数R2分别为0.8774和0.8912, 可见其去除过程不符合一级动力学反应, 即不是由物理扩散控制的.用准二级动力学模型拟合得到的R2均大于0.99, 且理论吸附量与实际吸附量较好的吻合, 这说明Cu(Ⅱ)、Zn(Ⅱ)在S-nZVI上的去除过程更符合准二级动力学模型, 为化学过程(Bezbaruah et al., 2011).此外, 根据式(6)计算可知, S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的初始吸附速率分别为925.93、152.43 mg·g-1·min-1, S-nZVI对Cu(Ⅱ)的吸附速度要快于对Zn(Ⅱ)的吸附速率.
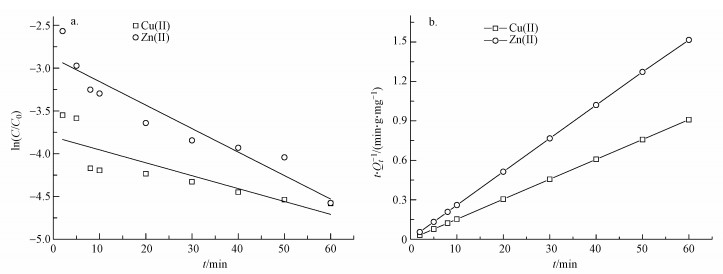 |
| 图 7 吸附过程的准一级动力学(a)和准二级动力学(b)模型拟合结果 Fig. 7 Pseudo-first-order(a) and pseudo-scend-order(b) plot for adsorption |
| 表 3 吸附过程的准一级动力学和准二级动力学拟合参数 Table 3 Parameters of pseudo-first-order and pseudo-scend-order for adsorption |
在25 ℃条件下, 将Cu(Ⅱ)、Zn(Ⅱ)的吸附量与相应的吸附平衡浓度做图, 得到吸附等温线.由图 8可知, 随着Cu(Ⅱ)、Zn(Ⅱ)平衡浓度的增大, 平衡吸附量逐渐增大, 最终会趋于饱和.
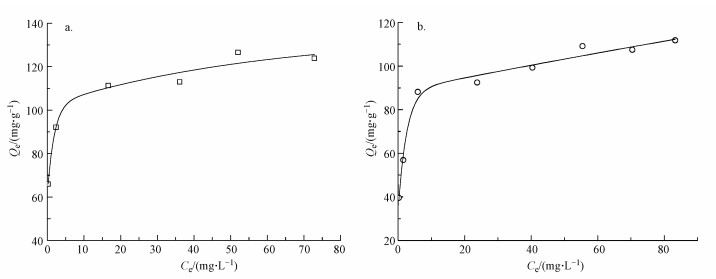 |
| 图 8 Cu(Ⅱ)(a)、Zn(Ⅱ)(b)在25 ℃下的吸附等温线 Fig. 8 The adsorption isotherms of Cu(Ⅱ)(a) and Zn(Ⅱ)(b) at 25 ℃ |
为了考察S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的吸附行为, 用Langmuir和Freundlich方程对实验数据进行拟合(图 9).Langmuir模型方程是指吸附剂表面是单分子层吸附, 其表面上的各个吸附点之间没有吸附质转移运动, 是均一的, 是与吸附量或覆盖率无关的理想模型, 当吸附剂表面为吸附质饱和时, 其吸附量达到最大值, 其模型方程式为:

|
(7) |
 |
| 图 9 Cu(Ⅱ)、Zn(Ⅱ)的Langmuir模型(a)和Freundlich模型(b)拟合结果 Fig. 9 Langmuir model(a) and Freundlich model (b) fitting of Cu(Ⅱ) and Zn(Ⅱ) |
Freundlich模型方程是假设一种多层吸附, 它是由于不均匀的吸附剂表面分布着不同能量的活性位点形成的, 其吸附热随吸附量成对数形式降低, 其模型方程为:

|
(8) |
式中, Ce和Qe分别为平衡时溶液中剩余的Cu(Ⅱ)、Zn(Ⅱ)浓度(mg·L-1)和平衡时吸附剂的单位吸附量(mg·g-1);Qm为吸附剂饱和吸附量(mg·g-1);KL为与吸附能力有关的常数(L·mg-1); KF和n则反映了吸附剂的吸附能力和吸附强度(郭晶晶, 2014).
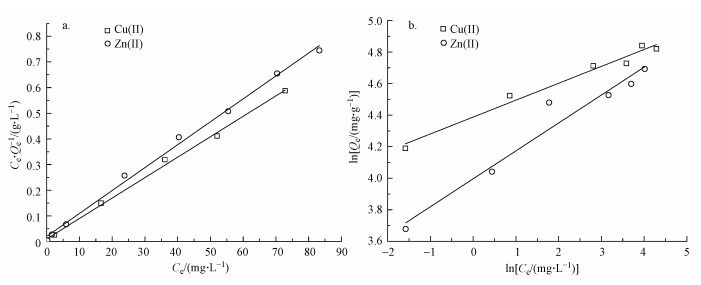
由图 9和表 4可知, S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的吸附过程更适合用Langmuir等温吸附模型描述, 其可决系数R2分别为0.9963和0.9958, 均大于0.99, 说明S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的吸附是均匀的单分子层吸附.通过计算可知, S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的最大吸附平衡量分别为125.63和111.98 mg·g-1, 与实验值较接近.采用Langmuir等温吸附模型定义的分离因子RL来评估吸附进行的难易程度(肖燕萍, 2017), RL方程如下所示:
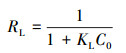
|
(9) |
| 表 4 吸附过程的Langmuir与Freundlich等温吸附模型参数 Table 4 Parameters of Langmuir and Freundlich isotherm models for adsorption |
式中, RL=0或RL>1时反应难以进行;RL=1时极易进行;0 < RL < 1时易于进行.由表 4可知, 0 < RL < 1, 表明S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的吸附反应易于进行.
3.7 S-nZVI 的磁性分离图 10a、10b分别为摇动S-nZVI和Zn(Ⅱ)的混合液产生的分散效果及在外加磁场的作用下S-nZVI的磁性分离效果.从图可以看到, S-nZVI在Zn(Ⅱ)溶液中有很好的分散效果, 且外加磁场可以完成S-nZVI与液相污染物的快速分离, 这说明S-nZVI具有良好的磁性, 可通过磁分离技术实现高效回收(李亚娟等, 2018).
 |
| 图 10 S-nZVI在Zn(Ⅱ)溶液中的分散(a)和磁性分离(b)效果 Fig. 10 Dispersion(a) and magnetic separation(b) effect of S-nZVI in Zn(Ⅱ) solution |
考虑到对S-nZVI的再次利用, 对反应后的S-nZVI进行再生处理:将使用后的S-nZVI采用磁铁包覆保鲜膜法将其取出, 置于盛有去离子水中的烧杯中搅拌冲洗3次, 用同样的方法取出并置于0.1 mol·L-1的盐酸中, 再将其放入含有0.05 mol的NaBH4溶液中进行还原, 用无水乙醇清洗3次, 再用无氧去离子水清洗3次后真空干燥待用(肖燕萍, 2017).由图 11a、11b可知, 在Cu(Ⅱ)、Zn(Ⅱ)浓度为20 mg·L-1时, 其对Cu(Ⅱ)的去除率随着再生次数的增加而逐渐降低, 且降低幅度越来越大, 至第5次再生时其去除率降低至80.25%;对Zn(Ⅱ)的去除率随着再生次数的增加逐渐降低, 但降低幅度较小, 至第5次再生时其去除率仅降低至96.84%.
 |
| 图 11 S-nZVI再生后对Cu(Ⅱ)(a)、Zn(Ⅱ)(b)的去除率(Cu(Ⅱ)、Zn(Ⅱ)投加量分别为0.030、0.050 g) Fig. 11 The removal rate of Cu(Ⅱ) (a) and Zn(Ⅱ) (b) after S-nZVI regeneration |
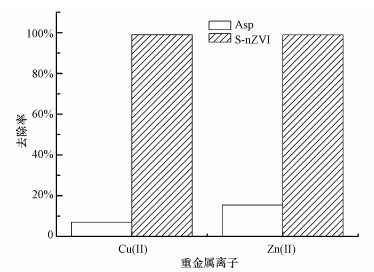
图 12为改性海泡石与S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的去除效果比较.在Cu(Ⅱ)、Zn(Ⅱ)浓度为20 mg·L-1时, 分别向Cu(Ⅱ)、Zn(Ⅱ)溶液中加入0.030、0.050 g的Asp和S-nZVI材料, 于60 min时取样测定.由图可知, Asp对Cu(Ⅱ)、Zn(Ⅱ)的去除率分别为6.96%、15.42%, S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的去除率分别为98.98%、98.97%, 表明S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的去除效果远好于Asp.
 |
| 图 12 Asp与S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)去除率的比较(Cu(Ⅱ)、Zn(Ⅱ)溶液中材料投加量分别为0.030、0.050 g) Fig. 12 Comparison of Cu(Ⅱ) and Zn(Ⅱ) removal rate by Asp and S-nZVI |
随着水体Cu、Zn污染的日益严重和新型功能材料开发的逐渐兴盛, 进行新型材料对Cu、Zn的去除研究具有重要意义.本研究选取的S-nZVI成功实现了从水体中去除Cu、Zn.通过调节pH、S-nZVI投加量、重金属离子溶液初始浓度等条件寻找去除Cu(Ⅱ)、Zn(Ⅱ)的最适条件及范围, 实验发现, S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)在60 min就可以快速去除, 且去除率随着pH的升高而升高, 这表明在实际应用中, S-nZVI可高效、快速地对实际水体中Cu(Ⅱ)、Zn(Ⅱ)进行去除, 且无需进行过多的pH调节即可达到较高的去除率水平, 并可满足一般排放标准要求的pH值限值为6~9.溶液初始浓度的降低有利于金属离子去除率的提高, 实验所配制的金属离子浓度较高仅是为明显看出去除效果, 实际水体中Cu(Ⅱ)、Zn(Ⅱ)的浓度远低于实验所配制的浓度, 因此, 水体中Cu(Ⅱ)的浓度将不会出现对S-nZVI活性的抑制现象.针对一定浓度的Cu(Ⅱ)、Zn(Ⅱ)溶液, S-nZVI投加量的增加有利其去除率的提高, 但存在最佳投加量, 当超过最佳投加量时, 对提高重金属去除效果的意义不大.
此外, 实验发现S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的最大吸附平衡容量分别为126.56、111.98 mg·g-1, 而其他关于吸附材料去除Cu(Ⅱ)、Zn(Ⅱ)的研究, 如徐应明等(2009)研究发现, 在36 h处理时间后天然海泡石和酸改性海泡石对Cu(Ⅱ)的饱和吸附量分别为22.10、24.36 mg·g-1;王昕等(2008)采用碳纳米管对Zn(Ⅱ)进行吸附研究发现, 即便60 min达到平衡, 其最大吸附量也仅为11.85 mg·g-1;祝爱侠(2012)采用超细电气石对Cu(Ⅱ)、Zn(Ⅱ)进行吸附去除, 发现在30 min时其吸附达到平衡, 但最大吸附量分别仅为11.43、8.57 mg·g-1.这些研究得到的最大吸附量都远低于本研究中得到的最大吸附量, 即相比于以上吸附材料, S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的去除效果较好, 在未来具有很好的应用前景.同时, 在实际应用中可以最大吸附量为基础对S-nZVI的投加量进行预估, 减少材料的不必要浪费.
在实际应用中, 需要考虑到S-nZVI的回收及重复利用.实验表明, 采用外加磁场的方式可以很好地对S-nZVI进行回收, 同时对材料进行一定的再生处理后可重复利用且重复利用率极高.因此, 综合以上因素, 对水体Cu(Ⅱ)、Zn(Ⅱ)的去除可以设计一个处理装置对其进行异位处理.此外, 实验整体也存在一些不足, 如实际水体中含有的物质较为复杂, 存在某些背景离子(腐殖酸等), 本研究未对其是否对S-nZVI去除重金属离子产生影响进行实验等.
5 结论(Conclusions)1) 本研究在液相还原法的基础上成功制备出S-nZVI, 且所制备的材料颗粒均匀.
2) pH、初始浓度、S-nZVI投加量等条件对Cu(Ⅱ)、Zn(Ⅱ)的去除效果有着明显的影响.60 min左右时, S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的去除达到平衡.Cu(Ⅱ)、Zn(Ⅱ)的去除率随着pH的升高而升高;溶液初始浓度的降低有利于金属离子去除率的提高, 但去除量在达到饱和前会随着初始浓度的升高而升高, 溶液浓度过高则会抑制S-nZVI对Cu(Ⅱ)的去除;S-nZVI投加量的增加有利于金属离子去除率的提高, 但对于一定浓度的重金属离子, 存在最佳投加量.
3) S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的去除过程采用准二级动力学模型的拟合效果较好, 说明是由化学反应控制的, S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的初始吸附速率分别为925.93、152.43 mg·g-1·min-1, S-nZVI对Cu(Ⅱ)的吸附速度要快于Zn(Ⅱ).
4) S-nZVI对Cu(Ⅱ)、Zn(Ⅱ)的吸附过程更符合Langmuir吸附等温模型, 说明是均匀的单分子层吸附, 吸附易于进行, 实验最大吸附平衡容量分别为123.90和109.13 mg·g-1, 与理论值较接近.
5) 采用外加磁场的方式可将S-nZVI回收, 材料再生处理后可重复利用次数不低于5次.
Bezbaruah A N, Shanbhogue S S, Simsek S, et al. 2011. Encapsulation of iron nanoparticles in alginate biopolymer for trichloroethylene remediation[J]. Journal of Nanoparticle Research, 13(12): 6673–6681.
DOI:10.1007/s11051-011-0574-x
|
陈健.2016.活性炭负载纳米零价铁去除矿山废水中Cu2+和Cr6+的研究[D].赣州: 江西理工大学
http://cdmd.cnki.com.cn/Article/CDMD-10407-1016244614.htm |
Fu R, Yang Y, Xu Z, et al. 2015. The removal of chromium(VI) and lead(Ⅱ) from groundwater using sepiolite-supported nanoscale zero-valent iron(S-NZVI)[J]. Chemosphere, 138: 726–734.
DOI:10.1016/j.chemosphere.2015.07.051
|
郭晶晶.2014.蒙脱石/零价铁纳米复合材料修复水体重金属污染效率及机理研究[D].呼和浩特: 内蒙古大学
http://cdmd.cnki.com.cn/Article/CDMD-10126-1014269447.htm |
韩占涛, 吕晓立, 张威, 等. 2013. 纳米零价铁地下水修复技术的最新研究进展[J]. 水文地质工程地质, 2013, 40(1): 41–47.
|
何桂春, 陈健, 丁军, 等. 2016. 活性炭负载纳米零价铁去除矿山废水中的Cu2+[J]. 有色金属科学与工程, 2016, 7(5): 119–124.
|
何元渊, 祁彩菊, 仲万军, 等. 2014. 核桃壳负载纳米零价铁吸附废水中Pb2+[J]. 精细化工, 2014, 31(4): 480–485.
|
季莹.2013.纳米零价铁: 固体溶液界面电化学特性和表面模型[D].上海: 同济大学
|
李琛, 于俊洋. 2013. 海泡石改性及其在含铬废水处理中的应用[J]. 杭州化工, 2013, 43(3): 4–7.
DOI:10.3969/j.issn.1007-2217.2013.03.002 |
Li S, Wang W, Liang F, et al. 2017. Heavy metal removal using nanoscale zero-valent iron (nZVI):theory and application[J]. Journal of Hazardous Materials, 322: 163–171.
DOI:10.1016/j.jhazmat.2016.01.032
|
李亚娟, 赵传起, 洪沛东, 等. 2018. 磁性还原石墨烯的制备及其对抗生素的吸附性能[J]. 环境工程学报, 2018, 12(1): 15–24.
|
李钰婷, 张亚雷, 代朝猛, 等. 2012. 纳米零价铁颗粒去除水中重金属的研究进展[J]. 环境化学, 2012, 31(9): 1349–1354.
|
廖润华, 夏光华, 成岳, 等. 2006. 改性海泡石的制备及其吸附性能试验研究[J]. 中国陶瓷工业, 2006, 13(4): 17–21.
DOI:10.3969/j.issn.1006-2874.2006.04.005 |
刘玉茹, 费学宁, 郝亚超, 等. 2013. 海泡石负载型纳米铁的制备及其对六氯丁二烯的降解特性[J]. 环境化学, 2013, 32(11): 2156–2161.
DOI:10.7524/j.issn.0254-6108.2013.11.020 |
Matheson L J, Tratnyek P G. 1994. Reductive dehalogenation of chlorinated methanes by iron metal[J]. Environmental Science & Technology, 28(12): 2045–2053.
|
母娜.2015.海泡石负载型纳米零价铁去除水和土壤中的多溴联苯醚[D].上海: 上海应用技术学院
http://cdmd.cnki.com.cn/Article/CDMD-10259-1015725764.htm |
孙国帅.2015.碳热法负载纳米零价铁对Cr(Ⅵ)和Cd(Ⅱ)的去除研究[D].哈尔滨: 哈尔滨工业大学
http://cdmd.cnki.com.cn/Article/CDMD-10213-1016773907.htm |
王昕, 张春丽, 任广军, 等. 2008. 碳纳米管吸附去除水溶液中锌离子的性能[J]. 电镀与精饰, 2008, 30(10): 4–6.
DOI:10.3969/j.issn.1001-3849.2008.10.002 |
Wu L, Liao L, Lv G, et al. 2013. Micro-electrolysis of Cr(Ⅵ) in the nanoscale zero-valent iron loaded activated carbon[J]. Journal of Hazardous Materials, 254/255(12): 277–283.
|
Xiao J, Gao B, Yue Q, et al. 2015. Characterization of nanoscale zero-valent iron supported on granular activated carbon and its application in removal of acrylonitrile from aqueous solution[J]. Journal of the Taiwan Institute of Chemical Engineers, 55: 152–158.
DOI:10.1016/j.jtice.2015.04.010
|
肖燕萍, 宋新山, 赵志淼, 等. 2017. 海藻酸钠/蒙脱石联合负载型纳米Fe0对Cu(Ⅱ)的去除研究[J]. 环境科学学报, 2017, 37(1): 227–233.
|
肖燕萍., 2017.不同负载型纳米零价铁对水中Cu(Ⅱ)和Cr(Ⅵ)的去除研究[D].上海: 东华大学
http://cdmd.cnki.com.cn/Article/CDMD-10255-1017805413.htm |
修瑞瑞, 何世颖, 宋海亮, 等. 2018. 改性硅藻土/纳米零价铁复合材料去除水中Cu2+的研究[J]. 环境污染与防治, 2018, 40(4): 414–417.
|
徐应明, 梁学峰, 孙国红, 等. 2009. 海泡石表面化学特性及其对重金属Pb2+、Cd2+、Cu2+吸附机理研究[J]. 农业环境科学学报, 2009, 28(10): 2057–2063.
DOI:10.3321/j.issn:1672-2043.2009.10.010 |
殷齐贺. 2017. 膨润土负载纳米零价铁去除废水中Cd(Ⅱ)的研究[J]. 福建质量管理, 2017(13): 151–152.
DOI:10.3969/j.issn.1673-9604.2017.13.127 |
张鑫. 2010. 纳米零价铁去除水中重金属离子的研究进展[J]. 化学研究, 2010, 21(3): 97–100.
DOI:10.3969/j.issn.1008-1011.2010.03.025 |
张亚南, 骆碧君, 武海虹, 等. 2015. 重金属去除方法的研究进展[J]. 盐业与化工, 2015, 44(10): 1–6.
|
祝爱侠.2012.超细电气石产品制备及对养殖水质改良效果和机理的研究[D].无锡: 江南大学
http://cdmd.cnki.com.cn/Article/CDMD-10295-1013129781.htm |
 2019, Vol. 39
2019, Vol. 39


