2. 河北工程大学能源与环境学院, 邯郸 056038;
3. 河北建材职业技术学院建筑工程系, 秦皇岛 066000;
4. 河北省水污染控制与水生态修复工程技术研究中心, 邯郸 056038
2. College of Energy and Environmental Engineering, Hebei University of Engineering, Handan 056038;
3. Department of Architecture and Civil Engineering, Hebei Construction Material Vocational and Technical College, Qinhuangdao 066000;
4. Hebei Engineering Research Center for Water Pollution Control and Water Ecological Remediation, Handan 056038
原位覆盖技术由于操作简单、修复效果显著, 已在水环境保护中被广泛应用.原位覆盖技术的关键是覆盖材料的选择, 目前市场上可选择的覆盖材料很多, 其中, 沸石由于具有稳定的理化性质和良好的水力传导, 且价格相对低廉, 因此, 多被用作底泥覆盖材料(Cristian Barca et al., 2012).为了提高天然沸石对水体的修复效果和经济性, 通常会将天然沸石先进行改性处理, 再均匀覆盖在底泥表面, 从而隔离底泥与上覆水的物质交换, 达到水体修复的目的.
在河流水生环境中, 微生物是营养物质循环的重要动力系统, 也是处理污染物的主要功能单元, 而河道底泥是微生物的主要存在场所, 是河流环境中微生物多样性的呈现和表达的最主要方式(雷旭等, 2015).原位覆盖属于规模较大的工程项目, 在施工过程中往往需要大型机械设备, 施工人员也较多, 因而会对水体自身的生态系统稳定性造成较大程度的干扰;并且改性沸石投放后成为河流系统的组成部分, 将直接影响到水体物质循环的环节和过程.因此, 改性沸石覆盖也是河流生态系统的重建过程.
通过检测和分析改性沸石覆盖前后底泥微生物群落结构的变化情况, 能够从侧面有效地了解人工扰动行为对河流生态系统的影响, 从而为修复后河流生态系统的重建提供理论依据和技术支持(王绍祥等, 2014).同时也便于分析修复后河流生态系统的重建过程, 为“一河一策、科学治河”平台的构建提供保障.为了解和分析改性沸石覆盖前期对河流底泥微生物群落结构的影响, 本研究通过静态模拟试验模拟改性沸石覆盖的修复过程, 并通过Illumina平台对常用的3种改性沸石(高温、HCl、NaCl改性)覆盖前后的河流底泥进行高通量测序分析.
2 采样与分析(Samples and analysis)现代·滏阳原著湿地公园隶属滏阳河邯郸市邯山区东部马庄乡河段, 位于秀水路以北、南环路以南.调查取样河段长约2 km, 西北的取水泵站, 供邯钢和绿化洒水车用水;西侧紧邻北街村, 沿河有一定数量的农田, 以蔬菜和玉米种植为主, 临村河岸有多个排水沟;河段北部临南环路, 桥下两侧边坡各有2个雨水管口, 水草丛生;河道中段设有拦污格栅, 有环卫人员定期清理, 不存在滞留现象.
采样时间为2017年10月, 共布设5个采样点(如图 1所示), 坐标分别为:点A(36°34′03.5″N, 114°28′59.2″E)、点B(36°34′02.8″N, 114°28′55.2″E)、点C(36°33′58.6″N, 114°28′56.2″E)、点D(36°34′55.4″N, 114°28′51.8″E)及点E(36°33′54.1″N, 114°28′51.7″E).取样点尽量选取一般位置, 避开雨水口、拦污格栅等扰动较大的位置, 取样点距离河岸1.5 m以上, 以保证选取位的一般性.采用自制的长1.0 m、直径60 mm的柱状采样器, 将表层连续泥样(0~5 cm)垂直一次性取出;为保证表层与沸石接触的底泥性质的均匀性, 在同一点取样4次, 共取20个泥样, 混合均匀后等量加入4根沉积柱中并编号;静置沉淀待其稳定后取其中3根分别加入10 g以400 ℃高温改性、1 mol · L-1 HCl溶液改性和1 mol · L-1 NaCl溶液改性的3种沸石, 使其均匀覆盖于泥样表面, 静置.由于沸石投加后吸附饱和时间约为7 d(Chen et al., 2011), 因此, 1周后取表层底泥, 挑出沸石, 置于离心管中, 底泥原样、高温改性沸石覆盖底泥、HCl改性沸石覆盖底泥及NaCl改性沸石覆盖底泥样品编号分别为OS-1、HT-2、HCl-3、NaCl-4, 准备进行微生物群落多样性分析.
 |
| 图 1 取样点位置示意图 Fig. 1 Locations of sampling points |
由于样品属于随机取样, 具有一般性和代表性, 而底泥微生物群落在不同位置的结构差异较大, 因此, 平行样品并不能体现试验的准确性(Miethling et al., 2011).将多个采样点的20个底泥样品混合进行测序更能体现目标河段底泥微生物的群落结构, 且可以提高分析效率, 降低试验成本.虽然混合后的底泥样品基质较为均匀, 可用于设置不同处理组的生物学重复样品, 但考虑到底泥微生物群落结构分布的特殊性, 本次试验并未设置平行样品, 具有一定的局限性.目前尚未见有关该问题的详细探讨, 对于河流底泥微生物群落的研究方法还需进一步发展、优化.
高通量测序流程一般包括6个部分:环境样品的DNA抽提、引物接头的设计合成、PCR扩增和产物纯化、PCR产物定量和均一化、PE文库的构建及Illumina测序.
2.1 DNA基因组的抽提 2.1.1 DNA的纯度和浓度采用Nano Drop2000型分子紫外分光光度仪测量4个底泥环境样品在230、260和280 nm处的吸光值, 检测环境样品的DNA纯度和浓度, 结果见表 1.从表 1可以看出, 4个环境样品的核酸与蛋白质的吸光度比值(OD260/280)均在1.6~2.0之间, 表明DNA纯度较高, 含有的RNA杂质较少, 可以用作后续PCR扩增试验;OD260/230数值较低, 说明目标河流底泥中存在有机污染物.
| 表 1 环境样品的DNA浓度和纯度 Table 1 Concentration and purity of DNA in environmental samples |
底泥样品总DNA提取后, 进行琼脂糖凝胶电泳试验检测DNA的完整性, 琼脂糖凝胶浓度为1%, 电场强度为5 V · cm-1, 电泳时间20 min, 电泳检测结果见图 2.从琼脂糖凝胶电泳图谱可以看出, DNA色带颜色较深, 表明提取的DNA含量较高;杂带较少, 表明DNA纯度较高, 含有的RNA杂质较少;通过比较1 kb Ladder条带可知, 4个DNA样本片段在6000~8000 bp之间.
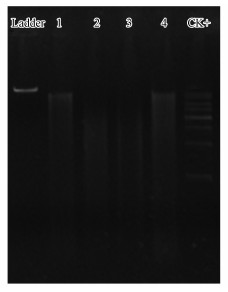 |
| 图 2 琼脂糖凝胶电泳图谱 (CK+为阳性对照) Fig. 2 Electrophoresis pattern of extracts of sediment DNA |
本次试验选定V3、V4区进行细菌的16S rRNA测序, 相关参数见 表 2.
| 表 2 PCR扩增引物及tag序列 Table 2 PCR amplification primers and tag sequences |
为了保证后续数据分析的准确性及可靠性, 需要满足两个条件:①尽可能使用低循环数扩增;②保证每个样品扩增的循环数统一.为此, 首先随机选取样品进行预实验, 确保在最低的循环数中绝大多数的样品能够扩增出浓度合适的产物.本次测试采用ABI GeneAmp®9700型PCR仪进行检测, 设定参数为:95 ℃预变性3 min;95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 30个循环;72 ℃延伸10 min.
2.2.3 PCR扩增结果通过2%琼脂糖凝胶电泳试验检测3 μL上样的PCR产物, 结果见图 3.对比DL2000条带分布可知, PCR扩增产物包含约750 bp的DNA片段, 可由此判断PCR产物目的条带大小正确、浓度合适, 可进行后续实验.
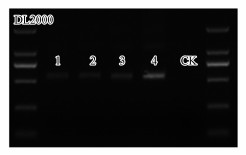 |
| 图 3 PCR扩增产物检测电泳图 Fig. 3 Electrophoretic diagram of PCR products |
本次环境样品的PCR产物检测采用Promega公司生产的QuantiFluorTM-ST蓝色荧光定量系统, 检测结束后将定量结果按要求比例混合, 待Miseq测序.
2.4 Miseq文库构建采用TruSeqTMDNA Sample Prep Kit试剂提取底泥DNA片段后, 将DNA片段的Y字形接头利用磁珠筛选去除其中的自连接片段, 筛选后将PCR进行复制扩增, 富集Miseq的文库模板, 完成后, 为得到DNA的单链片段, 加入NaOH使其进行变性反应, 从而完成Miseq文库构建工作.
2.5 Miseq测序Miseq平台对于DNA不能以单链片段的形式进行测序, 首先需要一个载体芯片, 本次底泥样品测序检测通过将5′-ACTCCTACGGGAGGCAGCAG-3′及5′-GGACTACHVGGGTWTCTAAT-3′引物与剪切下来的底泥样品DNA单链片段的两端进行碱基对互补, 从而达到固定DNA片段的目的, 形成bridge;固定完成后为产生DNA簇而进行PCR扩增试验;但DNA簇的形式不能进行测序, 需要在扩增完毕后再将DNA扩增子通过线性化处理从而形成单链结构, 进入碱基合成阶段;通过加入dNTP荧光标记和DNA的改造聚合酶的单次循环完成碱基合成过程;反应面版采用激光扫描的方式读取模板序列上的聚合核苷酸类别, 每次循环只扫描第一次聚合过程;为了核苷酸聚合反应的再次发生, 需要将终止和荧光基团进行止化学切割处理, 恢复引物中-3′端的接头作用;最后通过每次循环的荧光标记信号的识别收集, 从而统计和获取模板DNA片段序列(Ligi et al., 2014).
本次MiSeq Illumina测序共获得294660条16S rRNA序列, 平均读长440 bp;按照97%相似性对非重复序列(不含单序列)进行OTU(Operational Taxonomic Units)聚类, 在聚类过程中去除嵌合体, 本次测序共得到1756个OTU的代表序列.样本信息统计详见表 3.
| 表 3 样本信息统计表 Table 3 Sample information statistics |
OTU是在系统发生学或群体遗传学研究中, 为了便于进行分析, 人为给某一个分类单元(品系、属、种、分组等)设置的统一标志(朱德锐等, 2012).通过聚类操作, 将序列按照彼此的相似性分归为许多小组, 一个小组就是一个OTU.可根据不同的相似度水平, 对所有序列进行OTU划分, 通常对在97%的相似水平下的OTU进行生物信息统计分析(Ralph Medinger et al., 2010).通过构建Rank-Abundance曲线(图 4), 对不同改性沸石覆盖的底泥微生物多样性进行定性分析.图 4中由下至上分别为NaCl-4、OS-1、HCl-3、HT-2, 由图可知, 底泥原样的曲线形状比较平滑, 表示目标河段中的物种分布较为均匀, 并且3种改性沸石覆盖后的曲线形状并未有明显变化, 因此可以判断改性沸石覆盖对底泥微生物物种的分布情况影响较小.
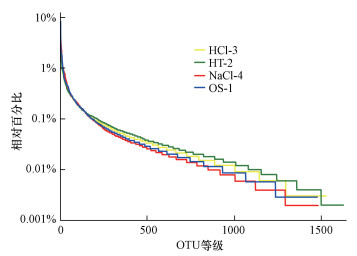 |
| 图 4 不同改性沸石覆盖的底泥微生物秩丰度曲线图 Fig. 4 Rank-abundance curves of microbes covered with different modified zeolites |
为能够直观地了解和表现环境样本中的物种(OTU)数目组成相似性及重叠情况, 本次分析选用相似水平为97%的OUT, 对3种改性沸石覆盖底泥和底泥原样进行交集Venn图分析(图 5).由图 5可知, 4个样本的重叠部分较多, 表示样本中共有物种较多, 可以判断3种改性沸石覆盖对底泥微生物多样性影响较小.
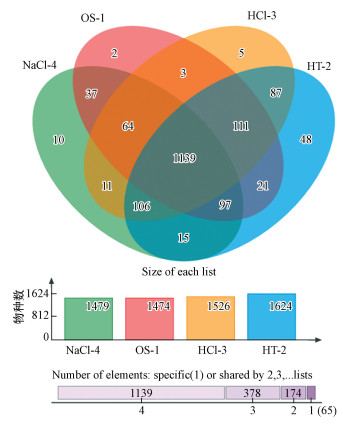 |
| 图 5 不同改性沸石覆盖的底泥微生物OTU水平的韦恩图 Fig. 5 Venn diagram of OTU of microbes covered with different modified zeolites |
为研究3种改性沸石对底泥微生物群落的影响, 通过单样本的多样性(Alpha多样性)对底泥微生物群落的丰度和多样性进行OTU水平上的定量分析, 其中, 多样性指数详见表 4.由表 4可知, 本次测序中的4个样品覆盖率(Coverage)均高于0.99, 表明本次试验能够真实地反映底泥样品的微生物群落特征(杨浩等, 2017);其中, 高温和盐酸改性沸石覆盖底泥样品的Shannon指数均高于底泥原样, 表明这两种改性沸石覆盖后, 底泥微生物多样性有所增加, 而氯化钠改性沸石覆盖底泥的Shannon指数低于原底泥, 但差别较小, 由此判断氯化钠改性沸石覆盖对底泥微生物多样性无明显影响.根据群落丰富度指数(Ace、Chao和Sobs)可以看出, 与多样性类似, 高温和盐酸改性沸石对底泥微生物丰富度的提高有促进作用, 而氯化钠改性沸石对其影响不大.
| 表 4 不同改性沸石覆盖的底泥微生物多样性指数 Table 4 Diversity index of microbes covered with different modified zeolites |
根据分类学分析结果, 可得不同样本在各分类水平(域、界、门、纲、目、科、属、种、OTU等)上的群落结构组成情况.本实验进行了系统分类学分析和数据库对比, 统计了样品细菌门类序列数及占总细菌序列的比例, 分析了改性沸石覆盖前后底泥中的优势细菌群落及特征分布, 图 6为3种改性沸石覆盖后和底泥原样中的细菌在Phylum水平上的组成情况.如图 6所示, 在合并小于0.01%的细菌门类序列中, 共检测到47个菌门, 基本可以全面反映底泥微生物组成情况.从图 6可以看出, 现代·滏阳原著湿地公园河流底泥中最主要的优势菌种为变形菌门(Proteobacteria), 占比约为36.68%, 其余优势菌门(大于1%)分别为:拟杆菌门(Bacteroridetes)、绿弯菌门(Chloroflexi)、蓝藻门细菌(Cyanobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、酸杆菌门(Acidobacteria)和硝化螺旋菌门(Nitrospirae).在脱氮除磷系统中, 变形菌门发挥着重要作用, 能够降解多种有机污染物, 因此可知, 底泥对于水体的自净能力具有重要意义, 其中, 厚壁菌门(Firmicutes)通常伴随着含有微量重金属的废水污染出现(武福平等, 2014), 根据目标河段底泥污染物的分布规律, 可以推测该河段可能曾受到重金属污染, 并且在深层底泥中重金属污染的风险更高.
 |
| 图 6 底泥微生物在门水平的群落分布 Fig. 6 Microbial community distribution in sediment at the phylum |
由图 6还可知, 盐酸和氯化钠改性沸石覆盖后, 底泥中的变形菌门(Proteobacteria)占比增加, 其中, 氯化钠改性沸石覆盖底泥中拟杆菌门(Bacteroridetes)的比例增加至16.63%.而高温改性沸石覆盖后底泥中的绿弯菌门(Chloroflexi)有所增加, 增占比例约13.64%, 变形菌门(Proteobacteria)占比(34.09%)与底泥原样基本相同, 而拟杆菌门(Bacteroridetes)占比减少到6.74%.拟杆菌门(Bacteroridetes)主要存在于厌氧或缺氧环境中, 在生物脱氮过程中发挥有重要作用, 并且能够代谢多种有机碳水化合物, 可将复杂的有机物如蛋白质水解为氨基酸和有机酸, 并可将纤维素、淀粉等水解为糖和酸, 脂类水解为低级的脂肪酸等(孙启明等, 2011).因此判断高温改性沸石不利于在长时间覆盖后水体自身对污染物的生物降解.
通过构建在基因水平上的Heatmap图(图 7), 将样本间丰度的相似性进行聚类分析, 结果发现, 底泥细菌群落结构在不同改性沸石覆盖的影响下存在着差异特征.由图 7可知, 微生物群落聚类为两个组, 其中, NaCl改性沸石覆盖的底泥与底泥原样基因表达的相似程度较高, 表明NaCl改性沸石覆盖处理基本不会对河流底泥微生物丰度产生影响, 而HCl改性和高温改性沸石覆盖对河流底泥微生物丰度产生的影响相类似.
 |
| 图 7 底泥微生物16S rRNA群落聚类图 Fig. 7 16S rRNA gene community clustering of sediment |
通过对3种改性沸石覆盖处理的河流底泥和底泥原样本进行Beta多样性分析, 可以简单、直观地评估不同样本微生物群落间OTU组成的差异.本次试验在基因水平上进行基于Bray-curbs距离的主坐标分析(Principal Co-ordinates Analysis), 结果如图 8所示.由图可知, 前两个主成分的贡献率分别为15.66%和70.97%, 说明本次分析所得到的样品的位置关系能够较好地反映底泥群落的结构差异.
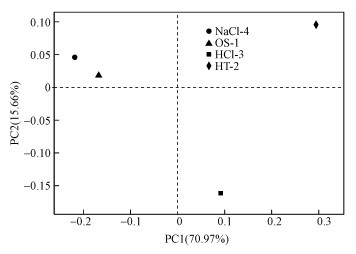 |
| 图 8 基于Bray-curbs距离的主坐标分析 Fig. 8 Bray-curbs distance based principal co-ordination analysis |
为了进一步探究不同改性沸石覆盖底泥的细菌群落结构差异性, 对数据进行深度挖掘, 根据得到的群落丰度数据, 运用Fisher精确检验方法对4个样本在门水平上的丰度差异物种进行假设性检验, 评估观察到的差异的显著性.本次试验将3种改性沸石覆盖的底泥样本分别与底泥原样进行比较, 结构如图 9所示.由图可知, 不同改性沸石覆盖对底泥微生物产生的影响不同, 由图 9a可知, 高温改性沸石覆盖前后绿弯菌门(Chloroflexi)的丰度差异较大, 而对拟变形菌门(Proteobacteria)的影响较小;而在图 9b、9c中显示, HCl改性和NaCl改性沸石覆盖的底泥中, 变形菌门(Proteobacteria)所占比例均有不同程度的增加, 而对绿弯菌门(Chloroflexi)的影响较小;3种改性沸石覆盖后的底泥中蓝藻门细菌(Cyanobacteria)均出现不同程度下降, 其中, NaCl改性沸石覆盖底泥与其他两种改性沸石相比对其影响较小, 蓝藻细菌是自然界固氮的主要参与者, 对氮素平衡起到重要作用.由图 9还可知, 高温和HCl改性沸石覆盖后, 底泥中的蓝藻门细菌(Cyanobacteria)占比减少较多, 表明这两种改性沸石相比NaCl改性沸石, 更有利于提高河流底泥对氮素污染物的降解能力, 降低底泥富营养化的风险.
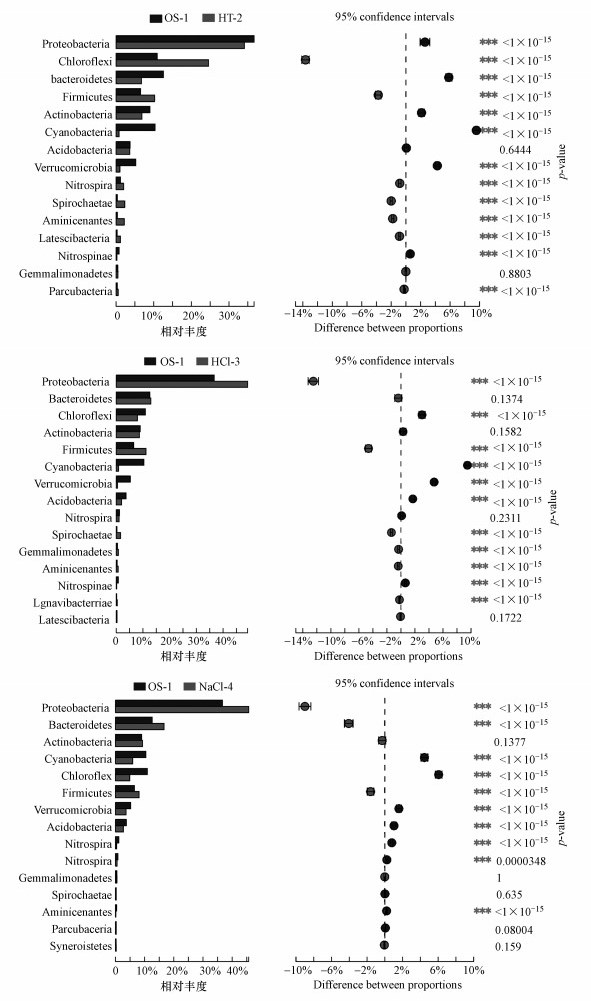 |
| 图 9 不同改性沸石覆盖底泥与原底泥微生物在门水平上的丰度差异检验对比 (a.高温改性, b.HCl改性, c.NaCl改性) Fig. 9 Comparison of phylum difference between sediment and original sediment in different modified zeolite (a.high temperature modified, b.HCl modification, c.NaCl modification) |
1) 在现代·滏阳原著湿地公园的河流中存在有机污染和重金属污染的可能性较大, 并且在深层底泥中污染风险更高;底泥中细菌物种分布均匀, 最主要的优势菌种为变形菌门(Proteobacteria), 占比约为36.68%, 其余优势菌门包括:拟杆菌门(Bacteroridetes)、绿弯菌门(Chloroflexi)、蓝藻门细菌(Cyanobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、酸杆菌门(Acidobacteria)和硝化螺旋菌门(Nitrospirae)等.
2) 不同改性沸石覆盖对底泥微生物群落均存在不同程度的影响, 其中, 高温和HCl改性沸石覆盖后底泥微生物多样性有所增加, NaCl改性沸石覆盖处理基本不会对河流底泥微生物产生影响.因此, 改性沸石覆盖虽然会对底泥微生物群落产生不同程度的影响, 但都不会对水体本身造成较强的扰动, 基本不会对原河流生态系统稳定性造成的破坏.
Chen G C, Yang Q, Zhao Y H. 2011. Renewability of wind power in China:A case study of nonrenewable energy cost and greenhouse gas emission by a plant in Guangxi[J]. Renewable and Sustainable Energy Reviews, 15(5): 2322–2329.
DOI:10.1016/j.rser.2011.02.007
|
Barca C, Gérente C, Meyer D, et al. 2012. Phosphate removal from synthetic and real wastewater using steel slags produced in Europe[J]. Water Research, 46(7): 2376–2384.
DOI:10.1016/j.watres.2012.02.012
|
雷旭, 李冰, 李晓, 等. 2015. 复合垂直流人工湿地系统中不同植物根际微生物群落结构[J]. 生态学杂志, 2015, 34(5): 1373–1381.
|
Ligi T, Oopkaup K, Truu M, et al. 2014. Characterization of bacterial communities in soil and sediment of a created riverine wetland complex using high-throughput 16S rRNA amplicon sequencing[J]. Ecological Engineering, 72: 56–66.
DOI:10.1016/j.ecoleng.2013.09.007
|
Miethling R, Wieland G, Backhaus H, et al. 2000. Variation of microbial rhizosphere communities in response to crop species, soil origin, and inoculation with Sinorhizobium meliloti, L33[J]. Microbial Ecology, 40(1): 43–56.
|
Medinger R, Nolte V, Pandey R V, et al. 2010. Diversity in a hidden world:potential and limitation of next-generation sequencing for surveys of molecular diversity of eukaryotic microorganisms[J]. Molecular Ecology, 19(s1): 32–40.
|
孙启明, 郑仁淑, 李援, 等. 2011. 东北地区某流域河流污染指示菌调查[J]. 环境与健康杂志, 2011, 28(5): 409–411.
|
王绍祥, 杨洲祥, 孙真, 等. 2014. 高通量测序技术在水环境微生物群落多样性中的应用[J]. 化学通报, 2014, 77(3): 196–203.
|
武福平, 夏传, 王艳琴, 等. 2014. 西北典型村镇集雨窖水水质变化及特性[J]. 环境工程学报, 2014, 8(9): 3541–3545.
|
杨浩, 张国珍, 杨晓妮, 等. 2017. 典型集雨人饮地区窖水微生物群落多样性及差异解析[J]. 环境科学, 2017, 38(11): 4733–4746.
|
朱德锐, 刘建, 韩睿, 等. 2012. 青海湖嗜盐微生物系统发育与种群多样性[J]. 生物多样性, 2012, 20(4): 495–504.
|
 2019, Vol. 39
2019, Vol. 39


