2. 代尔夫特理工大学生物技术系, 荷兰代尔伏特 2629 HZ
2. Department of Biotechnology, Delft University of Technology, 2629 HZ Delft, the Netherlands
磷(P)广泛存在于动、植物组织之中, 也是人体含量较多的元素之一, 约占人体重量的1%.磷和钙一样, 是组成人体骨骼和牙齿的重要成分, 骨骼中钙磷比例为2:1.磷还是软组织的重要组成部分, 人体所有细胞中都含磷;磷是DNA和RNA的组成成分, 是传递遗传信息和控制机体细胞正常代谢的重要物质, 同时参与体内能量代谢、氨基酸代谢及蛋白质和磷脂的形成;磷在血液中以酸式磷酸盐和碱式磷酸盐形式存在, 通过从尿中排出适当的酸碱物质和适当量的磷酸盐来调节体内的酸碱平衡.
可见, 磷是人类赖以生存不可缺或的营养物之一, 主要贮存在地壳之中(磷矿), 是一种难以再生的非金属矿产资源(Dijk et al., 2016).磷在地球上以“陆地→海洋”直线形式流动(郝晓地等, 2011), 从磷矿开采后主要(>80%)用于磷肥生产;大部分(通常>50%)未被作物吸收的磷因雨水冲刷会形成地表径流, 食物中未被人和动物吸收的磷则随排泄物进入地表水体(无污水处理情况下);磷最后随“条条江河通大海”的自然规律进入海洋.除海鸟在陆地排泄粪便以及人类海洋捕捞海产品外, 流入海洋中的磷在人类可目击到的地质演变期内很难再回归陆地.因此, 磷和煤、石油等一样都属于不可再生的宝贵自然资源.
磷矿藏在地球上分布极不均匀、储量十分有限.虽然地球磷矿基础储量为680×108 t (以P2O5计), 但经济储量仅有1/3, 约220×108 t(Jasinski, 2017).随着人口增长以及人类生活水平不断提高, 社会对磷的需求越来越高.国家统计局数据显示, 2015年我国磷肥产量已达970×104 t·a-1(P2O5)(国家统计局, 2015), 且每年增加量为50×104 t·a-1.以此增长速度, 我国到2030年时对磷肥使用量将会超过2000×104 t·a-1.再加上磷矿石无限制的出口, 我国未来磷资源消耗量十分惊人.2015年统计数字表明, 我国磷矿基础储量为31×108 t(P2O5)a.尽管新近(2017年7月)在贵州开阳又发现了超大优质(唯一不经选矿即可直接用于生产高浓度磷复合肥)磷矿2.7×108 t(P2O5)a, 但我国高品位磷矿储量总体上很低, P2O5含量≥30%的富磷矿资源储量只有16.6×108 t(P2O5), 仅为基础储量的一半.若按照目前“采富弃贫”的开采模式进行开采磷矿, 20年后, 我国磷矿石储量将开采殆尽a, “磷危机”现象随之而来.
因此, 我国急需考虑并实施磷回收战略.纵观磷流失、排放的整个路径, 对磷进行有效截流/回收的最佳节点主要集中在磷排放的源头和末端.源头磷回收有粪尿返田及源分离技术(郝晓地, 2006; 郝晓地等, 2016);末端磷回收指的是从污水处理过程中回收磷(全球每年约有1.3 Mt·a-1(以P计)经污水处理厂处理)(Wilfert et al., 2015), 以集中式为主流的现代污水处理技术可以实现在污水处理的同时对磷的截留、分离与回收.在实施磷回收工程方面虽然技术显得重要, 但国家宏观政策和经济补贴措施等亦不可小觑(郝晓地等, 2017).
有关磷回收产物研究与应用, 目前国际上趋之若鹜的是鸟粪石(MAP, MgNH4PO4·6H2O)及其它磷酸盐化合物(郝晓地等, 2011).然而, 纯鸟粪石回收需要苛刻的反应条件、且难以直接施用, 为此而受到学界实验质疑(Hao et al., 2013).最新研究发现, 出现在深水湖泊底部和海洋沉积物中的蓝铁矿(Vivianite, Fe3(PO4)2·8H2O)是一种非常稳定的磷铁化合物(Ksp = 10-36), 单位质量P的经济价值不菲.蓝铁矿除了能作为磷肥生产原料以外, 亦可以作为锂电池合成原料(杨艳飞, 2012);大颗粒高纯度蓝铁矿晶体本身还具有较高的收藏价值.
污水中除了含有较多的磷, 也因地质或水处理(使用铁混凝剂)原因而常常含有较多的铁(Wilfert et al., 2015).这就使人联想到, 在污水、污泥处理过程中是否可以形成蓝铁矿物质?已有研究发现, 在剩余污泥中确实发现了蓝铁矿物质的存在(Wilfert et al., 2015).这就为磷回收又打开一扇吸引眼球的窗户.因此, 有必要在研究发现的基础上对蓝铁矿的物理化学性质、生成环境、以及影响因素进行归纳, 以推动这一磷回收新目标产物的基础应用研究.
2 化学性质、经济价值与回收潜力(Chemical properties, economic value and recovered potential) 2.1 物化结构与性质蓝铁矿是一种磷矿石, 化学分子式为Fe3(PO4)2·8H2O, P2O5折标含量为28.3%, FeO为45%.蓝铁矿首先被英国矿物学家Vivian(1785—1855)发现, 并被命名为Vivianite(Rothe et al., 2016).蓝铁矿一般生成于少硫、富磷、富铁的还原性水环境中, 经常出现于湖泊、海洋、河流及沼泽等水体底部沉积物之中(Rothe et al., 2016).蓝铁矿属于单斜晶体, 具有一定的顺磁性, 奈耳温度(Néel temperature, 反磁性材料转变为顺磁性材料所需要达到的温度)是12 K(Frederichs et al., 2003; 钟旭群等, 2011), 空间群在C2/m, 莫氏硬度处于1.5~2之间, 密度为2.67~2.69 g·cm-3;蓝铁矿晶体的晶胞参数为:a=10.086 Å、b=13.441 Å、c =4.703 Å;α=γ = 90°、β=104.27°、Z = 2(秦善, 2011).蓝铁矿晶体结构中Fe(Ⅱ)呈六配位模式, 构成两类八面体(Catherine et al., 1982), 分别是单配位八面(FeO2(H2O)4)和双配位八面体(Fe2O6(H2O)4);[PO4]四面体将两种八面体链接成平行“0I0”层状结构, 层与层之间则由水分子连接, 如图 1a所示.
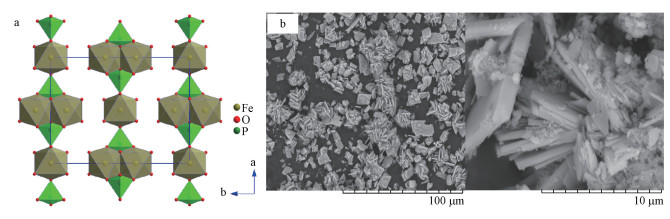 |
| 图 1 蓝铁矿晶体结构示意图(a)(秦善, 2011)及SEM成像(b) Fig. 1 Structure of vivianite crystal (a) and SEM image of vivianite crystal (b) |
蓝铁矿是一种非常稳定的磷-铁晶体, 几乎不溶于水(Ksp = 10-36)(Roussel, 2012), 但可溶于酸, 其生成pH环境一般在6~9之间(Wilfert et al., 2015).在室温及存在O2和光照条件下, 蓝铁矿会被缓慢氧化;被氧化时水分子(H2O)失去一个氢(H+)生成一个羟基(—OH), 同时铁(Fe2+)失去电子变为三价(Fe3+), 其氧化化学式为:Fe(3-x)2+Fe3+x(PO4)2(OH)x·(8-x)H2O(Rodgers et al., 1986).蓝色是蓝铁矿被氧化后的次生颜色, 在还原性条件下呈无色至淡绿色;蓝铁矿晶体被氧化程度加深, 其蓝色会逐渐变深、甚至变为黑色.蓝铁矿在高温时会逐渐脱去水分子(H2O);在N2环境中, 温度从393~723 K范围升温时蓝铁矿会失重28.8%, 这与蓝铁矿化学式中的水分子(H2O)质量分数28.7%非常接近(Ogorodova et al., 2017).
此外, 在自然环境中发现的蓝铁矿晶体中常伴生一些微量元素, 一般是少量的Mn和(或)Mg取代铁原子位置, 这主要与蓝铁矿晶体形成时的环境条件有关;在生成环境中存在一定浓度Mn2+、Mg2+时便会形成所谓的板磷铁矿(Ludlamite, (Fe, Mn, Mg)3(PO4)2·4H2O)、含水铁镁磷酸盐矿(Baricite, (Mg, Fe)3(PO4)2·8H2O) (Rothe et al., 2016).实验室中对蓝铁矿常用表征方法有:扫描电镜(SEM-EDX)、XRD、红外光谱、元素分析、穆斯堡尔(Mössbauer)光谱及热重分析等, 图 1b显示的便是蓝铁矿晶体SEM成像.
2.2 经济价值蓝铁矿早年间曾用作欧洲油画的蓝色颜料, 现代用途则较为广泛.首先, 作为一种含磷化合物, 与其它磷酸盐化合物一样可以作为磷肥的生产原料(Wilfert et al., 2015).其次, 较高纯度的蓝铁矿还能用于高能量密度储能材料——磷酸亚铁锂(LiFePO4)的合成, 是动力锂离子电池的主要合成原料之一(杨艳飞, 2012).再者, 大颗粒高纯度蓝铁矿晶体还具有较高的收藏价值.在目前磷酸盐矿国际市场中, 蓝铁矿的单位质量磷(P)经济价值最高, 其单位质量P价格高达51~96欧元·kg-1, 与普通磷矿石(0.7欧元·kg-1)、鸟粪石(9.8欧元·kg-1)、磷酸铝(3.4欧元·kg-1)价格形成鲜明对比(Alibaba, 2017).
2.3 从污泥中回收潜力磷在污水处理过程中经生物除磷(EBPR)工艺厌氧单元浓缩后, 最终还需要有一个由液相向固相的转移过程, 其相变过程需要某些金属离子参与, 与磷酸盐(PO43-)生成不溶性沉淀.磷回收过程中常见的外加金属盐有Ca2+、Mg2+、Al3+、Fe3+等, 这些金属离子会与PO43-形成羟磷灰石(HAP, Ca5(PO4)3OH)、鸟粪石(MAP, MgNH4PO4·6H2O)、磷酸铝(AlPO4)、甚至蓝铁矿(Vivianite, Fe3(PO4)2·8H2O)等(郝晓地等, 2011).
从溶解性角度, 鸟粪石溶解度(25 ℃, Ksp = 10-12.6)(Hanhoun et al., 2011)要大于蓝铁矿(25 ℃, Ksp = 10-36)(Roussel, 2012), 也大于羟基磷灰石(25 ℃, Ksp = 10-59)(Verbeek et al., 1980).从溶解度Ksp看, 羟基磷灰石显然最易生成, 但因其难以溶解, 很难被植物吸收、利用.此外, 羟基磷灰石、鸟粪石的生成环境条件较为苛刻.研究表明, 以羟基磷灰石回收磷时, P回收率达到80%以上时需要pH>9.0的反应条件(Zou et al., 2016);获得90%以上纯度鸟粪石沉淀的pH应在中性(7.0)附近(但反应速度极低), 而非多数人认为的碱性条件(pH=9~10)(Hao et al., 2008; Hao et al., 2013; Wang et al., 2010).相形之下, 蓝铁矿生成所需pH环境条件则较为宽泛, 在pH为6~9的范围均可生成(Wilfert et al., 2015), 甚至在pH=4.5~10.0的更宽范围亦可生成(自有实验).
市政污水的pH一般在6~8之间, 刚好可以满足蓝铁矿生成的条件.再者, 污水中常常因地质或水处理(铁混凝剂投加)原因而常常含有较多的铁, 这就为蓝铁矿生成创造了必要内在条件.荷兰的研究表明, 在污水处理厂生物污泥中确实发现存在较多的磷铁化合物, 如表 1所示(Wilfert et al., 2016).表 1显示, Nieuwveer污水处理厂(A/B法)各阶段污泥中均含有较多的蓝铁矿或其它磷酸铁比例, 远远高于鸟粪石含量;而Leewarden污水处理厂污泥中鸟粪石含量虽然较多, 但也存在一定量的蓝铁矿或其它磷酸铁比例(可能因污水中含铁量较低所致).
| 表 1 荷兰两污水处理厂各阶段污泥中蓝铁矿与其它磷酸盐化合物含量 Table 1 Contents of vivianite and other phosphate compounds in different biological sludge in two Dutch WWTPs |
从回收磷酸盐应用生成条件看, 向污水中投加铁的方式似乎更为现实, 因为铁极为廉价、易得, 特别是可以利用工厂废铁屑、铁刨花、甚至铁锈等.因此, 以回收蓝铁矿为目标的磷酸盐生成方式可能比鸟粪石更为现实、且成本低廉.此外, 向污水或污泥中投加铁还有着其它功效, 如零价铁在污泥消化系统中可促进甲烷(CH4)增产(Hao et al., 2017), 亦可用于防止管道腐蚀及产生H2S现象(Ge et al., 2013), 还可用来改善污泥脱水性能等(郝晓地, 2006).因此, 从污水/污泥中以蓝铁矿形式回收磷有可能是一种“一举多得”的资源回收方式.
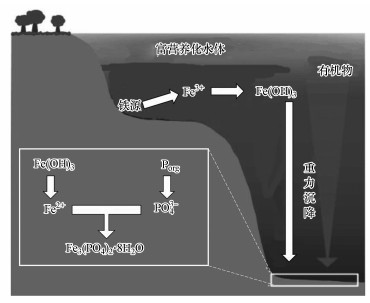
3 成因及影响因素分析(Analyses of formation causes and controlling factors) 3.1 自然水体形成蓝铁矿是一种生物矿, 即在有微生物参与下所形成的矿物质(Rothe et al., 2016), 生成于富铁、富磷的还原性水环境下.蓝铁矿在自然界中分布十分广泛, 在水淹土壤、沼泽、深水湖泊、海洋及富营养化水体底部沉积物中均有发现, 如表 2所示(Rothe et al., 2016).蓝铁矿在自然界磷流动中扮演着非常重要的角色, 有人估算进入水体中的总磷(TP)约有20%~40%被铁元素以蓝铁矿沉淀形式固定在水体底部(Rothe et al., 2014; Egger et al., 2015).蓝铁矿本身化学稳定性非常好, 能存在于水底上千年时间, 随地质变迁才有可能重见天日而回到地面.蓝铁矿如果在富营养化水体中形成, 则能将磷固定于水体沉积物中, 并因其难溶解特性而可有效防止因底泥释放后再次进入水体, 一定程度可减轻水体富营养化作用.
| 表 2 不同类型水体中发现的蓝铁矿以及鉴别方法(Reed et al., 2016) Table 2 Vivianite and associated detecting methods in different types of water |
在自然水体底部沉积物中蓝铁矿形成存在两个过程:①首先, 存在于有机物中的有机磷向无机磷酸盐(PO43-)转化及铁的还原(Fe3+→Fe2+);②蓝铁矿生成并以晶体形式析出(Rothe et al., 2016).在富营养化水体表层, 磷往往存在于有机碎屑之中;因重力作用沉积于水体底部;沉于水底的有机磷会被厌氧微生物分解转化为PO43-;同时, 沉淀在水体底部的高价铁化合物(Fe(Ⅲ))在异化金属还原菌(DMRB)等微生物的作用下被还原为二价铁离子(Fe2+);这两个微生物过程持续进行则会在水体底部形成一个Fe2+、PO43-局部浓度较高的环境条件而产生化学反应, 反应产物(蓝铁矿)达到饱和时便会以晶体形式析出, 从而将磷元素固定在水底沉积物中.蓝铁矿在自然水体中的形成过程可用图 2(Reed et al., 2016)及公式(1)~(4)来描述(Stabnikov et al., 2004).
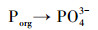
|
(1) |
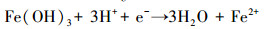
|
(2) |
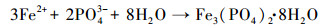
|
(3) |

|
(4) |
 |
| 图 2 蓝铁矿于自然水体中形成(Reed et al., 2016) Fig. 2 Formation of vivianite in deep water |
蓝铁矿自然形成过程可归纳为4个要素:①水体中需存在较高浓度磷、铁元素;②存在还原性水环境条件, 即需要较低的ORP;③存在较为丰富的有机质(为金属还原菌等异养微生物提供碳源);④适中的pH条件(6~9).污水中若能满足这4个要素条件, 蓝铁矿则有可能在污泥中形成, 即表 1所检测到的现象.
3.2 影响因素蓝铁矿是一种次生矿, 所以, 影响蓝铁矿生成的因素很多;环境中铁含量与价态、磷酸盐含量、微生物、以及其它金属离子和非金属离子存在与否均会影响到蓝铁矿生成.此外, 氢离子浓度(pH, 式(3)、(4))、氧化还原电位(ORP)以及溶液过饱和度等因素也会影响蓝铁矿生成.
此外, 蓝铁矿还是一种晶体, 在水溶液中析出还与晶体生长有关.晶体生长一般可以分为晶核生成和晶体生长, 当离子复合形成晶胚后晶体开始成长, 直至达到沉淀平衡状态.在蓝铁矿生成的溶液体系中溶液达到平衡状态时的化学势μ1和溶液过饱和时的化学势μ2之差Δμ是在溶液体系内生成蓝铁矿沉淀的反应动力, 如式(5)所示(闵乃本, 1982).

|
(5) |
假设平衡与过饱和两个状态的标准化学势相等, 即μ10=μ20, 则有:

|
(6) |
式中, k为波尔兹曼(Boltzm ann)常数, T为绝对温度, α为离子活度, Ω为过饱和度.
式(6)显示, 溶液体系内蓝铁矿晶体形成会受到环境温度、溶液过饱和度、离子强度及pH等因素制约, 这些因素主要影响离子存在形式与活度, 从而影响蓝铁矿的结晶过程.
3.2.1 微生物自然界中磷矿形成大多与微生物有着密切联系, 微生物在蓝铁矿的形成过程中亦扮演着十分重要的角色(Omelon et al., 2013).微生物参与过程分直接作用和间接作用:①直接作用主要是通过微生物的生理活动在反应体系内将Fe3+、有机磷、SO42-等经过一系列电子传递和转移形成溶解态的Fe2+、PO43-、S2-等, 该过程代表性微生物有金属还原菌(DMRB)、硫酸盐还原菌(SRB)以及水解酸化细菌等, 如图 3所示(Rothe et al., 2016);②间接作用主要在反应体系内对O2、NO3-等电子受体通过生化反应进行消耗, 形成一个还原性环境, 该过程中代表性微生物有硝化细菌和反硝化细菌, 此外, 微生物的生理活动对水环境的pH改变也会对蓝铁矿形成产生间接影响.
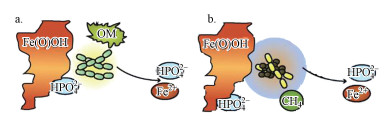 |
| 图 3 微生物将Fe3+还原为Fe2+:异化金属还原菌(DMRB)(a);甲烷厌氧氧化菌(AOM)(b)(Rothe et al., 2016) Fig. 3 Reduction of microorganisms from Fe3+ to Fe2+: dissimilatory metal reduction bacteria (a); anaerobic oxidation of methane (b) |
天然水体中的铁可能来源于铁矿石溶解或是其它人为添加, 饮用水或污水往往因胶体混凝或化学除磷常常需要投加大量铁混凝剂.然而, 水环境中的这些铁主要以高价(Fe3+)形式存在.水中Fe3+主要以水解形成絮状羟基铁(Fe(OH)3, HFO)为主, 因其具有较大比表面积而表现出较强的吸附性能, 可吸附PO43+而形成沉淀.此外, 未水解的Fe3+还会与水中PO43-直接生成FePO4沉淀.以上由Fe3+诱导生成的含磷沉淀物Fe(Ⅲ)-P会在厌氧以及在有机物存在条件下被异养金属还原菌(DMRB)、甲烷厌氧氧化细菌(AOM)等微生物还原(O′Loughlin et al., 2013), 如式(2)和(7)(Fu et al., 2016)所示;该还原过程会使Fe(Ⅲ)-P沉淀再次溶解释放PO43-和Fe2+, 如图 3所示.
随还原程度加深, 溶液的PO43-和Fe2+会逐渐升高;当PO43-和Fe2+浓度达到饱和后便会形成蓝铁矿晶体(Fe3(PO4)2·8H2O)从溶液中析出.水溶液中PO43-浓度较低而碳酸盐、硫化物较丰富的条件下还会生成菱铁矿(FeCO3)、黄铁矿(FeS2)等其它矿物质(Zachara et al., 1998).另外, 在天然水体或者污水中一般都有一定浓度的硫酸盐(SO42-)存在, 在有机物出现的厌氧环境中会诱发硫酸盐还原菌(SRB, Sulfate-Reducing Bacteria)的活动, 如式(9)(Mizuno et al., 1998)所示;SRB会将SO42-还原为S2-, 生成的S2-会和Fe2+发生如式(8)和(10)(Zhang et al., 2009; O′Connell et al., 2015)所示的化学过程.显然, S2-存在会和PO43-竞争Fe2+, 进而干扰蓝铁矿的正常形成.在Fe2+、PO43-、SO42-混合的反应体系内, 铁量不足时, SRB的存在会严重干扰蓝铁矿的形成(Roussel et al., 2016).
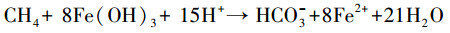
|
(7) |

|
(8) |
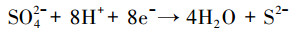
|
(9) |
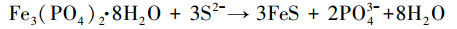
|
(10) |
微生物活动可以改变细胞周围的微环境, 对一些离子具有“浓缩效果”, 可提高细胞体周围离子浓度并改变酸碱度等.金属还原菌(DMRB)的生理活动会在细胞体周围形成一个局部较高的Fe2+、PO43-浓度, 这会导致在细胞周围的离子先于溶液中的离子饱和, 进而诱导蓝铁矿晶体在细胞体表面析出(Sánchez-Román et al., 2015).另外, 微生物细胞壁可能成为晶体形成的结核位点, 以此克服反应动力学的障碍, 在均质溶液形成晶核前生成沉淀;有人在西班牙Rio Tinto流域分离得到的放线菌、反硝化细菌细胞表面发现蓝铁矿晶体存在便印证了这一观点(Sánchez-Román et al., 2015).亦有研究表明, 蓝铁矿形成与甲烷厌氧氧化细菌(AOM)存在一定联系, 有人在AOM细胞内发现了富含铁、磷的颗粒, 这些颗粒与蓝铁矿形成有关(Milucka et al., 2012).
3.2.2 pH与ORP蓝铁矿生成于富Fe、PO43-及适中pH条件的还原性水环境中, pH以及ORP的变化对蓝铁矿形成会造成严重干扰(Wilfert et al., 2015).pH以及ORP对蓝铁矿生成的影响也可以分为直接影响和间接影响:①直接影响主要是影响离子存在形态, 进而影响蓝铁矿沉淀;②间接影响是通过影响与蓝铁矿生成相关的微生物活性而显现.
pH与ORP对蓝铁矿生成的直接影响主要是通过改变Fe、PO43-存在形态及化学平衡状态来影响其生成的.形成蓝铁矿核心元素之一的Fe是一种过渡性元素, 存在-2、0、+2、+3、+6多种价态.其中, +2、+3是比较常见的价态, 在水溶液中以亚铁离子(Fe2+)及铁离子(Fe3+)形式存在;这些价态易受水环境中ORP及pH影响(Cornell et al., 1999), 如图 4所示(铁在25 ℃条件下的Pourbaix图)(Kopeliovich, 2012).图 4显示, 蓝铁矿沉淀生成所需要的Fe2+产生环境需要保持还原性ORP条件及较低的pH(< 9, pH越低, 容许的ORP范围越宽);过高ORP环境会导致铁被氧化或转化为其它形态, 太低ORP可将铁还原为单质铁(污水处理过程中一般不会发生).因此, 铁的价态变化将会直接影响到蓝铁矿的生成.荷兰Nieuwveer污水处理厂中A、B段中蓝铁矿生成量之差异可以佐证上述观点, 因为A段中溶解氧(DO)为0.3 mg·L-1, 而B段中溶氧量为1.8 mg·L-1, 导致A段生成蓝铁矿含量明显高于B段(表 1)(Wilfert et al., 2016).pH单因子倾向于影响蓝铁矿生成的化学平衡状态;式(2)、(3)和(4)显示, 较低pH条件有利于过程(2)进行, 可有效保护Fe2+水解及防止其被氧化, 但较高的H+浓度会抑制过程(4)进行.pH单因子条件对蓝铁矿生成的影响呈现“此消彼长”的状态, 这样必然会存在一个最佳的pH范围(6~9)(Wilfert et al., 2015).此外, 蓝铁矿本身也会被氧化(氧分子、光子等), 但其在室温条件下被氧化的进程非常缓慢.
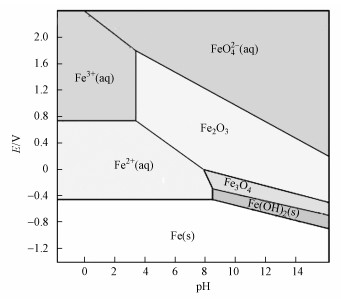 |
| 图 4 铁元素在不同pH及ORP条件下的Pourbaix图(Kopeliovich, 2012) Fig. 4 Pourbaix diagram of iron element under different pH and ORP conditions |
间接影响表现为:参与蓝铁矿生成的微生物(异养金属还原菌(DMRB)、产甲烷菌、甲烷厌氧氧化菌(AOM))易受到过酸、过碱以及较高氧化还原电位影响活性, 因为这些细菌通常存活于还原性及pH中性环境.
3.2.3 硫化物硫元素在污泥厌氧消化系统中也扮演着非常重要的角色, 并且在铁盐沉淀中与碳酸盐一起一直被认为起主导作用(生成黄铁矿和菱铁矿)(Yekta et al., 2014).然而, 最新研究表明, 在污泥厌氧消化系统中铁源充足的条件下黄铁矿(FeS2)与蓝铁矿(Fe3(PO4)2·8H2O)可以共存(Roussel et al., 2016).污水中往往含有较高的SO42-以及含硫有机物, SO42-在污泥厌氧消化系统中会被硫酸盐还原菌(SRB)等还原性细菌还原成为S2-, S2-和Fe2+则会生成FS2(黄铁矿);同时, S2-与已生成的蓝铁矿发生置换反应可生成黄铁矿, 导致PO43-释放.
水体沉积物中的S:Fe比(总硫:活性铁)可以用以衡量水环境中硫元素对蓝铁矿生成的影响;当比例高于1.5时, 相对而言铁显得不足, 该条件下铁会优先生成黄铁矿, 进而阻碍蓝铁矿的形成;当比值小于1.5时, 虽然硫的影响依然存在, 但该条件下蓝铁矿可以形成(Rothe et al., 2015).有人对德国湖泊/河流(Arendsee湖/富营养化、Groβ-Glienicke湖/中营养化、Lower Havel河/富营养化、Groβ er Müggelsee湖/富营养化)S:Fe比进行了检测并对蓝铁矿存在可能性进行了分析(被检测的4个水体中硫酸盐浓度分布在42.6~167 mg·L-1之间).检测结果表明, S:Fe越低越有利于蓝铁矿的出现, 蓝铁矿存在的最高S:Fe比为1:1(Rothe et al., 2003).也有人就S2-与蓝铁矿、菱铁矿反应导致PO43-释放这一过程进行了实验探究(Gächter et al., 2003).实验中配制1 mmol·L-1的FeCO3(菱铁矿, 固体)、0.5 mmol·L-1的Fe3(PO4)2·8H2O(蓝铁矿, 固体)溶液;然后, 向该系统中通入H2S, 观察通入硫负荷与PO43-释放量之间的关系.通入H2S形成的S2-会优先与菱铁矿(FeCO3)发生反应生成FeS, 溶液内总硫浓度低于1 mmol·L-1时反应体系内则没有PO43-释放, 同时也没有H2S分子积累, 但沉淀物中有FeS生成;当溶液内总硫浓度在1~2.5 mmol·L-1之间时, 随着总硫浓度增加反应体系内PO43-浓度也逐渐升高, 该环境条件下蓝铁矿与S2-反应释放PO43-, 直至完全释放, 且磷的释放与总硫浓度之间存在线性关系(P:S=2:3);在总硫浓度超过2.5 mmol·L-1后体系内H2S分子开始积累, PO43-浓度保持不变(Gächter et al., 2003).上述实验结果表明, 菱铁矿、蓝铁矿、黄铁矿的热力学稳定性依次升高, 因此, 菱铁矿形成对蓝铁矿具有一定的保护作用, 但当S2-浓度进一步升高将会导致蓝铁矿无法顺利形成.有人在类似的化学反应模型中得到了同样的结论, 当铁成为污泥消化系统内限制性条件时黄铁矿会在该系统中最先生成, 蓝铁矿在S2-消耗完全后才会形成、析出(Roussel et al., 2016).
硫对蓝铁矿生成的影响可以总结为:硫、铁的相对含量决定其对蓝铁矿生成的影响, 在铁相对不足的条件下硫会干扰蓝铁矿的形成, 严重时蓝铁矿不能形成;在铁足量情况下, 硫对蓝铁矿的干扰会非常小、甚至于消失.实际污水处理过程中若采用铁盐作为化学除磷剂, 铁的添加量可以人为调控, 似乎可以不考虑硫对蓝铁矿生成的负面效应.
3.2.4 腐殖质及其它污水及污泥中含有大量有机物, 在污泥总固体中有机物贡献率约为40%~80%(污泥干重)(Wilfert et al., 2015).有机物因含量大以及具有吸附、络合能力, 会对污泥厌氧消化中金属离子行为造成影响.有人估算, 活性污泥中约有22%的Fe处于与有机物结合状态, 这一比例会在污泥厌氧消化系统中升至30%(Rasmussen et al., 1996; Oikonomidis et al., 2010), 有机物会干扰铁在污水中的分布, 进而影响蓝铁矿生成.腐殖质便是这些有机物中最具代表性的物质之一, 腐殖质在污泥中含量较高, 可达剩余污泥中有机物含量的6%~20%(以VSS计)(郝晓地等, 2017; Frimmel et al., 1999);此外, 腐殖质分子量大、结构复杂、很难降解、且含有大量含氧官能团(羟基、羧基、酚羟基等)(Wilfert et al., 2015).
腐殖质在污泥厌氧消化系统中与Fe、PO43-之间相互作用非常复杂.首先, 腐殖质与铁结合能防止铁水解而形成聚合体(Karlsson et al., 2012);Mössbauer光谱分析表明, Fe3+与腐殖质反应时能充当氧化剂而被还原为Fe2+, 亦可作为非氧化剂与腐殖质吸附结合(Schwertmann et al., 2005).另外, 铁与腐殖质之间结合在不同官能团、不同结合位点上形成的化学键强度存在差异, 可形成不同类型的“铁-腐殖质”复合物(Karlsson et al., 2012), 这些复合物会影响铁的形态、水解以及和PO43-的反应.其次, 腐殖质存在对磷沉淀/回收的影响是复杂的, 有正面促进作用, 也有负面影响, 例如, 金属还原菌(DMRB)利用有机物将Fe3+还原, 在该过程中腐殖质可以充当电子供体加速环境中Fe2+生成, 可促进蓝铁矿的形成;腐殖质对金属离子络合与PO43-之间对Fe有竞争关系, 会抑制蓝铁矿的形成.然而, 铁诱导磷沉淀生成蓝铁矿过程中腐殖质的影响尚未形成统一的学术观点, 还有待进一步探究.
除此之外, 还存在其它一些影响蓝铁矿形成的因素, 如温度变化会对微生物活性、蓝铁矿晶体生长造成干扰(Madsen et al., 2014);钙、镁离子存在时会生成磷酸钙、鸟粪石等物质与铁竞争PO43-;而水中的镍、铜、锌等金属元素会优先与S2-反应, 对蓝铁矿形成具有保护作用.但总的说来, 这些因素在水环境中变化范围较小, 不太可能成为蓝铁矿形成的主要干扰因子.
4 蓝铁矿在污水中生成(Formation of vivianite in wastewater)明析蓝铁铁矿物化性质、成因及各类影响因素之后, 对照污水及污水处理过程运行条件可以发现, 在污水处理部分单元或污泥厌氧消化系统中存在蓝铁矿生成的必要内在与外在条件.首先, 污水及污泥中含有磷, 而且在污水处理厌氧单元(厌氧释磷)和污泥厌氧消化(细胞裂解)时会释放较多的磷.其次, 污水中常因前端给水处理(去除胶体)以及污水化学除磷投加铁盐混凝剂而产生过量的铁, 含量可高达1~10 mg·L-1(Wilfert et al., 2015)或17 g·kg-1 DS (干污泥)(Roussel et al., 2016).再次, 在污水处理全流程中, pH变化一般较小, 大多处于6~8范围内(Wilfert et al., 2015), 不会成为干扰微生物生理活性及蓝铁矿形成的主要外在环境因素.虽然在污水处理硝化以及其它好氧处理单元存在ORP高于+200 mV的现象, 但在污水处理厌氧单元和污泥厌氧消化内ORP均可低于-300 mV(Wilfert et al., 2015).最后, 污水中有机物是首要的污染物, 这会使异化金属还原菌(DMRB)等微生物在厌氧情况下可以保持较好的活性.因此, 污水处理或污泥厌氧消化过程完全具备蓝铁矿形成所需内在及外在条件, 这也正是实测中(表 1)发现污泥中存在蓝铁矿的理论基础.
蓝铁矿在污水/污泥处理过程的形成机制可用图 5所示路径予以解释.铁盐作为给水处理絮凝剂或污水化学除磷剂而过量进入水中;铁盐通过水解或化学反应对有机物、磷吸附并形成“铁-磷-有机物”沉淀;沉淀物进入污泥厌氧消化系统后在异化金属还原菌(DMRB)等一些还原性微生物作用下被溶解、还原, 沉淀又释放出Fe2+、PO43-;溶液环境中Fe2+、PO43-达到饱和时蓝铁矿便会以沉淀形式析出.
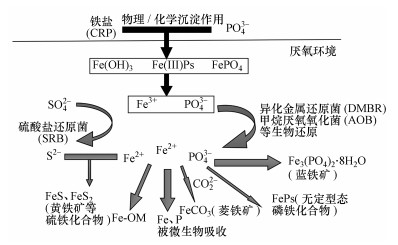 |
| 图 5 污水中蓝铁矿形成过程 Fig. 5 Formation progress of vivianite in wastewater |
有人在污泥中添加三价铁(水铁矿、赤铁矿)进行为期30 d污泥厌氧消化实验, 结果显示, 引入三价铁可有效沉淀磷(53%TP)(Cheng et al., 2015).实验虽然没有对Fe-P产物种类进行表征, 但结果分析认为是因三价铁(Fe3+)被还原转化为二价铁(Fe2+), 从而产生了磷沉淀(Cheng et al., 2015).也有其他学者做过类似的“污泥+铁”厌氧消化实验, 并对生成的Fe-P沉淀物进行了SEM-EDS表征, 确定外源铁引入到污泥消化系统中与磷生成的Fe-P沉淀就是蓝铁矿(Fe3(PO4)2·8H2O)(Roussel et al., 2016);并通过建立化学模型, 从化学反应动力学角度验证了在“污泥+铁”厌氧消化系统中蓝铁矿就是磷的主要沉淀形式, 且外源铁添加量与磷在蓝铁矿中的比例呈正相关性(Roussel et al., 2016).
有着上述实验基础, 荷兰研究人员以Leeuwarden和Nieuwveer两个污水处理厂作为考察对象, 对各处理单元中形成的磷酸盐沉淀物进行了定量和定性表征, 结果如表 1所示(Wilfert et al., 2016).Leeuwarden污水处理厂以强化生物除磷(EBPR)为处理工艺, 处理规模为38000 m3·d-1(2014年), 污水入厂后一分为二为两条平行处理流程(流程1和流程2分别为总进水流量的60%和40%);铁盐在该厂添加主要用于化学除磷(CPR)和防止在污泥厌氧消化时产生H2S, 流程1和流程2分别添加Fe3+和Fe2+铁盐;污水处理及污泥消化固体停留时间(SRT)分别为15 d和42 d;厂内磷、铁物料平衡如图 6a所示.Nieuwveer污水处理厂采用的是A/B法, 处理规模为75706 m3·d-1(2014年), 铁添加于A段, 用于除P和COD;A、B段及污泥消化系统内的HRT分别为15 h、16 d和25 d;厂内磷、铁物料平衡如图 6b所示.两污水处理厂各主要处理单元中Fe/P摩尔比如表 3所示.
 |
| 图 6 荷兰调研污水处理厂中磷、铁流动平衡:Leeuwarden厂(a);Nieuwveer厂(b)(Wilfert et al., 2016) Fig. 6 Flowing balance of phosphorus and iron in two Dutch WWTPs: Leeuwarden (a); Nieuwveer (b) |
| 表 3 荷兰污水处理厂主要处理单元中Fe/P摩尔比 Table 3 Molar ratio of Fe/P in two observed Dutch WWTPs |
研究人员对两污水处理厂主要处理单元中污泥取样检测分析发现, 各处理单元中均发现一定量蓝铁矿存在(表 1).对沉淀物表征分析后还发现, 蓝铁矿不是铁存在于污泥中的唯一物相;蓝铁矿中铁占污泥中总铁(TFe)含量的32%~73%;铁还能以黄铁矿(FeS2)(7%~27%TFe)以及氧化铁(Fe2O3)(4%~5%TFe)形式存在(Wilfert et al., 2016).此外, 调研中还对磷在不同物相中的分布做了相关分析, 沉淀物中生成的蓝铁矿、鸟粪石两种磷酸盐沉淀比例如表 1所示.表 1结果显示, 蓝铁矿和鸟粪石是磷在污泥中的主要沉淀形式, 但蓝铁矿占主导成分.
理论、实验及模拟表明, 污水处理厂形成蓝铁矿是完全可能的, 只是从污泥中回收需要具有相应的有效分离手段.
5 分离与提纯(Separation and purification)蓝铁矿在污泥厌氧消化中生成后与污泥混合在一起, 难以自然分离.因此, 需要采取技术手段实现分离, 否则, 以蓝铁矿形式回收磷在污水处理领域工程应用会受到极大限制.纵观文献, 目前还没有述及蓝铁矿与污泥有效分离的工程技术, 甚至实验室研发手段也较为罕见.为此, 有必要首先根据理论或现存分离技术, 寻找一些可能的实验技术, 并针对有效分离进行实验测试.根据蓝铁矿理化特征, 结合矿物分离领域一些分离提纯技术, 归纳出如下几种从污泥中分离蓝铁矿的可能途径.
5.1 密度分离剩余污泥大体上可以分为活性污泥、矿物质和水3种组分.3种组分在密度上存在明显差异, 活性污泥接近于水的密度(1 g·cm-3), 而蓝铁矿密度为2.67~2.69 g·cm-3, 是活性污泥的2.6倍.此外, 蓝铁矿密度也大于剩余污泥中大多数矿物质密度(表 4, 秦善, 2011; 选矿手册委员会, 1989).因此, 理论上利用蓝铁矿与其他成分之间密度差进行分离提纯具有可行性, 可以从重选与浮选两个方向进行分离与提纯.
| 表 4 剩余污泥中主要矿物质密度 Table 4 Density of main minerals contained in excess sludge |
重力选矿(重选)是采矿行业常用选矿工艺, 适合于处理有用矿物与脉石间具有较大密度差的矿石或其他原料(谢广元, 2016).活性污泥具有松散结构, 所含沉淀物又与污泥絮体具有足够大的密度差异, 可能利用密度差分离.
超重力分离是通过机械离心作用, 使具有密度差异的固体得以分离的技术.如表 4所示, 蓝铁矿密度比除磷酸钙(Ca3(PO4)2)以外的其他矿物质高, 只要控制适当离心力, 可首先分离Ca3(PO4)2(如果污泥中同时存在), 然后增加离心力后便可分离蓝铁矿.事实上, 离心是污泥脱水的一种常用技术;若能将污泥脱水与蓝铁矿分离有机结合, 则可在实现污泥脱水的同时一并将蓝铁矿与污泥分离, 有可能形成一种新的脱水、分离提纯技术.
5.1.2 浮选与反浮选气浮浓缩是目前除重力浓缩和机械浓缩之外浓缩剩余污泥的可行方法.气浮浓缩是指在污泥混合液中, 通入大量密集气泡, 使其与污泥颗粒进行相互粘附, 最终形成整体密度小于水的“气-泥”絮体, 浮于水面, 从而达到污泥浓缩的目的(崔志广等, 2007).气浮过程中密度大的蓝铁矿等则会沉降至气浮池底部, 实现反浮选分离.此种方法也是将污泥浓缩与矿物质分离有机结合的技术手段.
5.2 其他分离技术与辅助手段 5.2.1 磁性分离作为一种重要的物理选矿方法, 磁性分离技术(磁选)原理是利用不同矿物之间的磁性差异实现矿物质分离(谢广元, 2016).磁选过程简单方便、分选速度快、范围广、操作成本低, 且几乎不会带来二次污染, 比较适用于水污染物分选.如上所述, 蓝铁矿本身具有一定的顺磁性(Frederichs et al., 2003; 钟旭群等, 2011);通过磁性分选, 理论上可以对蓝铁矿进行分离.然而, 顺磁性所表现出的磁性非常弱, 用于蓝铁矿分离可能需要较强的磁场, 能耗则显得突出.因此, 利用磁选技术来分离提纯蓝铁矿应该不是最佳技术选择.
5.2.2 辅助技术磷酸亚铁在污泥中以蓝铁矿结晶形式存在, 所以, 晶体大小将会是后续分离提纯的重要影响因素.如上所述, 蓝铁矿晶体生长与多种因素有关, 如环境温度、PO43-浓度、Fe2+浓度、离子强度以及pH等;何种条件下蓝铁矿晶体能快速生成以及长大属于晶体学范畴, 需要进一步深入研究.
此外, 为避免蓝铁矿在污泥絮体中生成而增加分离提纯难度, 在厌氧消化污泥完成泥水分离之后, 可在富磷消化上清液中添加Fe2+进行磷沉淀与回收, 以这种方式生成的蓝铁矿将不会面临与污泥分离问题, 直接固液分离即可获得较高纯度蓝铁矿晶体.
6 结语(Conclusions)全球性磷危机导致从污水中回收磷的呼声和行动日趋高涨, 政策驱动技术, 技术日臻完善.寻求高磷含量并容易因地制宜获取的高经济价值的磷回收产物是全球普遍追求的目标.尽管鸟粪石(MgNH4PO4·6H2O)中P2O5含量很高(28.98%), 也是自然界存在的磷酸盐化合物, 但它在人工条件下合成不易, 况且又不能直接作为农肥, 仍需工业裂解提磷(PO43-).为此, 寻求其它形式的高含磷量磷回收产物成为人们新的探求.在此方面, 蓝铁矿(Fe3(PO4)2·8H2O)因P2O5含量(28.3%)几乎与鸟粪石相当、且亦在自然界和剩余污泥中存在而备受关注, 特别是它高端用途方面的市场潜在价值不菲.
蓝铁矿是一种生物次生矿, 即在微生物参与下形成的矿物质, 在自然界中分布十分广泛.决定蓝铁矿生成的条件除富铁、富磷的内在因素外, 还原性条件(ORP < -300 mV)及适中pH(6~9)等外在环境因素也制约着蓝铁矿的形成.对蓝铁矿生成的内在及外在因素综合分析后发现, 污水中存在形成蓝铁矿的铁、磷内在因素, 污水/污泥处理工艺中亦有其生成所需的ORP(厌氧单元或污泥厌氧消化)及pH(6~8)条件.
因此, 归纳蓝铁矿形成机理及明晰影响蓝铁矿形成的内在、外在影响因素有助于开展从污水中以蓝铁矿形式回收磷的基础研究及工程应用.其中, 对可能影响蓝铁矿形成的不利因素的辨析对今后实验研究特别重要, 可以诱发一些屏蔽这些负面影响因素的实验和应用技术.在工程应用方面, 今后研发从污泥中分离、提纯蓝铁矿的技术显得特别重要, 这需要从蓝铁矿与其它固体物质的密度差异及其磁性特征等方面进行深入研究.
Alibaba. 2017.磷酸盐矿物报价[OL]. 2017-11-10. https://detail.1688.com/offer/1232690362.html
|
CatherineA, CammonM. 1982. 蓝铁矿氧化过程的穆斯鲍尔谱研究[J]. 地球与环境, 1982(2): 41–44.
|
Cheng X, Chen B, Cui Y, et al. 2015. Iron(Ⅲ) reduction-induced phosphate precipitation during anaerobic digestion of waste activated sludge[J]. Separation & Purification Technology, 143: 6–11.
|
崔志广, 孙体昌, 寇珏, 等. 2007. 浮选捕收剂气浮浓缩城市污水处理厂剩余污泥的研究[J]. 中国矿业, 2007, 16(10): 70–73.
DOI:10.3969/j.issn.1004-4051.2007.10.021 |
Cornell R M, Schwertmann U, Cornell R, et al. 1999. The iron oxides:structure, properties, reactions, occurrences and uses[J]. Clay Minerals, 34(1): 209–210.
DOI:10.1180/claymin
|
Dijk K C V, Lesschen J P, Oenema O. 2016. Phosphorus flows and balances of the European Union Member States[J]. Science of the Total Environment, 542(Pt B): 1078–1093.
|
Egger M, Jilbert T, Behrends T, et al. 2015. Vivianite is a major sink for phosphorus in methanogenic coastal surface sediments[J]. Geochimica Et. Cosmochimica Acta, 169: 217–235.
DOI:10.1016/j.gca.2015.09.012
|
Frederichs T, Dobeneck T V, Bleil U, et al. 2003. Towards the identification of siderite, rhodochrosite, and vivianite in sediments by their low-temperature magnetic properties[J]. Physics & Chemistry of the Earth Parts A/b/c, 28(16): 669–679.
|
Frimmel F H, Abbt-Braun G. 1999. Basic characterization of reference NOM from Central Europe-Similarities and differences[J]. Environment International, 25(2/3): 191–207.
|
Fu L, Li S W, Ding Z W, et al. 2016. Iron reduction in the DAMO/Shewanella oneidensis MR-1 coculture system and the fate of Fe(Ⅱ)[J]. Water Research, 88: 808–815.
DOI:10.1016/j.watres.2015.11.011
|
Gächter R, Müller B. 2003. Why the phosphorus retention of lakes does not necessarily depend on the oxygen supply to their sediment surface[J]. Limnology & Oceanography, 48(2): 929–933.
|
Ge H, Zhang L, Batstone D J, et al. 2013. Impact of iron salt dosage to sewers on downstream anaerobic sludge digesters:Sulfide control and methane production[J]. Journal of Environmental Engineering, 139(4): 594–601.
DOI:10.1061/(ASCE)EE.1943-7870.0000650
|
国家统计局. 2015. 中国统计年鉴[M]. 北京: 中国统计出版社.
|
Hao X D, Wang C C, van Loosdrecht M C M, et al. 2013. Looking beyond struvite for P-recovery[J]. Environmental Science & Technology, 47(10): 49–65.
|
Hao X D, Wang C C, van Loosdrecht M C M. 2008. Struvite formation, analytical methods and effects of pH and Ca2+[J]. Water Science & Technology, 58(8): 1687–1692.
|
郝晓地. 2011. 磷危机概观与磷回收技术[M]. 北京: 高等教育出版社.
|
郝晓地. 2006. 可持续污水-废物处理技术[M]. 北京: 中国建筑工业出版社.
|
郝晓地, 周健, 张健. 2016. 源分离生态效应及其资源化技术[J]. 中国给水排水, 2016, 32(24): 20–27.
|
郝晓地, 宋鑫, van LoosdrechtM C M, 等. 2017. 政策驱动欧洲磷回收与再利用[J]. 中国给水排水, 2017, 33(8): 35–42.
|
郝晓地, 唐兴, 曹亚莉. 2017. 腐殖酸对污泥厌氧消化的影响极其屏蔽方法[J]. 环境科学学报, 2017, 37(2): 407–418.
|
Hao X D, Wei J, van Loosdrecht M C M, et al. 2017. Analysing the mechanisms of sludge digestion enhanced by iron[J]. Water Research, 117: 58–67.
DOI:10.1016/j.watres.2017.03.048
|
Hanhoun M, Montastruc L, Azzaro-Pantel C, et al. 2011. Temperature impact assessment on struvite solubility product:A thermodynamic modeling approach[J]. Chemical Engineering Journal, 167(1): 50–58.
DOI:10.1016/j.cej.2010.12.001
|
Jasinski S M. 2017. Phosphate rock[EB/OL]. U. S. Geological Survey, https://minerals.usgs.gov/minerals/pubs/commodity/phosphate_rock/mcs-2017-phosp.pdf
|
Karlsson T, Persson P. 2012. Complexes with aquatic organic matter suppress hydrolysis and precipitation of Fe(Ⅲ)[J]. Chemical Geology, 322-323: 19–27.
DOI:10.1016/j.chemgeo.2012.06.003
|
Kopeliovich D. 2012. Pourbaix diagrams[EB/OL]. SubsTech, http://www.substech.com/dokuwiki/doku.php?id=pourbaix_diagrams
|
Madsen H E L, Hansen H C B. 2014. Kinetics of crystal growth of vivianite, Fe3(PO4)2·8H2O, from solution at 25, 35 and 45℃[J]. Journal of Crystal Growth, 401: 82–86.
DOI:10.1016/j.jcrysgro.2013.11.014
|
Milucka J, Ferdelman T G, Polerecky L, et al. 2012. Zero-valent sulphur is a key intermediate in marine methane oxidation[J]. Nature, 491: 541–546.
DOI:10.1038/nature11656
|
闵乃本. 1982. 晶体生长的物理基础[M]. 上海: 上海科学技术出版社.
|
Mizuno O, Li Y Y, Noike T. 1998. The behavior of sulfate-reducing bacteria in acidogenic phase of anaerobic digestion[J]. Water Research, 32(5): 1626–1634.
DOI:10.1016/S0043-1354(97)00372-2
|
O'Connell D W, Jensen M M, Jakobsen R, et al. 2015. Vivianite formation and its role in phosphorus retention in Lake Ørn, Denmark[J]. Chemical Geology, 409: 42–53.
DOI:10.1016/j.chemgeo.2015.05.002
|
Ogorodova L, Vigasina M, Mel'Chakova L, et al. 2017. Enthalpy of formation of natural hydrous iron phosphate:Vivianite[J]. Journal of Chemical Thermodynamics, 110: 193–200.
DOI:10.1016/j.jct.2017.02.020
|
O'Loughlin E J, Boyanov M I, Flynn T M, et al. 2013. Effects of bound phosphate on the bioreduction of lepidocrocite (γ-FeOOH) and maghemite (γ-Fe2O3) and formation of secondary minerals[J]. Environmental Science & Technology, 47(16): 9157–9166.
|
Omelon S, Ariganello M, Bonucci E, et al. 2013. A review of phosphate mineral nucleation in biology and geobiology[J]. Calcified Tissue International, 93(4): 382–396.
DOI:10.1007/s00223-013-9784-9
|
Oikonomidis I, Wheatley A, Marquet C C, et al. 2010. Inorganic profiles of chemical phosphorus removal sludge[J]. Proceedings of the Institution of Civil Engineers Water Management, 163(2): 65–77.
DOI:10.1680/wama.2010.163.2.65
|
秦善. 2011. 结构矿物学[M]. 北京: 北京大学出版社.
|
Rasmussen H, Nielsen P H. 1996. Iron reduction in activated sludge measured with different extraction techniques[J]. Water Research, 30(3): 551–558.
DOI:10.1016/0043-1354(95)00203-0
|
Reed D C, Bo G G, Slomp C P. 2016. Shelf-to-basin iron shuttling enhances vivianite formation in deep Baltic Sea sediments[J]. Earth & Planetary Science Letters, 434: 241–251.
|
Rodgers K A, Henderson G S. 1986. The thermochemistry of some iron phosphate minerals:vivianite, metavivianite, barac'ite, ludlamite and vivianite/metavivianite admixtures[J]. Thermochimica Acta, 104: 1–12.
DOI:10.1016/0040-6031(86)85179-6
|
Rothe M, Frederichs T, Eder M, et al. 2014. Evidence for vivianite formation and its contribution to long-term phosphorus retention in a recent lake sediment:a novel analytical approach[J]. Biogeosciences, 11(5): 5169–5180.
|
Rothe M, Kleeberg A, Grüneberg B, et al. 2015. Sedimentary sulphur:iron ratio indicates vivianite occurrence:A study from two contrasting freshwater systems[J]. PloS One, 10(11): 1–18.
|
Rothe M, Kleeberg A, Hupfer M. 2016. The occurrence, identification and environmental relevance of vivianite in waterlogged soils and aquatic sediments[J]. Earth-Science Reviews, 158: 51–64.
DOI:10.1016/j.earscirev.2016.04.008
|
Roussel J, Carliell-Marquet C. 2016. Significance of Vivianite Precipitation on the Mobility of Iron in Anaerobically Digested Sludge[J]. Frontiers in Environmental Science, 4: 1–12.
|
Roussel J. 2012. Metal behaviour in anaerobic sludge digesters supplemented with trace nutrients[D]. Birmingham: University of Birmingham
|
Sánchez-Román M, Puente-Sánchez F, Parro V, et al. 2015. Nucleation of Fe-rich phosphates and carbonates on microbial cells and exopolymeric substances[J]. Frontiers in Microbiology, 6: 1024.
|
Schwertmann U, Wagner F, Knicker H. 2005. Ferrihydrite-humic associations:magnetic hyperfine interactions[J]. Soil Science Society of America Journal, 69(4): 1009–1015.
DOI:10.2136/sssaj2004.0274
|
Stabnikov V P, Tay T L, Tay D K, et al. 2004. Effect of iron hydroxide on phosphate removal during anaerobic digestion of activated sludge[J]. Applied Biochemistry & Microbiology, 40(4): 376–380.
|
Verbeek R M H, Steyaer H, Thun H P, et al. 1980. Solubility of synthetic calcium hydroxyapatites[J]. Journal of the Chemical Society Faraday Transactions, 76(4): 209–219.
|
Wang C C, Hao X D, Guo G S, et al. 2010. Formation of pure struvite at neutral pH by electrochemical deposition[J]. Chemical Engineering Journal, 159(1/3): 280–283.
|
Wilfert P, Kumar P S, Korving L, et al. 2015. The relevance of phosphorus and iron chemistry to the recovery of phosphorus from wastewater:A review[J]. Environmental Science & Technology, 49(16): 9400–9408.
|
Wilfert P, Mandalidis A, Dugulan A I, et al. 2016. Vivianite as an important iron phosphate precipitate in sewage treatment plants[J]. Water Research, 104: 449–460.
DOI:10.1016/j.watres.2016.08.032
|
杨艳飞. 2012.磷酸亚铁和磷酸亚铁锂制备工艺及其性能研究[D].郑州: 郑州大学
|
谢广元. 2016. 选矿学[M]. 北京: 中国矿业大学出版社.
|
选矿手册委员会. 1989. 选矿手册[M]. 北京: 冶金工业出版社.
|
Yekta S S, Bo H S, Björn A, et al. 2014. Thermodynamic modeling of iron and trace metal solubility and bspeciation under sulfidic and ferruginous conditions in full scale continuous stirred tank biogas reactors[J]. Applied Geochemistry, 47(8): 61–73.
|
Zachara J M, Fredrickson J K, Li S M, et al. 1998. Bacterial reduction of crystalline Fe3+ oxides in single phase suspensions and subsurface materials[J]. American Mineralogist, 83(11): 1426–1443.
|
Zou H, Wang Y. 2016. Phosphorus removal and recovery from domestic wastewater in a novel process of enhanced biological phosphorus removal coupled with crystallization[J]. Bioresource Technology, 211: 87–92.
DOI:10.1016/j.biortech.2016.03.073
|
Zhang L S, Keller J, Yuan Z G. 2009. Inhibition of sulfate-reducing and methanogenic activities of anaerobic sewer biofilms by ferric iron dosing[J]. Water Research, 43(17): 4123–4132.
DOI:10.1016/j.watres.2009.06.013
|
钟旭群, 庄故章. 2011. 蓝铁矿特征及其对铁矿选矿的意义[J]. 有色金属工程, 2011, 63(2): 199–203.
DOI:10.3969/j.issn.1001-0211.2011.02.048 |
 2018, Vol. 38
2018, Vol. 38


