PFOA是全氟化合物(Perfluorinated Compounds, PFCs)中最具代表性的有机化合物之一, 具有优良的热稳定性、化学稳定性、高表面活性、疏水性和疏油性等, 一直以来被广泛应用于纺织服装、表面活性剂、化妆品、农药、表面涂料乃至泡沫灭火剂等领域(Lindstrom et al., 2011; Chen et al., 2012).据报道, 我国每年消耗PFOA约200 t, 是全球最大的PFOA生产国和使用国(徐晓莉, 2017).由于PFOA化学性质稳定、不易降解, 可持久存在于环境中, 这将进一步加大PFOA对人类健康的威胁.PFOA可通过采食、吸入及皮肤接触等方式被机体吸收, 经过食物链富集后会放大其对生物的毒性.肝脏是机体重要的代谢器官, 小鼠染毒PFOA后, 主要蓄积于肝脏和血液中, 并导致肝损伤(Peng et al., 2012; Zheng et al., 2017; Tsuda et al., 2016).
PPAR-α是一类需要配体激活的转录因子, 而PFOA与脂肪酸具有相似性, 被认为可以充当PPAR-α的配体.PPAR-α被PFOA等环境污染物激活后, 可使过氧化酶体增殖, 增强脂质新陈代谢和脂肪酸氧化(Guruge et al., 2006).Quist等(2015)研究发现, 妊娠期小鼠饲喂低剂量PFOA, 会造成后代肝细胞肥大, 门静脉周伴发炎症, 线粒体数目增加结构异常.而这些病理变化与PPAR-α密切相关, PPAR-α通过调控膜的脂肪酸摄取、脂肪酸运输、脂肪酸氧化、酮合成及甘油三酯储存和脂肪分解等相关基因的转录来影响肝脏脂质代谢(Rakhshandehroo et al., 2010).相关的基因有酰基辅酶硫酯酶(acyl-CoA thioesterase 1, ACOT1)、长链酰基辅酶A合成酶(long-chain acyl-CoA synthetase, ACSL1)、软脂酸辅酶A氧化酶(palmitoyl-CoA oxidase, ACOX1)、肉碱脂酰转移酶I(carnitine palmitoyltransferaseI, CPT1a)等.目前, 国内外关于PFOA的研究大多集中在F1代, 而对其子代的损伤机制的研究相对较少.基于此, 本研究采用ELISA对小鼠肝脏中抗氧化酶进行测定, 并采用qPCR对肝脏中PPAR-α及其下游调控脂肪酸氧化基因的mRNA转录水平进行分析, 以探明妊娠期染毒PFOA对子代雌鼠造成肝脏损伤的致病机理.
2 材料与方法(Materials and methods) 2.1 实验试剂与仪器PFOA(分析纯99.2%, Sigma, USA);Go Taq®PCR Master Mix(A6001 Promega, USA);GoScriptTM Reverse Transcription System(A5001, Promega, USA);Eastep® Super总RNA提取试剂盒(LS1040, Promega, 北京);SQP电子分析天平(赛多利斯科学仪器有限公司, 北京);CKX41型倒置显微镜(Olympus, Japan);Synergy HTX多功能酶标仪(Bio Tek, USA);LightCycler®96全自动荧光定量PCR仪(罗氏诊断产品有限公司, 上海).
2.2 实验动物分组及处理选用未经产7~8周龄昆明小鼠(SPF级, 购于购自斯贝福(北京)实验动物科技有限公司, 许可证为SCXK(京)2015-0015), 常规饲养, 适应环境1周, 雌雄小鼠交配合笼, 9~12 h检出阴栓者, 定为孕0 d.将妊娠0 d的小鼠随机分为5组, 每组10只.A组为空白对照组, 孕1~17 d灌服去离子水0.2 mL, B、C、D、E组为PFOA处理组, 孕1~17 d分别灌服1.0、2.5、5.0、10.0 mg·kg-1去离子水溶解的PFOA 0.2 mL.剂量参考国内外相关文献(Lau et al., 2006; Das et al., 2017; 宋鹏琰等, 2017).所有怀孕母鼠单独饲养, 产后母鼠与其仔鼠同窝饲养, 21 d断奶, 泌乳期间不饲喂PFOA.动物处理过程通过实验动物管理和使用委员会的动物伦理学审查.妊娠期间, 每天记录母鼠体重变化.哺乳期间, 记录每日仔鼠存活数并每3 d记录一次仔鼠体重变化.子代雌鼠生长至21日龄, 采集血液及肝脏, 部分肝脏用Bouin氏液固定, 另一部分经液氮处理后于-80 ℃下存放, 备用.
2.3 流产率、存活率、肝脏指数测定计算方法流产母鼠鉴定:前期体重呈上升趋势, 后期体重持续降低后趋于平稳, 剖检子宫有充血或不完全吸收的胚胎, 即判定为流产母鼠.流产率:流产母鼠个数与妊娠母鼠个数之比.存活率:21日龄仔鼠存活数与产仔鼠数之比.肝脏指数:肝脏质量与体质量之比.
2.4 子代雌鼠肝脏组织病理变化将保存于Bouin氏液的肝脏组织经过“脱水→透明→浸蜡→包埋→切片”制备成5 μm石蜡切片, 通过苏木精-伊红(HE)染色, 在光学显微镜下观察病理变化.
2.5 子代雌鼠血清中AST、ALT活性测定天门冬氨酸氨基转移酶(AST/GOT)测定试剂盒(底物法)和丙氨酸氨基转移酶(ALT/GPT)测定试剂盒(底物法)购自中生北控生物科技股份有限公司, 采用半自动生化分析仪测定子代雌鼠血清中AST、ALT活性.
2.6 子代雌鼠肝脏中CAT和SOD含量检测过氧化氢酶(CAT)试剂盒和超氧化物歧化酶(SOD)试剂盒购自上海酶联生物科技有限公司, 采用酶联免疫法(ELISA)测定子代雌鼠肝脏中CAT和SOD含量.
2.7 子代雌鼠肝脏中PPAR-α及下游相关基因表达检测首先采用总RNA提取试剂盒提取肝脏组织中的总RNA, 通过RNA质量鉴定, 发现其OD260/OD280值都在1.9~2.1之间, 表明其纯度相对较高.然后用反转录试剂盒进行逆转录合成cDNA用于后续研究.采用Real-time PCR法对目的基因进行检测, 引物由大连宝生物有限公司设计合成.循环参数:95 ℃预变性30 s;95 ℃变性5 s, 60 ℃退火30 s, 40个PCR循环.以GAPDH为内参, 用2-ΔΔCt表示各目的基因的相对表达量.
| 表 1 引物序列及引物 Table 1 Gene sequence and primers |
采用Excel对测得的数据进行初步整理, 再通过SPSS19.0软件进行单因素方差分析, 计数率的比较采用χ2检验, p < 0.05为差异显著, p < 0.01为差异极显著, 结果用平均值±标准差表示.
3 结果(Results) 3.1 PFOA对母鼠流产率的影响从图 1可以看出, PFOA各处理组母鼠都有不同程度的流产, 流产率随PFOA摄入量的增加而上升.与对照组相比, 10.0 mg·kg-1 PFOA染毒组母鼠流产率显著上升(p < 0.05), 其他处理组没有显著差异(p>0.05).说明妊娠期染毒PFOA会诱发母鼠流产, 且剂量增加可加重流产.
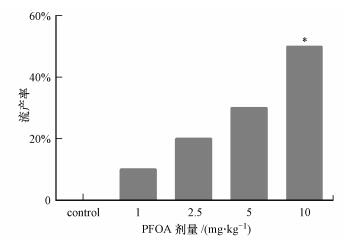 |
| 图 1 各处理组母鼠的流产率(*p < 0.05, **p < 0.01, 下同) Fig. 1 Abortion rate of mother rats in each treatment group |
如图 2所示, 仔鼠的死亡主要发生于出生后的5 d之内, 出生1周后存活率趋于平稳.与对照组相比, 10.0 mg·kg-1 PFOA染毒组的仔鼠存活率极显著降低(p < 0.01), 5.0 mg·kg-1 PFOA染毒组的仔鼠存活率显著降低(p < 0.05), 其他低剂量组差异不显著.说明母鼠妊娠期染毒PFOA会导致仔鼠死亡率增加, 且具有剂量依赖性.
 |
| 图 2 不同日龄仔鼠的存活率 Fig. 2 Survival rate of pups of different ages |
如图 3所示, PFOA染毒组子代体重上升幅度总体上低于对照组(10.0 mg·kg-1 PFOA处理组仔鼠存活数过少, 不具有统计学意义, 未在图中体现).与对照组相比, PFOA染毒组体重在出生后前8 d没有显著差异(p>0.05).在出生后第12 d, 5.0 mg·kg-1 PFOA染毒组子代体重与对照组相比出现显著差异(p < 0.05).出生后第16 d, 5.0 mg·kg-1 PFOA染毒组子代体重与对照组相比出现极显著差异(p < 0.01).出生后第20 d, 2.5和5.0 mg·kg-1 PFOA染毒组子代体重与对照组相比都出现极显著差异(p < 0.01).说明妊娠期染毒PFOA会减缓子代的体重上升趋势, 影响子代生长发育, 并具有剂量依赖性.
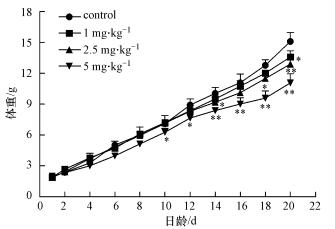 |
| 图 3 断奶前仔鼠的体重变化 Fig. 3 Changes in weight of pups before weaning |
剖检时肉眼观察发现, 5.0 mg·kg-1 PFOA处理组仔鼠肝脏边缘梗死, 表面有点状坏死灶;10.0 mg·kg-1 PFOA处理组坏死灶明显扩大, 肝脏肿大呈土黄色.进一步对肝脏组织切片观察, 结果如图 4所示, 空白对照组仔鼠窦状隙纹理清晰, 细胞质均匀, 细胞核完整;1.0 mg·kg-1 PFOA处理组仔鼠肝脏组织结构没有明显异常, 2.5 mg·kg-1 PFOA处理组肝细胞肿胀, 结构模糊, 窦状隙纹理不清;5.0 mg·kg-1 PFOA处理组仔鼠肝脏组织出现明显的空泡变性, 少量细胞核溶解;10.0 mg·kg-1 PFOA处理组仔鼠肝脏组织细胞肿大, 空泡变性加重, 部分细胞核发生溶解.
 |
| 图 4 PFOA对子代雌鼠的损伤作用(a、f.空白对照组;b.1.0 mg·kg -1 PFOA处理组;c.2.5 mg·kg -1 PFOA处理组;d、g.5.0 mg·kg-1 PFOA处理组;e、h.10.0 mg·kg-1 PFOA处理组;图中▲表示细胞核溶解, 表示空泡变性) Fig. 4 Injury effect of PFOA on progeny female mice |
由表 2可知, 与对照组相比, 各染毒剂量组肝脏指数明显升高, 差异极显著(p < 0.01);并且随PFOA暴露量的增大, 仔鼠肝脏指数也明显升高, 10.0 mg·kg-1剂量组极显著高于5.0 mg·kg-1剂量组, 5.0 mg·kg-1剂量组极显著高于1.0 mg·kg-1剂量组, 说明妊娠期染毒PFOA可显著升高仔鼠肝脏指数.
| 表 2 PFOA对子代雌鼠肝脏指数的影响 Table 2 Effect of PFOA on liver index of offspring females |
由表 3可知, 与对照组相比, PFOA处理组血清中AST和ALT活性明显升高, 具有显著差异(p < 0.01).各染毒组之间的AST活性差异不显著, ALT活性在10.0 mg·kg-1与1.0 mg·kg-1 PFOA处理组之间显著(p < 0.01), 其他组之间差异不显著.说明妊娠期染毒PFOA可造成仔鼠血清中AST、ALT活性升高, 并具有剂量依赖性.
| 表 3 PFOA对子代雌鼠血清中AST和ALT活性的影响 Table 3 Effect of PFOA on serum AST and ALT in offspring female |
由表 4可知, 与对照组相比, 5.0 mg·kg-1 PFOA处理组仔鼠肝脏中CAT含量显著升高(p < 0.05), 10.0 mg·kg-1 PFOA处理组仔鼠肝脏中CAT含量极显著升高(p < 0.01).与对照组相比, 除1.0 mg·kg-1组外, 其余PFOA处理组仔鼠肝脏中SOD含量极显著升高(p < 0.01), 高剂量(10.0 mg·kg-1)组有下降趋势, 与5.0 mg·kg-1组相比仔鼠肝脏中SOD含量极显著降低(p < 0.01).说明妊娠期染毒PFOA可造成仔鼠血清中CAT和SOD含量升高, 并具有剂量依赖性.
| 表 4 PFOA对子代雌鼠肝脏CAT和SOD含量的影响 Table 4 Effects of PFOA on CAT and SOD in the offspring of female offspring |
如图 4所示, 与对照组相比, 2.5 mg·kg-1的PFOA可显著下调PPAR-α mRNA表达(p < 0.05), 5.0 mg·kg-1的PFOA可极显著下调其表达(p < 0.01).1.0 mg·kg-1与10.0 mg·kg-1 PFOA组的表达量变化不明显.Cpt1a基因表达量在各组间无显著差异.与对照组相比, 2.5 mg·kg-1及以上剂量的PFOA可极显著上调Acot1和Acox1 mRNA的表达(p < 0.01), 且表达量随PFOA剂量的增加而增加.与对照组相比, 10.0 mg·kg-1 PFOA可使Acsl1 mRNA极显著上调, 而10.0 mg·kg-1以下剂量的PFOA使Acsl1 mRNA表达量变化不明显.说明一定剂量的PFOA可抑制PPAR-α基因的表达, 促进PPAR-α下游调控基因的表达.
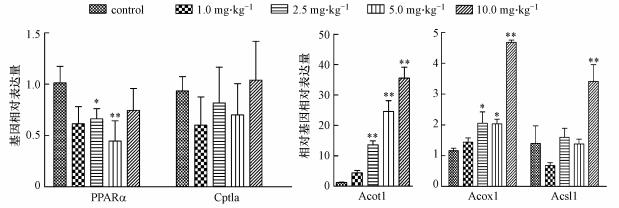 |
| 图 5 PFOA暴露对雌鼠肝脏组织PPAR-α及其下游基因表达的影响 Fig. 5 Effect of PFOA exposure on expression of PPAR-α and its downstream genes in female liver tissue |
Lau等(2006)研究表明, 妊娠期间染毒PFOA会诱发流产, 导致仔鼠存活率下降、生长发育迟缓等现象.李牧等(2017)和杨柳(2015)同时证明妊娠期染毒PFOA可增高母鼠的流产率, 增加肝脏指数.宋鹏琰等(2017)的研究也表明, 妊娠期染毒PFOA会导致仔鼠存活率显著降低.本研究结果与上述研究相同, 都发现妊娠期染毒PFOA会导致母鼠流产率升高、仔鼠存活率下降、肝脏指数增加等现象.
ALT与AST是目前国内外用于反映肝细胞损伤最常见的指标, 当肝细胞发生病变或坏死时, AST和ALT会从细胞中逸出.Wu等(2018)和Hui等(2017)用PFOA暴露于小鼠后, 发现血清中AST和ALT增加.本研究结果与之相似, 暴露PFOA后的子代小鼠随PFOA暴露量增大, 血清中AST和ALT的量逐渐增多, 表明PFOA可造成子代肝脏损伤.并且通过对肝脏病变进行HE染色, 发现肝脏损伤的严重程度与PFOA的暴露量呈正向关系, PFOA高剂量组出现了明显的细胞肿大、空泡变性和细胞核溶解现象, 此现象与王玲(2011)研究中发现的现象相似.
正常情况下, 细胞中活性氧(Reactive oxygen species, ROS)生成和消除都受到较强的控制, 处于动态平衡状态, 如果细胞发生氧化应激失衡, ROS累积能够损伤DNA、蛋白质及脂质等(Schieber et al., 2014).SOD和CAT是体内重要的抗氧化酶, SOD能将过多的ROS歧化生成水和H2O2, CAT能够降解体内过多的H2O2, 二者对机体均能起到一定的解毒及保护作用.本研究用ELISA方法对小鼠肝脏中CAT和SOD进行检测, 结果发现, PFOA暴露组的CAT和SOD含量显著升高, 推测是由于母体暴露PFOA后造成仔鼠氧化应激, 机体通过反馈调节升高了肝脏中CAT和SOD的含量.王力等(2017)对相关内容也进行了研究, 其结果显示, 1 mg·kg-1·d-1 PFOA可显著上调SOD和GSH-Px活性, 5和25 mg·kg-1·d-1 PFOA可显著上调MDA含量, PFOA对SD大鼠造成氧化应激, 本研究结果与之一致.
前期有学者(Boren et al., 2008)采用基因芯片技术检测PFOA处理后的大鼠基因表达情况, 结果显示, PFOA组有超过500个基因表达异常, 其中与脂类转运和代谢相关的基因簇关系最为密切.同时, Das等(2017)也对暴露全氟化合物的小鼠肝脏进行了基因分析, 发现全氟化合物可以改变关于脂肪分解代谢和脂肪酸、甘油三酯合成的基因表达水平.PPAR-α主要通过过氧化物酶体和线粒体β-氧化及微粒体ω-氧化调节脂肪酸氧化代谢和能量消耗(Pyper et al., 2010).由于PFOA具有与辛酸类似的结构, 可以作为PPAR-α激动剂, 因此, PPAR-α成为PFOA暴露最广泛研究的信号通路(Li et al., 2017).本研究采用qPCR法检测PPAR-α及其调控的下游基因表达水平, 进一步探讨PFOA通过PPAR-α通路对机体造成的损伤.
脂肪酸β-氧化是脂肪酸分解代谢的主要途径, 其中, Acsl1、Cpt1a、Acot1、Acox1是脂肪酸β氧化过程中必不可少的酶.有研究表明, PPAR-α通过调控Acsl1、Cpt1a、Acot1、Acox1基因的表达促进脂肪酸氧化(Rakhshandehroo et al., 2009; 2010; Nakamura et al., 2014).Acsl1在体内可以活化长链脂肪酸生成脂酰辅酶A, 是哺乳动物利用脂肪酸的第一步反应, 因此, 在脂肪代谢中起着重要作用(李庆岗等, 2012).本研究结果表明, 10 mg·kg-1的PFOA可以显著上调Acsl1 mRNA的表达量, 说明高剂量的PFOA可以导致脂酰辅酶A生成量增多.CPT1a介导酯酰辅酶A从细胞质进入线粒体, 是线粒体中脂肪酸的β-氧化的关键限速酶.本研究中Cpt1a基因的表达量没有显著变化, 所测得的Cpt1a基因结果与王玲(2011)研究的正常日粮组结果一致, 说明进入线粒体的酯酰辅酶A没有增多, 这可能导致由于高剂量PFOA引起过量的脂酰辅酶A进入过氧化物酶体.进入过氧化物酶体的脂酰辅酶A.在Acox的作用下脱氢氧化生成2-反-烯脂酰辅酶A, 而过氧化物酶体β氧化的一大特点是会生成H2O2(石如玲等, 2009).本研究发现, 经PFOA处理后Acox1 mRNA的表达量显著上调, 这将导致H2O2的产量显著升高, 加剧氧化应激, 造成肝细胞损伤.此外, 有研究报道Sprague-Dawley大鼠原代肝细胞接触PFOA后, Acot1可以作为PPAR-α激活的敏感指标(Liu et al., 2017).本研究对Acot1基因进行了检测, 发现10 mg·kg-1染毒组的表达量比对照组升高了35倍, 而Acot1可以将脂肪酸酰基辅酶A水解成为游离脂肪酸和相应的辅酶A, 游离脂肪酸可以作为PPAR-α内源性配体(Pyper et al., 2010b), 当大量的游离脂肪酸被脂肪酸结合蛋白转运至细胞核内时将极大程度地激活PPAR-α, 进一步诱导PPAR-α调控的下游基因表达, 进而产生恶性循环, 破坏机体脂质代谢平衡.
5 结论(Conclusions)妊娠期暴露PFOA能造成子代雌鼠肝损伤, 主要通过激活PPAR-α来诱导其调控的下游脂质代谢基因异常表达, 破坏机体脂质代谢平衡, 造成氧化应激.
Chen T, Zhang L, Yue J Q, et al. 2012. Prenatal PFOS exposure induces oxidative stress and apoptosis in the lung of rat off-spring[J]. Reproductive Toxicology, 33(4): 538–545.
DOI:10.1016/j.reprotox.2011.03.003
|
Das K P, Wood C R, Lin M T, et al. 2017. Perfluoroalkyl acids-induced liver steatosis:Effects on genes controlling lipid homeostasis[J]. Toxicology, 378: 37–52.
DOI:10.1016/j.tox.2016.12.007
|
Guruge K S, Yeung L W, Yamanaka N, et al. 2006. Gene expression profiles in rat liver treated with perfluorooctanoic acid (PFOA)[J]. Toxicology Science, 89(1): 93–107.
DOI:10.1093/toxsci/kfj011
|
Hui Z, Li R, Chen L. 2017. The impact of exposure to environmental contaminant on hepatocellular lipid metabolism[J]. Gene, 622: 67–71.
DOI:10.1016/j.gene.2017.04.024
|
Lau C, Thibodeaux J R, Hanson R G, et al. 2006. Effects of perfluorooctanoic acid exposure during pregnancy in the mouse[J]. Toxicology Science, 90(2): 510–518.
DOI:10.1093/toxsci/kfj105
|
Li K, Gao P, Xiang P, et al. 2017. Molecular mechanisms of PFOA-induced toxicity in animals and humans:Implications for health risks[J]. Environment Internationnal, 99: 43–54.
|
Lindstrom A B, Strynar M J, Libelo E L. 2011. Polyfluorinated compounds:past, present, and future[J]. Environment Science Technology, 45(19): 7954–7961.
DOI:10.1021/es2011622
|
李牧, 侯京玲, 王晓丹, 等. 2017. 枸杞多糖对全氟辛酸致仔鼠损伤的保护作用[J]. 中国兽医学报, 2017, 37(10): 1951–1956.
|
李庆岗, 陶著, 杨玉增, 等. 2012. 长链脂酰CoA合成酶(ACSL)的研究进展[J]. 中国畜牧兽医, 2012, 39(6): 137–140.
DOI:10.3969/j.issn.1671-7236.2012.06.034 |
Liu H, Wang J, Sheng N, et al. 2017. Acot1 is a sensitive indicator for PPARalpha activation after perfluorooctanoic acid exposure in primary hepatocytes of Sprague-Dawley rats[J]. Toxicology in Vitro, 42: 299–307.
DOI:10.1016/j.tiv.2017.05.012
|
Nakamura M T, Yudell B E, Loor J J. 2014. Regulation of energy metabolism by long-chain fatty acids[J]. Progress in Lipid Research, 53(1): 124–144.
|
Peng S, Yan L, Zhang J, et al. 2012. Hepatotoxicity of perfluorooctanoic acid in human hepatocytes using metabonomics[J]. Chinese Journal of Chromatography, 30(2): 123–127.
|
Pyper S R, Viswakarma N, Yu S, et al. 2010. PPARalpha:energy combustion, hypolipidemia, inflammation and cancer[J]. Nuclear Receptor Signaling.
DOI:10.1621/nrs.08002
|
Quist E M, Filgo A J, Cummings C A, et al. 2015. Hepatic mitochondrial alteration in CD-1 mice associated with prenatal exposures to low doses of perfluorooctanoic acid (PFOA)[J]. Toxicologic Pathology, 43(4): 546–557.
DOI:10.1177/0192623314551841
|
Rakhshandehroo M, Hooiveld G, Muller M, et al. 2009. Comparative analysis of gene regulation by the transcription factor PPARalpha between mouse and human[J]. PLoS One, 4(8): e6796.
DOI:10.1371/journal.pone.0006796
|
Rakhshandehroo M, Knoch B, Muller M, et al. 2010. Peroxisome proliferator-activated receptor alpha target genes[J]. PPAR Research(4): 393–416.
|
Schieber M, Chandel N S. 2014. ROS function in redox signaling and oxidative stress[J]. Current Biology, 24(10): R453–R462.
DOI:10.1016/j.cub.2014.03.034
|
石如玲, 姜玲玲. 2009. 过氧化物酶体脂肪酸β氧化[J]. 中国生物化学与分子生物学报, 2009, 25(1): 12–16.
|
宋鹏琰, 马双, 翟福展, 等. 2017. 妊娠期全氟辛酸染毒对子代雄鼠发育毒性的研究[J]. 环境科学学报, 2017, 37(10): 4033–4038.
|
Wu X, Xie G, Xu X, Wu W, Yang B. 2018. Adverse bioeffect of perfluorooctanoic acid on liver metabolic function in mice[J]. Environmental Science and Pollution Research, 25(5): 4787–4793.
DOI:10.1007/s11356-017-0872-7
|
王玲.2011.全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)干扰BALB/c小鼠脂类代谢效应研究[D].武汉: 华中农业大学
http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2004113 |
王力, 赵凤莲, 阚梦颖, 等. 2017. 全氟辛酸对大鼠肝脏氧化应激与PPARα及其所调控的CYP4A1基因表达的影响[J]. 卫生研究, 2017, 46(5): 802–806.
|
徐晓莉. 2017. PFOA类物质在我国的生产和加工使用现状[J]. 化工管理, 2017(25): 54–55.
DOI:10.3969/j.issn.1008-4800.2017.25.040 |
杨柳.2015.番茄红素缓解全氟辛酸对妊娠小鼠的肝脏毒性和生殖毒性研究[D].保定: 河北农业大学
http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2874412 |
Zheng F, Sheng N, Zhang H, et al. 2017. Perfluorooctanoic acid exposure disturbs glucose metabolism in mouse liver[J]. Toxicology and Applied Pharmacology, 335: 41–48.
DOI:10.1016/j.taap.2017.09.019
|
 2018, Vol. 38
2018, Vol. 38


