2. 南京水利科学研究院生态环境研究中心, 南京 210029;
3. 江苏省水文水资源勘测局, 南京 210098
2. Center for Eco-Environmental Research, Nanjing Hydraulic Research Institute, Nanjing 210029;
3. Jiangsu Water Resources Bureau, Nanjing 210098
抗生素是药物和个人护理用品(Pharmaceutical and Personal Care Products, PPCPs)中的一类有机代谢产物, 它能够选择性地干扰、抑制致病微生物的生存和形成次级代谢产物(Zhu et al., 2013).研究发现, 抗生素在人和动物体内均不能被完全吸收和代谢, 80%~90%以原形或活性代谢产物的形式通过粪便和尿液排出体外(Kummerer, 2009), 并且传统的水处理工艺并不能对所有抗生素都具有较好的去除效果(Schröder et al., 2012;Le-Minh et al., 2010).环境中抗生素的半衰期较短, 但频繁使用和持续排放使其呈现“假持久性”现象(Khetan et al., 2007).我国是抗生素生产和消费大国, 年消耗抗生素达18万t(人用和畜用), 人均消耗量是美国的10倍(Jiang et al., 2014), 因此, 抗生素滥用现象及其带来的环境污染问题更为严重, 尤其在经济发展较快、人口较密集的地区更为突出.
目前, 抗生素造成的环境污染问题已经引起了研究人员的广泛关注.关于抗生素的报道最早可追溯到1982年(Shenker et al., 2011), 近年来国内外科研人员对地表水(Xu et al., 2014)、土壤(Zhang et al., 2013)、地下水(Peng et al., 2014)、污水处理厂(Xu et al., 2015)甚至饮用水(Liu et al., 2013)和食物(Harrison et al., 2013)中抗生素种类和浓度的分布情况开展了细致的研究, 对抗生素的时空分布、在各相间的迁移转化(Yao et al., 2015;Zhang et al., 2015)、受降雨过程(Joy et al., 2013)和水质指标(Verlicchi et al., 2012)影响的情况进行了探究.此外, 在通过毒理机制评估抗生素的生态风险(Yan et al., 2014)和推求环境中抗性基因的赋存量(Zhang et al., 2013)等方面也取得了显著的成果.
太湖流域人口稠密、经济发达、禽畜和水产养殖强度高, 且流域水系复杂, 抗生素生态风险问题突出, 但目前太湖依然是多个环湖城市的饮用水源地, 因此, 太湖的抗生素问题已经引起了公众的密切关注.陈永山等(2011)在太湖苕溪流域底泥中发现典型抗生素的检出率均大于70%, 四环素类抗生素是该流域主要的抗生素污染种类, 尤以土霉素(0.7~276.6 ng·g-1)较为突出;Xu等(2014)对太湖湖区表层水、孔隙水和沉积物中抗生素的分布情况进行了研究, 发现磺胺类、氟喹诺酮类、大环内酯类、四环素和甲氧苄啶总浓度分别为127~1210 ng·L-1、1.5~216 ng·L-1、4.1~731 μg·kg-1, 其中, 罗红霉素在表层水和沉积物中浓度均相对较高;武旭跃等(2016)在太湖贡湖湾水域表层水中发现土霉素检出浓度最高, 且土霉素、氧氟沙星等处于高风险;Yan等(2014)在梅梁湾、竺山湾和贡湖湾检测出磺胺甲恶唑、诺氟沙星、氧氟沙星浓度分别为85.4、50.4、13.0 ng·L-1;Lin等(2016)分析了太湖流域某饮用水处理厂出水中抗生素浓度, 发现入水和出水中磺胺类的磺胺甲恶唑是检出浓度最高的抗生素, 分别为8.7 ng·L-1和5.4 ng·L-1, 且大环内酯类的罗红霉素的检出率高达100%;Wang等(2016)对太湖湖区水相和沉积相中抗性基因的占比状况进行了探究, 结果表明, 四环素抗性基因tetC、磺胺抗药性基因sul1和sul2存在于所有水和沉积物样品中.
太湖流域入湖河网是湖区污染物的重要输入通道(Yi et al., 2017), 但入湖河网中抗生素赋存现状尚不清楚.因此, 本文通过研究太湖流域检出率和检出浓度较高的典型抗生素SMX、OFL、ROM和OTC对平原河网生态环境的影响, 探究典型抗生素在湖泊上游复杂平原河网中的时空分布, 评估典型抗生素对敏感水生生物的生态风险, 以期为解析太湖抗生素的来源并提升太湖水生态安全提供参考.
2 材料与方法(Materials and methods) 2.1 采样点设置及样品采集研究区域宜溧-洮滆水系位于太湖流域西北部, 主要包括宜兴地区、无锡市区及常州武进地区, 是由200多条河流纵横交错形成的平原入湖河网.该片平原入湖河网的径流量占入湖径流总量的45%, 年均注入太湖的水量为4.88×109 m3, 陈东港、大浦港、太滆运河等为主要的入湖河流, 其中, 陈东港入湖水量最大, 约占总入湖水量的16%(燕姝雯等, 2011), 该水系也是入湖污染负荷通量最大的水系.
在太湖流域上游宜溧-洮滆水系布设44个监测位点, 具体信息如图 1和表 1所示.水系上游主要分为山区来水区和长江客水区, 其中, 山区来水区集中布点于南河水系(南溪河N1~N5, 北溪河B1~B3)和丹金溧漕河(D1~D3);长江客水区的站点布设集中在京杭大运河(J1~J4)和5条通江河道(G1~G5).水系中游站点围绕洮湖和滆湖布置:北干河(BG)、孟津河(MJ)、武宜运河(W1~W2)、太滆运河(TG)等.水系下游布设点包括乌溪港(M1)、黄渎港(M2)、大浦港(M3)等13个入湖河口.采样时间为2017年2月(枯水期)和7月(丰水期), 其中, 丰水期采样时间为降雨事件(降雨量27.3 mm)2 d后.每个点位分别采集5 L表层水后置于棕色玻璃瓶中, 并用彼得逊采泥器采集100 g河底表层沉积物,包好置于自封袋后于-20 ℃避光保存, 尽快冻干处理.所有样品采集后密封冷藏, 运回实验室48 h内分析, 严格遵守GB/T 12999—1991《水质采样样品的保存和管理技术规定》和ISO 5667-12-1995水质采样第12部分:底部沉积物采样指南中的相关规定.
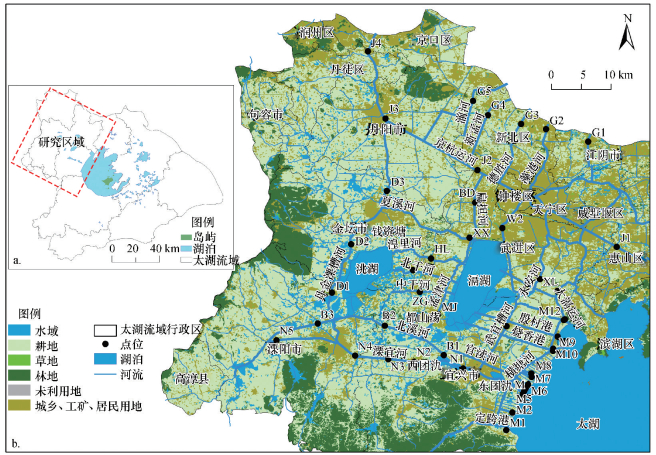 |
| 图 1 太湖流域上游宜溧-洮滆水系采样点位 Fig. 1 Location of study area and sampling sites in the upstream river networks of the Lake Taihu |
| 表 1 太湖流域上游宜溧-洮滆水系采样点和所属河流概况 Table 1 River systems and sampling sites in the upstream river networks of Taihu Lake, China |
分析中采用的设备主要包括:配有四级杆检测器的高效液相色谱-串联质谱(HPLC-MS/MS, Agilent 1290-6460, 美国), Agilent RRHD Eclipse Plus C18色谱柱(2.1 mm×50 mm, 1.8 μm), Zorbax Eclipse XDB-C18保护柱(2.1 mm×15 mm, 1.8 μm, 美国, Agilent);多通道固相萃取仪(美国, SUPELCO);EYELA MG-2200氮吹浓缩仪(日本, Rikakikai);Q-POD型MILLI-Q超纯水仪(德国, Millipore);DELTA320 pH计(瑞士, Mettle Toledo);R-210旋转蒸发仪(美国, HACH);Allegra X-22R高速台式离心机(美国, Backman Coulter);KQ-250B超声波清洗机;TF-FD-1冷冻干燥机;FA2104N电子天平;SAX强阴离子交换小柱(3 mL, 500 mg) (美国, SUPELCO);OASIS HLB固相萃取小柱(6 mL, 500 mg) (美国, Waters).
分析中采用的抗生素标准品和所用试剂包括土霉素、磺胺甲基异恶唑、罗红霉素、氧氟沙星, 均购自德国的Dr.Ehrenstorfer GmbH, 标准品纯度≥96%;13C3-咖啡因(Caffeine)作为回收率指示物, 购自美国的Cambridge Isotope Laboratories Inc;其它包括甲醇(HPLC、TEDIA)、乙腈(HPLC, TEDIA)、甲酸(HPLC, TCI)、盐酸、磷酸、磷酸二氢钠和Na2EDTA, 均为分析纯, 购自百灵威科技.
2.3 样品前处理和HPLC/MS/MS分析条件水相中抗生素的富集方法:量取5 L水样过0.45 μm混合纤维酯滤膜, 每个滤后水样加入2 g Na2EDTA作为螯合剂、50 ng 13C3-咖啡因作为回收率指示物, 盐酸调节水样至pH=3.在水样富集前, HLB固相萃取柱依次用6 mL甲醇、6 mL Na2EDTA水溶液(10 g·L-1, pH=3)和6 mL超纯水进行活化.将水样以不超过10 mL·min-1的流速通过HLB柱, 过柱完成后, 超纯水淋洗HLB小柱以去除多余杂质, 通入氮气干燥20 min, 6 mL甲醇洗脱至玻璃离心管, 洗脱液在40 ℃下用N2吹至近干, 复溶于1 mL甲醇-水溶液(1:1, V/V), 振荡1 min, 过0.22 μm的滤膜转移至色谱瓶, 待上机检测.
沉积相中抗生素的富集方法:采用超声辅助萃取法(SAE), 沉积物冻干后研磨过60目筛, 将土样混匀, 称取4.0 g置于50 mL离心管中, 依次加入2 g Na2EDTA、50 ng 13C3-咖啡因、15 mL乙腈-磷酸盐缓冲液(1:1, V/V, pH=3), 振荡10 min, 超声20 min, 以3500 r·min-1的转速离心10 min, 将上清液倒入旋蒸瓶中, 残渣反复提取两次, 合并上清液, 40 ℃旋转蒸发至上清液体积的1/2以下, 加入超纯水稀释至1000 mL, 以保证乙腈含量低于5%.SPE固相萃取柱为SAX-HLB串联柱, 后续步骤同水相中抗生素处理方法.
质谱条件:选择电喷雾离子源(ESI), 正离子模式;干燥气温度300 ℃, 干燥气流速5 L·min-1, 毛细管电压3500 V, MS1和MS2温度均为100 ℃, 喷雾针压力45 psi, 碰撞气为N2, 多离子反应监测扫描模式(MRM).进样量5 μL, 流动相流速0.2 mL·min-1, 柱温35 ℃, 流动相A为0.1%甲酸水溶液, B为乙腈.表 2所示为各种物质的母离子、子离子的质荷比及碰撞能.
| 表 2 目标抗生素的主要理化和MRM参数 Table 2 Physical properties and MRM parameters of antibiotics |
采用外标法定量, 配制一系列浓度梯度(0.01、0.1、0.5、1、10、50、100、200 μg·L-1)的混合标准溶液进行测定, 得到浓度-峰面积标准曲线, 各抗生素的标准曲线线性关系良好(R2>0.99).每批样品在前处理的同时做空白和样品加标实验进行质量控制.加标实验如下:取原水样(沉积物)加入浓度梯度分别为0、5、10、20、50 ng·L-1(ng·g-1)的4种抗生素标准溶液, 经过预处理后上机测定.通过与标线对比获取各种抗生素物质的浓度, 测量结果间的浓度差值与标品之间浓度差值的比值作为各抗生素的方法回收率.水样和沉积物样品中各抗生素的回收率分别为:土霉素80.1%±10.4%、84.6%±5.6%, 罗红霉素77.8%±8.1%、85.9%±2.7%, 氧氟沙星78.9%±1.5%、87.3%±2.1%, 磺胺甲恶唑75.0%±3.3%、81.6%±9.5%.水体和沉积物样品检出限分别为0.001~0.26 ng·L-1和0.2~1.0 ng·g-1, 水体和沉积物样品中咖啡因回收率分别为88.1%±1.1%和86.3%±5.3%.
2.5 生态风险评价和健康风险评价方法环境中残留药物的生态风险可以通过风险商值(Risk Quotients, RQs)来评价(European Commission, 2003).环境中的抗生素多以复合形式存在, 多种抗生素并存时的环境危害会因共存而加强(Leung et al., 2012).因此, 本文采用叠加模型计算抗生素的联合毒性风险商RQs(Quinn et al., 2008), 计算公式如式(1)~(3)所示.

|
(1) |

|
(2) |

|
(3) |
式中, MEC为环境实测浓度, 即抗生素在水环境中的实测浓度(ng·L-1);PNEC为预测无效应浓度, 即在现有认知下不会对环境中微生物或生态系统产生不利效应的最大药物浓度(ng·L-1);LC50为半致死浓度(ng· L-1), EC50为半最大效应浓度(ng·L-1), LC50和EC50均从文献中获取, 当存在多个值时, 取最小值;AF为评价因子, 取欧盟的技术指导文件推荐值(1000);RQs为联合毒性风险商;RQi为抗生素i的RQ值.当0.01≤RQs < 0.1时, 表明抗生素对生态环境为低风险;当0.1≤RQs < 1时, 表明抗生素对生态环境为中风险;当RQs≥1时, 表明抗生素对生态环境为高风险.
| 表 3 抗生素对敏感物种的毒理数据和风险商值(Jiang et al., 2014) Table 3 Toxicity data and PNEC of four antibiotics to the sensitive aquatic species |
根据江苏省水利厅2003年发布的《江苏省地表水(环境)功能区划》, 太湖湖西区宜溧-洮滆水系设立25个饮用水水源保护区和42个渔业用水区等功能区.参考Schwab等(2005)提出的抗生素健康风险评价方法, 根据美国国家环境保护局(EPA, 2000)推荐的风险商值法(Health Quotients), 估算抗生素的预测无效应浓度并计算相应的健康风险, 计算公式如(4)~(6)所示.

|
(4) |
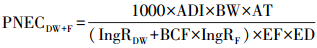
|
(5) |
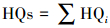
|
(6) |
式中, ADI为抗生素的日容许摄入量(μg·kg-1·d-1), 参照世界卫生组织和澳大利亚自然资源管理部长理事会的推荐标准(WHO, 2000);BW为平均体重, 取值为70 kg;AT为平均暴露时间, 取值为10950 d;IngRDW为成人饮水摄取率, 取值为2 L·人-1·d-1;BCF为鱼的生物浓缩因子, 取值为3.2 L·kg-1;IngRF为成年人鱼的消费率, 取值为0.0175 kg·人-1·d-1;EF为暴露频率, 取值为350 d·a-1;ED为暴露期, 取值为30 a;1000为不确定因子, 通过不确定因子来解释动物毒理数据对人外推的差异性.美国EPA规定, 当HQs≥1时, 表明抗生素对人体的健康风险不可接受;当0.1 < HQs≤1时, 表明抗生素对人体的健康风险较大;当HQs < 0.1时, 表明抗生素对人体的健康风险可以接受.
此外, 利用Origin 9.0和R软件对监测数据进行相关分析, 采用Crystal Ball完成500次蒙特卡洛分析, 对健康风险评价进行不确定分析.
3 结果(Results) 3.1 宜溧-洮滆水系水相中典型抗生素时空分布特征由表 4和图 2可知, 枯水期与丰水期宜溧-洮滆水系所有位点均有抗生素检出, 4种抗生素的检出水平均为ng·L-1量级.流域典型抗生素浓度呈现显著的时空差异性:各抗生素的检出水平表现为枯水期显著低于丰水期(p < 0.05);枯水期水系上游抗生素的检出水平高于水系下游, 且上游来水中长江客水区抗生素的检出水平高于山区来水区;丰水期检出浓度空间变化与之相反, 水系下游入湖河口处出现抗生素浓度显著增加的现象.
| 表 4 枯水期和丰水期4种抗生素在宜溧-洮滆水系水相和沉积相中的检出率及检出浓度 Table 4 Detection rates and concentrations of the four antibiotics in water and sediment samples in the upstream river networks of Taihu Lake during the wet and dry seasons |
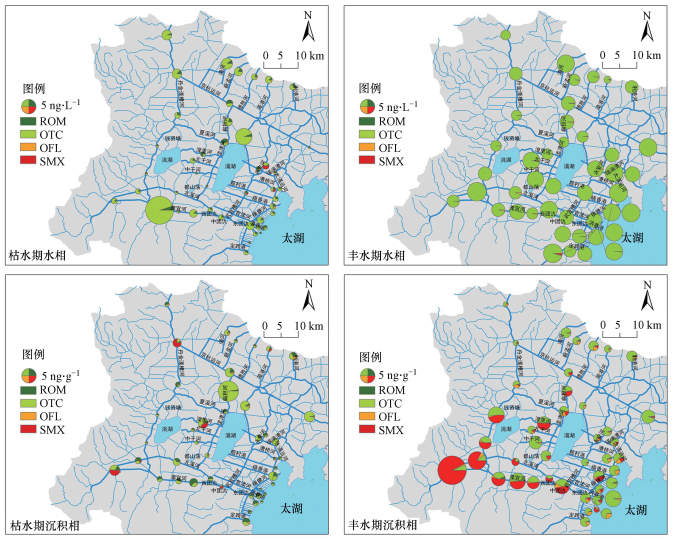 |
| 图 2 宜溧-洮滆水系水相和沉积相中抗生素的时空分布(图例中数字为圆饼总面积对应的抗生素总浓度, 不同种类抗生素在圆饼内所占面积比例对应其浓度比例) Fig. 2 Spatial-temporal variations of the antibiotics in water and sediment phases in the upstream river networks of Lake Taihu |
枯水期4种抗生素的平均检出率为60%±40%, OTC和ROM的检出率较高, SMX的检出率最低.流域4种抗生素检出总浓度最高为18.80 ng·L-1, 位于水系上游宜溧南河N4位点(溧阳), 且OTC是枯水期检出浓度最高的抗生素, 为17.85 ng·L-1(N4位点, 溧阳), 显著高于ROM、OFL、SMX(p < 0.05).丰水期4种抗生素的平均检出率为50%±50%, OTC和OFL的检出率高于SMX和ROM.丰水期4种抗生素检出总浓度最高为8.52 ng·L-1, 位于水系下游入湖河口M2位点.OTC的检出浓度最高(8.36 ng·L-1), 位于水系上游南河水系的宜溧北河B3位点(溧阳).流域OTC的检出水平表现为中、下游高于上游.丰水期OTC和OFL的检出水平显著高于枯水期(p < 0.05), 而ROM的检出率和检出水平均低于枯水期, SMX的检出水平在丰、枯水期无明显变化.丰水期OFL在水系上游南河水系的检出水平高于枯水期, 丰水期ROM在水系上游南河水系和水系下游入湖河口的检出水平显著低于枯水期(p < 0.05).
3.2 宜溧-洮滆水系沉积相中典型抗生素时空分布特征宜溧-洮滆水系丰枯水期所有点位沉积相中均有抗生素检出, 4种抗生素的检出水平均在ng·g-1量级(表 4和图 2).流域典型抗生素浓度呈显著的时空差异性:各抗生素的检出水平呈现枯水期显著低于丰水期(p < 0.05);枯水期水系上游抗生素的检出水平高于水系下游, 且长江客水区抗生素的检出水平普遍高于山区来水区;丰水期山区来水区及其下游入湖河口抗生素的检出水平显著高于长江客水区, 此外, 丰水期和枯水期沉积相中抗生素浓度沿迁移方向逐渐降低, 而水系下游入湖河口抗生素出现富集现象.
枯水期4种抗生素的平均检出率为72%±26%, OTC和ROM的检出率高于OFL和SMX.流域4种抗生素检出总浓度最高为9.81 ng·g-1, 且4种抗生素中OTC是枯水期沉积相检出浓度最高的抗生素(9.48 ng·g-1), 均位于水系中游扁担河BD位点(常州钟楼区), 其余抗生素枯水期检出水平较低.丰水期4种抗生素的平均检出率为92%±8%, OTC和OFL的检出率高于ROM和SMX.丰水期4种抗生素检出总浓度最高为48.29 ng·g-1, 且4种抗生素中SMX的检出浓度最高(46.74 ng·g-1), 均位于水系上游南河水系N5位点(溧阳).丰水期SMX主要在水系上游南河水系被检出, 显著高于其他位点浓度(p < 0.05).SMX的浓度在水系上游山区来水区丹金溧漕河沿迁移方向逐渐增加, 而在南河水系逐渐降低.丰水期OTC的平均检出水平是枯水期的5.7倍, 流域中、下游浓度增加幅度较大.与其他抗生素相比, 丰水期ROM、OFL检出水平相对较低, 且与枯水期相比检出水平无显著差异(p>0.05).
3.3 生态风险评价与健康风险评价基于最坏情况考虑, 如表 2所示, 筛选敏感物种对抗生素的急性和慢性毒理数据获取PNEC值, 选择环境中实测抗生素浓度计算宜溧-洮滆水系4种抗生素RQs值.由图 3可知, 所有点位的RQs均小于0.1, 处于低风险及以下状态, 丰水期的风险显著高于枯水期(p<0.05), 并且丰枯水期OTC的生态风险均为4种抗生素之首.健康风险评价结果如图 4所示, 结果表明, 水相中4种抗生素经饮用和鱼类食用等过程导致的健康风险从10-5~10-10数量级不等, 均低于0.01, 属于可接受风险.
 |
| 图 3 宜溧-洮滆水系生态风险商值(RQs)图 Fig. 3 Risk quotients (RQs) for the four antibiotics detected in the river networks |
 |
| 图 4 宜溧-洮滆水系健康风险商值(HQs)图 Fig. 4 Health risk quotients (HQs) for the four antibiotics detected in the river networks |
宜溧-洮滆水系沉积相中抗生素的检出率和检出水平均大于水相, 这是因为沉积相的理化性质对抗生素在两相间的分布影响更大(Zhou et al., 2011), 抗生素在水体流动过程中与沉积相发生多种反应过程(Kummerer, 2009), 且易通过分子作用力吸附在沉积物上(郭晓等, 2015).河道中频繁的航运扰动导致沉积物悬浮与沉降过程反复交替发生, 进而加快污染物的吸附解吸过程(张波等, 2012);此外, 受降雨稀释、光解、微生物降解、水解等因素影响(Yao et al., 2015), 导致沉积相中抗生素浓度沿水流方向逐渐降低.最终, 湖水的顶托作用使水系下游入湖河口淤积大量沉积物, 沉积物对抗生素的吸附作用使入湖河口沉积相中抗生素的浓度大幅累积形成污染源(Tamtam et al., 2008).SMX在沉积相中的检出水平远高于水相, 这是因为SMX更倾向于被沉积相吸附(Baker et al., 1997), 这可以从其较高的logKow值看出.Xu等(2014)研究发现, 太湖湖区沉积物、表层水和孔隙水中磺胺类、喹诺酮类、大环内酯类、四环素类、甲氧苄啶共15种抗生素的总浓度分别为4.1~731 μg·kg-1、127~1210 ng·L-1和1.5~216 ng·L-1, 远高于宜溧-洮滆水系抗生素的检出水平.宜溧-洮滆水系和太湖湖区的差异主要有以下两方面原因:一方面, 含沙量高和流量大的河道中抗生素浓度相对偏低(Zhou et al., 2011), 宜溧-洮滆水系沉积相中泥沙粒径大, 不易吸附抗生素, 并且入湖河道流量大(燕姝雯等, 2011), 冲刷作用强, 造成研究水系沉积相中抗生素的检出水平偏低;另一方面, 太湖湖区浮游植物的分解增加了湖区沉积物的有机质含量(张运林等, 2007), 且太湖水力停留时间长达半年, 吸附作用使抗生素大量富集在湖区沉积相中.此外, 太湖湖区渔业养殖中药物的直接投放也是导致湖区抗生素检出水平远高于上游水系的原因.
4.2 宜溧-洮滆水系4种典型抗生素来源宜溧-洮滆水系所处区域气候温和湿润, 人口密集养殖业发达, 抗生素在疾病治疗、预防和畜牧养殖上的使用频次和使用量相对较大(Liu et al., 2013), 人类活动、农业粪肥施用和水产养殖是造成OTC、ROM、OFL和SMX检出率较高的原因(Xu et al., 2014;Yi et al., 2017).此外, 大量居民沿河而居, 生活污水直排, 并且传统的水处理工艺并不能对所有抗生素都具有较好去除效果(Schröder et al., 2012;Le-Minh et al., 2010), 致使未经代谢而排出的抗生素和遗弃的药物经由城乡生活污水进入水体中(Ruhoy et al., 2007).据江苏省环境保护厅污染源调查数据可知, 水系上游长江客水区(镇江和常州)的医院和污水处理厂较多, 而水系上游南河水系的渔业养殖厂较多(江苏省环境保护厅, 2017), 抗生素在宜溧-洮滆水系地区的用途和用量是导致抗生素时空差异性的主要原因(Milic′ et al., 2013).宜溧-洮滆水系OTC的浓度比例及检出率最高, 且丰水期OTC浓度大于枯水期.四环素类抗生素属于广谱抗生素且价格低廉, 尤其是在我国南方被大量用于养殖业(郭欣妍等, 2014), 抗生素尤其是OTC在渔业养殖上仍存在一定的市场.丰水期(2017年7月)的降雨量和水相中OTC浓度分别是枯水期(2017年2月)的2.6倍(水利部太湖流域管理局, 2018)和26.3倍(本研究), 这表明丰水期OTC污染负荷的输入强度大于降雨稀释作用.据实地调查, 水系上游南河水系河网密布、水资源丰富, 枯水期渔业苗种未投入养殖, 进入春季后塘内消毒、渔业养殖等活动逐步展开, 以螃蟹、青虾、鱼为主的渔业养殖在丰水期(6—10月)大力发展, 抗生素的使用剂量和频次大大增加.虾塘和蟹塘在培育水草期间会将塘内淤泥取出晾干, 本次丰水期采样2天前(2017年7月17日)流域出现降雨事件, 降雨级别为大雨, 降雨事件对搁置在河岸的养殖塘泥冲刷严重, 含有抗生素的淤泥随降雨形成的地表径流被冲刷入河, 这可能是导致丰水期OTC污染负荷的输入强度大于降雨稀释作用的主要原因.水系抗生素含量在上游长江客水区与南河水系之间的季节性差异, 以及抗生素检出种类与检出水平的显著性差异证明水产养殖是宜溧-洮滆水系典型抗生素的主要负荷来源.Yan等(2014)研究发现, 江汉平原2014年4月抗生素的检出浓度比2013年12月高, 该结果显示, 与人类季节性活动有关的消费模式和环境条件可能会导致枯水期河水中抗生素浓度显著低于丰水期, 与本研究结果类似.此外, 南河水系与丹金溧漕河交汇处(溧阳)现有7家制药厂, 制药厂废水中含有高浓度的抗生素(Lin et al., 2016), 致使河流中抗生素浓度表现为丰水期比枯水期显著增加.
4.3 宜溧-洮滆水系4种典型抗生素健康与生态风险宜溧-洮滆水系中4种抗生素在枯水期和丰水期的健康风险均属于可接受风险范围, 且生态风险均处于低风险及以下状态, 但4种抗生素的联合毒性风险尤其是丰水期的联合毒性风险显著增加, 生态风险最高的抗生素是OTC.虽然残留在水相的抗生素浓度较低, 但它们的“假持久性”可能会对水生动植物产生一定的急性或慢性毒性效应, 导致水生生物产生抗性基因, 破坏原有生态系统的稳定性(WHO, 2014).与此同时, 沉积相对抗生素的吸附作用增加了沉积相中抗生素的浓度, 抗生素的生物活性依旧能够对底栖生物造成危害, 致使底栖生物抗性基因的比例增加(Mckinney et al., 2010), 而以捕食底栖生物为生的鱼类也会面临耐药性的问题, 长期食用具有耐药性的鱼对人类健康可能具有潜在威胁(Harrison et al., 2013).动物性食品对人类的健康风险评价日益受到相关学者的重视, 世界各国也均有关于各类抗生素残留的最高限量标准, 例如, 美国、欧盟和中国规定水产品中磺胺类抗生素的最高残留限量为100 μg·kg-1(农业部, 2003).综上所述, 虽然当前宜溧-洮滆水系抗生素风险较低, 但仍应该引起注意并加以防范, 避免渔业养殖活动中抗生素滥用, 进而降低生态风险和健康风险.
5 结论(Conclusions)1) 宜溧-洮滆水系中OTC、ROM、OFL、SMX在水相中的检出率分别为96.5%、57.0%、60.5%和4.5%, 沉积相中的检出率分别为96.5%、95.5%、90.0%和44.5%;OTC是水相中检出浓度最高的抗生素(17.85 ng·L-1), SMX是沉积相中检出浓度最高的抗生素(46.74 ng·g-1), 流域OTC的浓度比例及检出率最高;人类活动、禽类粪肥施用和水产养殖是造成4种典型抗生素检出率较高的原因.但对比以前在太湖湖区的研究结果发现, 宜溧-洮滆水系抗生素浓度总体上处于较低水平.
2) 宜溧-洮滆水系上游的南河丰水期抗生素的检出水平和检出率均大于枯水期, 存在显著的时间差异性;枯水期南河抗生素检出水平低于长江客水区, 而丰水期则相反, 存在显著的空间差异性.沉积相中抗生素浓度在河网水系沿迁移方向逐渐降低, 入湖河口(M1~M13)由于湖水顶托作用出现抗生素累积的现象.
3) 宜溧-洮滆水系4种抗生素健康风险评价结果表明, 4种抗生素均处于可接受风险水平(HQs < 0.01);生态风险评价结果表明, 4种抗生素均呈现低风险(RQs < 0.1), 其中, 生态风险最高的抗生素是OTC.为控制抗生素生态风险, 应对南河水系水产养殖业加强监管, 此外,入湖河口的抗生素富集现象也应引起关注.
Baker J R, Mihelcic J R, Luehrs D C, et al. 1997. Evaluation of estimation methods for organic carbon normalized sorption coefficients[J]. Water Environment Research, 69(2): 136–145.
DOI:10.2175/106143097X125281
|
陈永山, 章海波, 骆永明, 等. 2011. 苕溪流域典型断面底泥14种抗生素污染特征[J]. 环境科学, 2011, 32(3): 667–672.
|
USEPA.2000.Methodology for Deriving Ambient Water Quality Criteria for the Protection of Human Health[S].Office of Water U.S.Environmental Protection Agency
|
European Commission.2003.Technical guidance document in support of commission directive 93/67/EEC on risk assessment for new notified substances and commission regulation (EC)No1488/94 on risk assessment for existing substance[S].Luxembourg: Office for Official Publications of the European Communities
|
郭晓, 李国良, 刘孝利, 等. 2015. 梅江流域沉积物中四环素类抗生素的空间分布特征及其迁移转化规律[J]. 环境科学学报, 2015, 35(10): 3202–3209.
|
郭欣妍, 王娜, 许静, 等. 2014. 兽药抗生素的环境暴露水平及其环境归趋研究进展[J]. 环境科学与技术, 2014(9): 76–86.
|
Harrison E M, Paterson G K, Holden M T G, et al. 2013. Whole genome sequencing identifies zoonotic transmission of MRSA isolates with the novel mecA homologue mecC[J]. Embo Molecular Medicine, 5(4): 509–515.
DOI:10.1002/emmm.201202413
|
江苏省环境保护厅.2017.江苏省环境保护网[OL].2017-02-01. http://hbt.jiangsu.gov.cn
|
江苏水利厅.2003.江苏省地表水(环境)功能区划(苏政复(2003)29号)[OL].2008-10-01. http://jssslt.jiangsu.gov.cn/art/2008/10/29/art_42164_3548181.html
|
Jiang Y, Li M, Guo C, et al. 2014. Distribution and ecological risk of antibiotics in a typical effluent-receiving river (Wangyang River) in north China[J]. Chemosphere, 112: 267–274.
DOI:10.1016/j.chemosphere.2014.04.075
|
Joy S R, Bartelthunt S L, Snow D D, et al. 2013. Fate and transport of antimicrobials and antimicrobial resistance genes in soil and runoff following land application of swine manure slurry[J]. Environmental Science & Technology, 47(21): 12081–12088.
|
Khetan S K, Collins T J. 2007. Human pharmaceuticals in the aquatic environment:A challenge to green chemistry[J]. Chemical Reviews, 107(6): 2319–2364.
DOI:10.1021/cr020441w
|
Kummerer K. 2009. Antibiotics in the aquatic environment-a review-part I[J]. Chemosphere, 75(4): 417–434.
DOI:10.1016/j.chemosphere.2008.11.086
|
Le-Minh N, Khan S J, Drewes J E, et al. 2010. Fate of antibiotics during municipal water recycling treatment processes[J]. Water Research, 44(15): 4295–4323.
DOI:10.1016/j.watres.2010.06.020
|
Leung H W, Minh T B, Murphy M B, et al. 2012. Distribution, fate and risk assessment of antibiotics in sewage treatment plants in Hong Kong, South China[J]. Environment International, 42(1): 1–9.
|
Lin H, Dyar O J, Rosales-Klintz S, et al. 2016. Trends and patterns of antibiotic consumption in Shanghai municipality, China:a 6 year surveillance with sales records, 2009-14[J]. Journal of Antimicrobial Chemotherapy, 71(6): 1723–1729.
DOI:10.1093/jac/dkw013
|
Lin T, Yu S, Chen W. 2016. Occurrence, removal and risk assessment of pharmaceutical and personal care products (PPCPs) in an advanced drinking water treatment plant (ADWTP) around Taihu Lake in China[J]. Chemosphere, 152: 1–9.
DOI:10.1016/j.chemosphere.2016.02.109
|
Liu J L, Wong M H. 2013. Pharmaceuticals and personal care products (PPCPs):a review on environmental contamination in China[J]. Environment International, 59(3): 208–224.
|
Liu L, Zhu Y, Liang T, et al. 2013. Impacts of climate changes, soil nutrients, variety types and management practices on rice yield in East China:A case study in the Taihu region[J]. Field Crops Research, 149(2): 40–48.
|
Mckinney C W, Loftin K A, Meyer M T, et al. 2010. tet and sul antibiotic resistance genes in livestock lagoons of various operation type, configuration, and antibiotic occurrence[J]. Environmental Science & Technology, 44(16): 6102–6109.
|
Milic' N, Milanovic' M, Letic' N G, et al. 2013. Occurrence of antibiotics as emerging contaminant substances in aquatic environment[J]. International Journal of Environmental Health Research, 23(4): 296–310.
DOI:10.1080/09603123.2012.733934
|
农业部. 2003. 农业部发布动物性食品中兽药最高残留限量[J]. 中国兽药杂志, 2003, 25(2): 7–9.
|
Peng X, Ou W, Wang C, et al. 2014. Occurrence and ecological potential of pharmaceuticals and personal care products in groundwater and reservoirs in the vicinity of municipal landfills in China[J]. Science of the Total Environment, 490: 889–898.
DOI:10.1016/j.scitotenv.2014.05.068
|
Quinn B, Gagné F, Blaise C. 2008. An investigation into the acute and chronic toxicity of eleven pharmaceuticals (and their solvents) found in wastewater effluent on the cnidarian, Hydra attenuata[J]. Science of the Total Environment, 389(2/3): 306–314.
|
Ruhoy I S, Daughton C G. 2007. Types and quantities of leftover drugs entering the environment via disposal to sewage——revealed by coroner records[J]. Science of the Total Environment, 388(1/3): 137–148.
|
Schröder H F, Tambosi J L, Sena R F, et al. 2012. The removal and degradation of pharmaceutical compounds during membrane bioreactor treatment[J]. Water Science & Technology, 65(5): 833–839.
|
Schwab B W, Hayes E P, Fiori J M, et al. 2005. Human pharmaceuticals in US surface waters:a human health risk assessment[J]. Regul Toxicol Pharmacol, 42(3): 296–312.
DOI:10.1016/j.yrtph.2005.05.005
|
Shenker M, Harush D, Ben-Ari J, et al. 2011. Uptake of carbamazepine by cucumber plants - A case study related to irrigation with reclaimed wastewater[J]. Chemosphere, 82(6): 905–910.
DOI:10.1016/j.chemosphere.2010.10.052
|
水利部太湖流域管理局.2017.太湖网[OL].2017-09-01. http://www.tba.gov.cn/
|
Tamtam F, Mercier F, Bot B L, et al. 2008. Occurrence and fate of antibiotics in the Seine River in various hydrological conditions[J]. Science of the Total Environment, 393(1): 84–95.
DOI:10.1016/j.scitotenv.2007.12.009
|
Verlicchi P, Al A M, Galletti A, et al. 2012. Hospital effluent:investigation of the concentrations and distribution of pharmaceuticals and environmental risk assessment[J]. Science of The Total Environment, 430(2): 109–118.
|
Wang J, Pu H, Ye L, et al. 2016. Occurrence of antibiotic resistance genes and integronases genes in Taihu Lake[J]. Applied Environmental Biotechnology.
DOI:10.18063/AEB.2016.01.006
|
World Health Organization, International Programme on Chemical Safety, Toxicological Evaluation of Certain Veterinary Drug Residues in Food.2000.WHO Food Additive Series: 43.Estradiol- 17β, Progesterone, and Testosterone[R].Geneva: Toxicological Evaluation of Certain Veterinary Drug Residues in Food
|
World Health Organization. 2014. Antimicrobial resistance:global report on surveillance[J]. Australasian Medical Journal, 7(4): 237.
|
武旭跃, 邹华, 朱荣, 等. 2016. 太湖贡湖湾水域抗生素污染特征分析与生态风险评价[J]. 环境科学, 2016, 37(12): 4596–4604.
|
Xu J, Xu Y, Wang H, et al. 2015. Occurrence of antibiotics and antibiotic resistance genes in a sewage treatment plant and its effluent-receiving river[J]. Chemosphere, 119: 1379–1385.
DOI:10.1016/j.chemosphere.2014.02.040
|
Xu J, Zhang Y, Zhou C, et al. 2014. Distribution, sources and composition of antibiotics in sediment, overlying water and pore water from Taihu Lake, China[J]. Science of the Total Environment, 497-498: 267–273.
DOI:10.1016/j.scitotenv.2014.07.114
|
Yi Q, Chen Q, Hu L, et al. 2017. Tracking nitrogen sources, transformation, and transport at a basin scale with complex plain river networks[J]. Environmental Science and Technology, 51(10): 5396–5403.
DOI:10.1021/acs.est.6b06278
|
燕姝雯, 余辉, 张璐璐, 等. 2011. 2009年环太湖入出湖河流水量及污染负荷通量[J]. 湖泊科学, 2011, 23(6): 855–862.
|
Yan Z, Yang X, Lu G, et al. 2014. Potential environmental implications of emerging organic contaminants in Taihu Lake, China:comparison of two ecotoxicological assessment approaches[J]. Science of the Total Environment, 470-471: 171–179.
DOI:10.1016/j.scitotenv.2013.09.092
|
Yao L, Wang Y, Tong L, et al. 2015. Seasonal variation of antibiotics concentration in the aquatic environment:a case study at Jianghan Plain, central China[J]. Science of the Total Environment, 527-528: 56–64.
DOI:10.1016/j.scitotenv.2015.04.091
|
张波, 杜应旸, 陈宇炜, 等. 2012. 太湖流域典型河流沉积物的反硝化作用[J]. 环境科学学报, 2012, 32(8): 1866–1873.
|
Zhang Q Q, Ying G G, Pan C G, et al. 2015. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science and Technology, 49(11): 6772–6782.
DOI:10.1021/acs.est.5b00729
|
Zhang Y, Zhang C, Parker D B, et al. 2013. Occurrence of antimicrobials and antimicrobial resistance genes in beef cattle storage ponds and swine treatment lagoons[J]. Science of theTotal Environmental, 463-464: 631–638.
DOI:10.1016/j.scitotenv.2013.06.016
|
张运林, 秦伯强. 2007. 梅梁湾、大太湖夏季和冬季CDOM特征及可能来源分析[J]. 水科学进展, 2007, 18(3): 415–423.
DOI:10.3321/j.issn:1001-6791.2007.03.018 |
Zhou L J, Ying G G, Zhao J L, et al. 2011. Trends in the occurrence of human and veterinary antibiotics in the sediments of the Yellow River, Hai River and Liao River in northern China[J]. Environmental Pollution, 159(7): 1877–1885.
DOI:10.1016/j.envpol.2011.03.034
|
Zhu Y G, Johnson T A, Su J Q, et al. 2013. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proc Natl Acad Sci USA, 110(9): 3435–3440.
DOI:10.1073/pnas.1222743110
|
 2018, Vol. 38
2018, Vol. 38


