2. 浙江农林大学环境与资源学院, 杭州 311300;
3. 佛山科学技术学院环境与化学工程学院, 佛山 528000
2. College of Environmental and Resource Sciences, Zhejiang A & F University, Hangzhou 311300;
3. School of Environment and Chemical Engineering, Foshan University, Foshan 528000
多氯联苯(Polychlorinated Biphenyls, PCBs)是一种典型的持久性有机污染物(Persistent Organic Pollutants, POPs), 具有高度的化学稳定性、热稳定性、抗氧化性及高疏水性.由于PCBs的高度持久性、生物累积性及潜在致癌性, 已被列入优先控制环境污染物, 因而也受到人们越来越多的关注(Passatore et al., 2014).进入环境中的PCBs由于受到多种环境因素的影响, 在不同的介质间中会发生一系列的迁移转化过程, 而土壤是其在环境中的重要归宿(储少岗等, 1995).积累在土壤中的PCBs可通过生物链的富集作用, 浓缩放大后进入食物链, 对人体健康产生重大影响(WHO, 1987).因此, 修复PCBs污染土壤已经成为亟需解决的环境问题.
丛枝菌根(Arbuscular mycorrhizal, AM)真菌是自然界中广泛存在的一类植物共生真菌, 已被广泛应用于有机污染土壤, 如PCBs、多环芳烃(Polycyclic Aromatic Hydrocarbons, PAHs)、农药、石油等污染土壤的生物修复(李秋玲等, 2008;滕应等, 2008;卓胜等, 2011).目前的研究表明, AM真菌主要是通过促进植物生长及菌丝分泌物等来影响土壤微生物活性, 从而达到降解有机污染物的目的.秦华等(2015)在对美国南瓜(Cucurbita pepo L.)接种不同AM真菌后发现, AM真菌在提高根系生物量、促进微生物生长的同时, 也提高了PCBs的降解率, 且根际土壤中的降解率显著高于非根际土壤.生物质炭(Biochar)近年来已经成为环境修复领域的热门材料, 研究发现, 生物炭具有极强的吸附能力, 可以固定土壤中的有机污染物, 降低其生物有效性(罗力等, 2017; Zhang et al., 2013; Zhang et al., 2016).同时, 生物质炭还能改变土壤微生物群落及其活性, 从而影响土壤有机污染物的降解(樊诗亮等, 2016; Song et al., 2017).近年来, 动物源生物质炭也已经被用于土壤改良和环境修复.郭茜等(2017)发现与竹炭相比, 死猪炭在改善土壤pH值、提高作物产量方面具有更好的效果, 且将病死猪作为原材料经高温热解制备成病死猪炭, 不仅可以有效解决病死猪处理难的问题, 也可为生物质炭原材料的选择提供一个新的来源.
目前, 关于AM真菌及植物源生物炭修复有机污染土壤的研究已经大量开展, 然而AM真菌与动物源生物质炭对PCBs污染土壤的修复效果如何, 是否具有协同作用还不清楚.因此, 本研究拟以长三角地区某典型电子废弃物拆解区PCBs污染农田土壤为对象, 研究AM真菌和猪炭对PCBs污染土壤的联合修复效应, 并试图揭示其微生物机理, 以期为开发PCBs污染土壤的综合修复技术体系提供理论依据.
2 材料与方法(Materials and methods) 2.1 供试材料供试土壤采自浙江省台州市某电子废弃物拆解场地.表层土壤(0~20 cm)采集后去除碎石等杂物, 自然风干后加入无污染的农田土壤充分混合备用.混合后土壤的基本理化性质为:pH=8.17, 有机碳15.34 g·kg-1, 有效磷16.84 mg·kg-1, 速效钾112.19 mg·kg-1, 土壤PCBs 181.14 mg·kg-1, 属严重污染(Tang et al., 2010).
供试玉米(Zea mays L.)为京科糯2000, 购自当地农资公司.供试丛枝菌根真菌菌种为摩西管柄囊霉(Funneliformis mosseae) M47V, 从中国科学院南京土壤研究所获得.以黑麦草为宿主植物在灭菌河砂中繁殖4个月后, 去除黑麦草地上部分, 将根剪碎, 制成菌丝体、真菌孢子、侵染根段的混合接种物.扩繁菌剂的同时, 种植不接种AM真菌的黑麦草, 最终收获后制备不含AM真菌, 但其他均同于AM真菌菌剂的对照菌剂.
供试猪炭是利用热解装置将病死整猪在650 ℃缺氧条件下热解制成后磨碎成细小颗粒, 利用0.25 mm不锈钢筛将猪炭分为>0.25 mm和< 0.25mm粒径颗粒.猪炭的基本理化性质为:pH=10.1, C 19.8%, N 1.5%, H 0.6%, 灰分74.8%, 电导率5.1 dS·m-1.
2.2 试验设计本试验在浙江农林大学日光温室中进行, 设计接种或不接种AM真菌, 以及添加>0.25 mm或 < 0.25 mm粒径猪炭两个因子, 共设置6个处理, 即不接种AM真菌条件下:CK(接种对照菌剂和不加猪炭的对照)、< 0.25(接种对照菌剂同时添加 < 0.25 mm猪炭)、>0.25(接种对照菌剂同时添加>0.25 mm猪炭), 以及接种AM真菌条件下:AM(只接种AM真菌)、AM+ < 0.25(接种AM真菌同时添加 < 0.25 mm猪炭)、AM+>0.25(接种AM真菌同时添加>0.25 mm猪炭), 每个处理3个重复.试验采用容量2.5 L的塑料盆钵, 每盆装风干土1300 g, 风干菌剂每盆149 g(10%), 猪炭每盆37.1 g(2.5%), 与土壤混合后装入盆钵, 加水至土壤含水量为田间最大持水量的60%.玉米在育苗盘出苗后, 选择长势相近的3颗玉米幼苗移栽到盆钵中.盆栽试验从移栽开始计算, 自2017年3—6月, 生长时长为90 d, 生长期间平均日照时间为13 h·d-1, 平均温度为22 ℃, 平均湿度为61%.盆栽试验过程中, 常规管理, 保持土壤含水量为田间最大持水量的60%左右, 在浇水过程中避免产生渗流水, 以免影响土壤PCBs总量.培养期结束后, 收获植物并进行土壤取样, 用于后续玉米生物量、土壤PCBs含量及微生物分析.
2.3 样品的采集与测定方法 2.3.1 植物生物量与AM真菌侵染率试验结束后, 将玉米按照地上部和地下部分别收获.玉米根系收获后用去离子水冲洗干净, 取少量新鲜细根, 采用醋酸墨水染色法(杨亚宁等, 2010)测定AM真菌侵染率.剩余植物样品在70 ℃下烘干至恒重, 分别称重.
2.3.2 PCBs含量测定土壤PCBs含量测定参照Qin等(2013)的方法.称取3 g过100目筛的风干土壤, 加入30 mL正己烷/丙酮溶液(V:V=1:1)超声提取30 min (100 kHz, 25 ℃)后离心, 收集上清液.重复3次超声提取, 合并上清后于旋转蒸发仪上浓缩.浓缩液采用Florisil柱进行纯化, 15 mL色谱纯正己烷洗脱后, N2吹干, 1 mL正己烷溶解以备测定.PCBs同系物及其浓度采用气相色谱-质谱(N6890/5975B, Agilent, USA)测定.色谱柱为HP5-MS毛细管柱(30 m×250 μm×0.25 μm), 载气为氦气, 流速为1.0 mL·min-1, 进样口温度为300 ℃, 升温程序:80 ℃保持0.8 min, 以25 ℃·min-1的速率升至140 ℃, 保持1 min, 以10 ℃·min-1的速率升至260 ℃, 保持10 min.离子源温度设置为150 ℃;溶剂延迟2 min;选择全离子扫描模式, 扫描范围(m/z)为50 ~ 450, 调谐方式为自动调谐.
质量控制通过每隔9个样品采用相同方法测定标准对照(土壤样品中加入已知浓度的PCBs单体, IUPAC nos. 31、44及118)和空白对照(无水硫酸钠)实现.分析结果表明, 所有标准对照中, PCBs单体的提取率为(83.09%±5.32%)~(91.95%±3.45%), 所有空白对照中的PCBs单体含量均在检测限(0.01 μg·g-1)内.所有样品十氯联苯内标的平均提取率为82.9%, 且测定重复样品之间的相对标准差小于19%.
2.3.3 土壤微生物分析土壤总DNA采用PowerSoil® DNA Isolation Kit试剂盒提取, 称取0.5 g冻干土壤, 参照试剂盒使用说明提取DNA.土壤细菌16S rDNA基因丰度采用实时荧光定量PCR技术(Real-Time Quantitative PCR)测定.实时荧光定量PCR(qPCR)在CFX96TM Real-Time System(Bio-Rad, USA)仪器上进行, 反应体系20 μL, 其中, 土壤总DNA 1 μL, 50 μmol·L-1上游和下游引物各0.2 μL, 2×SYBR Premix Ex TaqTM 10 μL, 灭菌水8.6 μL, 每个样品3次重复.荧光定量PCR标准曲线采用已知浓度的16S rDNA基因质粒进行梯度稀释, 不同处理荧光定量PCR获得的基因拷贝数对数转换后进行比较.
利用Illumina Miseq平台对土壤DNA进行高通量测序研究细菌群落结构, 采用带barcode的519F和907R引物对扩增长度约400 bp的16S rDNA片段(Biddle et al., 2008), 采用TruSeqTM DNA Sample Prep LT Kit制备样品, 根据试剂盒操作说明采用MiSeq Reagent Kit进行高通量测序.测序结果采用Quantitative Insights Into Microbial Ecology (QIIME) 1.4.0 -dev pipeline(http://www.qiime.org)处理(Caporaso et al., 2010).首先, 对获得的序列进行质控(质量分>25, 序列长度>200 bp), 根据5 bp的barcode将所有序列分配到相应样品;其次, 对序列进行去噪处理(Reeder et al., 2010), 以97%为阈值筛分OTU.选择每个OTU中丰度最高的序列作为该OTU的代表序列, 根据Silva 104数据库(http://www.arb-silva.de/download/archive/qiime/)对OTU进行分类.采用PyNAST比对各OTU的代表序列, 并用QIIME去除二聚体序列.通过FastTree2构建系统发育树(Price et al., 2010).
2.4 数据处理数据采用Excel 2010处理, Origion 8.5作图, 利用SPSS18.0软件进行统计分析, 采用Duncan单因素方差分析进行处理间差异显著性检验(p < 0.05), 采用一般线性模型中单变量分析方法比较各处理在施炭与接种AM真菌双因子影响下土壤理化性质、植物生物量、细菌丰度及土壤中PCBs含量之间差异显著性.采用多元逐步回归分析的方法对土壤细菌种群丰度与PCBs含量进行回归分析.
3 结果与分析(Results and analysis) 3.1 土壤养分、AM真菌侵染率及植物生物量植株收获后, 土壤理化性质见表 1.单因素方差分析结果表明, 各处理中碱解氮含量无显著差异(p>0.05).与不接种AM真菌的对照相比, 接种AM真菌对土壤有效磷、速效钾、有机质含量及pH值的影响并不显著.无论是否接种AM真菌, 添加猪炭均显著提高了土壤有效磷、速效钾含量(p < 0.05), 但添加>0.25 mm粒径猪炭对土壤有机碳含量的影响不显著.未接种AM真菌条件下, 猪炭显著提高了土壤pH值(p < 0.05), 而在接种AM真菌条件下, 仅添加 < 0.25 mm粒径猪炭(AM+ < 0.25)处理显著提高了土壤pH值.一般线性模型单变量分析结果表明, 尽管AM真菌及猪炭粒径均显著影响土壤有效磷含量(p < 0.05), 但对于土壤有效磷含量的协同效应并不显著.猪炭粒径对土壤速效钾含量增加影响显著(p < 0.05), 但接种AM真菌对土壤速效钾含量没有显著影响.接种AM真菌降低了土壤有机碳含量及pH值, 而添加猪炭显著提高了土壤有机碳含量和pH值, 其中, AM真菌和猪炭对降低土壤pH值具有显著的协同效应(p < 0.05).一般线性模型结果表明, AM真菌能够提高土壤中有效磷含量, 降低土壤有机碳含量和pH值, 而猪炭对土壤中有效磷、速效钾、有机碳和pH值的提高均有显著的促进作用, 但不同粒径猪炭的促进效果没有显著差异.
| 表 1 土壤pH及养分含量 Table 1 Soil pH and properties in different treatments |
玉米根系AM真菌侵染率和植物收获后地上部、地下部及总生物量见表 2.接种AM真菌后, 根系AM真菌侵染率、植物生物量(地上部、地下部和总生物量)均显著高于不接种处理(p < 0.05).在接种情况下, 与不施炭处理相比, 添加猪炭显著提高了根系AM真菌侵染率(p < 0.05), 但也降低了植物生物量(p < 0.05), 其中, AM+ < 0.25处理显著降低了植物总生物量(p < 0.05).而在不接种情况下, 添加猪炭的处理与对照相比AM真菌侵染率与植物生物量均无显著差异(p>0.05).一般线性模型分析结果表明, 接种AM真菌能够显著提高植物根系AM真菌侵染率、植物生物量, 而猪炭的添加对植物生长有明显的抑制作用, 且接种AM真菌与添加猪炭具有显著的协同效应(表 2).
| 表 2 AM真菌侵染率和植物生物量 Table 2 AM fungal colonization rate and plant biomass |
接种AM真菌及添加猪炭对土壤PCBs降解具有一定的促进作用, 但除AM+>0.25处理外, 其它处理土壤中三氯联苯、四氯联苯及总PCBs含量与无AM真菌及猪炭的对照(CK)相比均无显著差异(p>0.05, 图 1).与CK相比, 大粒径猪炭添加处理(>0.25、AM+>0.25)下二氯联苯降解率显著提高(p < 0.05);单独添加两种粒径猪炭能显著降低土壤五氯联苯含量.与单独接种AM真菌的处理(AM)相比, AM+>0.25处理土壤五氯联苯含量显著降低.一般线性模型分析结果表明, 接种AM真菌及添加猪炭均能显著提高五氯联苯的降解率(p < 0.05), 但没有表现出显著的协同效应(表 3).总体而言, 与CK相比较, 接种AM真菌的同时添加大粒径生物质炭(AM+>0.25)有利于促进二氯、三氯、四氯联苯及总PCBs的降解率.
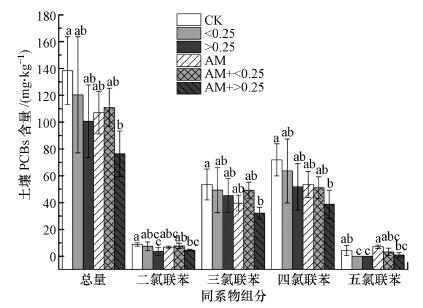 |
| 图 1 土壤PCBs同系物组分含量 (误差线表示标准偏差, 不同字母表示差异达到5%显著水平, 下同) Fig. 1 Concentrations of PCBs homologue groups in soils under different treatments |
| 表 3 多氯联苯降解率的一般线性模型分析 Table 3 General linear model analysis of PCBs degradation rate |
土壤细菌16S rDNA基因丰度测定结果(图 2)表明, 接种AM真菌有利于提高土壤中16S rDNA基因丰度, 其中, AM+ < 0.25处理细菌丰度显著高于不接种的对照(p < 0.05).同时, 施加不同粒径猪炭的各处理间也存在显著差异(p < 0.05), 具体表现为无论接种与否, 添加小粒径猪炭处理的土壤16S rDNA基因丰度显著高于添加大粒径猪炭处理.接种AM真菌及添加猪炭对土壤细菌16S rDNA基因丰度具有显著的促进作用, 但两者之间没有表现出协同作用.高通量测序结果分析发现, Acidobacteria、Actinobacteria、Alphaproteobacteria、Betaproteobacteria和Gammaproteobacteria为优势菌群, 且在不同处理下存在显著差异, 具体表现为接种AM真菌后Acidobacteria相对丰度显著提高(p < 0.05), Alphaproteobacteria、Betaproteobacteria和Gammaproteobacteria相对丰度显著降低(p < 0.05), 而Actinobacteria相对丰度无显著差异(图 3).同时, 与不加猪炭的处理(CK、AM)相比, 添加大粒径猪炭显著降低了Acidobacteria在土壤中的相对丰度(p < 0.05).无论接种及施炭与否, 各处理间Actinobacteria相对丰度均无显著差异.接种AM真菌与施炭对Chloroflexi细菌相对丰度的提高有一定协同作用.除此之外, 接种AM也显著提高了Planctomycetes、Gemmatimonadetes、Deltaproteobacteria在土壤中的相对丰度(p < 0.05), 同时显著降低了Firmicutes在土壤中的相对丰度(p < 0.05), 而猪炭的添加对这些细菌种群的相对丰度均无显著性影响.Bacteroidetes纲在接种AM真菌后相对丰度有所提高, 但并未达到0.05显著水平, 而小粒径猪炭的添加显著提高了Bacteroidetes纲的相对丰度(p < 0.05).逐步回归分析结果表明, Planctomycetes相对丰度与土壤三氯联苯降解显著相关(p < 0.05), 而Acidobacteria相对丰度与五氯联苯降解显著相关(p < 0.01, 表 4).
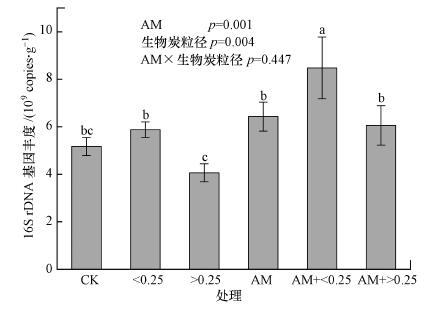 |
| 图 2 土壤16S rDNA基因丰度 Fig. 2 Soil 16S rDNA gene abundance under different treatments |
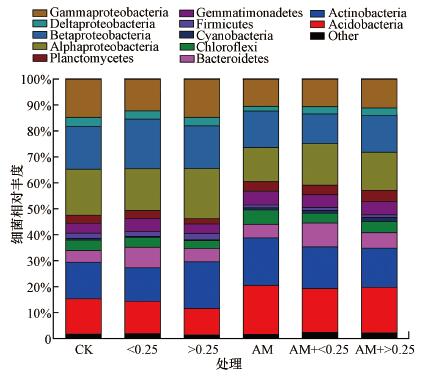 |
| 图 3 不同处理中细菌种群的相对丰度 Fig. 3 Relative abundance of the dominant bacterial classes derived from 16S rDNA genes in different treatments |
| 表 4 土壤PCBs同系物组分含量与细菌种群丰度逐步回归分析结果 Table 4 Stepwise regression analysis for the relationships between soil PCB homologue groups and bacterial abundance |
生物质炭作为土壤改良剂, 在改善土壤营养物质状况方面有重要作用(Chintala et al., 2014).研究表明, 在酸性(左静等, 2017)或碱性(Safaei et al., 2016)土壤中添加生物质炭, 能显著提高土壤pH值.Laird等(2010)发现, 土壤中总N和有机碳含量随生物质炭的添加而显著增加, 同时也提高了土壤中有效态的P、K、Ca等营养元素的含量, 这与本研究结果一致.本研究发现, 尽管土壤本底pH值为碱性, 添加猪炭仍然显著提高了其pH值, 同时显著增加了土壤中速效P、K和有机碳含量, 但对碱解氮含量没有影响.AM真菌可以通过菌丝分泌的有机酸活化土壤中P、调节土壤pH值(张玉凤等, 2003), 从而促进植物生长.本研究发现, 接种AM真菌后土壤有效磷含量增加、pH值降低, 但同时接种AM真菌也降低了土壤有机碳含量.究其原因, 可能是由于AM真菌菌丝分泌物促进了土壤中微生物的活性, 从而对土壤中原有有机质的降解产生了激发效应(Shahzad et al., 2015).在同时接种AM真菌和添加猪炭的处理中, AM+ < 0.25处理下有机碳含量显著高于AM +>0.25处理, 其原因可能是细粒径的猪炭遭受到更高程度的破坏, 从而导致更多的养分及有机碳释放到土壤中(Chen et al., 2017).
AM真菌能提高植物抗逆性, 促进植物生长(郭良栋等, 2013).本研究发现, 在重度污染土壤中, 接种AM真菌的处理显著提高了植物生物量.关于添加生物质炭对AM真菌影响的研究结果却不一致.Conversa等(2015)研究表明, 当泥炭与生物质炭按照30:70的比例加入土壤中时, 显著降低了植物生物量与根系的菌根侵染率.但也有研究发现, 添加生物质炭可有效提高植物根系的AM真菌侵染(Qiao et al., 2015; Yusif et al., 2017).本研究发现, 添加猪炭显著提高了植物根系AM真菌侵染率, 但对植物生长却表现出抑制作用, 且 < 0.25 mm粒径猪炭的抑制作用更为显著.生物质炭对作物产量的影响与制备原料、添加量等因素有关.Liu等(2014)研究发现, 添加40 t·hm-2小麦秸秆生物质炭可使番茄产量增长53.8%, 而2.5 t·hm-2生物质炭的添加反而降低了番茄的产量.本研究结果表明, 在不接种AM真菌的处理中, 添加 < 0.25 mm粒径猪炭同样降低了植物生物量.
4.2 AM真菌及猪炭对细菌丰度及群落结构的影响生物质炭表面的多孔隙结构及自身包含的营养物质, 为微生物的生长与繁殖创造了良好的条件(Lehmann et al., 2011).何玉亭等(2016)在室内培养条件下, 向土壤中添加不同质量(1%、2%、4%、6%土壤质量)的烟杆炭和桑条炭发现, 施入生物质炭后, 土壤细菌、真菌和放线菌数量均显著增加.在田间实验条件下的结果也表明(王成己等, 2017), 施用烟秆生物质炭后, 显著增加了烟草根际土壤的微生物种类(OTU数).同时也有研究表明, 与大粒径的生物质炭相比, 小粒径的生物质炭由于具有更大的比表面积及可提供更多的营养物质, 因而更有利于微生物的生长与繁殖(Chen et al., 2017).本研究也发现, 添加小粒径的猪炭有利于土壤细菌丰度的提高, 其中, 在接种AM真菌条件下, 添加小粒径猪炭显著提高了土壤细菌16S rDNA丰度.接种AM真菌对于土壤细菌丰度也具有一定的促进作用, 尽管AM处理与CK没有显著差异, 这说明AM真菌与植物共生过程中, 一方面可通过促进植物根系的生长, 增加根系分泌物的数量及影响范围, 另一方面又可以通过菌丝向土壤中释放分泌物, 为微生物提供充足的碳源和能源(秦华, 2015;王茜等, 2015), 从而提高土壤细菌丰度.
研究表明, AM真菌提高土壤微生物活性的同时也可对其群落结构产生影响(Qin et al., 2016).添加生物质炭也可通过改善土壤理化性质从而影响微生物群落结构, 其中, 生物质炭粒径大小、施用量及生物质炭种类在这一过程中均起重要作用(Pu et al., 2016).由于碳源种类及环境条件的不同, AM真菌及生物质炭添加对不同种群的微生物影响不同.本研究发现, 小粒径猪炭对Bacteroidetes纲的细菌相对丰度有显著促进作用, 而两种粒径猪炭对Actinobacteria的相对丰度均没有显著影响.Song等(2017)发现添加生物质炭显著促进了Bacteroidetes纲细菌的相对丰度.Khodadad等(2011)发现在森林土壤中添加生物炭显著促进了Actinobacteria的相对丰度.这说明不同土壤中添加不同种类的生物质炭对土壤不同微生物种群的影响具有差异.然而, 不同粒径猪炭对土壤微生物种群相对丰度的影响机制目前还不清楚, 仍然需要进一步研究.
4.3 AM真菌及猪炭对PCBs降解的影响研究表明, 生物质炭具有的高比表面积、多孔隙结构、强电子交换性和丰富碳质组分等特性, 使得生物质炭对有机污染物表现出强烈的吸附能力(张小凯等, 2015).郭彦蓉等(2015)通过在污染场地中添加不同质量比的生物质炭发现, 随着生物质炭施用量的增加, 植物体内的PCBs含量逐渐减少.本研究结果也表明, 接种AM真菌与添加猪炭均表现出提高土壤PCBs降解率的趋势, 其中, 接种AM真菌同时添加大粒径猪炭的修复效果最为显著, 而接种AM真菌同时添加小粒径猪炭尽管有降低土壤PCBs含量的趋势, 但与对照相比没有显著差异.究其原因, 可能是因为大粒径的猪炭添加后, 改善了土壤结构和通气性, 在一定程度上促进了多氯联苯的好氧降解.大量研究表明, 接种AM真菌及添加生物质炭主要通过影响土壤微生物丰度及群落结构来影响有机污染物的降解(Qin et al., 2016;Song et al., 2017).本研究发现在接种AM真菌后, 土壤中浮霉状菌纲(Planctomycetes)相对丰度也显著提高, 且逐步回归分析也表明该菌群的相对丰度与三氯联苯含量显著相关.此外, 土壤五氯联苯含量与酸杆菌纲相对丰度也是密切相关的.Correa等(2011)发现, 酸杆菌纲(Acidobacteria)、β-变形菌纲(Betaproteobacteria)等在PCBs污染土壤中的丰度增加, 说明这些微生物种群一方面可以耐受PCBs污染, 同时也能利用PCBs.然而, 不同的研究发现接种AM真菌或添加生物质炭影响的微生物类群不同, 对土壤有机污染物的降解效应也不同, 这可能与土壤性质、原始微生物群落及生物质炭的性质都有重要关系.猪炭作为一种新型的生物质炭, 其组成成分与植物源生物质炭有较大差异, 因此, 猪炭影响土壤微生物群落, 继而影响土壤PCBs降解的内在机理还需要继续深入的研究.
5 结论(Conclusions)1) AM真菌能够提高土壤中有效磷含量, 降低土壤有机质含量和pH值, 而猪炭对土壤中有效磷、速效钾、有机碳和pH值的提高均有显著的促进作用;接种AM真菌能够显著提高植物根系AM真菌侵染率、植物生物量, 而猪炭对植物生长有明显的抑制作用.
2) AM真菌与猪炭显著改变了土壤细菌种群相对丰度, 接种AM真菌并添加小粒径猪炭显著提高了土壤细菌16S rDNA丰度.
3) 与不接种AM真菌及添加猪炭的对照相比, 接种AM真菌的同时添加大粒径生物质炭(AM+>0.25)有利于促进二氯、三氯、四氯联苯及总PCBs的降解率;土壤三氯联苯降解与Planctomycetes相对丰度显著相关, 而五氯联苯降解与Acidobacteria相对丰度显著相关.
Biddle J F, Fitz-Gibbon S, Schuster S C, et al. 2008. Metagenomic signatures of the Peru Margin subseafloor biosphere show a genetically distinct environment[J]. Proceedings of the National Academy of Sciences, 105(30): 10583–10588.
DOI:10.1073/pnas.0709942105
|
Chen J H, Li S H, Liang C F, et al. 2017. Response of microbial community structure and function to short-term biochar amendment in an intensively managed bamboo (Phyllostachys praecox) plantation soil:Effect of particle size and addition rate[J]. Science of the Total Environment, 574: 24–33.
DOI:10.1016/j.scitotenv.2016.08.190
|
Chintala R, Schumacher T E, Mcdonald L M, et al. 2014. Phosphorus sorption and availability from biochars and soil/biochar mixtures[J]. CLEAN-Soil, Air, Water, 42(5): 626–634.
DOI:10.1002/clen.v42.5
|
储少岗, 徐晓白, 童逸平. 1995. 多氯联苯在典型污染地区环境中的分布及其环境行为[J]. 环境科学学报, 1995, 15(4): 423–432.
|
Conversa G, Bonasia A, Lazzizera C, et al. 2015. Influence of biochar, mycorrhizal inoculation, and fertilizer rate on growth and flowering of Pelargonium (Pelargonium zonale L.) plants[J]. Frontiers in Plant Science, 6: 429.
|
Correa P A, Lin L S, Just C L, et al. 2010. The effects of individual PCB congeners on the soil bacterial community structure and the abundance of biphenyl dioxygenase genes[J]. Environment International, 36(8): 901–906.
DOI:10.1016/j.envint.2009.07.015
|
樊诗亮, 何丽芝, 秦华, 等. 2016. 生物质炭对邻苯二甲酸二丁酯污染土壤微生物群落结构多样性的影响[J]. 环境科学学报, 2016, 36(5): 1800–1809.
|
郭茜, 陆扣萍, 胡国涛, 等. 2017. 死猪炭和猪炭对菜地土壤理化性质和蔬菜产量的影响[J]. 浙江农林大学学报, 2017, 34(2): 244–252.
|
郭彦蓉, 曾辉, 刘阳生, 等. 2015. 生物质炭修复有机物污染土壤的研究进展[J]. 土壤, 2015, 47(1): 8–13.
DOI:10.3969/j.issn.1673-3908.2015.01.002 |
何玉亭, 王昌全, 沈杰, 等. 2016. 两种生物质炭对红壤团聚体结构稳定性和微生物群落的影响[J]. 中国农业科学, 2016, 49(12): 2333–2342.
DOI:10.3864/j.issn.0578-1752.2016.12.009 |
Khodadad C L M, Zimmerman A R, Green S J, et al. 2011. Taxa-specific changes in soil microbial community composition induced by pyrogenic carbon amendments[J]. Soil Biology & Biochemistry, 43(2): 385–392.
|
Laird D A, Fleming P, Davis D D, et al. 2010. Impact of biochar amendments on the quality of a typical Midwestern agricultural soil[J]. Geoderma, 158(3): 443–449.
|
Lehmann J, Rillig M C, Thies J, et al. 2011. Biochar effects on soil biota-A review[J]. Soil Biology & Biochemistry, 43(9): 1812–1836.
|
Liu Z, Chen X, Jing Y, et al. 2014. Effects of biochar amendment on rapeseed and sweet potato yields and water stable aggregate in upland red soil[J]. Catena, 123: 45–51.
DOI:10.1016/j.catena.2014.07.005
|
李秋玲, 凌婉婷, 高彦征, 等. 2008. 丛枝菌根对土壤多环芳烃降解的影响[J]. 农业环境科学学报, 2008, 27(5): 1705–1710.
DOI:10.3321/j.issn:1672-2043.2008.05.002 |
罗力, 陈卫锋, 魏然, 等. 2017. 互花米草生物炭的添加对土壤吸附三氯生的影响及其机制研究[J]. 环境科学学报, 2017, 37(7): 2736–2743.
|
Passatore L, Rossetti, S, Juwarkar A A, et al. 2014. Phytoremediation and bioremediation of polychlorinated biphenyls (PCBs):State of knowledge and research perspectives[J]. Journal of Hazardous Materials, 278: 189–202.
DOI:10.1016/j.jhazmat.2014.05.051
|
Price M N, Dehal P S, Arkin A P. 2012. FastTree 2-approximately maximum-likelihood trees for large alignments[J]. Plos One, 5(5): e9490.
|
Pu W G, Hong T S, Hong H L, et al. 2016. PBDEs, PCBs and PCDD/Fs in the sediments from seven major river basins in China:Occurrence, congener profile and spatial tendency[J]. Chemosphere, 144: 13–20.
DOI:10.1016/j.chemosphere.2015.08.045
|
Qiao Y H, Rowley D, Wang K, et al. 2015. Effects of biochar and arbuscular mycorrhizae on bioavailability of potentially toxic elements in an aged contaminated soil[J]. Environmental Pollution, 206: 636–643.
DOI:10.1016/j.envpol.2015.08.029
|
Qin H, Brookes P C, Xu J M. 2014. Cucurbita, spp.and Cucumis sativus enhance the dissipation of polychlorinated biphenyl congeners by stimulating soil microbial community development[J]. Environmental Pollution, 184(1): 306–312.
|
Qin H, Brookes P C, Xu J M. 2016. Arbuscular mycorrhizal fungal hyphae alter soil bacterial community and enhance polychlorinated biphenyls dissipation[J]. Frontiers in Microbiology, 7: 939.
|
秦华, 白建峰, 徐秋芳, 等. 2015. 丛枝菌根真菌菌丝对土壤微生物群落结构及多氯联苯降解的影响[J]. 土壤, 2015, 47(4): 704–710.
|
秦华.2015.多氯联苯污染土壤的菌根际修复效率及其机理研究[D].杭州: 浙江大学
http://cdmd.cnki.com.cn/Article/CDMD-10335-1015320376.htm |
Reeder J, Knight R. 2010. Rapid denoising of pyrosequencing amplicon data:exploiting the rank-abundance distribution[J]. Nature Methods, 7(9): 668–669.
|
Safaei K M, Zhang Q, Lin D, et al. 2016. Biochar:A review of its impact on pesticide behavior in soil environments and its potential applications[J]. Journal of Environmental Sciences, 44(6): 269–279.
|
Song Y, Bian Y, Wang F, et al. 2017. Dynamic effects of biochar on the bacterial community structure in soil contaminated with polycyclic aromatic hydrocarbons[J]. Journal of Agricultural & Food Chemistry, 65(32): 6789–6796.
|
Shahzad T, Chenu C, Genet P, et al. 2015. Contribution of exudates, arbuscular mycorrhizal fungi and litter depositions to the rhizosphere priming effect induced by grassland species[J]. Soil Biology & Biochemistry, 80: 146–155.
|
Tang X J, Shen C F, Shi D Z, et al. 2010. Heavy metal and persistent organic compound contamination in soil from Wenling:An emerging e-waste recycling city in Taizhou area, China[J]. Journal of Hazardous Materials, 173: 653–660.
DOI:10.1016/j.jhazmat.2009.08.134
|
滕应, 骆永明, 高军, 等. 2008. 多氯联苯污染土壤菌根真菌-紫花苜蓿-根瘤菌联合修复效应[J]. 环境科学, 2008, 29(10): 2925–2930.
DOI:10.3321/j.issn:0250-3301.2008.10.041 |
王成己, 陈庆荣, 陈曦, 等. 2017. 烟秆生物质炭对烟草根际土壤养分及细菌群落的影响[J]. 中国烟草科学, 2017, 38(1): 42–47.
|
王茜, 王强, 王晓娟, 等. 2015. 丛枝菌根网络的生态学功能研究进展[J]. 应用生态学报, 2015, 26(7): 2192–2202.
|
World Health Organization/International Programme on Chemical Safety.1987.Environmental Health Criteria 70: Principles for the Safety Assessment of Food Additives and Contaminants in Food[M].Geneva: World Health Organization
|
杨亚宁, 巴雷, 白晓楠, 等. 2010. 一种改进的丛枝菌根染色方法[J]. 生态学报, 2010, 30(3): 774–779.
|
Yusif S A, Hayatu N G. 2017. Influence of biochar application and AMF inoculation on root colonization and selected soil chemical properties[J]. Annals of Biological Sciences, 5(1): 21–24.
|
Zhang X K, Sarmah A K, Bolan N S, et al. 2016. Effect of aging process on adsorption of diethyl phthalate in soils amended with bamboo biochar[J]. Chemosphere, 142: 28–34.
DOI:10.1016/j.chemosphere.2015.05.037
|
Zhang X K, Wang H L, He L Z, et al. 2013. Using biochar for remediation of soils contaminated with heavy metals and organic pollutants[J]. Environmental Science and Pollution Research, 20(12): 8472–8483.
DOI:10.1007/s11356-013-1659-0
|
张小凯, 何丽芝, 毛霞丽, 等. 2015. 老化过程对生物质炭吸附-解吸附邻苯二甲酸二乙酯的影响[J]. 环境科学学报, 2015, 35(12): 4012–4020.
|
张玉凤, 冯固, 李晓林. 2003. 丛枝菌根真菌对三叶草根系分泌的有机酸组分和含量的影响[J]. 生态学报, 2003, 23(1): 30–37.
|
卓胜, 苏嘉欣, 黎华寿, 等. 2011. 黑麦草-菌根-蚯蚓对多氯联苯污染土壤的联合修复效应[J]. 环境科学学报, 2011, 31(1): 150–157.
|
左静, 陈德, 郭虎, 等. 2017. 小麦秸秆生物质炭对旱地土壤铅镉有效性及小麦、玉米吸收的影响[J]. 农业环境科学学报, 2017, 36(6): 1133–1140.
|
 2018, Vol. 38
2018, Vol. 38


