生物土壤结皮(Biological Soil Crust, BSC), 又叫生物结皮, 实质上是由蓝藻、菌类的胞外分泌物与土壤矿物粘结复合而成的混合物(李新荣等, 2000;贾宝全等, 2003).在南方稻田BSC中, 蓝藻是BSC的主要组成部分, 部分丝状蓝藻能产生大量多糖物质, 可以粘附藻体附近的土壤等其他颗粒物(Bowker, 2007), 构成稻田BSC.灌溉水中重金属进入土壤必须要通过BSC.BSC因具高的吸附固定能力, 能有效地降低灌溉水中的重金属对稻田土壤的毒害.根据BSC中的主要组分, 一般认为, 吸附的重金属主要分布在BSC的3个组分上(Ho, 2005):第一, 胞外聚合物(EPS), BSC中蓝藻胞外多糖主要是一些杂多糖组成, 糖基上富含糖醛酸取代基和硫酸取代基, 这些带负电荷的基团对带正电荷的重金属离子有较强的结合能力, 此外, 细胞外多肽也能较好的结合与沉淀胞外重金属(Pereira et al., 2009);第二, 生物表面吸附位, 蓝藻、真菌等可以通过细胞表面含硫的巯基基团、磷酸功能基团及氨基酸基团等与重金属进行结合(史广宇等, 2017);第三, 生物内部或矿物内部, BSC中含有锰氧化菌(廖水姣等, 2013)、产生碳酸根的菌类等(Dhillon et al., 2012)都可以将重金属矿化或嵌入到新生成的矿物晶格中.EPS组分中的金属多为与水溶大分子或胶体结合的形态, 它们与细胞结合松散, 容易提取;生物吸附的重金属一般以络合结合形式存在, 被认为可以用EDTA提取;在生物内部或生物成矿内部的重金属无法被EDTA提取(Haack et al., 2003).
近年来, BSC被用于重金属富集研究, 徐杰等研究表明荒漠中BSC对大气中重金属铬、镉和砷等元素富集较多(徐杰等, 2012), 在北极圈内, 高浓度的钴、镉和铜等都在BSC中检出, 表明BSC可富集镉(Wojtun et al., 2013).万文结等报道, 锰氧化细菌能够氧化游离的锰离子, 吸附多种重金属, 控制其在环境中的转化和迁移(万文结等, 2017).诸多关于BSC富集重金属的研究是在干旱地带进行,而对于稻田土壤重金属污染控制研究尚未展开(闫德仁等, 2006;徐杰等, 2013).酸性土壤中镉的形态以Fe-Mn氧化态和可交换态为主, 其余三态有机态、碳酸盐态和残渣态的含量相对较低, 并且土壤中生物可利用态镉的含量较高, 占土壤总镉的60.2%~98.3%, 生物不可利用态仅占1.7%~39.2%(张鑫等, 2004).侯秀等(2009)研究结果表明在土壤中添加相同量的铁锰氧化矿物后, 土壤中镉的有效态含量明显降低, 软锰矿比针铁矿的吸附效果好.因此, 已有的研究说明南方酸性土壤中镉主要以Fe-Mn氧化态、可交换态和生物可利用态为主, 锰对土壤中镉的形态有影响, 而在锰对生物结皮固定镉的形态及分布影响方面未涉及.
南方稻田中锰的含量较高.为了详细探讨自然环境中的锰对BSC吸收固定镉的作用及机制, 本文以稻田BSC为基础, 在不同浓度锰盐条件下, 培养BSC并测量其对镉的富集及结合形态, 探究锰盐如何影响BSC对镉的吸收及形态转换.
2 实验内容(Experiment) 2.1 BSC采样及保存湖南省茶陵县红色农场的土壤是典型的水稻土壤, 通过等离子体耦合元素分析仪器测量知其中总镉为0.78 mg·kg-1, 从中采集BSC.利用塑料铲将完整的BSC约1~2 cm厚进行剥离.剥离后的BSC放置于保鲜盒中, 加入适当的当地灌溉水, 带回实验室进行后续实验.
2.2 BSC的培养设置5种培养组和1个空白组.每组溶液的总体积为100.00 mL, 含1.00 g结皮, 5.00 mL营养液(BG-11), 混匀, 在自然环境下培养15 d, 并在BSC培养的第1、4、8、12、15 d测量各组的pH和氧化还原电位.每组做3个平行实验.实验中使用的含镉复合液由国家标准溶液镉配制, 镉标准溶液购自国家钢铁材料测试中心钢铁研究总局.溶液均由去离子水配制.
| 表 1 BSC的培养组及不加BSC的空白组组分表 Table 1 Component of BSC cultures and blank control without-BSC |
利用SEM-EDS (JEM-1230 HC, JPN)对结皮的表面结构及形态进行表征.利用XPS(K-Alpha 1063, Thermo Fisher, UK)对关键元素的价态进行分析.利用X射线晶体衍射仪器(XRD, Rigaku-TTRIII JPN)对样品进行结构表征.
2.4 培养后的BSC中Cd、Mn含量测量为测量BSC中不同结合形态的Cd、Mn含量, 参考Stewart的方法(Stewart et al., 2015), 具体如下:在培养15 d后, 5种培养的样品置于离心机(设置离心时间10 min、转速5500 r·min-1)离心, 过滤, 取BSC并自然风干.将各组风干后约1.00 g的BSC放入50.0 mL的离心管, 依次加入25 mL超纯水、4 mmol·L-1的EDTA-2Na和10 mmol·L-1的丙磺酸(MOPS)直接进行连续的分步离心10 min-悬浮10 min-过滤-取上清液装聚乙烯瓶, 并分别记为EPS、EDTA、MOPS组.提取后, BSC加入去离子水淋洗-过滤-装聚乙烯瓶记为结皮组.EPS、MOPS和EDTA组的滤液各加入体积比为3:1的盐酸和硝酸的混合液即王水, 并进行水浴消解.结皮组先加入高氯酸放置一晚再加入王水置消解炉(XJS36-42W labotery LLC)消解.滤液和BSC消解完毕, 冷却, 过滤, 滤液装聚乙烯瓶(实验中HClO4、HCl、HNO3、EDTA-2Na等均购自国药集团化学试剂有限公司;MOPS购自北京索莱宝科技有限公司.)
利用等离子体耦合元素分析仪器(ICP PerkinElmer Optima 8300 USA)测量消解后结皮、EPS、MOPS和EDTA组滤液中镉、锰的含量, 其中命“总体”为结皮组、EPS组、MOPS组、EDTA组中的镉、锰总量;命“胞外聚合物”为EPS组的胞外聚合物结合镉、锰含量;命“生物吸附”为EDTA组和MOPS组的镉、锰量;命“非EDTA可提取”为“总体”减去“生物吸附和胞外聚合物”的镉、锰含量即非EDTA可提取态含量.同时, 分析镉、锰在胞外聚合物、生物吸附位和生物内部或生物成矿内部的分布.
3 结果与分析(Results and analysis) 3.1 BSC结构表征结果BSC含有一些矿物质, 如石英、累托石、高岭土.从样品的扫描电镜图及结合我们之前的研究, 可以得到光滑的表面和层状矿物是石英.表面粗糙的是累托石和高岭土, 因为其表面常覆盖一些生物有机体.生物效应诱发了各种矿物的聚集, 因此, 累托石和高岭土被聚集在一起.在一些扫描电镜下, 在BSC中显示硅藻、蓝藻及其胞外聚合物(EPS).其中硅藻显示多孔层状长条结构(陈衍婷等, 2011).利用EDS检测BSC中主要元素为O、C、Si、Al、Fe和K, 其含量分别为44.65%、27.77%、14.60%、7.47%、3.07%.Mn元素的含量低于1%, SEM中几乎无法分辨锰的氧化物矿物.但从宏观颜色上, 随着培养液中锰含量增加, 结皮的颜色会变深.在BSC培养第的15 d, 5种培养组BSC的XRD显示, 石英和累托石显示出强烈的衍射峰, 而生物生成的锰氧化物由于其很低的结晶度, 峰很弱.可以判断2θ为37.88°、56.57°、64.36°和71.3°对应于生物产生的水钠锰矿(Birnessite, JCPDS 43-1456).
3.2 镉、锰在BSC不同组分中的分布由图 1a总体知在培养体系中, BSC自身含镉量为3.39 mg·kg-1.在50.00 μg·L-1镉溶液中培养15 d后, BSC吸收镉量为1.99 mg·kg-1.BSC随着锰盐浓度增加对镉的去除能力增加, Mn-0、Mn-5、Mn-10、Mn-20吸收镉含量分别为1.99、3.11、3.77和4.91 mg·kg-1, 对水体中的镉的去除率分别为39.80%、62.20%、75.40%和98.20%.其中, 在20 mg·L-1锰盐培养下, 灌溉水中镉降低到2.15 μg·L-1, 远远低于农田灌溉水标准要求(< 10.00 μg·L-1)(GB5084农田灌溉水质标准, 2005).
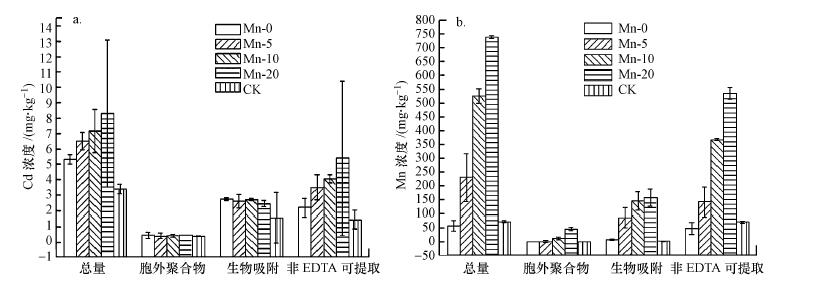 |
| 图 1 在Mn-0、Mn-5、Mn-10、Mn-20和CK 5种培养条件下不同组分BSC中镉和锰的分布 (各组浓度值代表平均值±标准偏差) Fig. 1 The Cd and Mn concentrations in the BSC fractions for processed samples in the treatment groups. Values represent means±stand deviation |
从图 1a可得在Mn-0、Mn-5、Mn-10、Mn-20和CK培养条件下BSC吸附镉的总量分别为5.38、6.50、7.16、8.30和3.39 mg·kg-1;生物内部或矿物内部的非EDTA可提取的镉量分别为2.20、3.50、4.04、5.40和1.44 mg·kg-1;生物表面络合吸附所吸附的镉量分别为2.74、2.60、2.71、2.45和1.55 mg·kg-1;EPS组分中各组吸附的镉量约为0.40~0.46 mg·kg-1.表明镉主要分布在非EDTA可提取态, 其次为生物吸附态.
从图 1b可得在Mn-0、Mn-5、Mn-10、Mn-20和CK培养条件下, BSC中锰总量分别为57、230、528、739和63 mg·kg-1;生物内部或矿物内部的非EDTA可提取的锰量分别为48、143、367、535和71 mg·kg-1;生物表面吸附所吸附的锰量分别为9、85、145、157和2 mg·kg-1;EPS组分中各组吸附的锰量很少.
由图 1可知, Cd在BSC中与Mn在BSC中的分布情况相似, 以非EDTA可提取态为主, 其次是生物吸附.镉、锰主要分布在生物内部或生物成矿内部约占总量的53.95%、71.99%, 生物表面吸附位上吸附的镉、锰分别占总量的39.21%、24.61%.生物内部或矿物内部固定了大量的镉、锰, 且随着锰盐含量增加镉固定量增加.而EPS中的镉约占总量的6.90%, EPS与重金属结合松散, 在镉的吸附中不占主要作用.
BSC中的镉主要分布在非EDTA可提取态组分, 从图 2可知, 对比非EDTA提取态组分中锰与镉的相关性, 随着非EDTA提取态锰含量增加, 内含非EDTA提取的镉量逐渐增加.其相关性为0.8745(n=10), 结果表明, 非EDTA提取态的锰与镉是极其相关的.我们认为锰盐在BSC表面被生物转化为锰氧化物矿物而不是被生物吸收作用, 因为锰含量远远高于正常生物吸收到体内含量(20~100 mg·kg-1)(谢苏婧等, 2003).在自然条件下, 锰氧化菌能将锰离子氧化成高价的锰矿物.在氧化过程中会吸附镉, 从而将镉富集到氧化锰矿物晶格中.所以, 锰盐可以促进BSC对镉的固定作用.
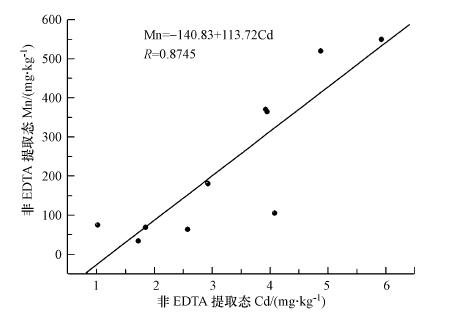 |
| 图 2 不同浓度含锰盐培养的BSC中非EDTA提取态镉和锰的相关性 Fig. 2 Correlation of Non-EDTA Extracted Cd and Mn in BSC Cultures under different Manganese Salt concentrations |
为了进一步探明锰促进BSC固定镉的机制, 对结皮中锰的价态及各元素分布进行表征.图 3a为各样品锰元素的XPS, 结果显示, 随着培养时锰浓度的增加, 结皮中锰的XPS响应强度越高, 表明含锰量越多.响应强度最大为Mn-20, 在640~645 eV有个明显突起的谱峰.将Mn-20中锰的XPS峰进行拟合, 其峰值641.9 eV, 对应为Mn4+特征(Nesbitt et al., 1998)(图 3b).我们认为是锰氧化菌将Mn2+氧化成Mn4+, 形成水钠锰矿物.由已有的报道说明Mn2+氧化和细胞外锰氧化物沉积的具体的氧化机制需进一步研究(Webb, 2005;Miyata et al., 2006;Dick et al., 2008;Learman et al., 2011a).
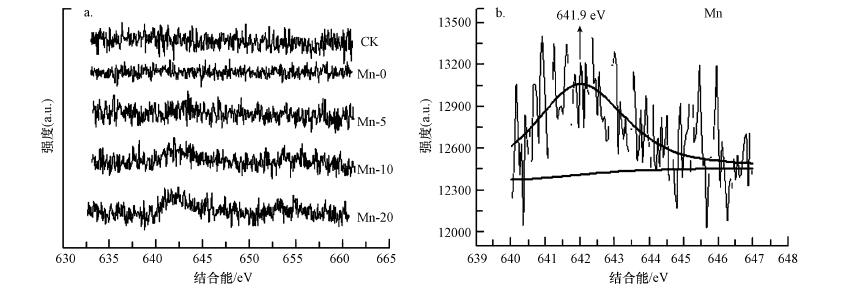 |
| 图 3 培养15 d后Mn-0、Mn-5、Mn-10、Mn-20和CK五组BSC的XPS谱图(a)与Mn-20拟合后的XPS谱图(b) Fig. 3 The XPS Mn (1s) spectra of the treated BSCs (a) and the deconvolution peaks for Mn-20(b) |
图 4a为Mn-20样品的SEM, 其中可以观察到生物形成的锰氧化物结构为多孔海绵状, 孔径100~200 nm, 壁厚为10~20 nm, 这与Miller报道的结果一致(Miller et al., 2012).而大块层状物应为结皮中粘土矿物, 如高岭土, 这个结果与区域内的EDS结果图 4d是相互吻合的.EDS显示, 结皮表面的主要元素为C、Mn、O、Si、Al和Ca.其中, C表示具有大量生物, 如包裹作用的EPS和锰氧化菌等;Si、Al、O、Ca应对应高岭土或累托石.
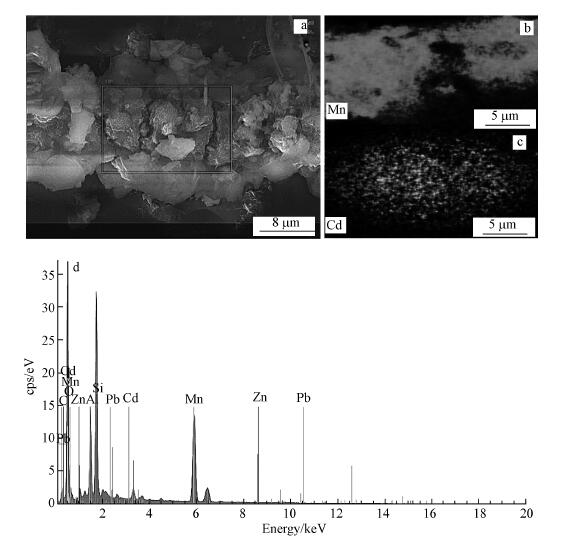 |
| 图 4 Mn-20的扫描电镜照片及元素分布(a.SEM, b.锰元素分布, c.镉元素分布, d.区域利用EDS分析元素组分) Fig. 4 Scanning electron microscopy and elemental distribution of Mn-20 (a.SEM, b. Distribution of Mn, c. Distribution of Cd, d. the EDS of selected area) |
BSC通过生物氧化水溶液中的Mn2+, 产生锰氧化物胶体颗粒并吸附在细胞壁表面, 形成结晶中心, 进一步的吸附和氧化过程促进其沉淀累积逐渐形成水钠锰矿(Learman et al., 2011b).成矿过程中, 镉负载或生物产生EPS抑制水钠锰矿层的有序堆积形成无序层状(Yu et al., 2012).溶液体系中的氧化还原电位和pH随时间变化结果见图 5.通过15 d的培养, 从总体上看pH值较初始值5.6上升至7.8左右, 除Without-BSC的空白组外, Mn-0、Mn-5、Mn-10、Mn-20和CK各组氧化还原电位基本呈下降趋势, 而pH呈上升趋势.不加BSC的空白组中既没有出现锰氧化物的沉淀, 也没有发生任何颜色变化, 表明引起Mn-0、Mn-5、Mn-10、Mn-20和CK实验组pH上升和氧化还原电位下降的主导因素是生物结皮对锰等离子的生物作用.由于生物氧化菌的作用, Mn2+先被O2-氧化为含Mn3+的中间产物并进一步歧化为Mn4+和Mn2+(Learman et al., 2011b), 同时生成H2O2, 于是导致pH值的逐渐上升和氧化还原电位的逐渐下降.
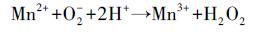
|
(1) |
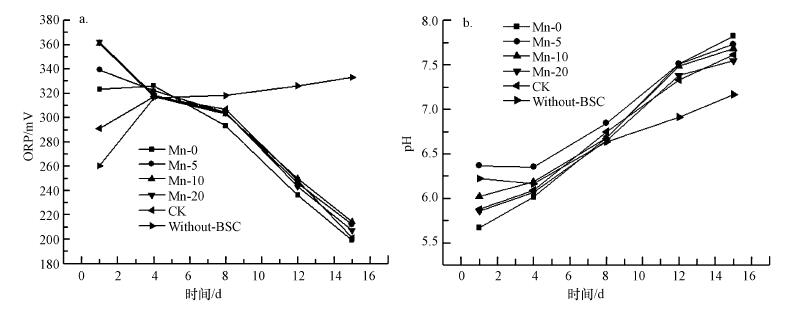 |
| 图 5 BSC在Mn-0、Mn-5、Mn-10、Mn-20、CK和Without-BSC组条件下于不同培养时间体系的氧化还原电位(a)和pH值(b) Fig. 5 The oxidization reduced potential (a) and pH (b) variation over time for BSC in solution |
也有报道说,在生物膜中, Cd2+、H+等阳离子优先吸附到锰氧化物上(Qianqian et al., 2013).生物形成的锰氧化物不仅比锰氧化矿物具有更多的缺陷位, 而且表面带负电荷, 对阳离子具有很强的富集作用.BSC中锰氧化物在产生过程中不停地吸附Cd2+, 导致镉进入锰氧化物晶格中, 极大地降低镉的生物有效性.
4 结论(Conclusions)通过在不同浓度锰盐条件下观察BSC对镉的吸收及分布情况, 结果显示锰盐的存在可以促进BSC对镉的固定作用, 且随着锰盐含量增加固定镉含量越多.这是由于BSC中含有锰氧化菌, 在锰离子氧化成水钠锰矿的过程中吸收镉离子, 并嵌入到锰矿晶格, 降低了镉的活性.锰氧化菌在BSC中没有进行分离和扩增培养, 其处于自然生长状态下就具有氧化固定重金属的作用.本研究对去除/固定灌溉水中活性镉具有重要的意义, 在实际环境中仅加入少量锰盐于BSC即可固定镉, 具有一定的实用价值.
Bowker M A. 2007. Biological soil crust rehabilitation in theory and practice:An underexploited opportunity[J]. Restoration Ecology, 15(1): 13–23.
DOI:10.1111/rec.2007.15.issue-1
|
陈衍婷, 尹丽倩, 陈进生, 等. 2011. 厦门近海表层沉积物结构特征及物源初探[J]. 环境科学与技术, 2011(S2): 1–6.
|
Dhillon G S, Brar S K, Kaur S, et al. 2012. Green approach for nanoparticle biosynthesis by fungi:current trends and applications[J]. Critical Reviews in Biotechnology, 32(1): 49–73.
DOI:10.3109/07388551.2010.550568
|
Dick G J, Justin W T, Beveridge T J, et al. 2008. Direct identification of a bacterial manganese(Ⅱ) oxidase, the multicopper oxidase MnxG, from spores of several different marine Bacillus species[J]. Applied & Environmental Microbiology, 74(5): 1527–1534.
|
王德荣, 崔淑贞, 徐应明, 等.2005. GB5084中华人民共和国国家标准农田灌溉水质标准[S].北京: 中国标准出版社
|
Haack E, Warren L A. 2003. Biofilm hydrous manganese oxyhydroxides and metal dynamics in acid rock drainage[J]. Environmental Science & Technology, 37(18): 4138–4147.
|
Ho Y S. 2005. Effect of pH on lead removal from water using tree fern as the sorbent[J]. Bioresour Technology, 96(11): 1292–1296.
DOI:10.1016/j.biortech.2004.10.011
|
侯秀, 王祖伟. 2009. 铁锰氧化矿物添加对土壤镉有效态及生物效应的影响[J]. 农业环境科学学报, 2009, 28(11): 2313–2317.
DOI:10.3321/j.issn:1672-2043.2009.11.018 |
贾宝全, 张红旗, 张志强, 等. 2003. 甘肃省民勤沙区土壤结皮理化性质研究[J]. 生态学报, 2003, 23(7): 1442–1448.
DOI:10.3321/j.issn:1000-0933.2003.07.025 |
Learman D R, Wankel S D, Webb S M, et al. 2011a. Coupled biotic-abiotic Mn(Ⅱ) oxidation pathway mediates the formation and structural evolution of biogenic Mn oxides[J]. Geochimica Et Cosmochimica Acta, 75(20): 6048–6063.
DOI:10.1016/j.gca.2011.07.026
|
Learman D R, Voelker B M, Vazquez-Rodriguez A I, et al. 2011b. Formation of manganese oxides by bacterially generated superoxide[J]. Nature Geoscience, 4(2): 95–98.
DOI:10.1038/ngeo1055
|
李新荣, 张景光, 王新平, 等. 2000. 干旱沙漠区土壤微生物结皮及其对固沙植被影响的研究[J]. 植物学报, 2000, 42(9): 965–970.
DOI:10.3321/j.issn:1672-9072.2000.09.015 |
廖水姣, 王革娇. 2013. 锰氧化菌及其生物锰氧化物在环境污染修复中的应用研究进展[J]. 华中农业大学学报, 2013, 32(5): 9–14.
DOI:10.3969/j.issn.1000-2421.2013.05.002 |
Miller A Z, Dionisio A, Braga M A S, et al. 2012. Biogenic Mn oxide minerals coating in a subsurface granite environment[J]. Chemical Geology, 322-323: 181–191.
DOI:10.1016/j.chemgeo.2012.07.005
|
Miyata N, Tani Y, Maruo K, et al. 2006. Manganese(Ⅳ) oxide production by Acremonium sp strain KR21-2 and extracellular Mn(Ⅱ) oxidase activity[J]. Applied & Environmental Microbiology, 72(10): 6467–6473.
|
Nesbitt H W, Banerjee D. 1998. Interpretation of XPS Mn(2p) spectra of Mn oxyhydroxides and constraints on the mechanism of MnO2 precipitation[J]. American Mineralogist, 83(3/4): 305–315.
|
Pereira S, Zille A, Micheletti E, et al. 2009. Complexity of cyanobacterial exopolysaccharides:composition, structures, inducing factors and putative genes involved in their biosynthesis and assembly[J]. Fems Microbiology Reviews, 33(5): 917–941.
DOI:10.1111/j.1574-6976.2009.00183.x
|
Yu Q, Sasaki K, Tanaka K, et al. 2013. Zinc sorption during bio-oxidation and precipitation of manganese modifies the layer stacking of biogenic birnessite[J]. Geomicrobiology Journal, 30(9): 829–839.
DOI:10.1080/01490451.2013.774075
|
史广宇, 程媛媛, 史绮, 等. 2017. 铜绿假单胞菌对铜和铅的吸附[J]. 环境科学学报, 2017, 37(6): 2107–2113.
|
Stewart T J, Behra R, Sigg L. 2015. Impact of chronic lead exposure on metal distribution and biological effects to periphyton[J]. Environmental Science & Technology, 49(8): 5044–5051.
|
万文结, 薛芷筠, 张泽文, 等. 2017. 锰氧化菌Arthrobacter sp.HW-16的锰氧化特性和氧化机制[J]. 环境科学, 2017, 38(5): 2036–2043.
|
王玉飞, 闫龙, 陈碧, 等. 2016. 榆林高岭土原矿的性能分析[J]. 硅酸盐通报, 2016, 35(2): 492–495.
|
Webb S M. 2005. Structural characterization of biogenic Mn oxides produced in seawater by the marine bacillus sp. strain SG-1[J]. American Mineralogist, 90(8/9): 1342–1357.
|
Wojtun B, Samecka-Cymerman A, Kolon K, et al. 2013. Metals in some dominant vascular plants, mosses, lichens, algae, and the biological soil crust in various types of terrestrial tundra, SW Spitsbergen, Norway[J]. Polar Biology, 36(12): 1799–1809.
DOI:10.1007/s00300-013-1399-0
|
谢苏婧, 谢树莲, 谢宝妹. 2003. 藻类植物中钙、镁、铁、锰、铜和锌含量分析[J]. 光谱学与光谱分析, 2003, 23(3): 615–616.
DOI:10.3321/j.issn:1000-0593.2003.03.058 |
徐杰, 敖艳青, 张璟霞, 等. 2012. 沙地不同发育阶段的人工生物结皮对重金属的富集作用[J]. 生态学报, 2012, 32(23): 7402–7410.
|
徐杰, 敖艳青, 张璟霞. 2013. 生物结皮富集营养元素和重金属元素的空间分异特性[J]. 干旱区资源与环境, 2013, 27(12): 161–166.
DOI:10.3969/j.issn.1003-7578.2013.12.027 |
闫德仁, 季蒙, 薛英英. 2006. 沙漠生物结皮土壤发育特征的研究[J]. 土壤通报, 2006, 37(5): 990–993.
DOI:10.3321/j.issn:0564-3945.2006.05.036 |
Yu Q, Sasaki K, Tanaka K, et al. 2012. Structural factors of biogenic birnessite produced by fungus Paraconiothyrium, sp. WL-2 strain affecting sorption of Co2+[J]. Chemical Geology, s 310-311(3): 106–113.
|
张鑫, 周涛发, 袁峰, 等. 2004. 铜陵矿区土壤中镉存在形态及生物有效性[J]. 生态环境学报, 2004, 13(4): 572–574.
DOI:10.3969/j.issn.1674-5906.2004.04.030 |
 2018, Vol. 38
2018, Vol. 38


