2. 湖北科技学院基础医学院, 环境-免疫与神经系统疾病实验室, 咸宁 437100;
3. 华中师范大学生命科学学院, 环境生物医学实验室, 武汉 430079
2. Laboratory of Environment-immunological and Neurological Diseases, Research Center of Basic Medical Sciences, Hubei University of Science and Technology, Xianning 43710;
3. Laboratory of Environment Biomedicine, Central China Normal University, Wuhan 430079
邻苯二甲酸酯(Phthalate Esters,PAEs),是目前在全球范围内大量生产并广泛使用的一类人工合成有机化合物,常被用作增塑剂以增加产品的柔韧性、光泽度和耐用性,被广泛地应用于塑料制品、工业涂料、化妆品、汽车、服装、农药等产品中,可经消化道、呼吸道、皮肤、医疗暴露等途径进入人体(Swan, 2008; Mikula et al., 2005;胡雄星等, 2007).
邻苯二甲酸酯与分子之间并不是以共价键结合,因此,它们很容易从聚合物中释放出来(Halden, 2010).已经研究证实(Smith et al., 2011; Carbone et al., 2012; Mckee et al., 2000; Jr et al., 2009),邻苯二甲酸酯具有多种毒性作用,包括生殖毒性、遗传毒性、神经毒性、致畸性、致癌性和内分泌干扰作用等.增塑剂DIDP(Diisodecyl Phthalate),即邻苯二甲酸二异癸酯,是一种新型增塑剂(Andaluri et al., 2018).由于新型增塑剂生殖发育毒性较低,因而产量和消费量逐年增加.随着其大量消费使用,其潜在的毒性作用和机制非常值得我们关注研究.
有关研究表明(Hushka et al., 2001),DIDP可导致SD大鼠的后代出生后存活率降低,且在F2子代中存活率降低更显著.Qin等(2018)研究表明,15 mg·kg-1·d-1 DIDP暴露可加重OVA诱导的过敏性哮喘.Shen等(2016)研究表明,DIDP可通过氧化应激加重异硫氰酸荧光素(FITC)诱导的过敏性皮炎.邻苯二甲酸酯类增塑剂BBP、DEHP、DINP等关于学习记忆等神经系统毒性已被证实(Ma et al., 2015; Tang et al., 2015; Min et al., 2014),但有关DIDP对学习记忆的影响及潜在机制的研究仍然较少,还有待证实.
甲醛(Formadehyde, FA)是危害人类健康的主要室内空气污染物,被广泛应用于工业中.研究认为甲醛是神经行为紊乱的效应因子,会导致失眠、头痛,注意力不集中、记忆力下降、失忆、情绪不稳定等症状(Malek et al., 2003).当甲醛浓度超过一定范围,短时间内人们就会感到头痛、恶心、呕吐、四肢乏力.动物实验的结果表明, 吸入甲醛可导致脑部氧化应激反应(Lu et al., 2008; Ahmed et al., 2016),甲醛暴露可能诱发抑郁和学习记忆障碍,大脑中氧化应激诱导的神经元损伤可能是导致这些效应的机制(Lu et al., 2008; Usanmaz et al., 2002; Tang et al., 2013).
中国是世界上最大的增塑剂生产国和消费国,消费量约占全球消费总量的1/4,且国内增塑剂市场多年来都由PAEs类增塑剂所主导,用量约占增塑剂总类的90%,受关注最多的品种主要有DEHP、DBP、BBP、DINP、DIDP、DNOP (陶刚等, 2008;王宏, 2011).目前我国已经检出的室内气体污染物主要有甲醛、氨、苯类化合物、放射性氡等,其中以甲醛最具典型性,对人类健康影响最为突出.研究表明,新装修房屋甲醛暴露可能是导致近些年我国大城市儿童白血病发病率增高的主要原因之一(Tang et al., 2009).由于公众对自身健康及室内空气质量重视程度的提高,甲醛作为室内空气污染物的典型代表已受到广泛的社会关注.
当前环境中的有毒物质通常并非单独存在,且多种有毒物质共同作用产生的毒性可能更大.DIDP和甲醛广泛的应用,使得人类在环境中可能存在摄入DIDP(主要途径为经口摄入)的同时,又暴露于FA(主要途径为吸入).口服暴露DIDP和吸入甲醛都可引起机体产生氧化应激反应(Shen et al., 2016; Lu et al., 2008; Ahmed et al., 2016),因此本实验通过联合DIDP灌胃和吸入甲醛染毒,研究二者共同暴露对学习记忆的影响以及氧化损伤机制.
2 材料与方法(Materials and methods) 2.1 实验动物SPF级3周龄雄性KM小鼠80只,购买自湖北省疾病预防控制中心实验动物中心.
2.2 主要仪器与试剂主要仪器:Morris水迷宫测试系统(AnyMaze软件,美国Stoelting公司)、小型智能环境气候舱(WH-2型,武汉宇信科技)、酶标仪(ELx800,美国Bio-Tek)、多功能荧光酶标仪(Hide Chameleon V,芬兰Hidex)、低温冷冻离心机(5424R,德国Eppendorf)、三用电热温水箱(HH-42,北京长源实验仪器厂)、显微镜(DP73,日本Olympus)、甲醛浓度检测仪(4160-19.99m,美国INTERSCAN).
主要试剂:邻苯二甲酸二异癸酯(DIDP)(纯度≥99%,Sigma公司)、二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)(纯度≥97%,Sigma公司)、硫代巴比妥酸(TBA)(分析纯,国药集团化学试剂有限公司)、Vitamin E(纯度≥99%,Sigma公司)、甲醛溶液(10%,Sigma公司)、还原型谷胱甘肽试剂盒(南京建成生物工程研究所)、小鼠8-OHdG ELISA试剂盒(上海源叶生物科技有限公司)、Folin-酚蛋白定量试剂盒(北京鼎国昌盛生物技术有限责任公司).
2.3 染毒方法与分组 2.3.1 染毒方法根据欧洲官方建议(EFSA, 2005),正常成人DIDP每日摄入限量为0.15 mg·kg-1·d-1,以此为依据,本实验设置DIDP染毒浓度梯度为0.15、1.5、15、150 mg·kg-1·d-1.DIDP与吐温80按照1:1的体积比例混匀,用灭菌生理盐水配制成15 mg·mL-1的原液,并逐步稀释配置0.015、0.15、1.5、15 mg·mL-1的染毒液,按照0.01 mL·g-1体重给相应组灌胃染毒,连续灌胃染毒21 d,对照组按0.01 mL·g-1体重给以生理盐水.维生素E与吐温80按照1:1的体积比例混匀,用灭菌生理盐水配制成10 mg·mL-1的溶液,按照0.01 mL·g-1体重给以灌胃.因吐温80仅作为DIDP和维生素E的助溶剂,此浓度的吐温80在先前的药理学体内实验中被证明是惰性的(Dimitrov et al., 2011),对生物体无毒副作用,因而阴性对照组只给予生理盐水.
我国规定的室内甲醛最高浓度为0.08 mg·m-3,根据已有研究,1 mg·m-3甲醛暴露周期14 d,职业暴露每天8 h(5 + 2模式),即可造成小鼠学习记忆能力下降(陆林洁等, 2017).在此基础上,设置FA浓度为1 mg·m-3.将小鼠置于与小型智能环境气候仓相连的玻璃染毒缸(由8.4 L通气式干燥器改造而成)中,由小型智能环境气候仓持续稳定地输出浓度为1 mg·m-3的气态甲醛,舱内湿度为45%±5%,气流量为2 L·min-1.每天8 h气态甲醛吸入,职业暴露(染毒5 d,休息2 d)循环3周,吸入甲醛期间禁食禁水.
每天上午定时给小鼠灌胃DIDP和VitE,所有组灌胃结束后,(F)、(G)、(H)组进行甲醛染毒.水迷宫实验期间,(A)~(E)组DIDP灌胃后进行水迷宫实验,(F)、(G)、(H)组在甲醛染毒结束后进行水迷宫实验.
 |
| 图 1 染毒流程图 Fig. 1 Exposure scheme diagram |
适应性喂养5 d后,将80只小鼠随机均分为8组,每组10只,具体组别设置:(A)阴性对照组(Saline组);(B)0.15 mg·kg-1·d-1 DIDP组(DIDP0.15组);(C)1.5 mg·kg-1·d-1 DIDP组(DIDP1.5组);(D)15 mg·kg-1·d-1 DIDP组(DIDP15组);(E)150 mg·kg-1·d-1 DIDP组(DIDP150组);(F)1 mg·m-3 FA组(FA组);(G)1 mg·m-3 FA+15 mg·kg-1·d-1 DIDP组(FA+DIDP组);(H)1 mg·m-3 FA+15 mg·kg-1·d-1 DIDP+100 mg·kg-1·d-1 VitE组(FA+DIDP+VitE组).
2.4 Morris水迷宫实验Morris水迷宫主要用于研究啮齿动物脑学习记忆机制,如今已经广泛的应用于学习记忆、阿尔茨海默症、智力与衰老等研究领域.
本实验用水迷宫装置如图 2所示,圆形水池被人为假设等分为Ⅰ、Ⅱ、Ⅲ、Ⅳ 4个象限,并在某一固定位置放置一黑色圆形逃逸平台,水面高于平台1 cm,水温控制在(24±2) ℃.
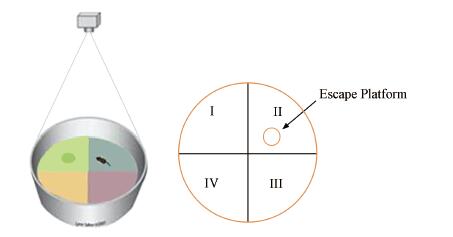 |
| 图 2 水迷宫装置及象限划分示意图 Fig. 2 Water maze device and quadrants division |
每天分别从第Ⅰ、Ⅱ、Ⅲ象限池边的固定位置将小鼠面向池壁放入水中,使它们寻找固定在第Ⅱ象限的逃逸平台.从小鼠放入水中开始,由装置正上方与计算机相连的摄像机跟踪小鼠游泳,计时60 s,在60 s跟踪期内找到平台所需时间,即为逃避潜伏期,如果60 s内未能找到平台,则将逃避潜伏期记为60 s,并由人引导其至逃生平台保持15 s.连续测试7 d,检测小鼠学习能力.第8 d为遗忘期,不进行训练.第9 d撤去逃生平台后,以相同方法重复水迷宫实验,对小鼠记忆能力进行检测,跟踪记录小鼠放入水中后60 s内的游泳轨迹、在目标象限(图 2第Ⅱ象限)累计游泳时间等信息,并由AnyMaze软件采集分析实验数据,得出各组实验小鼠空间记忆能力强弱(Usanmaz et al., 2002; Liu et al., 2014).
2.5 脑组织样本制备染毒结束后,将小鼠脱颈处死,剪开并剥离颅骨,取出完整脑组织.取部分脑组织,置于4%多聚甲醛中固定后,进行海马H & E染色切片和Nissl染色切片制作.其余脑组织制成10%的组织匀浆液.将匀浆在4 ℃、9800 g条件下离心10 min,取上清液进行氧化应激水平的检测,其余上清液冷冻保存于-80 ℃冰箱待用.
2.6 脑组织氧化应激水平检测 2.6.1 ROS的含量测定活性氧簇(ROS)含量运用DCF荧光法进行测定(Lebel et al., 1992).取匀浆上清,用PBS(pH=7.5)做50倍稀释.取100 μL稀释液移至酶标板,加入100 μL 10 μmol·L-1的DCFH-DA荧光染料,37 ℃避光保持30 min,通过荧光酶标仪读取激发波长485 nm和发射波长525 nm处的荧光强度.
2.6.2 GSH的含量测定还原型谷胱甘肽(GSH)含量测定严格按照试剂盒说明书进行操作.GSH含量(μmol·g-1 prot)=[(测定OD值-空白OD值)/(标准OD值-空白OD值)]×标准管浓度×样本稀释倍数/待测匀浆蛋白浓度.用Folin-酚法测定蛋白含量.
2.6.3 MDA的含量测定丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法进行测定(Ohkawa et al., 1979).将0.5 mL样品加入到2 mL 0.6%TBA溶液,并在沸水中反应15 min.用冷水冷却后在4 ℃以9800 g离心10 min,取上清液测量波长532、600和450 nm处吸光度.根据公式MDA(μmol·g-1 prot)= [6.45(OD532-OD600)-0.56×OD450]/待测匀浆蛋白浓度.用Folin-酚法测定蛋白含量.
2.6.4 8-OHdG的含量测定8-羟基脱氧鸟苷(8-OHdG)含量测定严格按照ELISA试剂盒说明书进行操作,波长450 nm处测定吸光度,计算出样品中8-OHdG的含量.试剂盒检测灵敏度:最低检测浓度<1.0 ng·mL-1.
2.7 统计学分析采用GraphPad Prism 5.0统计软件对数据进行分析.两组样本均数之间的比较采用t检验,多组样本均数之间的两两比较采用SNK-q检验.
3 结果(Results) 3.1 水迷宫实验图 3a、图 3c显示,随着训练天数增加,不同组小鼠逃避潜伏期均下降,其中,阴性对照组下降最为明显,而图 3a中DIDP150组和图 3c中FA+DIDP组的降低幅度最慢.图 3b显示,前7 d平均逃避潜伏期,随DIDP染毒浓度升高而延长.图 3d显示,与阴性对照组相比,FA组和FA+DIDP组前7 d平均逃避潜伏期增加,差异具有统计学意义(p=0.0146, p=0.0020);FA+DIDP组较FA组前7 d平均逃避潜伏期延长,FA+DIDP+VitE组较FA+DIDP前7 d平均逃避潜伏期降低,差异具有统计学意义(p=0.0375).
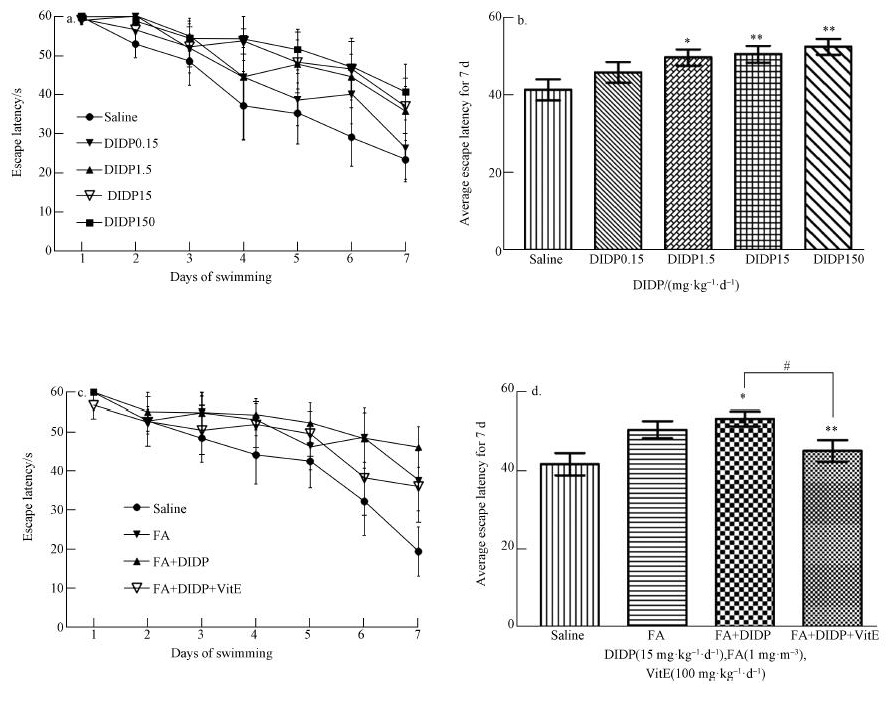 |
| 图 3 不同处理组小鼠前7 d平均逃逸时间 (与对照组比较,*p < 0.05,**p < 0.01;组间比较,#p < 0.05下同) Fig. 3 The average escape latency in the first 7 days of different groups (compared with control group, *p < 0.05, **p < 0.01; comparison between groups, #p < 0.05, the same below) |
图 4显示,水迷宫测试第9 d不同染毒组小鼠在目标象限停留时间,较阴性对照组均下降,其中,DIDP15、DIDP150组、FA组、FA+DIDP组与阴性对照组比较,差异具有统计学意义(p < 0.05, p < 0.01);FA+DIDP组较FA组小鼠在目标象限停留时间较短,FA+DIDP+VitE组小鼠较FA+DIDP组小鼠在目标象限停留时间更长,差异具有统计学意义(p=0.0469).
 |
| 图 4 不同处理组小鼠第9天目标象限停留时间 Fig. 4 The target quarter retention time on the 9th day of different groups |
图 5为水迷宫测试第9 d,对小鼠进行空间记忆能力检测的游泳轨迹图.由图 5可知,阴性对照组小鼠游泳集中在原放置平台的象限(第Ⅱ象限),而DIDP15组、DIDP150组、FA组,及FA+DIDP组小鼠游泳轨迹较散乱,不规则.FA+DIDP+VitE组较FA+DIDP组小鼠游泳较多集中在第Ⅱ象限.
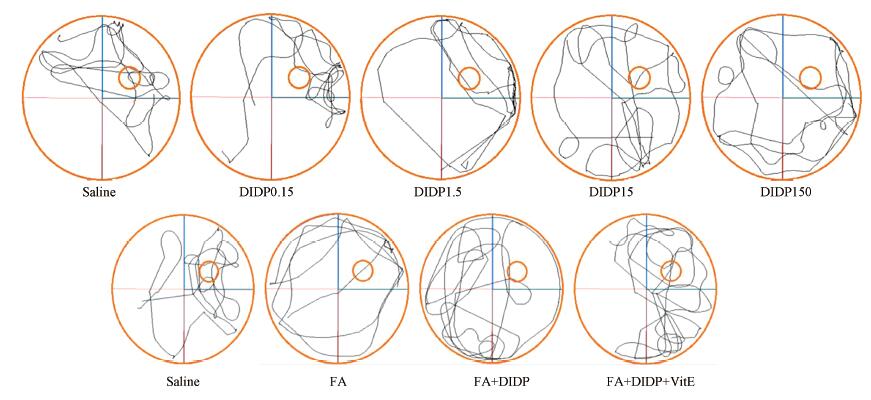 |
| 图 5 不同处理组小鼠游泳轨迹图 Fig. 5 The swimming tracks of different groups |
H&E染色结果显示(图 6),Saline组小鼠海马CA1区锥体细胞层次较多、较厚,细胞排列整齐,分布均匀.随着DIDP染毒浓度的升高,由DIDP0.15组~DIDP150组海马CA1区椎体细胞损伤程度逐渐加重,在DIDP150组出现细胞肿胀变圆.FA+DIDP组损伤较FA组严重,CA1区椎体细胞排列明显变疏松散乱,可见大量神经元丢失,神经细胞固缩或细胞内呈空泡样改变,FA+DIDP+VitE阻断剂保护组细胞虽仍有损伤,但与FA+DIDP染毒组相比细胞排列较规则,细胞层较厚,损伤程度下降.
 |
| 图 6 小鼠海马CA1区H&E染色40x镜观察图 Fig. 6 H&E staining of mice hippocampal CA1 area 40x microscopic view |
Nissl染色结果显示(图 7),Saline组小鼠海马CA1区神经细胞结构清晰,胞体较小,轴状树突较长,细胞质均匀透亮,核仁清晰,尼氏小体(Nissl substance)丰富.随着DIDP染毒浓度的升高,海马CA1区椎体细胞出现不同程度的损伤,细胞内Nissl小体含量显著下降.DIDP15组和DIDP150组出现尼氏小样丢失,细胞出现深染、皱缩,说明细胞出现老化现象.FA+DIDP组损伤较FA组严重,CA1区大量细胞胞浆固缩、深染,部分细胞质呈空泡样(cytoplasmic vacculation)病变,尼氏小体减少.FA+DIDP+VitE阻断剂保护组细胞虽仍有损伤,但与FA+DIDP染毒组相比,细胞形态较规则,尼氏小体减少有所缓解,损伤程度有所下降.
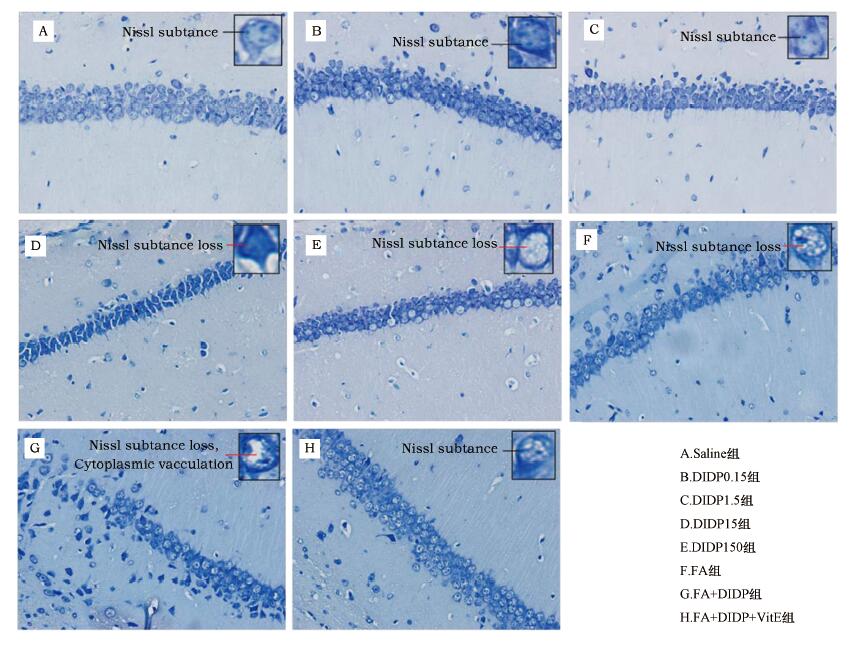 |
| 图 7 小鼠海马CA1区Nissl染色40x镜观察图 Fig. 7 Nissl staining of mice hippocampal CA1 area 40x microscopic view |
由图 8可知,脑组织氧化应激水平检测结果,DIDP暴露后小鼠脑组织匀浆中ROS、MDA、8-OHdG的含量随着DIDP染毒浓度升高均出现不同程度的上升,FA+DIDP组较FA组上述3个指标含量均明显上升,FA+DIDP+VitE阻断剂保护组较FA+DIDP组上述3个指标含量下降;GSH含量随DIDP染毒浓度升高而下降,FA+DIDP组较FA组含量下降,FA+DIDP+VitE组较FA+DIDP组含量上升.
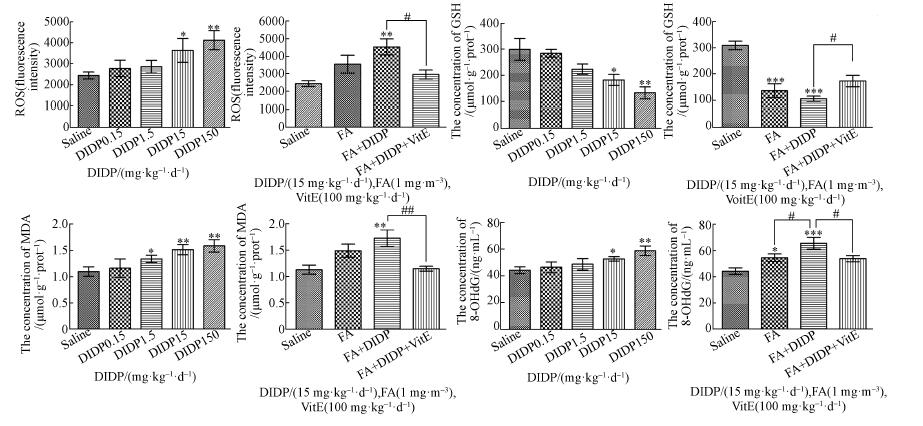 |
| 图 8 脑组织匀浆中氧化应激指标测试结果 Fig. 8 Oxidative Stress test results in brain tissue homogenate |
邻苯二甲酸酯是目前全球性的环境污染物质之一.DIDP作为新型增塑剂中的一种,由于具有毒性小,性能优良的特点而被越来越广泛的应用,它的广泛应用引起的潜在危险值得我们注意和研究.由于人类神经系统中成熟神经元不能通过增殖以进行自我修复,使得该系统特别容易受到环境污染物的影响而造成损伤(Ma et al., 2015).在这项研究中,我们评估了暴露于DIDP和FA对小鼠学习记忆能力、海马CA1区病理损伤和脑组织氧化应激水平的影响,并研究了阻断剂VitE对二者联合所致氧化损伤的保护作用.
暴露于DIDP和FA后,小鼠水迷宫实验显示学习记忆能力的下降,训练前7 d,DIDP15组、DIDP150组、FA组、FA+DIDP组小鼠需要较阴性对照组更长的时间来寻找逃逸平台.换言之,来自这些组的小鼠学习能力受到不同程度的破坏;另外,上述4组的小鼠,在目标象限(第Ⅱ象限)游泳所占时间较少,其游泳轨迹较不规则,较无目的性,说明其对目标平台位置记忆能力较差.FA+DIDP+VitE组较FA+DIDP组小鼠,训练前7 d,平均逃逸潜伏期较短,即找到逃逸平台的耗时较短,且在目标象限停留时间较长,游泳轨迹也较多集中在目标象限,说明FA+DIDP+VitE组较FA+DIDP组小鼠游泳较有目的性,学习、记忆能力有所改善.
随着DIDP染毒浓度升高,小鼠海马CA1区神经细胞和组织结构破坏明显,FA+DIDP组较FA组损伤更为严重,FA+DIDP+VitE阻断剂保护组虽仍有损伤,但与FA+DIDP染毒组相比,损伤程度有所减轻.说明FA和DIDP联合使得损伤较单独染毒加重,加用VitE对二者联合造成的损伤起到了一定的保护作用.
口服暴露DIDP和吸入甲醛都可引起机体产生氧化应激反应.氧化应激(Oxidative Stress, OS)是指体内氧化与抗氧化作用的失衡,更倾向于氧化,导致体内活性氧(reactive oxygen species, ROS)产生过多,体内自由基蓄积,超过局部抗氧化能力,引起细胞或组织氧化损伤的过程(刘朝巍等, 2008).氧化应激是导致疾病和衰老的重要因素之一(李国林等, 2007).高水平的氧化应激可以诱导炎症反应,导致细胞增殖、分化或死亡等.本研究中,随着DIDP染毒剂量的升高,ROS含量逐渐上升,其中DIDP15组、DIDP150组、和FA+DIDP组ROS含量较阴性对照组显著上升,FA+DIDP+VitE组较FA+DIDP组ROS含量下降,差异具有统计学意义(p < 0.05, p < 0.01).说明DIDP暴露可导致活性氧含量上升,与Shen等(2016)的研究中,DIDP诱导活性氧的显着增加结果一致.
机体本身存在抗氧化系统,一类是酶抗氧化系统,包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px),过氧化氢酶(CAT)等;另一类为非酶抗氧化系统,包括维生素C、维生素E、谷胱甘肽、褪黑素等(常君瑞, 徐东群, 2006).GSH是体内重要的还原性剂和自由基清除剂,其含量的多少反映机体抗氧化能力的强弱.本研究中,DIDP15组、DIDP150组、FA组和FA+DIDP组GSH含量较阴性对照组显著下降,FA+DIDP+VitE组较FA+DIDP组GSH含量上升,差异具有统计学意义(p < 0.05, p < 0.01).说明DIDP暴露致使机体抗氧化物质GSH含量下降,与Ma等(2015)关于DINP致GSH含量下降的研究结果一致.
在产生大量自由基的氧化还原不平衡的环境中,即氧化应激状态,可能引起大分子、膜和DNA的氧化损伤,对细胞功能和活力不利(Dworakowski et al., 2006).自由基在生物体内产生脂质过氧化过程,MDA是脂质过氧化的检测指标,间接反映细胞损伤程度(Gaweł et al., 2004).本研究中,DIDP1.5组、DIDP15组、DIDP150组和FA+DIDP组MDA含量较阴性对照组显著上升,FA+DIDP+VitE组较FA+DIDP组MDA含量下降,差异具有统计学意义(p < 0.05, p < 0.01).说明较高剂量DIDP诱导小鼠脑组织细胞发生脂质过氧化,使细胞膜结构发生损伤.
8-OHdG是活性氧自由基攻击DNA的氧化基本产物,是评价DNA氧化损伤的重要生物标志物(Vallyathan, Shi, 1997).线粒体DNA中的高水平8-OHdG可能由巨大的氧代谢,相对低效的DNA修复以及线粒体中组蛋白的缺失引起(Richter et al., 1988).DNA的氧化损伤可能在正常衰老和神经退行性疾病中发挥作用(Patrizia Mecocci et al., 1994).本研究中,DIDP15组、DIDP150组、FA组和FA+DIDP组8-OHdG含量较阴性对照组显著上升,FA+DIDP+VitE组较FA+DIDP组8-OHdG含量下降,差异具有统计学意义(p < 0.05, p < 0.01).说明较高剂量DIDP可以引起小鼠脑组织DNA氧化损伤.
综上所述,DIDP15组、DIDP150组、FA组和FA+DIDP组小鼠,与阴性对照组比较,氧化应激水平升高,学习记忆能力下降,15 mg·kg-1·d-1的DIDP联合1 mg·m-3的FA暴露存在毒性相加或一定的协同作用;FA+DIDP+VitE组较FA+DIDP组氧化损伤减轻,100 mg·kg-1·d-1的VitE显著降低了FA+DIDP联合造成的氧化损伤,且使小鼠的学习记忆能力得到改善.
本研究验证了DIDP对学习记忆的不利影响,证明新型增塑剂DIDP存在一定的神经毒性作用,但其造成神经毒性的分子机制仍不甚清楚,有关其毒性的充分科学证据及机制仍需不断深入研究.
5 结论(Conclusions)新型增塑剂DIDP(15、150 mg·kg-1·d-1)21 d重复染毒,可通过氧化应激引起小鼠脑组织氧化损伤,从而导致小鼠学习记忆能力降低,且差异具有统计学意义;同时15 mg·kg-1·d-1 DIDP可加重1 mg·m-3 FA造成的学习记忆能力下降,二者联合存在毒性相加的作用;VitE可通过降低小鼠脑组织氧化应激水平,对FA+DIDP联合暴露所造成的小鼠学习记忆能力下降起到一定的保护作用.
Andaluri G, Manickavachagam M, Suri R. 2018. Plastic toys as a source of exposure to bisphenol-A and phthalates at childcare facilities[J]. Environmental Monitoring & Assessment, 190(2): 65.
|
Ahmed H H, Morsy F A, El-Nabarawy S K, et al. 2016. Lycopene:an effective neuroprotective option against neurodeterioration induced by formaldehyde inhalation[J]. Comparative Clinical Pathology, 25(6): 1171–1184.
DOI:10.1007/s00580-016-2323-0
|
Carbone S, Samaniego Y A, Cutrera R, et al. 2012. Different effects by sex on hypothalamic-pituitary axis of prepubertal offspring rats produced by in utero and lactational exposure to di-(2-ethylhexyl) phthalate (DEHP)[J]. Neurotoxicology, 33(1): 78–84.
DOI:10.1016/j.neuro.2011.11.009
|
常君瑞, 徐东群. 2006. 甲醛对机体超氧化物歧化酶、谷胱甘肽过氧化物酶和丙二醛的影响[J]. 卫生研究, 2006, 35(5): 653–655.
DOI:10.3969/j.issn.1000-8020.2006.05.043 |
Dimitrov M, Nikolova I, Benbasat N, et al. 2011. Acute toxicity, antidepressive and mao inhibitory activity of mangiferin isolated from hypericum aucheri[J]. Biotechnology & Biotechnological Equipment, 25(4): 2668–2671.
|
Dworakowski R, Anilkumar N, Zhang M, et al. 2006. Redox signalling involving NADPH oxidase-derived reactive oxygen species[J]. Biochemical Society Transactions, 34(5): 960–964.
DOI:10.1042/BST0340960
|
EF SA. 2005. Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food (AFC) on a request from the Commission related to Diisodecylphthalate (DIDP) for use in food contact materials[J]. The EFSA Journal, 245: 1–14.
|
Gaweł S, Wardas M, Niedworok E, et al. 2004. Malondialdehyde (MDA) as a lipid peroxidation marker[J]. Wiadomosci Lekarskie, 57(9/10): 453–455.
|
Halden R U. 2010. Plastics and Health Risks[J]. Annu Review Public Health, 31(1): 179–194.
DOI:10.1146/annurev.publhealth.012809.103714
|
Hushka L J, Waterman S J, Keller L H, et al. 2001. Two-generation reproduction studies in Rats fed diisodecyl phthalate[J]. Reproductive Toxicology, 15(2): 153–169.
DOI:10.1016/S0890-6238(01)00109-5
|
胡雄星, 韩中豪, 刘必寅, 等. 2007. 邻苯二甲酸酯的毒性及其在环境中的分布[J]. 环境科学与管理, 2007, 32(1): 37–40.
DOI:10.3969/j.issn.1673-1212.2007.01.010 |
Jr G L, Barlow N J, Howdeshell K L, et al. 2009. Transgenerational effects of Di (2-ethylhexyl) phthalate in the male CRL:CD(SD) rat:added value of assessing multiple offspring per litter[J]. Toxicological Sciences, 110(2): 411–425.
DOI:10.1093/toxsci/kfp109
|
Lebel C P, Ischiropoulos H, Bondy S C. 1992. Evaluation of the probe 2', 7'-dichlorofluorescin as an indicator of reactive oxygen species formation and oxidative stress[J]. Chemical Research in Toxicology, 5(2): 227–231.
DOI:10.1021/tx00026a012
|
李国林, 印大中. 2007. ROS介导的蛋白质氧化的生化机制[J]. 生命的化学, 2007, 27(6): 516–520.
DOI:10.3969/j.issn.1000-1336.2007.06.017 |
Liu X, Zhang Y, Li J, et al. 2014. Cognitive deficits and decreased locomotor activity induced by single-walled carbon nanotubes and neuroprotective effects of ascorbic acid[J]. International Journal of Nanomedicine, 9(1): 823–839.
|
刘朝巍, 张涛, 杨卓. 2008. 氧化应激损伤线粒体参与癫痫病理过程[J]. 中国病理生理杂志, 2008, 24(1): 198–200.
DOI:10.3321/j.issn:1000-4718.2008.01.050 |
Lu Z, Li C M, Qiao Y, et al. 2008. Effect of inhaled formaldehyde on learning and memory of mice[J]. Indoor Air, 18(2): 77–83.
DOI:10.1111/j.1600-0668.2008.00524.x
|
陆林洁, 蔡洁, 安结然, 等. 2017. 甲醛与DEHP联合染毒对小鼠学习记忆能力的影响[J]. 中国环境科学, 2017, 37(12): 4751–4762.
DOI:10.3969/j.issn.1000-6923.2017.12.041 |
Malek F A, Möritz K U, Fanghänel J. 2003. A study on the effect of inhalative formaldehyde exposure on water labyrinth test performance in rats[J]. Annals of Anatomy-Anatomischer Anzeiger, 185(3): 277–285.
DOI:10.1016/S0940-9602(03)80040-7
|
Ma P, Liu X, Wu J, et al. 2015. Cognitive deficits and anxiety induced by diisononyl phthalate in mice and the neuroprotective effects of melatonin[J]. Scientific Reports, 5: 14676.
DOI:10.1038/srep14676
|
Mckee R H, Przygoda R T, Chirdon M A, et al. 2000. Di(isononyl) phthalate (DINP) and di(isodecyl) phthalate (DIDP) are not mutagenic[J]. Journal of Applied Toxicology, 20(6): 491–497.
DOI:10.1002/(ISSN)1099-1263
|
Min A, Liu F, Yang X, et al. 2014. Benzyl butyl phthalate exposure impairs learning and memory and attenuates neurotransmission and CREB phosphorylation in mice[J]. Food & Chemical Toxicology, 71(8): 81–89.
|
Mikula P, Svobodova Z, Smutna M. 2005. Phthalates:toxicology and food safety-a review[J]. Czech Journal of Food Sciences, 23(6): 217–223.
|
Ohkawa H, Ohishi N, Yagi K, et al. 1979. Assay of lipid peroxides in animal tissue by thiobarbituric acid reaction[J]. Analytical Biochemistry, 95(2): 351–358.
DOI:10.1016/0003-2697(79)90738-3
|
Patrizia Mecocci M D, Usha MacGarvey M S, Beal D M F. 1994. Oxidative damage to mitochondrial DNA is increased in Alzheimer's disease[J]. Annals of Neurology, 36(5): 747–751.
DOI:10.1002/(ISSN)1531-8249
|
Qin W, Deng T, Cui H, et al. 2018. Exposure to diisodecyl phthalate exacerbated Th2 and Th17-mediated asthma through aggravating oxidative stress and the activation of p38 MAPK[J]. Food & Chemical Toxicology, 114: 78–87.
|
Richter C, Park J W, Ames B N. 1988. Normal oxidative damage to mitochondrial and nuclear DNA is extensive[J]. Proceedings of the National Academy of Sciences of the United States of America, 85(17): 6465–6467.
DOI:10.1073/pnas.85.17.6465
|
Smith C A, Macdonald A, Holahan M R. 2011. Acute postnatal exposure to di(2-ethylhexyl) phthalate adversely impacts hippocampal development in the male rat[J]. Neuroscience, 193(193): 100–108.
|
Shen S, Li J, You H, et al. 2016. Oral exposure to diisodecyl phthalate aggravates allergic dermatitis by oxidative stress and enhancement of thymic stromal lymphopoietin[J]. Food & Chemical Toxicology, 99: 60–69.
|
Swan S H. 2008. Environmental phthalate exposure in relation to reproductive outcomes and other health endpoints in humans[J]. Environmental Research, 108(2): 177–184.
DOI:10.1016/j.envres.2008.08.007
|
Tang J Q, Yuan Y, Wei C X, et al. 2015. Neurobehavioral changes induced by di(2-ethylhexyl) phthalate and the protective effects of vitamin E in Kunming mice[J]. Toxicology Research, 4(4): 1006–1015.
DOI:10.1039/C4TX00250D
|
Tang X, Bai Y, Duong A, et al. 2009. Formaldehyde in China:production, consumption, exposure levels, and health effects[J]. Environment International, 35(8): 1210–1224.
DOI:10.1016/j.envint.2009.06.002
|
Tang X Q, Zhuang Y Y, Zhang P, et al. 2013. Formaldehyde impairs learning and memory involving the disturbance of hydrogen sulfide generation in the hippocampus of rats[J]. Journal of Molecular Neuroscience, 49(1): 140–149.
DOI:10.1007/s12031-012-9912-4
|
陶刚, 梁诚. 2008. 国内外增塑剂市场分析与发展趋势[J]. 塑料科技, 2008, 36(6): 78–81.
DOI:10.3969/j.issn.1005-3360.2008.06.013 |
Usanmaz S E, Akarsu E S, Vural N. 2002. Neurotoxic effects of acute and subacute formaldehyde exposures in mice[J]. Environmental Toxicology & Pharmacology, 11(2): 93–100.
|
Vallyathan V, Shi X. 1997. The role of oxygen free radicals in occupational and environmental lung diseases[J]. Environmental Health Perspectives, 105(Suppl 1): 165–177.
DOI:10.1289/ehp.97105s1165
|
王宏. 2011. 增塑剂的生产及研发现状[J]. 化学工程与装备, 2011, 40(9): 190–192.
|
 2018, Vol. 38
2018, Vol. 38


