1, 2, 4-三氯苯(1, 2, 4 -TCB)作为一种化学原料和中间体,在农药、染料、医药、消毒等行业中被广泛应用(Rapp,2001;刘军等,2002;Zhang et al., 2005),目前已在多种环境介质中被检出(宋洋等,2011).由于其持久性、高毒性及随食物链的富集性(Adebusoye et al., 2007),美国环境保护局(EPA)已将其列入31种环境优先控制污染物名单.目前,地下水中1, 2, 4 -TCB污染的修复技术主要有抽出处理技术(蒲敏,2017)、土壤气相抽提法(殷甫祥等,2010)、生物修复(宋洋等,2011)、可渗透反应墙(张晓慧等,2015)等.由于物理修复和化学修复存在处理成本高、易产生二次污染、工程可行性差等缺点,未得到更广泛的应用.而以厌氧降解为代表的微生物修复具有投资少、操作简单、对周围环境影响小且不产生二次污染等优点(曲传阳等,2007),在降解和转化氯苯类污染物方面表现出了巨大的潜力(陈朱蕾等,2006;Yoshikawa et al., 2007).
氯苯类化合物(CBs)的微生物降解机制包括好氧降解、还原脱氯和共代谢.由于氯原子强烈吸引电子云,使苯环上电子云密度降低,在好氧条件下,氧化酶很难从苯环上获取电子而发生氧化反应;而在厌氧条件下,环境的氧化还原电位较低,CBs显示出较好的厌氧生物降解性,且其降解性随氯原子的增多而提高,因而厌氧降解是CBs降解的一个重要途径(甘平等,2000;Wu et al., 2002).另外,地下水原位修复过程中由于水中溶解氧的含量低(Boopathy,2000;Kaschl et al., 2005),而注入氧气的费用高、难度大(Farhadian et al., 2008),及氯苯类污染物可能形成DNAPLs迁移至地下深层厌氧区域,如承压含水层(Fung et al., 2009;Nelson et al., 2011; 2014;Zhou et al., 2015),致使其难以进行好氧降解.因此,厌氧转化过程是CBs进行地下水原位修复的重要机制.研究表明,厌氧条件下,微生物可以通过脱氯共呼吸作用,将CBs还原脱氯(Holliger et al., 1999).
南京某化工厂生产荧光增白剂135(PF),厂区分布如图 1所示.PF是具有双苯并唑对称型结构的复杂有机化合物,几乎不溶于水,在纺织纤维和食品包装行业应用广泛,基本性质见表 1.场地调查发现研究区浅层含水层主要由灰色的粘土质淤泥组成,而深层含水层主要由褐色的粉质粘土构成,地下水环境为厌氧(水质参数见表 2)且存在多种污染物:1, 2, 4-三氯苯(TCB)、二氯苯同分异构体(DCB)、一氯苯(MCB)、苯.其中污染最严重的是1, 2, 4-TCB,2013年S1点水样浓度达到7300 μg·L-1,比荷兰干预值(DIV)高出730倍.对比2013年和2016场地样品的监测结果(表 3和表 4),可以发现地下水中这些污染物的浓度有逐渐降低的趋势,Cl-的浓度明显增大,说明很可能存在厌氧条件下氯苯类化合物的自然降解.
 |
| 图 1 南京某厂区监测井和钻孔的分布图 Fig. 1 Layout of the Nanjing Site with monitoring wells and soil borings |
| 表 1 PF的基本性质 Table 1 Basic properties of PF |
| 表 2 场地各监测点水质参数 Table 2 Water quality parameters of the site monitoring points |
| 表 3 2013年地下水污染物监测结果 Table 3 Concentrations of contaminants in groundwater in 20133 |
| 表 4 2016年地下水污染物监测结果 Table 4 Concentrations of contaminants in groundwater in 2016 |
为了验证该场地菌群对氯苯类污染物的厌氧脱氯自然降解过程,并研究PF对该脱氯过程的影响,本文选择地下水污染程度最高的1, 2, 4-TCB为典型污染物,研究1, 2, 4-TCB厌氧脱氯过程和PF对该过程的影响.研究结果为揭示南京某场地地下水中氯苯类污染物自然衰减机制及地下水1, 2, 4 -TCB污染场地原位生物修复提供重要依据,也可供其它类似污染场地借鉴.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 样品实验所用水土样取自南京某受氯苯类污染物污染的化工厂,厂区分布如图 1所示.土样取自1, 2, 4-TCB浓度高的S1钻孔地面以下1.5~2 m处,储存在离心管内并立即用封口膜和自封袋密封以隔离氧气.水样取自W4监测井并储存在棕色瓶内,装满整个瓶子并用封口膜隔离氧气.所有的样品都放置于4 ℃冰箱中保存,并在1周内开展室内实验.
2.1.2 主要化学试剂化学试剂:1, 2, 4-TCB、1, 3-DCB、1, 2-DCB、1, 4-DCB、MCB、苯均为Sigma-Aldrich产品,纯度≥99%;PF标准品(≥98%):FWA135 (沃凯国药);实验用水为超纯水.
2.1.3 CBs标准储备液由于CBs在水中的溶解度极低,采用有机溶剂甲醇作为它的助溶剂.标准储备液配方见表 5,在4 ℃下避光保存.
| 表 5 标准储备液配方 Table 5 Standard stock solution formulation |
① NaHCO3溶液:6 g NaHCO3,无菌去离子水1 L;② Na2S溶液:0.5 g Na2S·9H2O,无菌去离子水1 L;③ NH4Cl溶液:0.285 gNH4Cl,无菌去离子水1 L;④ MgCl2溶液:0.2 g MgCl2·6H2O,无菌去离子水1 L;⑤ K2HPO4溶液:0.1 g K2HPO4·3H2O,无菌去离子水1 L;⑥ FeCl2溶液:0.1 g FeCl2·4H2O,无菌去离子水1 L;⑦ KH2PO4溶液:0.055 g KH2PO4,无菌去离子水1 L;⑧刃天青溶液:0.001 g刃天青,无菌去离子水1 L.
配好的指示剂为黑色溶液,有悬浮颗粒.实验时,将指示剂露置于厌氧培养箱中,如指示剂仍保持黑色,厌氧培养箱处于厌氧状态;如指示剂变为红色,则厌氧箱仍未达到厌氧状态.
2.2 实验设备Tekmar HT3顶空自动进样器;Agilent 6890N气相色谱仪,配FID火焰检测器;Agilent DB-5ms毛细管色谱柱(30 m×250 μm×0.25 μm);上海新苗厌氧培养箱;Minipore synergy超纯水机;厌氧手套袋(Aldrich AtmosBag).
2.3 实验方法 2.3.1 实验步骤① 水土样的分装和转移是在充满惰性气体(二氧化碳/氮气:20%/80%)的一次性厌氧手套袋内进行的.取30 g土样、165 mL地下水,置于250 mL透明玻璃瓶中(一共9瓶,供下列3组实验使用).玻璃瓶配有保证气密性的带阀瓶盖,通过手动开闭阀门来确保后期取样过程中整个体系的厌氧环境.
② 设置3组实验:1)高温灭菌组(a组);2)只添加TCB组(b组);3)添加TCB和PF组(c组).实验过程中,为确保实验数据的准确性,减少实验误差,每组实验均做3个平行样.3组均投喂15.96 μmol 1, 2, 4-TCB,第3组额外添加17.24 μmol PF(c1、c2、c3).
③ 分装转移好水土样之后,盖上瓶盖并关闭阀门,将样品瓶转移至厌氧培养箱,并持续提供气体混合物(CO2/H2/N2:10%/10%/80%),室温下静置避光培养.
④ 静置2~3 d后取实验瓶中上清液测定1, 2, 4-TCB含量作为初始浓度(测试方法见2.3.2节),之后定期进行取样、测样并分析1, 2, 4-TCB及还原脱氯产物的浓度随时间的变化趋势.实验过程中所有的脱氯菌群均采用间歇式投喂的方法进行培养,即每隔一段时间待体系内投喂的1, 2, 4-TCB消耗完全、紧接着再次投喂1, 2, 4-TCB,以达到驯化的效果.
2.3.2 分析方法1, 2, 4-TCB及其还原脱氯产物采用顶空气相色谱法进行测定.FID火焰检测器温度为250 ℃,柱温程序为:初始35 ℃保持1.5 min,以15 ℃·min-1的速度升温至100 ℃,再以5 ℃·min-1的速度升温至185 ℃后保持10 min,最后以20 ℃·min-1的速度升温至200 ℃后保持10 min.氮气作为载气,分流比20:1,载气流速为18.8 mL·min-1.
顶空自动进样器分析条件:炉温:90 ℃;传输线温度:100 ℃;定量环温度:70 ℃;样品平衡时间:40 min.
2.3.3 方法的质量控制用气密性注射器分别吸取不同体积的标准储备液溶于200 mL超纯水中,将其稀释成相应浓度的DBs标准溶液,具体参数见表 6.标准溶液配制完成后避光静置3~5 d,待气液两相平衡后,在2.3.2节色谱条件下进样,以目标组分的峰面积y对相应的质量浓度x(mg·L-1)进行线性回归,确定该分析方法的线性关系.
| 表 6 标准溶液配制 Table 6 Standard solution formulation |
分析方法的检出限和定量限依照美国EPA和中国环境保护标准HJ 168-2010给出的t检验法进行确定.由于空白试验未检测出CBs,故对浓度为估计方法检出限3~5倍的样品进行7次平行测定.计算7次平行测定的标准误差,并依照标准给出的公式计算方法检出限,以4倍检出限作为方法定量限.
分析方法的回收率和精密度通过阴性样品(不含CBs的空白样)的添加回收试验进行日内考察,即分别在空白样中添加低、中、高3个浓度水平,将各加标样品的测定结果从GC标曲上读出,代入加标回收率公式:加标回收率=加标样品测定值/加标量×100%,得到CBs在不同加标水平下的回收率.
2.3.4 降解率计算方法降解率依据零级动力学计算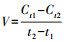
以目标组分的峰面积y与相应的质量浓度x(mg·L-1)进行线性回归,结果见图 2.由图 2可知,在CBs标样浓度范围内,可决系数R2 >0.998,表明被分析物浓度和相应的峰面积呈良好的线性关系.方法检出限和定量限的结果见表 7.
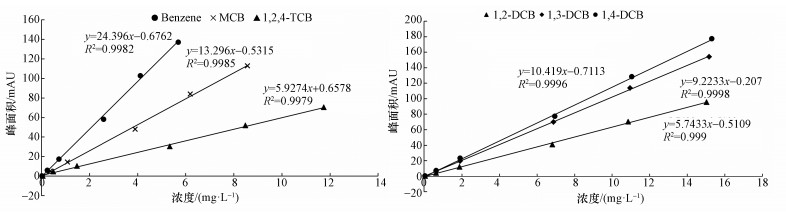 |
| 图 2 CBs的标准曲线 Fig. 2 Standard curves of CBs |
| 表 7 CBs的方法检出限和方法定量限(n=7) Table 7 Limits of detection and quantification for CBs (n=7) |
方法回收率和相对标准偏差(RSD)见表 8.由表 8可知,CBs加标浓度在0.05 ~20 mg·kg-1时,回收率在82.8% ~ 94.3%之间,相对标准偏差在2.46%~4.11%之间.
| 表 8 CBs在不同加标水平下的回收率及相对标准偏差(n=6) Table 8 Recovery and RSD of CBs (n=6) |
如表 4所示,2016年再次取样时样品中仍含有污染物,但浓度值已经很低.场地取样完成后样品在实验室放置5 d之后才开始进行水土样的分装和转移,导致测试初始浓度未检出,故将实验采用的反应体系中1, 2, 4-TCB的初始含量定为15.96 μmol.
尽管各实验组平行样间的总体降解趋势是相似的,但每个样品瓶的脱氯速率略有不同.灭菌组3个实验瓶的降解图以均值的方式在一张图中展示(图 3),样品间的标准差以误差棒的形式表示.由图 3可知,灭菌组实验瓶内的1, 2, 4-TCB含量基本保持不变,说明灭菌组没有脱氯活动,所以分析实验组数据时,不需扣除灭菌对照组的数据.
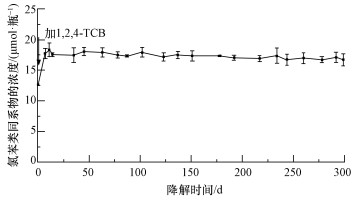 |
| 图 3 灭菌组各样品瓶内1, 2, 4-TCB的降解 (箭头表示进行投喂, 误差线代表平均标准差) Fig. 3 Degradation of 1, 2, 4-TCB in sterilization control bottles (The arrows represent different feeding events and error bars are +/- one standard deviation of the mean.) |
由于厌氧降解周期长达300 d,且不同脱氯阶段对应的时间段不一样,故本文仅展示第一次脱氯过程的速率表.各实验组平行样间的脱氯开始时间和脱氯速率差别较大,造成这一现象的主要原因是微生物易被土壤吸附,实验所用土样为粉质粘土,非均质性强,随机取30 g土样置于各样品瓶,容易出现各样品间降解菌数量不一致.
3.3.1 1, 2, 4-TCB还原脱氯TCB组各样品瓶内1, 2, 4-TCB的脱氯过程显示出一定的规律性,脱氯速率见表 9.降解图以样品瓶b1(图 4a)为例进行阐述.由图 4a可知,在滞后约7周后1, 2, 4-TCB开始脱氯,在第14周左右消耗完全.脱氯速度从第8周的0.05 μmol·d-1增加到第12周的1.02 μmol·d-1.脱氯产物1, 2-DCB、1, 3-DCB、1, 4-DCB的摩尔比率约为10%、35%、55%.1, 2, 4-TCB发生还原脱氯反应形成1, 2-DCB、1, 3-DCB、1, 4-DCB的Gibbs自由能依次是-147.3、-149.9和-153.4 kJ·mol-1,即1, 2, 4-TCB发生还原脱氯反应的产物顺序应该是1, 4-DCB>1, 3-DCB>1, 2-DCB(Adrian et al., 2002).本次实验结果也印证了1, 2, 4-TCB的这一脱氯规律.后续再次投喂1, 2, 4-TCB,脱氯速度增加到7 μmol·d-1,几乎可在48 h内将1, 2, 4-TCB完全降解.降解速率会随着投喂次数的增加而越来越快,主要是因为投喂过程中降解菌的富集,且降解速率与降解菌的数量成正比(Keller et al., 2018).
| 表 9 1, 2, 4-TCB在实验组条件下的脱氯速率 Table 9 The dechlorination rate of 1, 2, 4-TCB in active microcosm bottles |
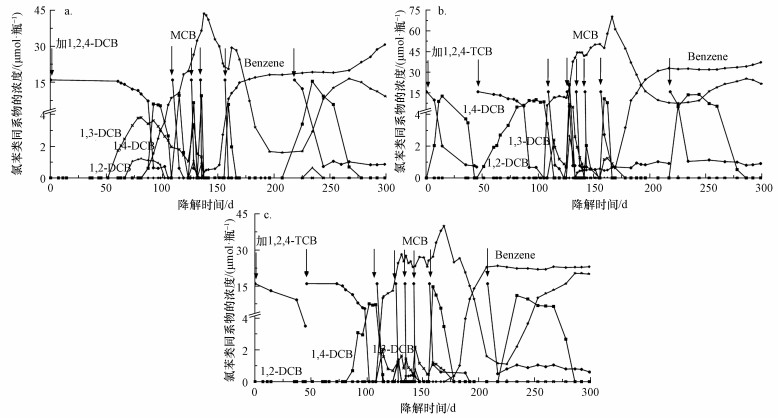 |
| 图 4 TCB组各样品瓶内的菌群对1, 2, 4-TCB的降解 (箭头表示进行投喂,a.样品瓶b1,b.样品瓶b2,c.样品瓶b3) Fig. 4 Degradation of 1, 2, 4-TCB by microbes in TCB-amended condition (The arrows represent different feeding events, a.Bottle b1, b.Bottle b2, c.Bottle b3) |
比较第1次投喂1, 2, 4-TCB之后各样品瓶内降解菌的响应,样品瓶b2(图 4b)的脱氯速度最快,投喂之后不到1周1, 2, 4-TCB就开始降解并产生1, 4-DCB.脱氯速度从第1周的0.89 μmol·d-1升到第2周的1.1 μmol·d-1再降到第3周的0.07 μmol·d-1,说明降解菌的降解速率和1, 2, 4-TCB的浓度有关.随着降解过程的推进,1, 2, 4-TCB的含量逐渐降低,降解速率也随之减小.
3.3.2 DCBs还原脱氯DCBs的脱氯速率见表 10~12.鉴于实验周期长达1年,投喂总次数达到8次,且实验后半段的降解趋势和前半段一致,为了更加清晰地看到该阶段DCB各同分异构体的变化情况,以b1瓶第50 ~160 d为例对DCBs的降解过程进行阐述.如图 5所示,1, 2-DCB和1, 3-DCB先脱氯产生MCB.1, 4-DCB滞后约两周之后开始降解,脱氯速度从第14周的0.19 μmol·d-1增加到第17周的0.88 μmol·d-1,并在第108 d左右消耗完全.虽然1, 2-DCB和1, 3-DCB比1, 4-DCB先开始降解,但脱氯速度相对缓慢,1, 2-DCB的脱氯速度从第12周的0.001 μmol·d-1增加到第15周的0.21 μmol·d-1,1, 3-DCB的脱氯速度从第12周的0.06 μmol·d-1增加到第17周的0.14 μmol·d-1.在后续投喂过程中,可以看到随着投喂次数的增加,DCBs的降解速度越来越快,1, 2、1, 3、1, 4-DCB在第20周时的脱氯速度分别为0.46、0.76和4.71 μmol·d-1.
| 表 10 1, 2-DCB在实验组条件下的脱氯速率 Table 10 The dechlorination rate of 1, 2-DCB in active microcosm bottles |
| 表 11 1, 3-DCB在实验组条件下的脱氯速率 Table 11 The dechlorination rate of 1, 3-DCB in active microcosm bottles |
| 表 12 1, 4-DCB在实验组条件下的脱氯速率 Table 12 The dechlorination rate of 1, 4-DCB in active microcosm bottles |
 |
| 图 5 TCB组b1瓶内的菌群对1, 2, 4-TCB的降解 (箭头表示进行投喂) Fig. 5 Degradation of 1, 2, 4-TCB by microbes in TCB-amended condition (The arrows represent different feeding events) |
MCB的脱氯速率见表 13.由表 13和图 4a可知,DCBs降解产生的MCB在第160 d左右开始脱氯生成苯,脱氯速度从第23周的0.296 μmol·d-1到第25周的1.94 μmol·d-1再到第28周的0.007 μmol·d-1.后期降解活动的减缓可能和苯的大量累积有关,由于苯对微生物有很大的毒害性,当其含量积累到一定浓度之后,其毒性对菌体的抑制作用逐渐显现出来,表现为降解率的下降.我国地下水质量标准(GB/T 14848-2017)规定,当苯含量大于120 μg·L-1时即为Ⅴ类水(危害人体健康,不宜作为生活饮用水),美国职业安全卫生研究所(NIOSH)出版的《有害化学物手册》中规定苯的最大允许暴露量(PEL)为5 mg·L-1,TCB组各样品瓶内降解产生苯浓度(6~15 mg·L-1)远超过这两个限定值,证明实验后期苯对降解菌的毒害确实存在.
| 表 13 MCB在实验组条件下的脱氯速率 Table 13 The dechlorination rate of MCB in active microcosm bottles |
因PF在水中的溶解度只有0.05 mg·L-1,测定PF浓度需取大量水样,考虑到实验用血清瓶中水土样体积有限(约180 mL),大量取样会对实验体系造成扰动从而影响实验结果,所以实验过程中并未对PF的浓度变化进行定量监测.
TCB+PF组各样品瓶内1, 2, 4-TCB的脱氯过程显示出一定的规律性,对比TCB+PF组(图 6)和TCB组(图 2)各样品瓶内CBs的降解过程和脱氯速率,可以看到在整个降解周期内,TCB+PF组和TCB组的脱氯过程基本一致,两组实验1, 2, 4-TCB的脱氯产物都是1, 2-DCB、1, 3-DCB和1, 4-DCB,且摩尔比率约为10%、35%、55%;两组实验DCBs的脱氯产物都是MCB,且DCB各同分异构体的降解趋势基本保持同步,降解率最高可达100%.但MCB到苯的转化率TCB+PF组最高只有13.2%,远远小于TCB组(89.3%~96.3%).从PF的结构式可以看到其含不饱和碳个数较多,反应中多作为电子供体,而苯在生物降解过程中也是作为电子供体(Burland et al., 1999),相互间存在一定的竞争关系.
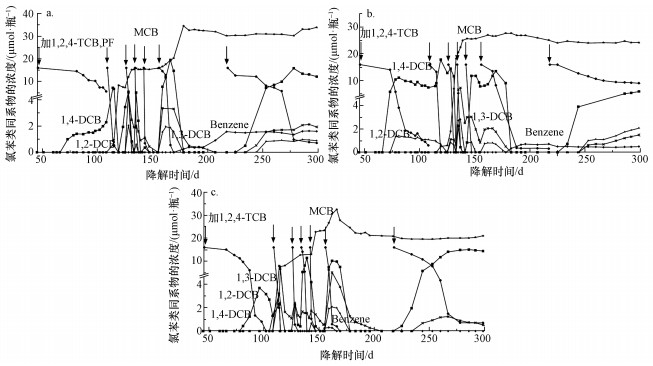 |
| 图 6 TCB+PF组各样品瓶内的菌群对1, 2, 4-TCB的降解 (箭头表示进行投喂,a.样品瓶c1,b.样品瓶c2,c.样品瓶c3) Fig. 6 Degradation of 1, 2, 4-TCB by microbes in TCB+PF-amended condition (The arrows represent different feeding events, a.Bottle c1, b.Bottle c2, c.Bottle c3) |
1) 实验结果证明,场地的土著微生物能够在厌氧条件下通过脱氯过程将1, 2, 4-TCB转化为DCBs、MCB并完全脱氯生成苯,为确认该场地能够发生自然降解提供了强有力的证据.
2) 1, 2, 4 -TCB的脱氯产物包括1, 2-DCB,1, 3-DCB和1, 4-DCB,摩尔比率约为10%、35%、55%.随1, 2, 4-TCB投喂次数的增加,降解菌的脱氯速度越来越快,最高可达到7 μmol·d-1,而DCBs和MCB的脱氯速度相对缓慢.1, 2-DCB和1, 3-DCB先脱氯产生MCB,1, 4-DCB滞后约两周开始降解,脱氯速度从第14周的0.19 μmol·d-1增加到第17周的0.88 μmol·d-1,并在第108 d左右消耗完全.虽然1, 2-DCB和1, 3-DCB比1, 4-DCB先开始脱氯,但脱氯速度相对缓慢,1, 2-DCB的脱氯速度从第12周的0.001 μmol·d-1增加到第15周的0.21 μmol·d-1,1, 3-DCB的脱氯速度从第12周的0.06 μmol·d-1增加到第17周的0.14 μmol·d-1.DCBs降解产生的MCB在第160 d左右开始脱氯生成苯,脱氯速度从第23周的0.296 μmol·d-1到第25周的1.94 μmol·d-1再到第28周的0.007 μmol·d-1.
3) 荧光增白剂PF并不会影响或者改变1, 2, 4-TCB的脱氯过程,但对MCB脱氯到苯的过程具有一定的抑制作用,致使MCB到苯的转化率很低.
Adebusoye S A, Picardal F W, Ilori M O, et al. 2007. Aerobic degradation of di-and trichlorobenzenes by two bacteria isolated from polluted tropical soils[J]. Chemosphere, 66(10): 1939–1946.
DOI:10.1016/j.chemosphere.2006.07.074
|
Adrian L, Görisch L. 2002. Microbial transformation of chlorinated benzenes under anaerobic conditions[J]. Research in Microbiology, 153(3): 131–137.
DOI:10.1016/S0923-2508(02)01298-6
|
Boopathy R. 2000. Factors limiting bioremediation technologies[J]. Bioresource Technology, 74(1): 63–67.
DOI:10.1016/S0960-8524(99)00144-3
|
Burland S M, Edwards E A. 1999. Anaerobic benzene biodegradation linked to nitrate reduction[J]. Applied and Environmental Microbiology, 65(2): 529–533.
|
陈朱蕾, 蔡新美, 张文静, 等. 2006. 六氯苯厌氧降解菌的筛选及其降解能力的研究[J]. 三峽大学学报(自然科学版), 2006, 28(6): 548–551.
|
EPA. 2010. Priority Chemicals[OL]. 2010-3-5. http://www.epa.gov/epawaste/hazard/wastemin/Priority.htm
|
Farhadian M, Vachelard C, Duchez D, et al. 2008. In situ bioremediation of monoaromatic pollutants in groundwater:a review[J]. Bioresource Technology, 99(13): 5296–5308.
DOI:10.1016/j.biortech.2007.10.025
|
Fung J M, Weisenstein B P, Mack E E, et al. 2009. Reductive dehalogenation of dichlorobenzenes and monochlorobenzene to benzene in microcosms[J]. Environmental Science & Technology, 43(7): 2302–2307.
|
甘平, 朱婷婷. 2000. 氯苯类化合物的生物降解[J]. 环境污染治理技术与设备, 2000, 1(4): 1–12.
|
Holliger C, Wohlfarth G, Diekert G. 1999. Reductive dechlorination in the energy metabolism of anaerobic bacteria[J]. FEMS Microbiol Reviews, 22(5): 383–398.
|
Kaschl A, Vogt C, Uhlig S, et al. 2005. Isotopic fractionation indicates anaerobic monochlorobenzene biodegradation[J]. Environmental Toxicology and Chemistry, 24(6): 1315–1324.
DOI:10.1897/04-321R.1
|
Keller A H, Kleinsteuber S, Vogt C. 2018. Anaerobic benzene mineralization by nitrate-reducing and sulfate-reducing microbial consortia enriched from the same site:Comparison of community composition and degradation characteristics[J]. Microbial Ecology, 75(4): 941–953.
DOI:10.1007/s00248-017-1100-1
|
刘军, 陈旭庚, 李家斌, 等. 2002. 1, 2, 4 -三氯苯的研究动态[J]. 中国工业医学杂志, 2002, 15(3): 161–163, 170.
DOI:10.3969/j.issn.1002-221X.2002.03.018 |
马桂科. 2011. 生物曝气法去除地下水中苯污染的研究[D]. 长春: 吉林大学
|
Nelson J L, Fung J M, Cadillo-Quiroz H, et al. 2011. A role for Dehalobacter spp.in the reductive dehalogenation of dichlorobenzenes and monochlorobenzene[J]. Environmental Science & Technology, 45(16): 6806–6813.
|
Nelson J L, Jiang J, Zinder S H. 2014. Dehalogenation of chlorobenzenes, dichlorotoluenes, and tetrachloroethene by three Dehalobacter spp[J]. Environmental Science & Technology, 48(7): 3776–3782.
|
彭淑婧, 李坚, 刘佳, 等. 2011. 焦化废水污泥中苯系物降解优势混合菌群筛选驯化[J]. 煤炭技术, 2011, 30(10): 185–187.
|
蒲敏. 2017. 污染场地地下水抽出处理技术研究[J]. 环境工程, 2017, 35(4): 6–10.
|
曲传阳, 贾凌云. 2007. 六氯苯环境清除技术研究进展[J]. 安徽农业科学, 2007, 35(22): 6895–6897.
DOI:10.3969/j.issn.0517-6611.2007.22.101 |
Rapp P. 2001. Multiphasic kinetics of transformation of 1, 2, 4-trichlorobenzene at nano-and micromolar concentrations by Burkholderia sp.strain PS14[J]. Applied and Environmental Microbiology, 67(8): 3496–3500.
DOI:10.1128/AEM.67.8.3496-3500.2001
|
宋洋, 王芳, 蒋新. 2011. 微生物降解1, 2, 4-三氯苯研究进展[J]. 土壤, 2011, 43(3): 343–349.
|
Wu Q, Milliken C E, Meier G P, et al. 2002. Dechlorination of chlorobenzenes by a culture containing bacterium DF-1, a PCB dechlorinating microorganism[J]. Environmental Science & Technology, 36(15): 3290–3294.
|
殷甫祥, 张胜田, 赵欣, 等. 2010. 气相抽提法(SVE)去除土壤中挥发性有机污染物的试验研究[J]. 农业环境科学学报(自然科学版), 2010, 29(8): 1495–1501.
|
Yoshikawa M, Zhang M, Toyota K. 2017. Integrated anaerobic-aerobic biodegradation of Multiple contaminants Including chlorinated ethylenes, benzene, toluene, and dichloromethane[J]. Water, Air, & Soil Pollution, 228(1): 25.
|
张晓慧, 葛芳州, 董玉婧, 等. 2015. 可渗透反应墙原位修复污染地下水研究进展[J]. 工业用水与废水, 2015, 46(3): 1–5.
DOI:10.3969/j.issn.1009-2455.2015.03.001 |
Zhang J, Zhao W, Pan J, et al. 2005. Tissue-dependent distribution and accumulation of chlorobenzenes by vegetables in urban area[J]. Environ Int, 31: 855–860.
DOI:10.1016/j.envint.2005.05.034
|
Zhou X, Zhang C, Zhang D, et al. 2015. Polyphasic characterization of an anaerobic hexachlorobenzene-dechlorinating microbial consortium with a wide dechlorination spectrum for chlorobenzenes[J]. Journal of Bioscience And Bioengineering, 120(1): 62–68.
DOI:10.1016/j.jbiosc.2014.11.023
|
 2018, Vol. 38
2018, Vol. 38