汞是一种全球性的有毒痕量元素, 具有高度蓄积性、广泛迁移性及环境持久性, 在人类体内积累将造成失明瘫痪、神经学损伤和染色体功能短缺(Beckers, 2017)等危害.含汞废气是对产生环境污染最为严重的工业废气之一(Palinka et al., 2010;吴玉海, 2018), 主要释放源为含汞化石燃料及相关工业垃圾的焚烧(孙阳昭, 2013;杨昕, 2016).烟气中汞的物质特性与化学行为由氧化形态所决定, 而工业生产过程中Hg0和Hg2+构成了烟气中汞的主要形态(Zhang et al., 2012;熊建林, 2016).
目前, 含汞废物的处理方法主要有催化氧化及化学吸附法(孙创, 2014;赵莉, 2018), 其中吸附法是应用较为广泛的工艺(Zheng et al., 2012;张霞忠, 2017), 而生物吸附因其成本低、来源广泛等优点逐渐获得了国内外学者的关注(王建龙, 2015;张霞忠, 2017), 具有较大的应用潜力.含汞废物生物吸附技术主要利用细菌、真菌、藻类等生物体以及其中所含组分对重金属物质进行去除以达净化目的(王建龙, 2015).其中, 大肠杆菌、奇异变形菌、假单胞菌属及变形杆菌等(Filali et al., 2000; kholodii et al., 2000;梁彩柳, 2016;刘文静, 2017)菌的质粒上具有操控“mer”操纵子的抗性基因(Osborn et al., 1997; Dash et al., 2012), 能产生对重金属汞的降解酶, 并通过生物吸附或生物积累过程产生相关抗性(Yu et al, 2014; Wei et al., 2017).厌氧条件下, 谷胱甘肽、巯基乙酸、硫醇化合物也发现有吸附汞的功能(Zheng et al., 2012;奚涛, 2015);链霉菌、脱硫菌属ND132及硫亚硝酸盐还原菌PCA等微生物也可以通过生物修复机制将重金属汞进行钝化(Colombo et al., 2013).Mahbub(2016)从长期受汞污染的土壤中分离出的假黄单胞菌属SE1菌株, 在含汞条件下的EC50可达到22.6 mg·L-1;瑞士肠杆菌、柠檬酸杆菌和克罗诺杆菌能够吸附荧光灯含汞废物, 吸收率可达63.6% (Al-Ghouti et al., 2016);类似的钝化过程也可发生于鞘脂单胞菌属SE2中, 同时菌株内与汞有关的酶机制也得到了一定强化(Mahbub et al., 2016).
好氧反硝化酶体系及抗性质粒能存在于假单胞菌属(Pseudomonas)、副球菌属(Paracoccus)、芽孢杆菌属(Bacillus)、产碱杆菌属(Alcaligenes)中(Compeau et al., 1985; Ridway et al., 1990), 虽然重金属汞对大部分微生物产生了生长抑制作用, 但假单胞菌属、杆菌属等微生物种类能将反硝化功能及抗汞功能进行耦合.生物吸附重金属的研究日益增多, 但目前反硝化菌对烟气中Hg0、Hg2+的吸附特性研究尚未见报道.论文研究反硝化菌生物吸附烟气中Hg0、Hg2+的性能及其影响因素、吸附动力学、吸附等温试验, 采用FTIR和EDS等手段研究吸附微生物, 分析反硝化菌对汞的吸附机理, 以期为反硝化菌微生物在中小型锅炉燃煤烟气脱汞领域的应用提供基础依据.
2 材料与方法(Materials and methods) 2.1 供试菌株实验用反硝化耐汞菌株从某污水处理厂二沉池回流污泥中进行选育, 并于无菌条件下进行分离纯化获得.实验对培养后菌液进行离心收集, 真空冷冻干燥后得到土黄色的反硝化菌颗粒, 研磨保存备用作为吸附剂.采用固定脱水置换干燥等手段进行预处理, 并置于扫描电镜下观察分析供试菌株的形态结构, 发现该菌株整体呈现短棒状形态, 且菌群被分子量较小的脂肪、糖类等化合物所粘结, 同时被小分子附着物所包袱, 表面有光泽且存在少量凸起, 平均粒径为329.45 nm, 长度约为0.75 μm.经16S rDNA序列分析鉴定, 该菌主要为陶厄氏菌属(Thauera)与假单胞菌属(Pseudomonas), 对重金属汞具有较好的吸附性能.
2.2 吸附实验 2.2.1 Hg0吸附实验Hg0吸附实验装置如图 1所示.利用渗透率为315 ng·min-1(60 ℃)的商用汞渗透管(VICI Metronics)产生Hg0, 利用U型干燥管作为渗透腔, 在加入一定玻璃球以达到受热均匀的前提条件下, 利用空气压缩机使恒温和均匀气流通过装置以产生含有Hg0的蒸气.蒸气均匀进入盛有一定体积相同干重浓度菌体悬浮液的100 mL三口烧瓶中, 随后分别改变pH、温度以及进气Hg0浓度, 进行单因素实验考察参数变化对吸附容量产生的影响.测定进出装置的Hg0浓度, 得到Hg0吸附效率在不同参数下的变化关系以及吸附效率R和吸附容量Q, 计算公式如式(1)、式(2)所示.相同处理进行3次重复, 同时扣除空白对照实验吸附值, 下同.
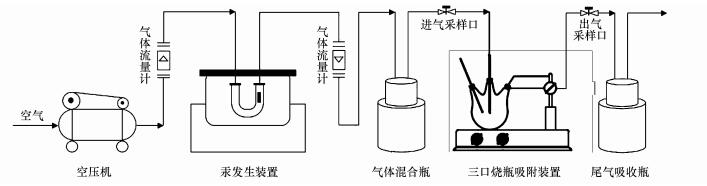 |
| 图 1 反硝化菌生物吸附剂吸附Hg0装置示意图 Fig. 1 Schematic diagram of adsorption of Hg0 by denitrifying bacteria |
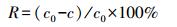
|
(1) |
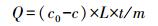
|
(2) |
式中, R为Hg0的去除效率, c0为Hg0的初始浓度(μg·m-3), c为Hg0的平衡浓度(μg·m-3), Q为吸附容量(μg·g-1), L为气体流量速度(m3·min-1), t为吸附反应时间(min), m为吸附剂质量(g).
2.2.2 Hg2+吸附实验在一定体积盛有Hg2+浓度梯度为0.4、2.4、4.8 μg·L-1的离子溶液内投加菌体, 分别改变pH、温度及离子浓度, 150 r·min-1摇床上恒温振荡处理12 h, 10000 r·min-1离心分离10 min, 经0.45 μm滤膜, 浓硝酸处理随即进行微波消解, 定容后测定得到滤液中Hg2+浓度.吸附效率R和吸附容量Q分别按照式(3)、式(4)进行计算.
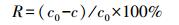
|
(3) |
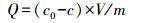
|
(4) |
式中, R为Hg2+的去除效率, c0为Hg2+的初始浓度(μg·L-1), c为Hg2+的平衡浓度(μg·L-1), Q为吸附容量(μg·g-1), V为培养液体积(L), m为吸附剂质量(g).
2.3 吸附动力学实验取一定体积相同干重浓度菌体溶液于三角烧瓶中, 在pH=7、气体流量为0.16 L·min-1的条件下, 设置浓度梯度为55.4、75.8、115.8 μg·m-3的Hg0气体均匀通过装置, 在35 ℃条件下分别反应5、15、30、90、120、150、210、240、270、300和360 s, 随即采用MVI测定进出口Hg0浓度, 计算吸附效率与吸附容量, 并绘制出动力学吸附曲线;取质量浓度为0.4、2.4和4.8 μg·L-1的Hg2+重金属原液, 调节吸附初始pH=7, 在35 ℃、150 r·min-1分别振荡5、10、20、30、60、180、300、420、600和720 min, 10000 r·min-1离心10 min, 过0.45 μm滤膜, 对滤液中Hg2+的浓度进行测定, 计算吸附效率与吸附容量, 绘制出动力学吸附曲线.
2.3 吸附等温模型实验取一定体积相同干重浓度菌体溶液于三角烧瓶中, 在pH=7、气体流量为0.16 L·min-1的条件下, 设置Hg0浓度为55~100 μg·m3的含汞气体, 在25、30、35 ℃温度梯度下进行6 min的平衡吸附实验, 并绘制出Hg0等温吸附曲线;在pH=7、转速为150 r·min-1的条件下, 设置Hg2+浓度为0.4、2.4、4.8 μg·L-1重金属原液, 在25、30、35 ℃温度梯度下进行12 h的平衡吸附实验, 并绘制出Hg2+等温吸附曲线.
2.4 主要仪器便携式汞蒸气检测仪:MVI型, 测量范围为0.1~2000 μg·m-3, 英国离子仪器有限责任公司;原子荧光光谱仪:AFS-930型, 检测限为0.01 μg·L-1, 北京吉天有限公司;高通量密闭微波消解系统:CEM Mars6型, 美国培安仪器有限责任公司;恒温振荡箱(常州诺基仪器有限责任公司);离心机(凯达仪器有限责任公司);热场发射环境扫描电镜-能谱电子背散射衍射系统(EDS):Quanta 400F型, 美国赛默飞仪器有限责任公司; 傅里叶红外光谱仪(FTIR):EQUINOX 55型, 德国布鲁克仪器有限责任公司.
3 结果与分析(Results and analysis) 3.1 反硝化菌对重金属汞的吸附性能 3.1.1 pH对反硝化菌吸附性能的影响反硝化菌菌液所处环境pH的变化对其吸附重金属汞的能力影响较强.在进气流速为0.16 L·min-1、反应吸附时间为6 min、吸附剂用量为0.175 g·L-1的条件下, pH对反硝化菌吸附Hg0的影响如图 2a所示.当菌液pH在4.20~9.00范围内, 去除效率达到25.10%及以上, pH=8.00时达到最高的去除效率, 为33.33%, 吸附容量达到142 μg·g-1.在小于8.00(大于8.00)时, 随着pH的降低(pH的升高), 去除效率则有所下降.在温度为35 ℃、转速为150 r·min-1、吸附剂用量为0.175 g·L-1且初始Hg2+浓度为4.8 μg·L-1条件下时, pH对反硝化菌吸附Hg2+的影响如图 2b所示.当菌液处于3.00~9.00范围内, 去除效率达到16.70%及以上, pH=8.00时达到最高的去除效率, 65.00%, 吸附容量达到21.02 μg·g-1.在pH为3.00~8.00范围内, Hg2+吸附效率及吸附容量都是随着pH的上升而增大的, 当pH由8.00继续上升时, 反硝化菌对Hg2+的吸附性能则受到严重影响.
 |
| 图 2 pH对重金属汞吸附性能的影响 Fig. 2 Effect of pH on mercury removal by the denitrifying bacteria |
这是因为当生存pH环境处于偏碱性7~8的弱碱性条件下, 反硝化菌能达到较快的生长速度, 迅速达到反硝化菌生长的稳定期(张淑楠, 2015).研究表明, 稳定期为反硝化菌的最佳反硝化时间(张淑楠, 2015).当所处环境pH在低于6.00高于8.00之间时, 反硝化速率将发生下降(曹文超, 2017), 酸性和碱性的条件对于吸附过程都有不同程度的抑制.在pH较低的情况下, 溶液中大量存在的H+对乙酰辅酶A与丙酮酸脱氢酶活性产生影响, 抑制了反应可供电子碳源的活性细胞结构以致产生解絮现象, 从而影响反硝化过程进行(张志, 2005).而当H+浓度高于反硝化酶的适应范围时, 微生物吸收环境中营养物质的能力以及酶的活性将受到制约.当pH高于8.50时, 菌液内产生高浓度游离氨, 导致化学平衡发生重大变化, 平衡往不利于反硝化产碱方向进行(张志, 2005), 从而使反硝化菌生长活性受到抑制, 硝态氮还原速率发生显著下降(王佩琦, 2018).pH对反硝化菌吸附Hg0及Hg2+都存在抑制作用, 不同pH条件微生物的性能也产生相应变化, 但酸性条件下pH对反硝化菌吸附Hg0抑制作用更大, 碱性条件对吸附Hg2+过程影响更大.
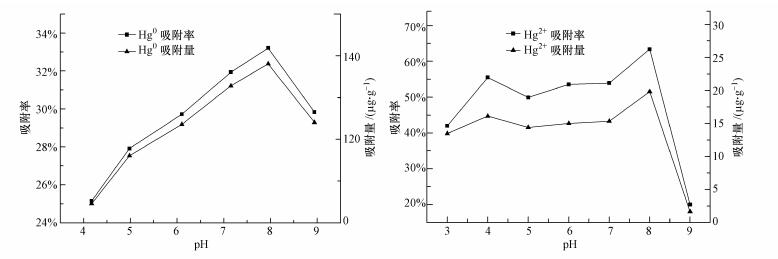
3.1.2 吸附剂用量对反硝化菌吸附性能的影响在进气流速为0.16 L·min-1、进气浓度为75.8 μg·m-3、pH为8、吸附剂用量(干重)分别为0.0875、0.175、0.35、0.7、1.05及1.4 g·L-1条件下, 考察生物吸附剂的用量对于Hg0吸附过程影响, 结果如图 3a所示.由图可知, 吸附剂用量的增加可以提高吸附剂对Hg0的吸附效果, 当吸附剂用量从0.0875 g·L-1上升到0.35 g·L-1时, 吸附效率从20.01%上升到33.20%, 吸附容量由81.00 μg·g-1上升到137.08 μg·g-1.在初始浓度为4.8 μg·L-1、转速为150 r·min-1、pH为8且吸附剂用量(干重)分别为0.0875、0.175、0.35、0.7、1.05及1.4 g·L-1条件下, 对吸附剂吸附Hg2+的效果进行考察, 结果如图 3b所示.随着菌体用量的增加, 吸附效率和吸附容量也有所上升.当吸附剂用量从0.0875 g·L-1上升到0.35 g·L-1时, 吸附效率从70.10%上升到92.46%, 吸附容量从19.27 μg·g-1上升到25.36 μg·g-1.反硝化菌生物吸附剂具有一定的比表面积和吸附位点以供吸附, 同时位点与浓度差成正比(文晓凤, 2016), 当吸附剂浓度为0.35 g·L-1时达到饱和吸附位点, 此时吸附效率以及吸附容量达到最大而不再上升.但当进一步增加吸附剂用量高于0.35 g·L-1时, Hg0吸附与Hg2+的吸附效率都发生下降现象.此时菌体浓度增加反应物数量却保持不变, 菌体在吸附过程中发生团聚, 堵塞细胞表面的空隙以及干涉结合位点功能, 导致达不到饱和吸附位点, 单位菌体吸附的金属量减少, 表观显示为吸附效率和吸附容量发生下降(Esposito et al., 2001).综上来看, 菌体浓度在0.35 g·L-1时, 吸附效果最佳, 吸附剂含量过高或者过低都会使吸附效率产生下降, 其他研究者的实验结果显示类似规律.武振华等(2006)发现超磁细菌B.megaterium D01在吸附Pd2+时, 持续投加吸附剂吸附容量发生下降, 文晓凤等(2016)利用龙葵内生菌(Bacillus nealsonii)吸附Cd2+过程中, 吸附剂用量从2.5 g·L-1提高至4.0 g·L-1时, 吸附效率从96%下降至70%以下, Mukhopadhyay(2007)也发现A.niger吸附Cu2+产生同样规律, Rahender Kumar(2008)等在他们的实验中发现吸附剂含量高于0.024 g·mL-1时, Aspergillus niger、Aspergil-lus sydoni及Penicillium janthinellum的吸附效率提升减缓.
 |
| 图 3 吸附剂用量对重金属汞吸附性能的影响 Fig. 3 Effect of adsorbent dosage on mercury removal ration by the denitrifying bacteria |
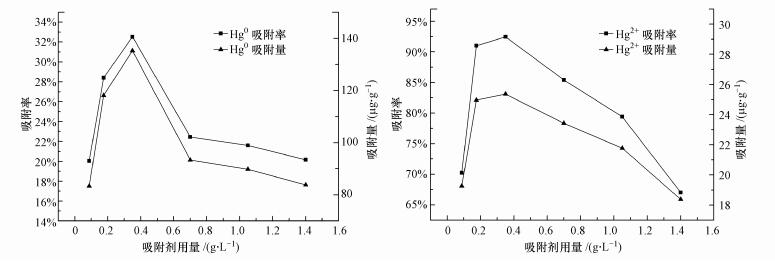
不同价态汞的初始质量浓度的变化对反硝化菌生物吸附剂的吸附性能具有一定影响, 且存在相似的影响规律.在进气流速为0.16 L·min-1、pH为8、吸附剂用量(干重)为0.175 g·L-1且进气浓度为28.0~340.0 μg·m-3条件下, 考察进气Hg0浓度对反硝化菌生物吸附剂Hg0吸附过程的影响, 结果如图 4a所示.由图 4a可以看出, 反硝化菌对Hg0的吸附效率及吸附容量随着其初始浓度的提高而下降, 当进气浓度提高到95.7 μg·m-3以上时, 吸附剂的生物吸附效率下降到32.10%及以下.当进气浓度增加至240.0、322.0及340.0 μg·m-3时, 吸附效率下降至26.92%、26.55%和26.35%.为保证实验中Hg0的初始浓度及吸附效率, 实验Hg0初始浓度参数设置为75.8 μg·m-3.在转速为150 r·min-1、pH为8、吸附剂用量(干重)为0.175 g·L-1且初始Hg2+浓度为0.1~4.8 μg·L-1条件下, 对吸附剂吸附Hg2+的效果进行考察, 结果如图 4b所示.Hg2+吸附效率随着Hg2+初始浓度的增大而显著减小:当Hg2+初始浓度为0.4 μg·L-1时, Hg2+吸附效率在12 h内达到95.67%, 基本吸附完全.当Hg2+浓度进一步增大到1.2、2.4和4.8 μg·L-1时, 12 h内Hg2+吸附效率分别只有94.15%、92.28%和92.04%, 且吸附效率变化缓慢.结果表明, 不同形态汞初始质量浓度过高或者过低对汞吸附效率都具有较大影响, Hg0进气浓度达到95.7 μg·m-3左右时, Hg0具有较高的吸附效率;Hg2+初始浓度为0.4 μg·L-1时, 反硝化菌能体现较好的吸附性能.实验认为, 在一定范围内提高汞初始浓度, 能促进反硝化菌的吸附效果, 这期间由于重金属的参与增强了与汞的还原或氧化有关蛋白质的活性, 促进了电子传递物质的产生(He et al., 2009;丁文, 2018), 进一步提高汞初始浓度则产生了一定的不利影响, 此时重金属对微生物的毒害作用使微生物的代谢能力有所减弱.
 |
| 图 4 初始浓度对重金属汞吸附性能的影响 Fig. 4 Effect of initial concentration on mercury removal by the denitrifying bacteria |
综上来看, 反硝化菌生物吸附剂对Hg0及Hg2+的吸附性能良好.对于Hg0吸附过程而言, 在35 ℃, pH为8, ,吸附剂用量为0.35 g·L-1, Hg0初始浓度为95.7 μg·m-3时, 反硝化菌生物吸附剂对Hg0的吸附效率最佳, 可达43.01%;对于Hg2+吸附过程而言, 在35 ℃, pH为8, 吸附剂用量为0.35 g·L-1, 初始Hg2+浓度为0.4 μg·L-1时, 反硝化菌生物吸附剂对Hg2+的吸附效率最佳, 达到98.12%, 与其他吸附剂对Hg0的吸附效率(如杨文等(2017)利用自筛选菌S4对Hg2+吸附效率为93.88%, 高圣博等(2017)采用甲烷氧化菌素对Hg2+吸附效率为70.00%)相比, 本研究中所采用的反硝化菌生物吸附剂对于汞的吸附能力较高.
3.2 吸附动力学反硝化降解菌在不同初始汞浓度下的吸附过程如图 5所示.采用Lagergren拟一级(Pseudo-first-order)(5)和拟二级(Pseudo-second-order)(6)反应动力学方程对实验数据进行拟合, 反应方程式具体如下:
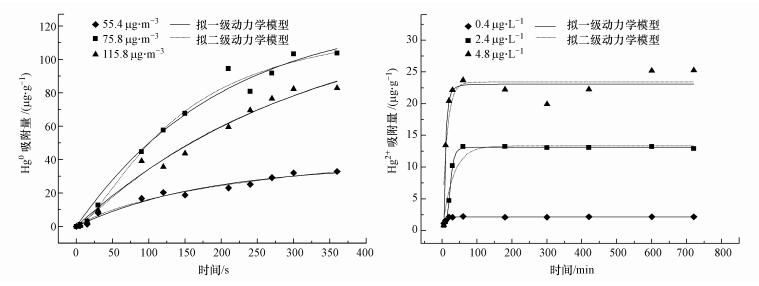 |
| 图 5 反硝化降解菌生物吸附剂吸附Hg0(a)以及Hg2+(b)的动力学特征 Fig. 5 Adsorption Kinetics of mercury by denitrifying bacteria biosorbent |
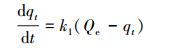
|
(5) |
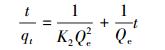
|
(6) |
式中, qt为t时刻反硝化菌吸附剂的吸附容量(μg·g-1), Qe为平衡时反硝化菌吸附剂的吸附容量(μg·g-1), k1为拟一级动力学方程吸附速率常数(s-1;min-1), k2为拟二级动力学方程吸附速率常数(g·μg-1·s;g·μg-1·min).
如图 5a所示, 在含有Hg0条件下发生慢速吸附, 在吸附过程360 s时间内, 菌体对Hg0的吸附容量随时间而缓慢增大, 从0.37 μg·g-1(1.15、0.48 μg·g-1)上升到37.86 μg·g-1(121.79、99.85 μg·g-1), 反应进行到300 s左右, 吸附容量基本开始稳定不变, 达到最大吸附容量的84.52%、84.83%与84.41%, 可以认为达到吸附平衡.如图 5b所示, 在含有不同浓度Hg2+(0.4、2.4与4.8 μg·L-1)条件下的吸附过程中, 反硝化降解菌能够在短时间内对Hg2+完成快速吸附, 60 min即可达到较高吸附水平, 分别为饱和吸附容量的98.12%、96.45%及86.35%.由于物理吸附发生较快, 反应初期, 推测Hg2+与Hg0吸附分别以物理吸附与化学吸附为主导.Hg2+吸附初期, 快速吸附主要由表面吸附完成, 研究显示, 微生物细胞壁表面的多糖、脂质与蛋白质给重金属提供了大量的结合位点, 而表面吸附机制不依赖于细胞代谢存在, 重金属最快可在1 min内完成吸附(Delgado et al., 1998;孟庆玲, 2017), 且大部分过程可逆(Veglio et al., 1997), 常被称作被动吸附.通常来说, 革兰氏阳性细菌与阴性细菌相比, 除了共有肽聚糖之外还含有磷酸基与羟基的磷壁酸, 因此具有更好的吸附效果(Choinacka et al., 2012;杜辉辉, 2017).而对于Hg2+的第二阶段与Hg0吸附过程中的缓慢累积, 可能受到细胞扩散及胞内代谢的调节, 可称作主动吸收.研究显示, 重金属的存在将影响微生物细胞壁的通透性, 生物累积主要表现为非平衡过程(Zumrive et al., 2000).该累积有细胞代谢过程支持, 如藻类可利用培养基底物中的碳酸氢根反应产生碳源CO2(Zumrive et al., 2000), 因此细胞壁附近氢氧根离子浓度有所上升, 表现为有毒金属氢氧化物的沉淀;细胞通过硫离子与磷酸根离子的释放可以形成难溶的硫化物与磷酸盐, 从而实现生物转化与生物矿化(Gavrilescu et al., 2004;姚海燕, 2016), 该特性已于铁离子、锰离子与铅离子的实验中得到证明(Loukidou et al., 2005).
图 5b的结果还显示, 随着反应时间的继续增加, 吸附容量增加缓慢并趋于平衡, 但在Hg2+4.8 μg·L-1浓度下有脱附现象发生(>60 min), 吸附容量下降至19.93 μg·g-1后发生回升.当反应进行至720 min(12 h)时, 吸附均达到平衡状态.Kadukova等(2005)的实验利用活的小球藻kessleri进行Cu2+吸附实验时存在解吸现象, Cu2+的存在对活细胞表面的结合能力产生损害并直接导致积累铜的再释放.此外, 实验所处反应条件下, 反硝化降解菌吸附剂在Hg0上可达到的最大吸附容量(121.79 μg·g-1)大于Hg2+(25.25 μg·g-1).
为探讨吸附动力学特征, 将实验数据与拟一级和拟二级动力学方程进行拟合, 拟合结果(表 1、表 2)显示Hg0存在条件下, 拟一级动力学模型相关参数具有更高回归系数, 但Hg2+拟合结果则相反.表 1表明, Hg0吸附用拟一级反应动力学模型拟合的相关系数较高(R2=09856、0.9813、0.9630), 且平衡吸附容量的预测值(Qe=37.06、130.51、107.36 μg·g-1)与实际吸附容量(37.86、121.79、99.85 μg·g-1)十分接近, 而与拟二级方程计算的理论平衡吸附容量相差甚远, 故Hg0的吸附符合拟一级反应动力学方程.此外, 二级速率常数k2, cal随着初始浓度的升高而减小, 二级动力学模型拟合的相关参数结果一般.
| 表 1 反硝化降解菌生物吸附剂吸附Hg0动力学模型结果 Table 1 kinetic model simulation of the Hg0 adsorption by denitrifying Bacteria |
| 表 2 反硝化降解菌生物吸附剂吸附Hg2+动力学模型结果 Table 2 Kinetic model simulation of the Hg2+ adsorption by denitrifying Bacteria |
由表 2可知, 反硝化降解菌对Hg2+具有一定吸附性, 准一级反应动力学方程拟合所得到吸附剂的吸附容量Qe为0.56、8.81与11.30 μg·g-1(0.4、2.4、4.8 μg·L-1), 明显低于实际测量数值(2.25、13.25、25.25 μg·g-1), 且相关性较差(R2=0.7318、0.9518、0.7066).因此, 反硝化降解菌生物吸附剂吸附Hg2+的吸附过程不符合拟一级动力学方程.由Lagergren拟二级反应动力学方程拟合所得到的吸附容量Qe为2.19、13.74、25.11 μg·g-1, 与实验所得数值接近, 且相关系数结果较为接近1(R2=0.9998、0.9910、0.9950), 说明拟二级反应动力学方程能更好的描述反硝化降解菌吸附Hg2+的行为.根据拟二级反应动力学方程的机理, 吸附过程中可以忽略质量扩散所产生的影响, 主要影响行为是化学吸附过程, 吸附剂与Hg2+之间的电子交换和共享的共价力对步骤发生的速度产生了限制.综上, Hg0吸附过程中平衡吸附容量的预测可以用拟一级反应动力学模型计算, 而Hg2+吸附容量则可利用拟二级反应动力学模型进行预测.
3.3 吸附等温线模型为研究反硝化降解菌生物吸附剂吸附Hg0及Hg2+的吸附等温曲线, 实验采用Langmuir模型及Freundlich模型进行拟合, 具体方程如式(7)、(8)、(9)所示, 拟合曲线如图 6所示.
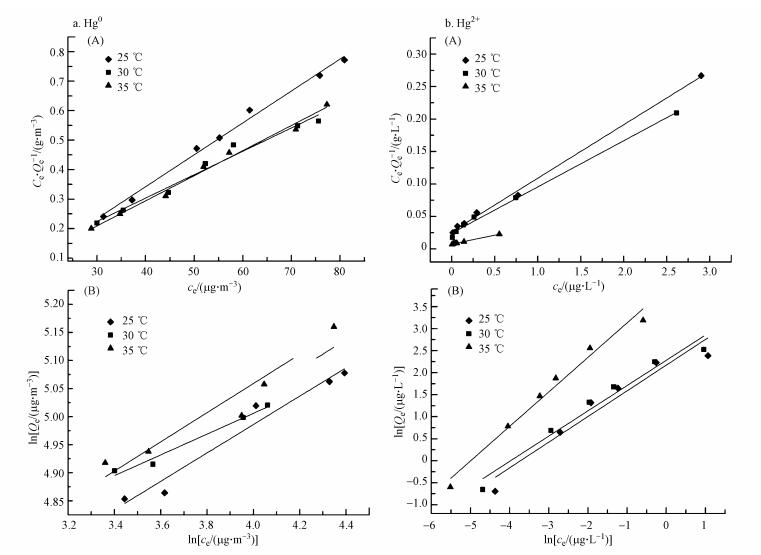 |
| 图 6 Hg0(a)和Hg2+(b)的Langmuir(A)及Freundlich(B)吸附模型拟合结果 Fig. 6 Langmuir(A) and Freundlich(B) adsorption isotherm of Hg0(a) and Hg2+(b) |
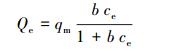
|
(7) |
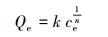
|
(8) |
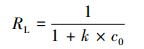
|
(9) |
式中, Qe为吸附平衡时吸附剂的吸附容量(μg·g-1), qm为吸附剂的最大吸附容量(μg·g-1), ce为反应平衡时的浓度(μg·L-1), b为表征吸附能力的吸附平衡常数(L·μg-1), k为Freundlich吸附容量常数, n为亲和常数, RL为亲和常数.
实验设置了不同温度(25、30、35 ℃), 以研究吸附剂对Hg0与Hg2+的吸附行为, 并利用Langmuir和Freundlich吸附模型对吸附过程进行分析, 模型参数与相关系数见表 3及表 4.由表可知, Hg0条件下, 对比Langmuir和Freundlich模型拟合参数值可以发现, Langmuir模型相关性较好(R2=0.9921、0.9733、0.9885), 理论吸附容量在30 ℃达到较大值(126.10 μg·g-1).而Hg2+条件下, Langmuir吸附模型比Freundlich吸附模型更适于描述反硝化降解菌吸附Hg2+的行为, 不同温度(25、30、35 ℃)下, 均达到较高的相关系数(R2=0.9971、0.9950、0.9965), 理论最大吸附容量可达36.23 μg·g-1, 且吸附容量随着溶液中条件温度的上升而上升, 表明温度位于35 ℃左右时有利于反硝化降解菌吸附剂对于Hg2+的吸附.Langmuir通常用于描述单分子层吸附状态, 各处吸附能相同, 并认为吸附过程中吸附剂表面均匀且表面各个吸附点之间不存在吸附质的转移运动.Freundlich模型通常用于描述吸附剂表面不均匀且吸附热不均匀分布的一种吸附行为, 是一种非均相表面于非理想状态下的多层吸附过程.一般认为, 1/n处于0~2之间时, 吸附反应是易于进行的, 通过拟合可以发现Hg0与Hg2+实验所处反应条件下菌体1/n均处于该范围, 表明吸附过程发生得较为顺利.
| 表 3 不同温度下反硝化降解菌吸附剂吸附Hg0的Langmuir和Freundlich模型参数及相关系数 Table 3 The Langmuir and Freundlich model parameters of Hg0 adsorption at different temeratures |
| 表 4 不同温度下反硝化降解菌吸附剂吸附Hg2+的Langmuir和Freundlich模型参数及相关系数 Table 4 The Langmuir and Freundlich model parameters of Hg2+ adsorption at different temperatures |
采用傅里叶变换-红外光谱仪(FTIR)分析吸附前后反硝化菌细胞壁上化学官能团所发生的变化, 并依照文献对谱图的主要吸收峰进行解读.图 7的谱图显示反硝化菌所含组分复杂, 在整个吸收波数范围内均呈现了一定吸收.且吸附物前后, FTIR谱图呈现一定差异性, 差异主要表现为吸附物质不同(Hg0与Hg2+)所产生的吸收峰的强弱差.对比吸附Hg0与Hg2+前后谱图 7可知, 吸附后3200~3500 cm-1处的吸收峰强度均大于吸附前, 这表明反硝化菌生物吸附剂吸附不同价态汞后所含酚羟基或醇羟基含量上升;吸附前后2917.82~3355.59 cm-1(Hg0)及2912.03~3307.37 cm-1(Hg2+)处的谱峰可归属为细胞壁上来自蛋白质的C—H键伸展运动, 其中起明显作用的为CH2—键的不对称伸展运动, 此外, 还有碳水化合物中结合水O—H键的伸展运动, Hg0与Hg2+作用后谱图都表现为宽而强的吸收峰;1640(Hg0)、1623 cm-1(Hg2+)处是N—H的平面弯曲振动;1540(Hg0)、1535 cm-1(Hg2+)为典型细胞蛋白质特征谱带Ⅰ带, 即C=O的伸展振动, 以及酰胺Ⅱ带, 即N—H的弯曲振动和C—N的伸展振动的叠加(Kamnev et al., 1999; Sruthy et al., 2018).
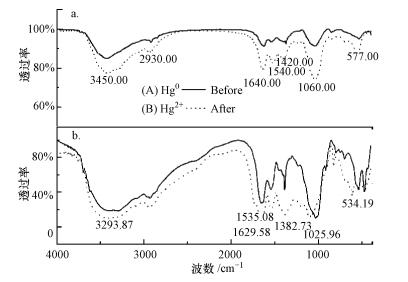 |
| 图 7 反硝化菌吸附Hg0(a)与Hg2+(b)前后的红外光谱图 Fig. 7 Infrared spectra of denitrifying Bacteria before and after the adsorption of Hg0(a) and Hg2+(b) |
吸附Hg2+过程发生后, 1382 cm-1处吸收峰强度变化明显大于Hg0吸附, 说明Hg2+吸附过程与Hg0吸附过程相比较, 脂肪化合物可能产生更大贡献, 且氨基含量也随之上升(杨天伟, 2016);1000~1074 cm-1处的谱峰主要为—PO43-、胺基中的C—N的伸缩振动及糖环的振动吸收带, 该类基团在反硝化菌吸附剂吸附Hg0时表现出更强的吸收峰;600 cm-1以下的波数范围存在M—O和O—M—O(M为金属离子)的振动吸收峰, 而反硝化菌吸附不同价态汞前后红外光谱图在543~476 cm-1以及607~457 cm-1之间均存在一定的吸收, 且吸附后吸收峰明显有所增强.杨天伟等(2016)利用红外光谱技术对富集汞后的牛肝菌进行分析发现, 在1033、1074 cm-1的多糖吸收波数段、1402 cm-1附近的蛋白质与脂肪等的—CH3吸收波数段存在明显吸收峰.
结果表明, 反硝化菌吸附不同价态汞前后的红外谱图吸收峰位情况基本类似, 但存在少数峰位发生位移现象, 除P—O基团以及M—O和O—M—O基团吸收峰往高波数方向移动外, 其余基团吸收峰位基本未发生明显移动.此外, 通过比较官能团吸附前后变化强度, 猜测Hg0吸附过程中胺基、糖环等基团产生作用, Hg2+吸附过程中, 脂肪化合物、氨基等基团产生作用.
3.5 EDS分析反硝化菌吸附Hg0(a)与Hg2+(b)后菌体表面的EDS光谱图如图 8所示, 在反硝化菌生物吸附剂吸附Hg0与Hg2+后, 出现了明显的Hg吸收峰, 表明不同价态汞在反硝化菌吸附剂表面产生积累, 且Hg0存在条件下显示出更大的脉冲数, 进一步说明了在实验条件浓度下, 反硝化菌生物吸附剂能在Hg0实验条件下达到更高的吸附容量.研究表明, 细菌表面面对刺激条件会发生动态变化.如梁龄予等(2015)利用扫描和能谱对吸附Cr6+前后的玉米芯进行分析, 发现吸附前后微观形态发生变化且Cr6+的峰值明显升高.Majumdar(2010)的实验也显示, 吸附后菌体表面能均一吸附铅离子, 同时观察到积累发生, 这与本文的研究结果一致.
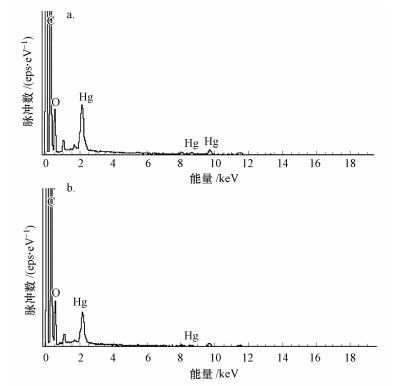 |
| 图 8 反硝化菌吸附Hg0(a)与Hg2+(b)后的EDS分析 Fig. 8 EDS analysis of Denitrifying Bacteria after the adsorption of Hg0(a) and Hg2+(b) |
1) 反硝化菌生物吸附剂对Hg0及Hg2+的吸附性能良好, 0.35 g·L-1菌体于35 ℃、pH为8、初始Hg0(Hg2+)浓度为95.7 μg·m-3(0.4 μg·L-1)对Hg0(Hg2+)进行吸附, Hg0(Hg2+)的吸附效率可达到43.01%(98.12%).
2) 反硝化菌生物吸附剂对Hg0的吸附行为符合拟一级动力学方程, 此吸附过程较为符合化学吸附(配位吸附), 反应在360 s可达平衡;对Hg2+的吸附行为符合拟二级动力学方程, 以物理吸附(静电吸附)为主, 反应在12 h可达平衡.
3) 反硝化菌生物吸附剂对Hg0及Hg2+的等温过程都可用Langmuir方程表示, 表现为单层吸附.此时Hg0的饱和吸附容量为126.10 μg·g-1, Hg2+的饱和吸附容量为36.23 μg·g-1.
4) Hg0及Hg2+吸附前后傅里叶红外光谱分析结果表明, Hg0吸附后糖环、磷酸基团吸收峰更加强而宽, Hg2+作用后脂肪化合物相关基团强度增强, 它们是反硝化菌对Hg0及Hg2+吸附的主要吸附位点.
Al-Ghouti M A, Abuqaoud R H, Abu-Dieyeh M H. 2016. Detoxification of mercury pollutant leached from spent fluorescent lamps using bacterial strains[J]. Waste Management, 49: 238–244.
|
Beckers F, Rinklebe J. 2017. Cycling of mercury in the environment:source, fate, and human health implications:a review[J]. Crit Rev Environ Sci Technol, 47(10): 00–00.
|
Chojnacka K. 2010. Biosorption and bioaccumulation--the prospects for practical applications[J]. Environment International, 36(3): 299–307.
|
Colombo M J, Ha J, Reinfelder J R, et al. 2013. Anaerobic oxidation of Hg(0) and methylmercury formation by Desulfovibrio desulfuricans, ND132[J]. Geochimica Et Cosmochimica Acta, 112(7): 166–177.
|
Compeau G C, Bartha R. 1985. Sulfate-Reducing Bacteria:Principal Methylators of Mercury in Anoxic Estuarine Sediment[J]. Applied & Environmental Microbiology, 50(2): 498–502.
|
Cui H, Li F, Ren B, et al. 2018. Biosorption of aquatic Pb2+, Hg2+, and Cd2+ using a combined biosorbent-Aspergillus niger-Treated Rice Straw[J]. Separation Science & Technology, 53(4): 626–635.
|
曹文超, 郭景恒, 宋贺, 等. 2017. 设施菜田土壤pH和初始C/NO3对反硝化产物比的影响[J]. 植物营养与肥料学报, 2017, 23(5): 1249–1257.
|
丁文, 吴胜春, 朱成, 等. 2018. 水稻响应重金属胁迫的蛋白质组学研究进展[J]. 环境污染与防治, 2018, 40(1): 95–99.
|
杜辉辉. 2017. Cd(Ⅱ)、Pb(Ⅱ)在土壤矿物-有机互作界面的分子结合机制[D]. 武汉: 华中农业大学
|
Dash H R, Das S. 2012. Bioremediation of mercury and the importance of bacterial mer, genes[J]. International Biodeterioration & Biodegradation, 75(6): 207–213.
|
Delgado A, Anselmo A M, Novais J M. 1998. Heavy metal biosorption by dried powdered mycelium of fusarium flocciferum[J]. Water Environment Research, 70(3): 370–375.
DOI:10.2175/106143098X125019
|
Esposito A, Pagnanelli F, Lodi A, et al. 2001. Biosorption of heavy metals by Sphaerotilus natans:an equilibrium study at different pH and biomass concentrations[J]. Hydrometallurgy, 60(2): 129–141.
|
The European Parliament and the Council. 2013. Directive 2013/38/EU of the European Parliament and of the Council of 12 August 2013[J]. Official Journal of the European Communities: L226.
|
Filali B K, Taoufik J, Zeroual Y, et al. 2000. Waste water bacterial isolates resistant to heavy metals and antibiotics[J]. Current Microbiology, 41(3): 151–156.
|
Gavrilescu M. 2004. Removal of heavy metals from the environment by biosorption[J]. Engineering in Life Sciences, 4(3): 219–232.
|
GY Kholodii, et al. 2000. Pseudomonas putida partial transposon[J]. Russian Journal of Genetics, 36(4): 459–469.
|
高圣博, 辛嘉英, 窦博鑫, 等. 2017. 甲烷氧化菌素催化二价汞还原的研究[J]. 化学工程师, 2017, 31(11): 1–6.
|
He Z, Gao F, Sha T, et al. 2009. Isolation and characterization of a Cr(Ⅵ)-reduction Ochrobactrum sp. strain CSCr-3 from chromium landfill[J]. Journal of Hazardous Materials, 163(2/3): 869–873.
|
Jia L, Li B, Xu L, et al. 2018. Effects of different preparation conditions on kinetics and adsorption of mercury by biomass char[J]. Chinese Journal of Environmental Engineering, 12(1): 134–144.
|
Kaduková J, Virć íková E. 2005. Comparison of differences between copper bioaccumulation and biosorption[J]. Environment International, 31(2): 227–232.
DOI:10.1016/j.envint.2004.09.020
|
Kamnev A A, Ristić M, Antonyuk L P, et al. 1997. Fourier transform infrared spectroscopic study of intact cells of the nitrogen-fixing bacterium Azospirillum brasilense[J]. Journal of Molecular Structure, 408(408): 201–205.
|
Loukidou M X, 2005. Zouboulis A I. Biosorption of Toxic Metals[M]. Water Encyclopedia. John Wiley & Sons, Inc
|
梁彩柳. 2016. 一株海洋类产碱假单胞菌的汞抗性及富集行为机制研究[D]. 深圳: 深圳大学
|
梁龄予, 王耀晶, 闫颖, 等. 2015. 玉米芯吸附水中Cr(Ⅵ)的特性及SEM-EDS表征分析[J]. 生态环境学报, 2015, 24(2): 305–309.
|
刘文静. 2017. 抗汞菌株的筛选检测以及抗汞蛋白结构与功能的研究[D]. 合肥: 安徽大学
|
吴鹏宇, 夏令. 2017. 活性污泥胞外聚合物吸附重金属离子的研究进展[J]. 绿色科技, 2017(16): 75–80.
|
Mahbub K R, Krishnan K, Naidu R, et al. 2016. Mercury resistance and volatilization by Pseudoxanthomonas, sp. SE1 isolated from soil[J]. Environmental Technology & Innovation, 6: 94–104.
|
Mahbub K R, Krishnan K, Naidu R, et al. 2017. Mercury remediation potential of a mercury resistant strain Sphingopyxis sp.SE2 isolated from contaminated soil[J]. Journal of Environmental Sciences, 51(1): 128–137.
|
Majumdar S S, Das S K, Chakravarty R, et al. 2010. A study on lead adsorption by Mucor rouxii, biomass[J]. Desalination, 251(1/3): 96–102.
|
Mukhopadhyay M, Noronha S B, Suraishkumar G K. 2007. Kinetic modeling for the biosorption of copper by pretreated Aspergillus niger, biomass[J]. Bioresource Technology, 98(9): 1781–1787.
DOI:10.1016/j.biortech.2006.06.025
|
Kumar R, Bishnoi N R, Garima, et al. Biosorption of chromium(Ⅵ) from aqueous solution and electroplating wastewater using fungal biomass[J]. Chemical Engineering Journal, 135(3): 202–208.
DOI:10.1016/j.cej.2007.03.004
|
Osborn A M, Bruce K D, Strike P, et al. 1997. Distribution, diversity and evolution of the bacterial mercury resistance (mer) operon[J]. Fems Microbiology Reviews, 19(4): 239–262.
DOI:10.1111/j.1574-6976.1997.tb00300.x
|
Palinka L A, Sholupov S E, Mashyanov N R, et al. 2010. Global mercury emissions to the atmosphere from anthropogenic and natural sources[J]. Atmospheric Chemistry & Physics Discussions, 10(13): 5951–5964.
|
Qin H, Xiao R, Guo L, et al. 2018. Mercury (Ⅱ) adsorption from aqueous solution using nitrogen and sulfur co-doped activated carbon[J]. Water Science and Technology: wst2018117.
|
Sruthy S, Mohan M, Binish M B. 2018. Biosorption of mercury by metal tolerant bacteria from arctic using FT-IR spectroscopy[C]. International Conference on Photo-Chemistry and ITS Applications
|
孙创, 宁平, 冯权莉, 等. 2014. 含汞排放物处理技术的研究进展[J]. 现代化工, 2014, 34(10): 49–52.
|
孙阳昭, 陈扬, 蓝虹, 等. 2016. 中国汞污染的来源、成因及控制技术路径分析[J]. 环境化学, 2016, 32(6): 937–942.
|
Veglio F, Beolchini F. 1997. Removal of metals by biosorption:a review[J]. Hydrometallurgy, 44(3): 301–316.
DOI:10.1016/S0304-386X(96)00059-X
|
Wei Z S, Wang J B, Huang Z S, et al. 2017. Effect of gaseous mercury on nitric oxide removal performance and microbial community of a hybrid catalytic membrane biofilm reactor[J]. Chemical Engineering Journal, 316: 584–591.
|
王建龙, 陈灿. 2015. 重金属生物吸附[M]. 北京: 科学出版社.
|
王佩琦, 周伟丽, 何圣兵, 等. 2018. 磷对混养反硝化污泥活性和微生物群落结构的影响[J]. 环境科学, 2018, 39(3): 1350–1356.
|
文晓凤, 杜春艳, 袁瀚宇, 等. 2016. 改性磁性纳米颗粒固定内生菌Bacillus nealsonii吸附废水中Cd2+的特性研究[J]. 环境科学学报, 2016, 36(12): 4376–4383.
|
文晓凤, 杜春艳, 袁瀚宇, 等. 2016. 改性磁性纳米颗粒固定内生菌Bacillus nealsonii吸附废水中Cd2+的特性研究[J]. 环境科学学报, 2016, 36(12): 4376–4383.
|
吴玉海. 2018. 工业废水废气治理方法研究[J]. 信息记录材料, 2018(1): 22–23.
|
武振华, 孙津生, 宋慧平, 等. 2006. 趋磁细菌(MTB)吸附Pd2+的实验研究[J]. 离子交换与吸附, 2006, 22(5): 385–391.
DOI:10.3321/j.issn:1001-5493.2006.05.001 |
奚涛. 2015. 重金属汞、铜、铅、镉的酶联免疫吸附快速检测方法研究[D]. 上海: 上海交通大学
|
熊建林. 2016. (NH4)2S法同时脱除冶炼烟气中Hg和SO2[D]. 昆明: 昆明理工大学
|
Xia L I, Dan Z, Fei S, et al. 2017. Biosorption of mercury(Hg2+) from water by immobilized residues from four types of edible mushroom[J]. Chinese Journal of Applied & Environmental Biology, 23(5): 879–885.
|
Yu Z, Li J, Li Y, et al. 2014. A mer, operon confers mercury reduction in a Staphylococcus epidermidis, strain isolated from Lanzhou reach of the Yellow River[J]. International Biodeterioration & Biodegradation, 90(1): 57–63.
|
杨天伟, 张霁, 李涛, 等. 2016. 红外光谱结合化学计量学方法快速鉴别牛肝菌种类及总汞含量分析[J]. 光谱学与光谱分析, 2016, 36(11): 3510–3516.
|
杨文, 陈小敏, 朱保虎, 等. 2017. 一株耐汞菌的分离鉴定及其去汞特性[J]. 环境工程学报, 2017, 11(1): 602–607.
|
杨昕. 2016. 生物质与煤混合燃烧过程中汞的释放特性研究[D]. 北京: 华北电力大学
|
姚海燕, 李洋, 龙飞, 等. 2016. 电子废弃物处理场地重金属污染土壤的钝化修复及其机理初析[J]. 上海第二工业大学学报, 2016, 33(2): 127–133.
DOI:10.3969/j.issn.1001-4543.2016.02.009 |
Zhang Y, Cui Y, Chen L Y. 2012. Mercury inhibits the L170C mutant of aquaporin Z by making waters clog the water channel[J]. Biophysical Chemistry, 160(1): 69–74.
|
Zheng W, Liang L, Gu B. 2012. Mercury reduction and oxidation by reduced natural organic matter in anoxic environments[J]. Environmental Science & Technology, 46(1): 292–299.
|
张淑楠, 王心义, 夏大平. 2015. 初始pH值对微生物反硝化的影响[J]. 环境工程, 2015(s1): 67–71.
|
张霞忠, 袁烈梅. 2017. 汞吸附研究进展[J]. 环境污染与防治, 2017, 39(5): 563–568.
|
张志, 任洪强, 张蓉蓉, 等. 2005. pH值对好氧颗粒污泥同步硝化反硝化过程的影响[J]. 中国环境科学, 2005, 25(6): 650–654.
DOI:10.3321/j.issn:1000-6923.2005.06.003 |
赵莉, 刘宇, 吴洋文, 等. 2018. 燃煤烟气中零价汞的催化氧化理论研究进展[J]. 中国电力, 2018, 51(3): 170–176.
|
 2018, Vol. 38
2018, Vol. 38


