纳米二氧化钛(nTiO2)已被广泛应用于造纸、涂料、纺织、化妆品、动物饲料等领域, 是第二重要的纳米材料.中国年产nTiO2为800~1800 t, 而欧洲和美国年产nTiO2分别为55~3000 t和7800~38000 t(Skocaj et al., 2011; Piccinno et al., 2011; Hendren et al., 2011; Gao et al., 2013).已有的研究显示, 当nTiO2暴露于阳光或紫外线下时, 会显示出很强的细胞毒性(Mansfield et al., 2015; Sanders et al., 2012).研究发现, nTiO2在阳光或紫外照射下可通过光催化产生丰富的活性氧基团(Reactive oxidative species, ROS), 如O2·-和HO2·, 这些ROS会造成动物(Kim et al., 2014)、植物(Ghosh et al., 2010)、细菌(Erdem et al., 2015)和藻类细胞(Al-Awady et al., 2015)的氧化损伤.但有关nTiO2在黑暗环境下对生物体造成的损害及生物体应答nTiO2毒性作用的机制报道还不多(Erdem et al., 2015).
多头绒泡菌是黏菌的一种, 主要生活在黑暗、潮湿环境下.在固体培养基上培养时, 多头绒泡菌可形成覆盖几平方厘米原质团(多核体细胞), 但仍然具有单细胞的特性(Beekman and Latty, 2015; Haindl and Holler, 2005; Elliott et al., 2013), 多头绒泡菌原质团对nTiO2具有较好的耐受性(Sujatha et al., 2005; Guttes et al., 1961; Zhang et al., 2017), 对化学物质(Beylina et al., 1996)、磁场(Marron et al., 1986)、光(Barrantes et al., 2010)、重力(Block et al., 1996)等环境刺激非常敏感.本研究小组在前期研究中在黑暗条件下以多头绒泡菌为材料对nTiO2的细胞毒性进行了评估, 确定了nTiO2在黑暗条件下产生毒性作用的胁迫浓度范围(Zhang et al., 2017), 找到了nTiO2对多头绒泡菌胁迫作用的生理生化指标, 并建立了相关的检测方法.但采用生理生化指标评估nTiO2毒性的方法耗时较长且准确性不高.因此, 建立一种全面、高效、准确检测nTiO2细胞毒性的方法对应用nTiO2及评估nTiO2释放对环境影响具有现实意义.
基于GC/MS的代谢组学分析技术可检测细胞、组织和其他生物基质中小分子量代谢产物的水平, 也能反映机体对遗传修饰、生理变化和环境刺激的动态应答(Ryan and Robards, 2006).非靶向代谢组学分析可以提供代谢物扰动的准确信息, 是发现差异代谢物、评估毒物作用模式、研究环境风险的有力手段(Bundy et al., 2009; Ratnasekhar et al., 2015; Taylor et al., 2010).本研究以多头绒泡菌原质团为单细胞模型, 通过代谢组学分析技术研究了nTiO2对多头绒泡菌代谢物的影响, 从代谢角度评估了nTiO2的细胞毒性.
本研究将多头绒泡菌原质团暴露于nTiO2, 然后提取各组样品的代谢物并通过基于GC/MS的代谢组学技术进行检测, 最后通过软件分析及统计学分析处理代谢组的结果, 筛选出被nTiO2显著干扰的差异代谢物, 评估nTiO2对多头绒泡菌的毒性作用.
2 材料和方法(Materials and methods) 2.1 nTiO2及相关试剂锐钛矿型nTiO2悬浮液(型号VK-TA33, 粒径30 nm, 含量为100 mg·mL-1)购自杭州万景股份有限公司.用于代谢组学分析的试剂均购自Sigma-Aldrich Chemical (St. Louis, MO).除另有说明外, 本研究所使用的化学试剂均为分析级纯.
2.2 nTiO2的特性nTiO2颗粒的平均流体动力半径是用透射电镜(Philips, CM12, 荷兰)进行表征观察, MSD培养基中的nTiO2粒径用激光粒度分析仪(Brookhaven, USA)通过动态光散射进行测量(26 ℃下平衡3 min后, 对样品进行5次测量, 每个测量的读数和持续时间设置为默认参数), 收集强度分布数据进行分析, 用设备提供的专有软件分析培养基中nTiO2的平均粒径.
2.3 多头绒泡菌的培养和nTiO2的暴露本研究使用的多头绒泡菌(M3CVII, ATCC 204388)由德国雷根斯堡大学生物物理研究所的Eggehard Holler教授提供, 用MSD培养基培养(Daniel and Baldwin, 1964).培养条件为26 ℃下暗培养(液体培养时, 摇速为150 r·min-1).取0.1 g(湿重)生长至对数期的多头绒泡菌接种于MSD培养板上, 5 d以后, 将多头绒泡菌原质团切成几份等重(0.1 g)的小块, 分别接种到含有0和15 mg·mL-1 nTiO2的固体培养基上(nTiO2浓度高于15 mg·mL-1后会抑制多头绒泡菌生长并造成氧化损伤(Zhang et al., 2017)).每个浓度下的样品设置3个生物学重复, 样品暴露于nTiO23 d后刮取多头绒泡菌原质团称重, 随后进行代谢组检测.
2.4 代谢物提取和分析代谢物的提取和分析参考已有的文献(Bo et al., 2014; Lisec et al., 2006; Hu et al., 2013)进行.取nTiO2胁迫培养后的多头绒泡菌原质团于2 mL甲醇/水溶液(V/V=4:1)中, 与0.4 mL氯仿混合后通过超声波破碎细胞6 min(功率为500 W);取0.8 mL破碎液, 在冰浴下用超声波再提取20 min.样品在4 ℃下离心(12000 r·min-1)10 min后, 取0.5 mL上清液冷冻干燥后加入80 μL BSTFA (含1% TMCS)溶解干燥的样品, 再加20 μL正己烷振荡混合1 min, 之后在70 ℃下衍生60 min, 再在室温下孵育30 min, 然后进行GC-MS分析.
2.5 GC-MS的条件和数据采集GC-MS的操作和数据采集参考已有的文献(Bo et al., 2014)进行.取各组衍生样品1 μL, 用安捷伦7890B气相色谱与Agilent 5977A MSD系统(Agilent, CA, USA)进行检测, GC柱为DB-5 ms熔融石英毛细管柱(30 m × 250 μm × 0.25 μm, J&W Scientific, Folsom, CA, USA);检测条件为:注射器温度为260 ℃;MS四极杆温度和离子源温度分别为150 ℃和230 ℃;GC柱初始温度设置为90 ℃;分析开始后以10 ℃·mL-1的速度升至180 ℃;再以5 ℃·min-1的速度升高至240 ℃, 然后以25 ℃·min-1的速度升至290 ℃, 最后在290 ℃下维持11 min;流动相为氦气, 流速为1 mL·min-1.
2.6 代谢组学数据处理差异代谢物的筛选参考已有的文献(Bo et al., 2014)进行.GC/MS数据用Chroma TOF软件(v4.34, LECO, St Joseph, MI)分析;用Fiehn数据库对代谢物进行定性分析;与比较组校对后生成包含样本信息、峰值名称、保留时间、m/z和峰值强度文件.之后通过Excel 2007软件对数据做归一化处理, 再通过log2软件将每个样品的数据转化成总峰面积, 之后导入SIMCA(版本14.0, Umetrics, Umea, Sweden)软件进行PCA (Principal component analysis)、PLS-DA (Partial least squares discriminant analysis)及OPLS-DA (Orthogonal partial least squares discriminant analysis)等多变量统计分析.然后基于OPLS-DA模型获得VIP值(Variable important in projection)并通过SPSS 19.0软件进行独立样本t检验获得p值, 选取同时满足VIP> 1.0和p < 0.05的代谢物作为差异代谢物.最后通过NIST 05标准质谱数据库(NIST, Gaithersburg, MD)和可用的参考标准鉴定获得的代谢物清单.
3 结果(Results) 3.1 nTiO2诱导多头绒泡菌的代谢紊乱利用GC/MS对多头绒泡菌样品中代谢产物水平进行半定量分析, 采用无监督主成分分析(PCA)和受监督正交偏最小二乘判别分析(OPLS-DA)等多变量统计分析评估解析后的峰.与PCA相比, OPLS-DA能够将样品分类信息通过模型表现出来, 从而使组间差异表现得更显著.如图 1所示, 模型参数R2X= 0.624, R2Y= 0.998, Q2= 0.946, 说明该模型的建模能力和预测能力均较好, 对照组和15 mg·mL-1 nTiO2处理组可显著区分, 无交叉和重叠, 表明15 mg·mL-1 nTiO2处理会造成多头绒泡菌的代谢物发生显著变化.图 1a为PCA评分图, 从图中可以看出对照组样本和15 mg·mL-1 nTiO2处理组样本在整体分布上有分离趋势, 说明nTiO2对多头绒泡菌的代谢物产生了影响.图 1b为OPLS-DA评分图, 对照组和实验组明显分离, 表明对照组和15 mg·mL-1 nTiO2处理组存在显著差异.
 |
| 图 1 样品的PCA(a)和OPLS-DA(b)得分图(注:PCA评分图显示15 mg·mL-1 nTiO2处理组和对照组的差异;OPLS-DA得分图显示15 mg·mL-1 nTiO2处理组和对照组的差异) Fig. 1 PCA(a) and OPLS-DA(b) score plots of samples |
从OPLS-DA分析结果和t检验分析结果中筛选VIP > 1、p < 0.05的显著变化代谢物.在15 mg·mL-1 nTiO2处理的多头绒泡菌中发现了包括糖(如磷酸三辛酯)、糖醇、有机酸、氨基酸、多胺、类黄酮等60余种出现显著差异的代谢物.我们认为这些差异代谢物与nTiO2毒性作用有关.在15 mg·mL-1 nTiO2处理的多头绒泡菌中, 有8种代谢物的水平提高了100倍以上(表 1);在22种受nTiO2干扰的糖代谢物中, 有8种呈增加趋势, 有4种呈下降趋势;在7种受nTiO2干扰的核苷酸代谢物中, 有2种呈增加趋势, 有3种呈下降趋势;在22种受nTiO2干扰的氨基酸代谢物中, 有13种呈增加趋势, 有4种呈下降趋势;除主要代谢产物外, 黄酮等次级代谢产物也受到了nTiO2显著干扰, 其中黄酮类化合物芒柄花黄素提高了5.15×104倍.在已鉴定的代谢物中, 谷胱甘肽在15 mg·mL-1 nTiO2处理组中显示出了最大的nTiO2诱导增加量(4.67×106倍).
| 表 1 暴露于nTiO2后多头绒泡菌中作为差异代谢物的潜在的候选代谢物 Table 1 Potential candidate metabolites as biomarkers of P. polycephalum macroplasmodium exposed to nTiO2 |
在图 2中, 主要受干扰的代谢物被绘制为简化的代谢网络图, 提供了15 mg·mL-1 nTiO2处理下多头绒泡菌代谢产物的变化情况.
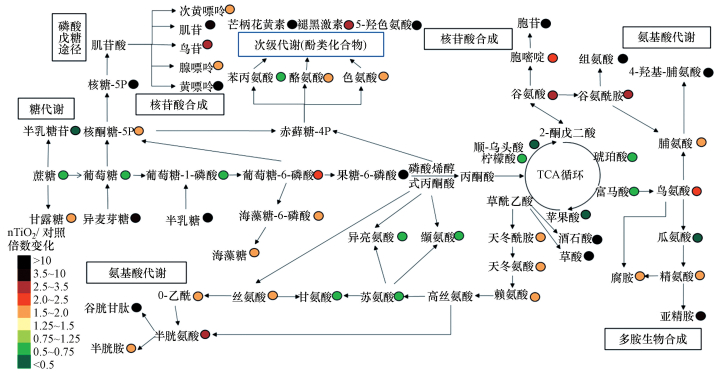 |
| 图 2 在黑暗条件下, 多头绒泡菌暴露于15 mg·mL-1 nTiO2组与对照组相比观察到的主要代谢扰乱的简化网络图(以各组处理的平均值(n = 6)与对照的平均值相比较来计算倍数变化.暴露时间:3 d) Fig. 2 A simplified metabolic network map of the major metabolic perturbations observed in P. polycephalum macroplasmodium exposed to 15 mg·mL-1 nTiO2 under dark conditions compared with the control (Fold changes were calculated as the means (n = 6) ratios of each treatment compared with the mean of the control. Exposure time: 3 days) |
从图 2中可以观察到包括TCA循环、核苷酸合成及糖代谢在内的多条生物途径的代谢物都发生了不同程度的改变.在常见的代谢途径中, 脯氨酸代谢、嘌呤代谢和谷胱甘肽代谢被显著扰乱.此外, 有12个代谢物的变化较为显著, 分别是核糖-5P、谷胱甘肽、黄嘌呤、半乳糖、芒柄花黄素、5-羟色氨酸、果糖-6-磷酸、胞苷、组氨酸、酒石酸、草酸和4-羟基-脯氨酸.
4 讨论(Discussion)目前, 已有的nTiO2毒性评估方法耗时长且准确性不高, 这一定程度上制约了nTiO2的商业应用及增加了nTiO2释放到环境中的不确定性.要将nTiO2广泛地应用于商业和释放到环境中需要一种准确、快速的毒性评估方法.因此, 本研究评估了商业上获得的nTiO2对多头绒泡菌生长的潜在影响, 并使用基于GC/MS的代谢组学技术来研究nTiO2对多头绒泡菌代谢物的影响.代谢组学分析可在全细胞水平筛选经毒性物质处理后含量发生变化的潜在差异代谢物并且此方法已被广泛应用(Suvagandha et al., 2014; Ratnasekhar et al., 2015).同时大面积的多头绒泡菌原质团可以提供足够的代谢产物用于研究单细胞在全细胞水平的代谢情况, 这表明多头绒泡菌是研究生物体接触毒性物质时, 在单细胞水平上代谢情况的优良细胞模型.相比于已有的nTiO2毒性评估方法, 本研究采用的方法可在全细胞水平上同时检测多种代谢物, 此方法更加高效, 结果更加全面和准确.
在生物体生长发育时, 碳水化合物代谢包括糖酵解途径和三羧酸循环(TCA循环)在产生给细胞供能的物质中具有中心作用.碳水化合物被水解成葡萄糖或其他中间产物进入糖酵解途径和TCA循环.TCA循环是能量生产的代谢枢纽, 也是氧化磷酸化主要燃料的生产来源.本研究代谢组测定的结果显示当多头绒泡菌暴露于15 mg·mL-1的nTiO2时, TCA循环中产生的柠檬酸、顺式乌头酸、琥珀酸、富马酸和苹果酸的水平下降, 这表明TCA循环的活性受到了干扰.已有研究发现当秀丽隐杆线虫暴露于亚致死剂量的nTiO2时TCA循环代谢物水平下降的情况(Ratnasekhar et al., 2015), 这与本研究的结果相符.因此本研究推测, 多头绒泡菌生长受抑制的现象与上述代谢物水平下降直接相关.除了TCA循环受到影响外, 还观察到糖酵解途径涉及的代谢物水平发生变化.在使用高剂量(15 mg·mL-1)nTiO2处理组中检测到蔗糖、葡萄糖、葡萄糖-1-磷酸的水平显著下降.基于代谢网络图(图 2), 本研究推测糖酵解途径中代谢物水平的改变可能与参与戊糖磷酸途径(PPP)、核苷酸生物合成途径、氨基酸代谢、糖醇生物合成途径和负责二次代谢产物生产途径的代谢物水平变化有关.
来自糖酵解途径产生的的葡萄糖和葡萄糖-6-磷酸进入PPP, 对于以NADPH的形式产生的细胞还原能力至关重要.NADPH是氧化还原物质如谷胱甘肽(GSSG)所必需的, 且可以保护细胞免受ROS的影响(Jamieson, 1998).PPP在提供芳香族氨基酸和核酸合成的前体中起到至关重要的作用(Stincone et al., 2015).PPP被分为非氧化和氧化分支, 前者将葡萄糖-6-磷酸转化成核酮糖-5P和NADPH, 后者为核酸和芳香族氨基酸合成提供核糖-5P.目前, 有研究发现当酿酒酵母受到环境胁迫产生氧化应激时, 其与PPP相关的产物会出现上调(Koppram et al., 2016).本研究结果显示当多头绒泡菌暴露于nTiO2时, 核酮糖-5P和核糖-5P的水平显着增加, 表明PPP可能作为抗氧化防御机制的一部分抵抗nTiO2的应激, 这与已有研究的结果是相似的.上述结果表明PPP和nTiO2暴露之间存在密切联系.此外在高剂量nTiO2处理组中, 与PPP相关的几种代谢产物的含量(低黄嘌呤、肌苷、鸟嘌呤、腺嘌呤和黄嘌呤)明显增加.在同一组中也检测到胞嘧啶和胞苷含量也显著增加.这些结果表明当多头绒泡菌暴露于nTiO2时有潜在的核苷酸需求.
PPP也与芳香族氨基酸(包括苯丙氨酸, 酪氨酸和色氨酸)的生物合成有关.芳香族氨基酸不仅是蛋白质的重要成分, 而且是生产某些类型酚类次级代谢产物的前体(Suastegui and Shao, 2016; Demidkina et al., 2009).在本研究中, 在nTiO2暴露下一些芳香族氨基酸和次级代谢物(酪氨酸、色氨酸、甲状腺素、褪黑激素和5-羟色氨酸)的水平显著升高(图 2).尤其是在15 mg·mL-1nTiO2处理组中, 芒柄花黄素(一种类黄酮)的水平增加了5.15×104倍.黄酮类化合物被认为是比维生素C和E还有类胡萝卜素更有效的抗氧化剂(Dai and Mumper, 2010), 而类黄酮衍生物则通过其HO·清除活动降低了紫外辐射下TiO2在水溶液中的氧化作用(Di et al., 2002).黄酮类化合物也被证明可以通过它们的—OH官能团来与nTiO2结合(Cao et al., 2016).因此对暴露于TiO2的多头绒泡菌来说, 芒柄花黄素被认为可能是类黄酮差异代谢物或解毒剂.
除了上述主要代谢物和次级代谢物外, 氨基酸衍生的代谢物(烟酰胺)的含量也显著增加.值得注意的是, 该代谢物的水平增加了至少5个数量级.烟酰胺是一种金属螯合剂, 普遍存在于高等植物中.许多研究发现在植物中烟酰胺涉及重金属解毒作用(Sharma et al., 2006; Takahashi et al., 2003; Weber et al., 2004).每个烟酰胺分子内的3个羧酸基都能够实现与过渡金属的高效结合.在本研究中烟酰胺的含量被nTiO2显著改变, 表明烟酰胺在暴露于nTiO2的多头绒泡菌中可能在解毒方面起作用, 同时可能作为nTiO2暴露的潜在差异代谢物.
本研究筛选的nTiO2毒性潜在差异代谢物都是与生物体生长密切联系的.本研究发现15 mg·mL-1 nTiO2处理的多头绒泡菌中TCA循环的部分代谢物水平下降, 这与秀丽隐杆线虫暴露于亚致死剂量的nTiO2时TCA循环代谢物水平下降的情况类似(Ratnasekhar et al., 2015).本研究发现15 mg·mL-1 nTiO2处理的多头绒泡菌中核酮糖-5P和核糖-5P的水平显着增加, 这与酿酒酵母受到环境胁迫产生氧化应激时其与PPP相关的产物出现上调的情况类似(Koppram et al., 2016).本研究还发现15 mg·mL-1 nTiO2处理的多头绒泡菌中烟酰胺的水平显著上升, 这与许多研究显示在植物中烟酰胺涉及重金属解毒作用类似(Sharma and Dietz, 2006; Takahashi et al., 2003; Weber et al., 2004).因此, 本研究采用的nTiO2毒性评估方法相比于已有的方法更加全面、高效和准确.
5 结论(Conclusions)当多头绒泡菌暴露于nTiO2后, 通过GC/MS代谢组学在全细胞水平检测到多种主要代谢产物及部分次级代谢产物发生了显著的变化, 这些发生显著变化的代谢物都具有作为nTiO2毒性潜在差异代谢物的可能.此外, 本研究也提出了将多头绒泡菌应用于单细胞毒性实验的可能.
Al-Awady M J, Greenway G M, Paunov V N. 2015. Nanotoxicity of polyelectrolyte-functionalized titania nanoparticles towards microalgae and yeast:role of the particle concentration, size and surface charge[J]. Rsc Advances, 5: 37044–37059.
DOI:10.1039/C5RA05577F
|
Barrantes I, Glockner G, Meyer S, et al. 2010. Transcriptomic changes arising during light-induced sporulation in Physarum polycephalum[J]. Bmc Genomics, 11(1): 115.
DOI:10.1186/1471-2164-11-115
|
Beekman M, Latty T. 2015. Brainless but Multi-Headed:Decision making by the acellular slime mould physarum polycephalum[J]. Journal of Molecular Biology, 427(23): 3734–3743.
DOI:10.1016/j.jmb.2015.07.007
|
Beylina S I, Matveeva N B, Teplov V A. 1996. Autonomous motile activity and chemotactical behaviour of Physarum polycephalum plasmodium[J]. Biofizika, 41(1): 133–138.
|
Block I, Briegleb W, Wolke A. 1996. Acceleration-sensitivity threshold of physarum[J]. Journal of Biotechnology, 47: 239–244.
DOI:10.1016/0168-1656(96)01385-5
|
Bo Y, Jin C Y, Liu Y M, et al. 2014. Metabolomic analysis on the toxicological effects of TiO2 nanoparticles in mouse fibroblast cells:from the perspective of perturbations in amino acid metabolism[J]. Toxicology Mechanisms And Methods, 24(7): 461–469.
DOI:10.3109/15376516.2014.939321
|
Bundy J G, Davey M P, Viant M R. 2009. Environmental metabolomics:a critical review and future perspectives[J]. Metabolomics, 5(1): 3–21.
DOI:10.1007/s11306-008-0152-0
|
Cao X Q, Ma C C, Gao Z L, et al. 2016. Characterization of the interactions between titanium dioxide nanoparticles and polymethoxyflavones using surface-enhanced raman spectroscopy[J]. Journal of Agricultural and Food Chemistry, 64(49): 9436–9441.
DOI:10.1021/acs.jafc.6b03906
|
Dai J, Mumper R J. 2010. Plant phenolics:extraction, analysis and their antioxidant and anticancer properties[J]. Molecules, 15(10): 7313–7352.
DOI:10.3390/molecules15107313
|
Daniel J W, Baldwin H H. 1964. Chapter 2 methods of culture for plasmodial myxomycetes. in:david mp (ed) methods in cell biology[J]. Academic Press, 1: 9–41.
|
Demidkina T V, Antson A A, Faleev N G, et al. 2009. Spatial structure and the mechanism of tyrosine phenol-lyase and tryptophan indole-lyase[J]. Molecular Biology, 43(2): 269–283.
DOI:10.1134/S0026893309020101
|
Di C A, Passi S, Ippolito F, et al. 2002. Free radical scavenger activity of rutosides[J]. Minerva Cardioangiologica, 50(6): 701–707.
|
Elliott G O, Murphy K J, Hayes J J, et al. 2013. Replication-independent nucleosome exchange is enhanced by local and specific acetylation of histone H4[J]. Nucleic Acids Research, 41(4): 2228–2238.
DOI:10.1093/nar/gks1451
|
Erdem A, Metzler D, Cha D K, et al. 2015. The short-term toxic effects of TiO2 nanoparticles toward bacteria through viability, cellular respiration, and lipid peroxidation[J]. Environmental Science and Pollution Research, 22(22): 17917–17924.
DOI:10.1007/s11356-015-5018-1
|
Gao Y, Luo Z, He N, et al. 2013. Metallic nanoparticle production and consumption in China between 2000 and 2010 and associative aquatic environmental risk assessment[J]. Journal of Nanoparticle Research, 15(6): 2182–2182.
|
Ghosh M, Bandyopadhyay M, Mukherjee A. 2010. Genotoxicity of titanium dioxide (TiO2) nanoparticles at two trophic levels plant and human lymphocytes[J]. Chemosphere, 81(10): 1253–1262.
DOI:10.1016/j.chemosphere.2010.09.022
|
Guttes E, Rusch H P, Guttes S. 1961. Morphological observations on growth and differentiation of physarum polycephalum grown in pure culture[J]. Developmental Biology, 3(5): 588–614.
DOI:10.1016/0012-1606(61)90034-3
|
Haindl M, Holler E. 2005. Use of the giant multinucleate plasmodium of physarum polycephalum to study RNA interference in the myxomycete[J]. Analytical Biochemistry, 342(2): 194–199.
DOI:10.1016/j.ab.2005.03.031
|
Hendren C O, Mesnard X, Dröge J, et al. 2011. Estimating production data for five engineered nanomaterials as a basis for exposure assessment[J]. Environmental Science & Technology, 45(7): 2562–2569.
|
Hu X, Li H, Tang P, et al. 2013. GC-MS-based metabolomics study of the responses to arachidonic acid in blakeslea trispora[J]. Fungal Genetics & Biology Fg & B, 57(2): 33–41.
|
Jamieson D J. 1998. Oxidative stress responses of the yeast Saccharomyces cerevisiae[J]. Yeast, 14(16): 1511–1527.
DOI:10.1002/(ISSN)1097-0061
|
Kim M S, Louis K M, Pedersen J A, et al. 2014. Using citrate-functionalized TiO2 nanoparticles to study the effect of particle size on zebrafish embryo toxicity[J]. Analyst, 139(5): 964–972.
DOI:10.1039/c3an01966g
|
Koppram R, Mapelli V, Albers E, et al. 2016. The presence of pretreated lignocellulosic solids from birch during saccharomyces cerevisiae fermentations leads to increased tolerance to inhibitors-a proteomic study of the effects[J]. Plos One, 11(2): e0148635.
DOI:10.1371/journal.pone.0148635
|
Lisec J, Schauer N, Kopka J, et al. 2006. Gas chromatography mass spectrometry-based metabolite profiling in plants[J]. Nature Protocols, 1(1): 387–396.
DOI:10.1038/nprot.2006.59
|
Mansfield C M, Alloy M M, Hamilton J, et al. 2015. Photo-induced toxicity of titanium dioxide nanoparticles to daphnia magna under natural sunlight[J]. Chemosphere, 120: 206–210.
DOI:10.1016/j.chemosphere.2014.06.075
|
Marron M T, Goodman E M, Greenebaum B, et al. 1986. Effects of sinusoidal 60-Hz electric and aagnetic-fields on atp and oxygen levels in the slime-mold, physarum-polycephalum[J]. Bioelectromagnetics, 7(3): 307–314.
DOI:10.1002/(ISSN)1521-186X
|
Piccinno F, Gottschalk F, Seeger S, et al. 2011. Industrial production quantities and uses of ten engineered nanomaterials in Europe and the world[J]. Journal of Nanoparticle Research, 14(9): 1109.
|
Ratnasekhar C, Sonane M, Satish A, et al. 2015. Metabolomics reveals the perturbations in the metabolome of Caenorhabditis elegans exposed[J]. Nanotoxicology, 9(8): 994–1004.
DOI:10.3109/17435390.2014.993345
|
Ryan D, Robards K. 2006. Metabolomics:The greatest omics of them all?[J]. Analytical Chemistry, 78(23): 7954–7958.
DOI:10.1021/ac0614341
|
Sanders K, Degn L L, Mundy W R, et al. 2012. In vitro phototoxicity and hazard identification of nano-scale titanium dioxide[J]. Toxicology and Applied Pharmacology, 258(2): 226–236.
DOI:10.1016/j.taap.2011.10.023
|
Sharma S S, Dietz K J. 2006. The significance of amino acids and amino acid-derived molecules in plant responses and adaptation to heavy metal stress[J]. Journal of Experimantal Botany, 57(4): 711–726.
DOI:10.1093/jxb/erj073
|
Skocaj M, Filipic M, Petkovic J, et al. 2011. Titanium dioxide in our everyday life; is it safe?[J]. Radiology and Oncology, 45(4): 227–247.
|
Stincone A, Prigione A, Cramer T, et al. 2015. The return of metabolism:biochemistry and physiology of the pentose phosphate pathway[J]. Biological Reviews, 90(3): 927–963.
DOI:10.1111/brv.2015.90.issue-3
|
Suastegui M, Shao Z Y. 2016. Yeast factories for the production of aromatic compounds:from building blocks to plant secondary metabolites[J]. Journal of Industrial Microbiology & Biotechnology, 43(11): 1611–1624.
|
Sujatha A, Balaji S, Devi R, et al. 2005. Isolation of physarum polycephalum plasmodial mutants altered in sporulation by chemical mutagenesis of flagellates[J]. European Journal of Protistology, 41(1): 19–27.
DOI:10.1016/j.ejop.2004.08.001
|
Suvagandha D, Nishijo M, Swaddiwudhipong W, et al. 2014. A biomarker found in cadmium exposed residents of thailand by metabolome analysis[J]. International Journal of Environmental Research and Public Health, 11(4): 3661–3677.
DOI:10.3390/ijerph110403661
|
Takahashi M, Terada Y, Nakai I, et al. 2003. Role of nicotianamine in the intracellular delivery of metals and plant reproductive development[J]. Plant Cell, 15(6): 1263–1280.
|
Taylor N S, Weber R J M, White T A, et al. 2010. Discriminating between different acute chemical toxicities via changes in the daphnid metabolome[J]. Toxicological Sciences, 118(1): 307–317.
DOI:10.1093/toxsci/kfq247
|
Weber M, Harada E, Vess C, et al. 2004. Comparative microarray analysis of arabidopsis thaliana and arabidopsis halleri roots identifies nicotianamine synthase, a zip transporter and other genes as potential metal hyperaccumulation factors[J]. Plant Journal, 37(2): 269–281.
DOI:10.1046/j.1365-313X.2003.01960.x
|
Zhang Z, Zhang J, Shi C, et al. 2017. Effect of oxidative stress from nanoscale TiO2 particles on a physarum polycephalum macroplasmodium under dark conditions[J]. Environmental Science Pollution Research, 24(20): 17241–17249.
DOI:10.1007/s11356-017-9484-5
|
 2018, Vol. 38
2018, Vol. 38


