2. 南华大学极贫铀资源绿色开发技术湖南省重点实验室, 衡阳 421001
2. Hunan Province Key Laboratory of Green Development Technology for Extremely Low Grade Uranium Resources, Hengyang 421001
环境中的铀主要来源于各种人类活动, 如铀矿开采、核武器试验、核事故泄露等(Soudek et al., 2014).铀是一种毒性很强的放射性元素, 其毒性表现为化学和放射性毒性, 对人体危害极大, 长期暴露在铀环境中会增加人的患癌风险.铀污染已经成为一个敏感的环境问题, 关系到核工业的可持续发展和人类的健康, 因此, 治理铀污染土壤已经成为当前亟待解决的问题(谭煜健等, 2017).
近年来, 植物修复技术以其原位、经济、绿色等优点而受到人们关注, 已经成为治理重金属和放射性核素污染土壤的有效手段(Chaney et al., 2007; Garbisu et al., 2001).然而, 植物修复的治理效果取决于植物对污染物的富集能力和植物的生物量.目前多数对铀具有超富集或富集能力的植物都存在生物量较低、根系扩张深度有限、对环境的适应性较差等问题(Kuppusamy et al., 2016), 因此, 如何增加植物的生物量、提高植物对环境的抗性成为植物修复铀污染土壤技术中的关键.植物根际促生菌及其分泌物不但可以给植物提供必要的营养物质和生长调节因子来提高植物的生物量, 还可以明显改变污染土壤中金属离子的活性和移动性, 从而达到提高超积累植物修复效率的目的(Ma et al., 2009).
假单胞菌属的菌种广泛分布在植物的根际, 荧光假单胞菌(Vurukonda et al., 2016)和绿针假单胞菌橙色亚种(Carlier et al., 2008)这两种植物根际促生菌(Plant Growth Promoting Rhizobacteria, PGPR)能产生促进植物生长的吲哚乙酸、有机酸、铁载体、ACC脱氨酶、氰酸等物质, 促进某些植物的存活和生长.当植物根际促生菌具有较好的抗逆性时, 也能增加其宿主植物对重金属(Ma et al., 2011)、干旱(Benabdellah et al., 2011)、盐度(Siddikee et al., 2011)、植物病原体(Pane et al., 2015)等的抗性, 从而使整个植物修复过程更加高效.已有大量研究利用植物根际促生菌来提高植物修复的效果, 如Dimkpa等(2009)发现唐德链霉菌(Streptomyces tendae F4)能明显促进向日葵对Cd的吸收, 使向日葵能高效地修复Cd污染的土壤;Venkatesh等(2012)发现铜绿假单胞杆菌(P.aeruginosa)分泌的鼠李糖脂能增强污染土壤中Cu的流动性, 使土壤中Cu的去除率升高.然而, 目前很少有将植物根际促生菌应用于植物修复干旱、重金属或放射性核素等多种胁迫同时存在的土壤的研究.
博落回在我国分布广泛, 生物量较大, 适应力极强(余林岚等, 2017), 是一种对铀具有较好富集效果的罂粟科植物(丁德馨等, 2010;Li et al., 2014), 在修复重金属污染土壤方面具有很大的潜力和价值.同时, 李旭等(2015)发现博落回对Pb、Zn也具有一定的富集能力;Jian等(2016)研究发现, 博落回对修复Cd污染的土壤具有重要价值.但目前对博落回的研究多针对重金属污染土壤修复, 对博落回在干旱胁迫下修复铀污染土壤的研究较少.根据我国铀矿资源的开采和利用情况, 砂岩型铀矿已成为我国铀矿资源的主要类型, 而砂岩型铀矿主要分布在北方降雨量较少、土壤相对干旱的地区, 采用植物修复铀污染土壤时, 必须提高植物的抗旱性.因此, 本文拟在博落回根系接种荧光假单胞菌和绿针假单胞菌橙色亚种这两种植物根际促生菌, 探究博落回在植物根际促生菌作用下抗干旱和铀富集性能的变化, 以期为干旱地区的植物修复提供新思路.
2 材料与方法(Materials and methods) 2.1 供试材料实验所用的两株菌种:荧光假单胞菌(Pseudomonas fluorescens, 编号23919, 记为菌种Ⅰ)和绿针假单胞菌橙色亚种(Pseudomonas chlororaphis subsp. aurantiaca, 编号23920, 记为菌种Ⅱ), 均购于中国工业微生物菌种保藏管理中心;博落回种子采自衡阳市郊云母山;供试土壤取自南华大学园艺区耕作层土壤(0~20 cm深度), 参考张甘霖等(2012)的方法对土壤基本理化性质进行测定, 结果如表 1所示.土壤碾碎自然风干后过4 mm筛, 按5:1的比例与河沙混合均匀, 在高压蒸汽(121 ℃、101 kPa)下连续灭菌3 d消灭土壤中的原有微生物, 然后将土壤放置在温度为25 ℃、湿度约55%的温室中, 取其中一半土壤加入UO2(NO3)2溶液, 调节土壤中U含量在20 mg·kg-1.土壤平衡16周后, 再次灭菌后分装到花盆(外径26 cm, 底径15.7 cm, 高17.6 cm)中, 每盆3 kg土壤.
| 表 1 供试土壤基本理化性质 Table 1 Basic physicochemical properties of the tested soil |
将细菌接种到含5 g·L-1蛋白胨、3 g·L-1牛肉浸膏、5 g·L-1氯化钠的液体培养基中, 置于28 ℃的生化培养箱中静置培养.培养好的菌液以8000 r·min-1离心15 min, 获取离心后的细菌, 并用无菌水稀释至菌悬液的OD600≈1.0(约108 CFU·mL-1), 然后将单个的菌液及混合好的菌液分别接种到处理好的土壤中, 并用灭菌铲搅拌混合均匀(赵青云等, 2015).实验组每千克土壤接种100 mL菌悬液(同上离心后用无菌水稀释的菌悬液), 对照组接种等量的无菌水.将以上花盆用保鲜膜封口, 置于25 ℃的温室中孵化3周.
2.3 种子侵染和发芽试验挑选颗粒饱满的博落回种子将其浸泡在无菌水中7 h, 捞出沥干后放入1%的次氯酸钠溶液中浸泡10 min进行消毒, 然后用无菌水漂洗种子3次, 每次1 min.将灭菌好的种子随机均匀的分成4组(对照组CK、侵染组Ⅰ、侵染组Ⅱ和侵染组Ⅲ), 平铺在培养皿中, 侵染组Ⅰ、Ⅱ、Ⅲ的培养皿中分别加入100 mL OD600≈1.0的荧光假单胞菌、绿针假单胞菌橙色亚种、荧光假单胞菌+绿针假单胞菌橙色亚种的菌悬液进行充分侵染2 h, 对照组加入等量无菌水浸泡.
侵染结束后的种子在无菌操作台中沥干, 将4组种子分别播种到发芽盒中, 每穴20粒种子, 每组播种10穴.将发芽盒置于25 ℃, 相对湿度为60%的光照培养箱中, 光照处理12 h, 暗处理12 h, 根据种子的需要给种子浇无菌水, 每隔5 d给各组种子喷洒一次相应的菌液或无菌水, 记录种子的发芽情况(幼苗破土即可视为发芽), 以萌发20 d为准, 探究植物根际促生菌对博落回种子发芽率的影响.
2.4 盆栽试验盆栽试验所选地为衡阳市南华大学温室, 控制温室内温度为25 ℃、湿度约55%, 利用补光灯保持光照时长12 h·d-1.本研究为干旱(无干旱、有干旱)、U(未污染、20 mg·kg-1)、菌种Ⅰ(接种、未接种)、菌种Ⅱ(接种、未接种)等4因素2水平的完全随机试验设计, 共16个处理.取长势一致的博落回幼苗, 将根部浸泡在1%的次氯酸钠溶液10 min, 并用无菌水冲洗干净后移栽到盆栽中.待幼苗生长1个月后参照文献(谢文华等, 2017)控制水量, 对照组保持土壤相对含水量(土壤含水量占田间持水量的百分数)为75%~80%(无干旱), 干旱组控制土壤相对含水量在30%~35%(重度干旱), 两种干旱条件下都含以下处理:①对照, 未接种菌+无U污染;②未接种菌+U污染;③接种菌Ⅰ+无U污染;④接种菌Ⅰ+U污染;⑤接种菌Ⅱ+无U污染;⑥接种菌Ⅱ+U污染;⑦菌Ⅰ/Ⅱ同时接种+无U污染;⑧菌Ⅰ/Ⅱ同时接种+U污染.每个处理3个平行样, 每天监测盆栽中含水量, 根据盆栽需要不定期浇水.每隔2周给盆栽土壤浇一次相应的植物根际促生菌菌液(空白组浇无菌水), 4个月后对植物进行收割.
2.5 博落回各项指标测定 2.5.1 博落回生长指标将博落回地上部和地下部分别收获, 样品分别用自来水、去离子水清洗3次, 根系置于20 mmol·L-1的EDTA-Na2中交换15 min, 以除去根系表面吸附的铀, 最后用去离子水冲洗3次, 吸水纸吸干表面水分, 然后分别测量博落回的株高、茎粗及根部和地上部分的鲜重.
2.5.2 叶片相对水含量(RWC)测定参照文献(Chaves et al., 2009)的方法测定叶片相对含水量.将收割的新鲜博落回取相同部位的叶片, 测其鲜重w1;将叶片置入去离子水中浸泡24 h, 擦拭干表面水分, 测得饱和重量w2;最后将叶片放入75 ℃干燥箱中干燥72 h, 测得干重w3.叶片相对水含量按照公式(1)计算.
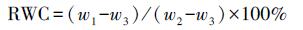
|
(1) |
取植物倒二叶新鲜叶片, 清洗干净沥干后称取0.200 g剪碎放入试管中, 然后加入10 mL丙酮和无水乙醇的混合物(丙酮:无水乙醇= 2:1), 用封口膜封口置于25 ℃摇床中, 遮光振荡24 h后离心取上清液, 用分光光度计测量在663、645和652 nm波长处吸光度值(Ding et al., 2016).按照如下公式计算叶片中叶绿量:
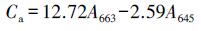
|
(2) |
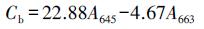
|
(3) |
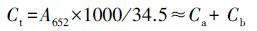
|
(4) |
式中, Ca为叶绿素a含量, Cb为叶绿素b含量, Ct为叶绿素总量, A为波长.
2.5.4 脯氨酸含量测定利用酸性茚三酮比色法(李合生, 2006)测定叶片中脯氨酸含量.称取0.200 g新鲜植物叶片, 剪碎后放入试管中.加入5 mL 3%磺基水杨酸溶液, 沸水浴中浸提10 min, 取出试管冷却至室温后, 吸取上清液2 mL, 加入2 mL水、2 mL冰乙酸和3 mL 2.5%的酸性茚三酮(以3:2的冰乙酸和6 mol·L-1的磷酸作溶剂进行配制)溶液, 放入沸水浴中加热45 min进行显色, 取出试管冷却, 然后加入5 mL甲苯充分振荡, 萃取红色物质.用分光光度计测定在520 nm波长处的吸光度值, 利用标准曲线计算脯氨酸含量.
2.5.5 博落回对铀的富集根据文献(胡南等, 2012)测定植物铀含量.将收割处理好后的植物放入80 ℃干燥箱中干燥72 h, 移入瓷坩埚中用高温马弗炉在600 ℃下灰化6 h, 待完全冷却过后取出样品, 准确称量0.200 g灰分, 放入聚四氟乙烯管中, 采用ETHOS-1型微波消解仪进行消解.消解完成后, 将消解液定容至50 mL, 过滤后用ICP-MS(7700 X, Agilent, USA)测定溶液中的铀含量.
2.6 统计学分析所有的实验数据均采用3次重复的平均值±标准误差表示.用SPSS18.0统计软件对博落回鲜重、株高、茎粗、叶绿素含量、U富集量进行方差分析, 通过Tukey多重比较法检验处理间的差异显著性(p < 0.05), 用不同小写字母表示差异显著性.用Origin8.0进行制图.
3 结果与讨论(Results and discussion) 3.1 接种植物根际促生菌对博落回种子发芽率和生长指标的影响保证植物在干旱胁迫下的发芽率是进行植物修复的最基本要求.由图 1可知, 接种植物根际促生菌显著提高了博落回的发芽率, 接种荧光假单胞菌和绿针假单胞菌橙色亚种使博落回种子的发芽率分别提高了59.09%和40.91%, 两种细菌同时接种时, 博落回种子发芽率仅提高了36.36%.干旱胁迫下植物种子活力会降低, 发芽率会下降, 而植物根际促生菌分泌的赤霉素和生长素等物质能促进博落回种子发芽, 提高博落回种子的发芽率, 这对植物修复具有重大意义.
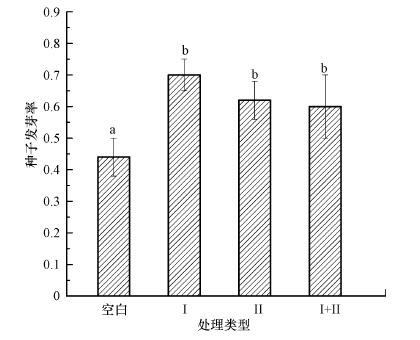 |
| 图 1 接种植物根际促生菌对博落回种子发芽率的影响 (Ⅰ:接种荧光假单胞菌, Ⅱ:接种绿针假单胞菌橙色亚种, Ⅰ+Ⅱ:同时接种两种细菌;不同小写字母表示不同菌种对博落回种子发芽率影响显著(p < 0.05)) Fig. 1 Effects of inoculation with PGPR on the germination rate of Macleaya cordata |
接种植物根际促生菌对博落回生长指标的影响如表 2所示, 在相同胁迫条件下, 接种了植物根际促生菌的博落回, 与空白组相比鲜重显著增加.其中, 在铀单独胁迫下, 接种荧光假单胞菌对博落回生长指标的促进效果最为明显, 使其鲜重增加了97.36%, 且植株高度和茎粗也分别增加了90.52%和4.00%.从表 2可以看出, 在不接种植物根际促生菌时, 博落回生长在铀、干旱和铀+干旱的胁迫下, 其鲜重与对照组相比分别减少了52.49%、65.93%和72.96%, 株高分别降低了26.14%、52.07%和41.29%, 茎粗分别减少了12.48%、30.74%和30.07%.研究表明, 当植物未接种促生菌时, 在重金属胁迫、干旱胁迫和重金属+干旱胁迫的条件下, 植物的生长情况会受到抑制(Anjum et al., 2011; Ings et al., 2013).而当博落回接种植物根际促生菌后, 植物对环境胁迫的反应明显改善, 植物的生长发育状况都比未接种植物根际促生菌的植物好.接种荧光假单胞菌时, 在铀、干旱、干旱+铀3种胁迫条件下博落回鲜重与空白组相比分别增加了97.36%、35.03%和48.46%;接种绿针假单胞菌橙色亚种时, 在铀或干旱胁迫下博落回鲜重分别增加了80.26%和21.01%, 铀+干旱胁迫时植物鲜重无明显变化;两种细菌同时接种时, 3种胁迫条件下博落回鲜重分别增加了21.68%、17.33%和43.01%.博落回接种植物根际促生菌以后, 植物根际促生菌分泌的一些化学物质, 如IAA、铁载体、ACC脱氨酶等能缓和植物遭受的干旱或铀的胁迫, 增强博落回的抗旱等能力(Ma et al., 2016), 使博落回在干旱胁迫下也能有较高的生物量.但两种细菌同时接种时, 对博落回生物量的提高效果明显低于细菌单独接种时, 可能是因为两种植物根际促生菌存在着竞争作用, 相互抑制, 导致对博落回生长的促进作用低于单独接种一种细菌, 具体原因仍有待探究.
| 表 2 接种植物根际促生菌对博落回生长指标的影响 Table 2 Effects of inoculation with PGPR on the growth index of Macleaya cordata |
叶片相对水含量是反应叶片水分状况的指标, 能直接反映出植物体内水分亏缺的程度.当植物在干旱胁迫下具有较高的生物量时, 需要保持较高的叶片相对水含量(Ma et al., 2016).如图 2所示, 未接种植物根际促生菌时, 博落回在干旱和干旱+铀胁迫条件下叶片相对含水量较对照组分别降低了16.91%和22.64%.Khoyerdi等(2016)和Jin等(2015)研究发现, 开心果和马齿苋在干旱胁迫下叶片中相对含水量也会减少.而在干旱和干旱+铀胁迫条件下, 接种了植物根际促生菌后植物叶片中相对水含量显著增加.如在干旱胁迫下, 两种细菌单独接种及同时接种时, 博落回叶片相对含水量较空白组分别提高了26.90%、19.31%和29.48%;在干旱+铀胁迫时, 两种细菌单独接种及同时接种时, 博落回叶片相对含水量较空白组分别提高了37.59%、35.56%和36.11%.这一结果与Ortiz等(2015)提出的观点相符合, 证明了接种植物根际促生菌能提高植物根部在干旱情况下对水分的吸收.荧光假单胞菌和绿针假单胞菌橙色亚种都能产生植物生长素(IAA), 已有大量研究表明, 因IAA能直接刺激植物细胞的伸长和有丝分裂, 抑制主根的生长, 促进侧根和根须的生长和形成, 使植物根的相对表面积和延伸范围增加(Kamnev et al., 2000; Glick et al., 1998; Patten et al., 2002; Sheng et al., 2006), 从而促进博落回根部对水分的吸收.叶片相对含水量的高低能反映出植物代谢活动的强弱(Colom et al., 2003), 对干旱适应性越强的植物在干旱胁迫下叶片的相对含水量就越高(朱春云等, 1996).而荧光假单胞菌和绿针假单胞菌橙色亚种都能使博落回叶片的相对含水量在一定干旱条件下仍保持在一个较高的水平, 提高博落回对干旱的抗性, 也使博落回在干旱胁迫下仍能较好的生长.
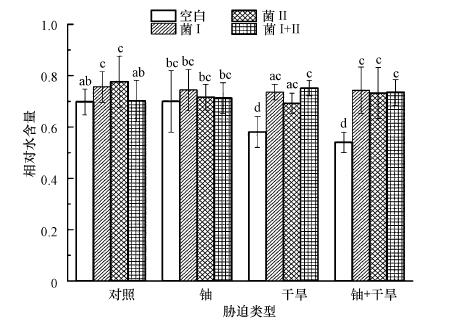 |
| 图 2 接种植物根际促生菌对博落回叶片相对水含量的影响 Fig. 2 Effects of inoculation with PGPR on leaf relative water content of Macleaya cordata |
叶绿素含量的高低是反映植物抗旱能力的重要参数之一.研究表明, 干旱会导致叶绿素前体细胞生物合成受到限制、色素的缺失及叶绿体类囊体膜破坏, 从而使叶片中的色绿含量降低(Ashraf et al., 2013).由表 3可知, 未接种植物根际促生菌时, 生长在3种胁迫条件下的博落回叶片中叶绿素a、叶绿素b及叶绿素总量与对照组相比显著降低, 如在单独干旱胁迫下, 未添加植物根际促生菌的博落回叶片中叶绿素a、叶绿素b和叶绿素总量与对照组相比分别降低了57.50%、31.69%和50.54%.而博落回在接种植物根际促生菌以后, 叶片中的叶绿素含量显著增加, 如在单独干旱胁迫下, 接种了荧光假单胞菌的博落回叶片中叶绿素a、b和叶绿素总量与空白组相比分别增加了87.52%、43.42%和71.11%;在干旱+铀胁迫下分别增加了74.02%、135.71%和95.92%.在各个胁迫条件下, 单独接种荧光假单胞菌、绿针假单胞菌橙色亚种及两种细菌同时接种, 都增强了博落回对干旱的抗性, 使博落回叶片中叶绿素含量高于对照组, 让博落回在干旱胁迫下也能正常进行光合作用等生理活动, 保持较高的生物量.
| 表 3 接种植物根际促生菌对博落回叶片叶绿素含量的影响 Table 3 Effects of inoculation with PGPR on chlorophyll content in leaves of Macleaya cordata |
图 3为接种植物根际促生菌对博落回叶片中脯氨酸含量(以鲜重计)的影响, 在没有干旱或铀胁迫时, 是否接种植物根际促生菌对博落回叶片中脯氨酸含量无影响, 博落回未受到外界胁迫, 体内没有大量的积累脯氨酸.而在干旱和铀+干旱胁迫时, 未接种植物根际促生菌的博落回叶片中脯氨酸含量显著增加, 最为明显的是干旱+铀胁迫, 其次是干旱胁迫.在干旱胁迫下, 接种荧光假单胞菌、绿针假单胞菌橙色亚种及两种细菌同时接种时, 叶片中脯氨酸含量有与未接种植物根际促生菌相比分别降低了71.70%、64.91%和61.35%;在干旱+铀同时胁迫时, 博落回叶片中脯氨酸含量与空白组相比分别降低了70.70%、66.38%和60.73%.Hayat等(2012)研究表明, 当植物遇到干旱、重金属等胁迫时, 体内会大量积累脯氨酸、蔗糖等无生物毒性且分子量较小的可溶性有机物质, 这类物质通过调节植物细胞渗透压和保持细胞膜完整性等方式来保护植物.在一些研究(Ortiz et al., 2015; Armada et al., 2015)中也发现, 接种了植物根际促生菌的植物体内脯氨酸含量低于同条件下没有接种的植物, 表明植物根际促生菌能增强植物对生物胁迫的抗性.从图 3中也可看出, 接种荧光假单胞菌和绿针假单胞菌橙色亚种后, 在同等条件下博落回体内脯氨酸含量变化较为平缓, 受干旱影响较空白组小, 在干旱和干旱+铀胁迫下的胁迫反应没有空白组强烈, 表明博落回抗旱性在接种植物根际促生菌后得到增强.
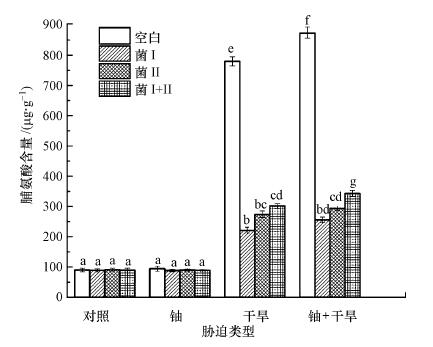 |
| 图 3 接种植物根际促生菌对博落回叶片中脯氨酸含量的影响 Fig. 3 Effects of inoculation with PGPR on proline content of the Macleaya cordata′s leaves |
植物修复的效果主要取决于植物对污染元素的富集能力和植物的生物量, 当单株植物对污染元素的富集量升高时, 在相同植物生物量情况下, 植物修复的效果也就越好.当博落回处于干旱胁迫下时, 各部位的铀含量显著低于正常状态(表 4), 可能是由于干旱在一定程度上限制了博落回的发育, 使博落回各部位对铀的富集量降低.在干旱胁迫下, 接种了植物根际促生菌的博落回对铀的富集量显著高于未接种的博落回.如接种了荧光假单胞菌的博落回根、茎、叶的铀富集量比空白组分别提高了99.28%、121.58%和192.63%;接种绿针假单胞菌橙色亚种时根、茎、叶的富集量比空白组分别提高了54.26%、122.47%和179.49%;两种细菌同时接种时根、茎、叶的富集量比空白组分别提高了39.54%、50.31%和71.50%.接种了荧光假单包菌、绿针假单胞菌橙色亚种及同时接种两种细菌时, 单株博落回对铀的富集总量分别提高了109.52%、66.67%和42.86%.在没有干旱胁迫下, 单独接种荧光假单胞菌和绿针假单胞菌橙色亚种后博落回根、茎、叶对铀好富集量分别提高了124.71%和107.54%、154.29%和70.67%、87.32%和83.14%;同时接种两种植物根际促生菌也能使博落回根、茎、叶的富集量分别提高143.93%、25.39%和65.39%.接种荧光假单胞菌、绿针假单胞菌橙色亚种及同时接种两种细菌时, 单株博落回对铀的富集总量分别提高了122.64%、103.77%和43.40%.接种植物根际促生菌后, 博落回对铀的富集量显著提高, 其主要原因可能有两方面:一是植物根际促生菌分泌的含铁细胞、植物生长激素(IAA)、1-氨基-1-羧基环丙烷脱氨酶(ACCD)等促进了植物根的伸长(Kamnev et al., 2000), 使博落回对铀的富集量增加;另一方面, 植物根际促生菌通过分泌生物表面活性剂、有机酸等物质活化铀在土壤中的生物有效性, 增加了博落回对土壤中铀的提取量, 从而提高博落回富集铀的性能(Braud et al., 2009; Rajkumar et al., 2010).
| 表 4 接种植物根际促生菌对博落回富集铀的影响 Table 4 Effects of inoculation with PGPR on the bioaccumulation of uranium in Macleaya cordata |
1) 博落回根际单独接种荧光假单胞菌、单独接种绿针假单胞菌橙色亚种及同时接种这两种菌后, 其生物量、相对含水量、叶绿素和脯氨酸含量等指标得到了明显改善, 抗干旱性能和富集铀性能也都得到增强, 且在相同条件下荧光假单胞菌的增强效果最显著.
2) 通过在博落回根际单独接种荧光假单胞菌, 可以增强博落回对干旱地区铀污染土壤的修复作用.
Anjum S A, Xie X, Wang L, et al. 2011. Morphological, physiological and biochemical responses of plants to drought stress[J]. African Journal of Agricultural Research, 6(9): 2026–2032.
|
Armada E, Azcon R, Lopez-Castillo O M, et al. 2015. Autochthonous arbuscular mycorrhizal fungi and Bacillus thuringiensis from a degraded Mediterranean area can be used to improve physiological traits and performance of a plant of agronomic interest under drought conditions[J]. Plant Physiology and Biochemistry, 90: 64–74.
DOI:10.1016/j.plaphy.2015.03.004
|
Ashraf M, Harris P J C. 2013. Photosynthesis under stressful environments:An overview[J]. Photosynthetica, 51(2): 163–190.
DOI:10.1007/s11099-013-0021-6
|
Benabdellah K, Abbas Y, Abourouh M, et al. 2011. Influence of two bacterial isolates from degraded and non-degraded soils and arbuscular mycorrhizae fungi isolated from semi-arid zone on the growth of Trifolium repens under drought conditions:Mechanisms related tobacterial effectiveness[J]. European Journal of Soil Biology, 47(5): 303–309.
DOI:10.1016/j.ejsobi.2011.07.004
|
Braud A, Jezequel K, Bazot S, et al. 2009. Enhanced phytoextraction of an agricultural Cr-and Pb-contaminated soil by bioaugmentation with siderophore-producingbacteria[J]. Chemosphere, 74(2): 280–286.
DOI:10.1016/j.chemosphere.2008.09.013
|
Carlier E, Rovera M, Jaume A R, et al. 2008. Improvement of growth, under field conditions, of wheat inoculated with Pseudomonas chlororaphis, subsp.aurantiaca, SR1[J]. World Journal of Microbiology & Biotechnology, 24(11): 2653–2658.
|
Chaney R L, Angle J S, Broadhurst C L, et al. 2007. Improved understanding of hyperaccumulation yields commercial phytoextraction and phytomining technologies[J]. Journal of Environmental Quality, 36(5): 1429–1443.
DOI:10.2134/jeq2006.0514
|
Chaves M M, Flexas J, Pinheiro C. 2009. Photosynthesis under drought and salt stress:regulation mechanisms from whole plant to cell[J]. Annals of Botany, 103(4): 551–560.
DOI:10.1093/aob/mcn125
|
Colom M R, Vazzana C. 2003. Photosynthesis and PSⅡ functionality of drought-resistant and drought-sensitive weeping lovegrass plants[J]. Environmental and Experimental Botany, 49(2): 135–144.
DOI:10.1016/S0098-8472(02)00065-5
|
丁德馨, 李广悦, 胡南, 等.2010.一种利用植物修复铀尾矿砂的方法[P].中国专利.CN101642768.2010-02-10
|
Ding Y J, Zhang J J. 2016. Extraction of REPs from leaves reflectance spectrum for estimation of chlorophyll content[J]. International Federation of Automatic Control-Papers On Line, 49(16): 205–208.
|
Dimkpa C O, Merten D, Svato Scaron A, et al. 2009. Metal-induced oxidative stress impacting plant growth in contaminated soil is alleviated by microbial siderophores[J]. Soil Biology & Biochemistry, 41(1): 154–162.
|
Garbisu C, Alkorta I. 2001. Phytoextraction:a cost-effective plant-based technology for the removal of metals from the environment[J]. Bioresource Technology, 77(3): 229–236.
DOI:10.1016/S0960-8524(00)00108-5
|
Glick B R, Penrose D M, Li J. 1998. A model for the lowering of plant ethylene concentrations by plant growth-promoting bacteria[J]. Journal of Theoretical Biology, 190(1): 63–68.
DOI:10.1006/jtbi.1997.0532
|
Hayat S, Hayat Q, Alyemeni M N, et al. 2012. Role of proline under changing environments:a review[J]. Plant Signaling & Behavior, 7(11): 1456–1466.
|
胡南, 丁德馨, 李广悦, 等. 2012. 五种水生植物对水中铀的去除作用[J]. 环境科学学报, 2012, 33(7): 1637–1645.
|
Ings J, Mur L A J, Robson P R H, et al. 2013. Physiological and growth responses to water deficit in the bioenergy crop Miscanthus x giganteus[J]. Frontiers in Plant Science, 4(2): 468.
|
Jian N, Liu Y, Zeng G, et al. 2016. Cadmium accumulation and tolerance of Macleaya cordata:a newly potential plant for sustainable phytoremediation in Cd-contaminated soil[J]. Environmental Science and Pollution Research International, 23(10): 10189–10199.
DOI:10.1007/s11356-016-6263-7
|
Jin R, Shi H, Han C, et al. 2015. Physiological changes of purslane (Portulaca oleracea L.) after progressive drought stress and rehydration[J]. Scientia Horticulturae, 194: 215–221.
DOI:10.1016/j.scienta.2015.08.023
|
Kamnev A A, Lelie D V D. 2000. Chemical and biological parameters as tools to evaluate and improve heavy metal phytoremediation[J]. Bioscience Reports, 20(4): 239–258.
DOI:10.1023/A:1026436806319
|
Khoyerdi F F, Shamshiri M H, Estaji A. 2016. Changes in some physiological and osmotic parameters of several pistachio genotypes under drought stress[J]. Scientia Horticulturae, 198: 44–51.
DOI:10.1016/j.scienta.2015.11.028
|
Kuppusamy S, Palanisami T, Megharaj M, et al. 2016. In-situ remediation approaches for the management of contaminated sites:a comprehensive overview[J]. Rev Environ Contam Toxicol, 236(18): 1–115.
|
Li C W, Hu N, Ding D X, et al. 2015. Phytoextraction of uranium from contaminated soil by Macleaya cordata before and after application of EDDS and CA[J]. Environmental Science & Pollution Research, 22(8): 6155–6163.
|
李旭, 韦靖, 欧杨丽桃, 等. 2015. 不同有色金属矿区的三种植物中五种重金属元素含量的测定[J]. 福建分析测试, 2015, 24(5): 18–22.
DOI:10.3969/j.issn.1009-8143.2015.05.04 |
李合生. 2006. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社: 192–194.
|
Ma Y, Rajkumar M, Freitas H. 2009. Isolation and characterization of Ni mobilizing PGPB from serpentine soils and their potential in promoting plant growth and Ni accumulation by Brassica spp[J]. Chemosphere, 75(6): 719–725.
DOI:10.1016/j.chemosphere.2009.01.056
|
Ma Y, Prasad M N, RajkumarM, et al. 2011. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances, 29(2): 248–258.
DOI:10.1016/j.biotechadv.2010.12.001
|
Ma Y, Rajkumar M, Chang Z, et al. 2016. Inoculation of Brassica oxyrrhina, with plant growth promoting bacteria for the improvement of heavy metal phytoremediation under drought conditions[J]. Journal of Hazardous Materials, 320: 36–44.
DOI:10.1016/j.jhazmat.2016.08.009
|
Ortiz N, Armada E, Duque E, et al. 2015. Contribution of arbuscular mycorrhizal fungi and/or bacteria to enhancing plant drought tolerance under natural soil conditions:Effectiveness of autochthonous or allochthonous strains[J]. Journal of Plant Physiology, 174: 87–96.
DOI:10.1016/j.jplph.2014.08.019
|
Pane C, Zaccardelli M. 2015. Evaluation of Bacillus strains isolated from solanaceous phylloplane for biocontrol of Alternaria early blight of tomato[J]. Biological Control, 84: 11–18.
DOI:10.1016/j.biocontrol.2015.01.005
|
Patten C L, Glick B R. 2002. Role of Pseudomonas putida indoleacetic acid in development of the host plant root system[J]. Applied and Environmental Microbiology, 68(8): 3795–3801.
DOI:10.1128/AEM.68.8.3795-3801.2002
|
Rajkumar M, Ae N, Prasad M N V, et al. 2010. Potential of siderophore-producing bacteria for improving heavy metal phytoextraction[J]. Trends in Biotechnology, 28(3): 142–149.
DOI:10.1016/j.tibtech.2009.12.002
|
Sheng X F, Xia J J. 2006. Improvement of rape (Brassica napus) plant growth and cadmium uptake by cadmium-resistant bacteria[J]. Chemosphere, 64(6): 1036–1042.
DOI:10.1016/j.chemosphere.2006.01.051
|
Siddikee M A, Glick B R, Chauhan P S, et al. 2011. Enhancement of growth and salt tolerance of red pepper seedlings (Capsicum annuum L.) by regulating stress ethylene synthesis with halotolerantbacteriacontaining1-aminocyclopropane-1-carboxylicaciddeaminase activity[J]. Plant Physiology & Biochemistry, 49(4): 427–434.
|
Soudek P, Petrova S, Buzek M, et al. 2014. Uranium uptake in Nicotiana sp under hydroponic conditions[J]. Journal of Geochem Explor, 142(4): 130–137.
|
谭煜健, 胡南, 张辉, 等. 2017. 满江红对不同形态铀的吸附行为[J]. 环境科学学报, 2017, 37(10): 3713–3719.
|
Venkatesh N M, Vedaraman N. 2012. Remediation of soil contaminated with copper using Rhamnolipids produced from Pseudomonas aeruginosa, MTCC 2297 using waste frying rice bran oil[J]. Annals of Microbiology, 62(1): 85–91.
DOI:10.1007/s13213-011-0230-9
|
Vurukonda S S, Vardharajula S, Shrivastava M, et al. 2016. Enhancement of drought stress tolerance in crops by plant growth promoting rhizobacteria[J]. Microbiological Research, 184: 13–24.
DOI:10.1016/j.micres.2015.12.003
|
谢文华, 陈琴, 白璐. 2017. 干旱胁迫下3种驱蚊植物营养生长期叶绿素含量变化[J]. 中国测试, 2017, 35(6I): 185–193.
|
余林岚, 程辟, 唐其, 等. 2017. 不同胁迫博落回根中生物碱含量变化及相关基因表达量分析[J]. 分子植物育种, 2017, 15(4): 1–7.
|
张甘霖, 龚子同. 2012. 土壤调查实验室分析方法[M]. 北京: 科学出版社.
|
赵青云, 赵秋芳, 王辉, 等. 2015. 根际促生菌Bacillus subtilisY-IVI在香草兰上的应用效果研究[J]. 植物营养与肥料学报, 2015, 21(2): 535–540.
|
朱春云, 刘霞. 1996. 锦鸡儿等旱生树种抗旱生理的研究[J]. 干旱区研究, 1996(1): 59–63.
|
 2018, Vol. 38
2018, Vol. 38


