2. 南华大学极贫铀资源绿色开发技术湖南省重点实验室, 衡阳 421001
2. Hunan Province Key Laboratory of Green Development Technology for Extremely Low Grade Uranium Resources, Hengyang 421001
随着我国核电的快速发展, 对铀的需求量也在不断增加.但陆地铀资源只能供人类使用约100年(Abney et al., 2016), 人类需要寻找新的铀资源.在铀矿勘查、开采和铀水冶过程中所产生的大量低浓度含铀废水就是一类非常重要的铀资源.研究这类废水铀的提取方法, 不仅可以为这类铀资源的开发利用提供新技术, 而且还能治理这类废水污染(Shin et al., 2016).近几十年来, 研究者们已提出了化学沉淀法、溶剂萃取法、离子交换法、膜分离法和吸附法等多种提取废水铀的方法(Bleise et al., 2003).其中吸附法因其工艺简单、效率高、成本低等优点被认为是提取废水铀最合适的方法(魏广芝等, 2007; Zhou et al., 2012; Chen et al., 2013; Wang et al., 2016; Wen et al., 2016; 刘晨等, 2017).
磁性纳米材料具有体积小、比表面积大、在外加磁场作用下易被分离等优点, 因而利用磁性纳米材料吸附放射性核素和重金属离子的技术, 受到了研究人员的广泛关注.同时, 磁性材料特定的表面活性位点容易被化学修饰和功能化, 因此它对目标金属离子的选择性吸附性能也很容易通过化学修饰得到提高(Wei et al., 2014; Zeng et al., 2014; Tan et al., 2015; Tan et al., 2015; Saleh et al., 2017).
离子液体(Ionic liquids, ILs)是由有机阳离子和无机或有机大阴离子构成的在室温及接近室温下为液体的物质.由于离子液体具有蒸汽压低、热稳定性和化学稳定性好、离子交换能力强、电子传递能力高、电化学窗口宽、可设计性等特点, 在放射性核素分离富集方面引起广泛关注(褚泰伟等, 2007; 李宏宇等, 2014).近年已有众多学者报道了单独使用磁性纳米离子液体或功能化离子液体分离富集U(VI)的研究, 并取得了良好的效果.然而, 将功能化离子液体接枝负载到纳米磁性材料表面并应用于吸附低浓度废水铀的研究还尚未见报道.
本研究先通过在磁性纳米粒子CoFe2O4表面包覆一层SiO2、在包覆层表面接枝负载功能化离子液体3-氰甲基-1-乙烯基咪唑鎓氯化物(PCMVImCl)、对离子液体表面的腈基进行偕胺肟化, 制备出磁性核壳结构的CoFe2O4@SiO2@PIL-AO复合材料;再采用傅立叶变换红外光谱(FTIR)、扫描电镜(SEM)和X射线光电子能谱(XPS)对其结构进行表征;最后研究这种复合材料对低浓度废水铀的吸附行为、吸附动力学及吸附机理.本研究的目的是为低浓度废水铀的提取提供一种新型吸附剂.
2 材料与方法(Materials and methods) 2.1 主要仪器与试剂扫描电镜、傅立叶变换红外光谱仪、X射线光电子能谱仪、电感耦合等离子体质谱仪、电动搅拌器、数控超声波清洗器、真空干燥箱、精密pH计.所有化学试剂都是分析纯级别, 无需进一步纯化.
铀标准储备液参照文献(Pang et al., 2011)所述方法配制, 八氧化三铀基准试剂由中核集团272铀业公司提供.实验所用不同铀浓度溶液, 通过超纯水稀释标准储备液制备.
2.2 CoFe2O4@SiO2@PIL-AO材料的制备磁性核壳CoFe2O4@SiO2@PIL-AO材料通过4个步骤合成, 详细合成路线如图 1所示.
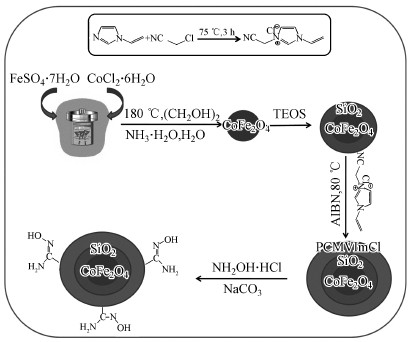 |
| 图 1 CoFe2O4@SiO2@PIL-AO合成步骤 Fig. 1 Procedures for the synthesis of CoFe2O4@SiO2@PIL-AO |
将10 mmol Fe3O4·7H2O与5 mmol CoCl2·4H2O溶解在150 mL乙二醇和100 mL去离子水的混合溶液中, 加入10 mL氨水, 超声振荡10 min.然后把混合溶液倒入500 mL高温反应釜中, 在180 ℃条件下加热反应24 h.冷却至室温后, 倒入烧杯中, 用磁铁分离3 min, 收集黑色沉淀.用乙醇和水分别洗涤3次, 在60 ℃条件下真空干燥12 h.
2.2.2 CoFe2O4@SiO2的制备把0.5 g CoFe2O4加入到80 mL乙醇中, 超声振荡10 min, 然后再向溶液中分别加入20 mL去离子水, 10 mL氨水和1 mL正硅酸乙酯(TEOS), 室温下电动搅拌8 h(Tang et al., 2007; Cannas et al., 2010).反应完成后将混合溶液倒入烧杯中, 用磁铁分离3 min, 收集黑色沉淀.用乙醇和水各洗涤3次, 在60 ℃条件下真空干燥12 h.
2.2.3 PCMVImCl的制备将4.7 g 1-乙烯基咪唑与3.75 g氯乙腈加入到50 mL圆底烧瓶中, 密封, 然后在75 ℃条件下电动搅拌6 h.反应完全后, 收集淡黄色固体, 并用乙酸乙酯和乙醚分别洗涤2次, 淡黄色固体在60 ℃下干燥12 h.
2.2.4 CoFe2O4@SiO2@PIL的制备先将3 g CoFe2O4@SiO2加入到50 mL乙腈中, 然后分别加入3 g PCMVImCl、0.2 g偶氮二异丁腈(AIBN)和10 mL去离子水, 在80 ℃、N2保护下电动搅拌72 h.反应后将溶液倒入烧杯中, 用磁铁分离3 min, 收集黑色固体.用乙腈洗涤3次后在60 ℃条件下真空干燥12 h.
2.2.5 CoFe2O4@SiO2@PIL-AO的制备在25 mL去离子水和25 mL乙醇的混合溶液中加入3 g CoFe2O4@SiO2@PIL, 再加入1.5 mL NH2·OH·HCl, 在80 ℃、N2保护的条件下电动搅拌24 h.然后将溶液倒入烧杯中, 用磁铁吸3 min, 收集剩余固体.最后将收集的固体用乙醇洗涤3次, 在60 ℃条件下真空干燥12 h.
2.3 吸附实验在不同实验条件下进行分批次吸附实验, 考察CoFe2O4@SiO2@PIL-AO对U(VI)的吸附性能.在一系列150 mL三角烧瓶中, 用移液管移取50 mL不同浓度的U(VI)溶液, 加入0.02 g CoFe2O4@SiO2@PIL-AO吸附剂, 采用0.1 mol·L-1 HCl和0.1 mol·L-1 NaOH溶液调节溶液pH值, 并于298.15~328.15 K、180 r·min-1条件下的恒温摇床中振荡一段时间.吸附完成后用磁铁分离3 min, 取上清液5 mL, 经0.22 μm聚偏氟乙烯滤头过滤后, 采用ICP-MS分析溶液中U(VI)的浓度.
吸附容量Q、吸附率A和分配系数Kd分别使用以下公式计算:
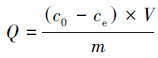
|
(1) |
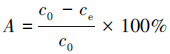
|
(2) |

|
(3) |
式中, c0和ce分别是U(VI)的初始浓度(mg·L-1)和平衡浓度(mg·L-1);V是溶液体积(L);m是吸附剂的质量(g).
2.4 解吸实验将最佳吸附条件下达到吸附平衡的CoFe2O4@SiO2@PIL-AO与溶液用磁铁分离, 采用50 mL 0.1 mol·L-1 HCl对其进行解吸, 并用ICP-MS分析解吸液中U(VI)的浓度.然后将解吸后CoFe2O4@SiO2@PIL-AO用超纯水清洗至中性, 干燥.干燥好的CoFe2O4@SiO2@PIL-AO再用于U(VI)的吸附, 上述步骤重复5次, 研究其重复利用性能.
3 结果与讨论(Results and discussion) 3.1 表征 3.1.1 傅里叶变换红外光谱图 2为CoFe2O4@SiO2@PIL-AO及中间产物CoFe2O4、CoFe2O4@SiO2、CoFe2O4@SiO2@PIL的红外光谱图.可以看出, 上述4种材料在588 cm-1附近都有较强的吸收峰, 可能是Fe—O的伸缩振动峰(Carja et al., 2011).通过在CoFe2O4表面包裹SiO2以后, CoFe2O4@SiO2、CoFe2O4@SiO2@PIL和CoFe2O4@SiO2@PIL-AO的红外谱图在1090和470 cm-1附近出现Si—O—Si的伸缩振动峰(Wang et al., 2006).从CoFe2O4@SiO2@PIL红外图谱可以看出在2242 cm-1附近出现新的吸收峰, 这可能是—C≡N基伸缩振动峰, 表明PCMVImCl离子液体被成功接枝固载到CoFe2O4@SiO2表面.从CoFe2O4@SiO2@PIL-AO红外图谱可以看出2242 cm-1附近的吸收峰消失且在3194、1649、1269和920 cm-1附近出现新的吸收峰(—NH2, —CN—, —C—N—和—N—O—)(Das et al., 2015), 这可能是因为CoFe2O4@SiO2@PIL与盐酸羟胺反应, CoFe2O4@SiO2@PIL中的腈基转化为偕胺肟基团.上述结果表明PCMVImCl离子液体成功接枝固载到CoFe2O4@SiO2表面, 且—C≡N基成功被偕胺肟化.
 |
| 图 2 CoFe2O4 (a), CoFe2O4@SiO2 (b), CoFe2O4@SiO2@PIL (c)和CoFe2O4@SiO2@PIL-AO (d)的红外光谱图 Fig. 2 FTIR spectra for CoFe2O4 (a), CoFe2O4@SiO2 (b), CoFe2O4@SiO2@PIL (c) and CoFe2O4@SiO2@PIL-AO (d) |
图 3为CoFe2O4@SiO2@PIL-AO及中间产物CoFe2O4、CoFe2O4@SiO2、CoFe2O4@SiO2@PIL的扫描电镜图, 从图 3可以看出CoFe2O4颗粒成均匀的球形, 包裹SiO2后, 球形颗粒尺寸变大, 表面也变得光滑.通过接枝固载PCMVImCl离子液体后, 球形粒子尺寸进一步增大, 颗粒之间出现粘结.对CoFe2O4@SiO2@PIL进行偕胺肟化后, CoFe2O4@SiO2@PIL-AO颗粒还呈球形, 但颗粒之间粘结更明显.
 |
| 图 3 CoFe2O4 (a), CoFe2O4@SiO2 (b), CoFe2O4@SiO2@PIL (c)和CoFe2O4@SiO2@PIL-AO(d)扫描电镜图 Fig. 3 SEM images for CoFe2O4 (a), CoFe2O4@SiO2 (b), CoFe2O4@SiO2@PIL (c) and CoFe2O4@SiO2@PIL-AO (d) |
采用XPS对CoFe2O4@SiO2@PIL-AO的元素组成进行了分析, CoFe2O4@SiO2@PIL-AO的XPS全谱图如图 4所示.由图可知, CoFe2O4@SiO2@PIL-AO中含有Si、C、N、O、Fe、Co等元素.证实PCMVImCl离子液体可能已成功接枝固载到CoFe2O4@SiO2表面.
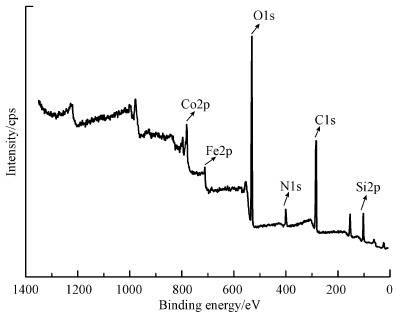 |
| 图 4 CoFe2O4@SiO2@PIL-AO XPS全谱图 Fig. 4 XPS full-scan spectra for CoFe2O4@SiO2@PIL-AO |
溶液pH值的变化对U(VI)吸附性能的影响如图 5所示.由图 5可知, 在pH=4 ~ 6时, CoFe2O4@SiO2@PIL-AO对U(VI)的吸附率和吸附容量随着溶液pH值的升高而迅速增加;在pH=6时, 吸附率和吸附容量达到最大值;随着pH值的进一步增加, 吸附率和吸附容量逐渐下降.为解释上述现象, 本文采用Visual MINTEQ 3.0软件模拟了铀在不同pH条件下的存在形态, 其结果如图 6所示.在pH=4时, 溶液中U(VI)主要以UO22+存在, 同时在该pH条件下溶液中存在大量与UO22+竞争的H+和H3O+, 从而CoFe2O4@SiO2@PIL-AO对U(VI)的吸附率及吸附容量较小, 随着溶液pH值的升高(pH>4), 溶液中的U(VI)主要以UO2OH+和(UO2)2(OH)22+存在, 同时溶液中的H+和H3O+浓度降低, H+和H3O+与U(VI)的竞争得到缓解, 使得吸附率和吸附容量增加.然而随着pH值的进一步升高(pH>6), 吸附率和吸附容量反而降低, 这可能是由于溶液中的U(VI)发生水解, 生成了不利于CoFe2O4@SiO2@PIL-AO吸附的水解产物(UO2)3(OH)5+、(UO2)4(OH)7+、UO2CO3(aq)、UO2(CO3)34-和UO2(CO3)22-.以上结果表明CoFe2O4@SiO2@PIL-AO吸附U(VI)的最佳溶液pH值为6.
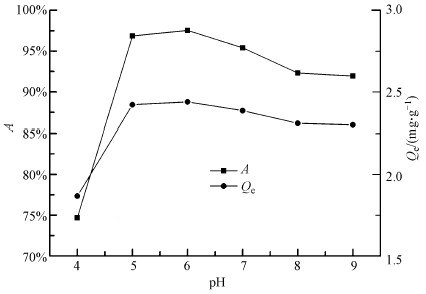 |
| 图 5 溶液pH对U(VI)吸附效果的影响(c0= 1 mg·L-1, m=0.02 g, V=50 mL, t=8 h, T=298.15 K) Fig. 5 Effect of pH on U(VI) adsorption efficiency by CoFe2O4@SiO2@PIL-AO |
 |
| 图 6 铀在不同pH条件下的存在形态(c0= 1 mg·L-1, PCO2 =101.5 Pa) Fig. 6 Predicted U (VI) speciation in aqueous solution as function of pH |
吸附时间对U(VI)吸附性能的影响如图 7所示.结果表明:CoFe2O4@SiO2@PIL-AO对U(VI)的吸附率和吸附容量随着吸附时间的增长而增加, 经历了快速吸附(0~25 min)、慢速吸附(25~420 min)和吸附平衡(420~480 min)3个过程.CoFe2O4@SiO2@PIL-AO对U(VI)的吸附率和吸附容量在前25 min内迅速增加, 25~420 min内增加速度变缓, 直至420 min后达到平衡.为了研究CoFe2O4@SiO2@PIL-AO对U(VI)吸附的动力学特征, 采用准一级和准二级动力学模型研究该吸附过程.两种模型的线性公式可分别表示为:
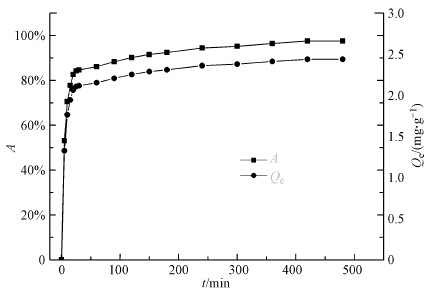 |
| 图 7 吸附时间对U(VI)吸附效果的影响(c0=1 mg·L-1, V=50 mL, pH=6.00±0.05, m=0.02 g, T=298.15 K) Fig. 7 Effect of adsorption time on U(VI) adsorption efficiency by CoFe2O4@SiO2@PIL-AO |
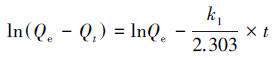
|
(4) |

|
(5) |
式中, Qe和Qt分别为吸附平衡时的吸附容量(mg·g-1)和时间为t时的吸附容量(mg·g-1);k1(h-1)和k2(h-1)分别是准一级和准二级动力学模型的速率常数.线性拟合结果如图 8所示.动力学参数k1、k2和Qe可分别通过线性拟合方程的斜率和截距计算得出, 结果见表 1.准二级动力学方程的可决系数R2接近1, 且大于准一级动力学方程的可决系数, 实验平衡吸附容量Qe, exp (2.438 mg·g-1)与理论平衡吸附容量Qe, cal (2.454 mg·g-1)非常接近, 因此, CoFe2O4@SiO2@PIL-AO对U(VI)的吸附动力学行为可以用准二级动力学模型来描述.上述结果表明表面吸附为该吸附过程的主要控制步骤, 而且这一过程主要是化学吸附过程(Bektaş et al., 2004; Namasivayam et al., 2007).
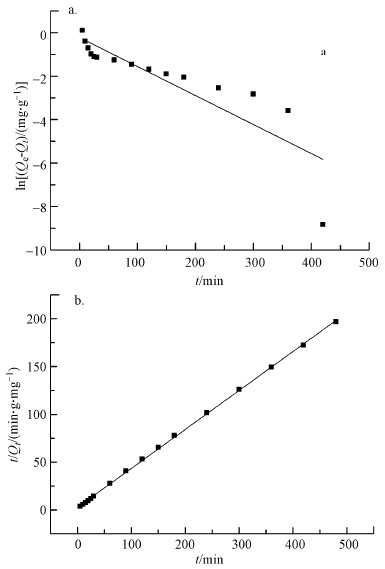 |
| 图 8 准一级方程(a)和准二级方程(b)的线性拟合 Fig. 8 Linear fitting curves for pseudo-first-order kinetic model (a) and pseudo-second-order kinetic model (b) |
| 表 1 铀吸附的动力学参数 Table 1 Adsorption kinetics parameters for U(VI) adsorption |
在V=50 mL, pH=6.00±0.05, m=0.02 g, t=8 h, T=298.15 K条件下, 研究了不同初始U(VI)浓度对U(VI)吸附效果的影响, 其结果如图 9所示.
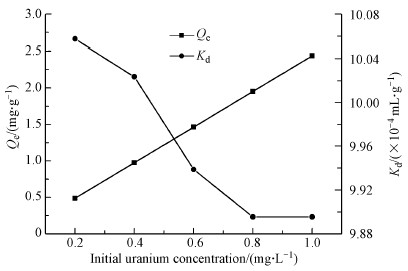 |
| 图 9 初始U(VI)浓度对吸附容量和Kd的影响(V=50 mL, pH=6.00±0.05, m=0.02 g, t=8 h, T=298.15 K) Fig. 9 Effect of initial U(VI) concentration on adsorption capacity and Kd for CoFe2O4@SiO2@PIL-AO |
随着初始U(VI)浓度的增加, CoFe2O4@SiO2@PIL-AO对U(VI)的吸附容量也逐渐增加.然而随着初始U(VI)浓度的增加, U(VI)的分配系数逐渐减少.这可能是由于随着U(VI)浓度增加, 吸附剂表面更多的活性位点被占据, 但还未到达饱和, 使得吸附容量增加而分配系数降低.采用Langmuir和Freundlich等温线模型对实验数据进行拟合, 其拟合曲线如图 10所示.Langmuir模型和Freundlich模型的线性方程分别表示为:
 |
| 图 10 Langmuir方程(a)和Freundlich方程(b)的线性拟合曲线 Fig. 10 Linear fitting curves for Langmuir equation (a) and Freundlich equation (b) |
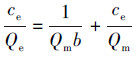
|
(6) |

|
(7) |
式中, ce为吸附平衡时溶液中U(VI)的浓度(mg·L-1), Qe为吸附平衡时的U(VI)的吸附容量(mg·g-1), Qm为理论饱和吸附容量(mg·g-1), b为Langmuir常数, KF和n分别为与吸附容量和吸附强度有关的Freundlich常数.
根据线性拟合方程的斜率和截距可分别计算出Langmuir和Freundlich等温线的参数Qm、b、KF、n及R2, 其结果如表 2所示.对比表 2中的参数可知, Freundlich等温线模型的可决系数(R2=0.999)大于Langmuir等温线模型的可决系数(R2=0.891).Freundlich模型更适合描述CoFe2O4@SiO2@PIL-AO对U(VI)的吸附过程, 由此可知CoFe2O4@SiO2@PIL-AO对U(VI)的吸附为多层吸附(Lee et al., 2009).Freundlich等温线方程中的n>1, 表明U(VI)容易被CoFe2O4@SiO2@PIL-AO吸附(Lin et al., 2011).
| 表 2 CoFe2O4@SiO2@PIL-AO吸附U(VI)的等温线模型参数 Table 2 Isotherm model parameters for adsorption of U(VI) by CoFe2O4@SiO2@PIL-AO |
Langmuir等温线模型参数表明, CoFe2O4@SiO2@PIL-AO对U(VI)的最大饱和吸附容量为109.051 mg·g-1.将CoFe2O4@SiO2@PIL-AO与其他吸附剂吸附U(VI)的效果进行比较, 结果如表 3所示.从表 3可以看出, CoFe2O4@SiO2@PIL-AO相对其他吸附剂, 具有较高的最大吸附容量, 是一种高效的低浓度铀吸附材料.
| 表 3 不同吸附剂吸附U(VI)能力的比较 Table 3 Comparison of adsorption of U(VI)by different adsorbents |
在V=50 mL, c0=1 mg·L-1, pH=6.00±0.05, t=8 h, m=0.02 g的条件下, 研究了不同温度(298.15、308.15、318.15、328.15 K)对U(VI)的吸附效果的影响, 实验结果如图 11所示.随着温度的升高, CoFe2O4@SiO2@PIL-AO对U(VI)的吸附容量逐渐增大.结果表明较高的温度有利于U(VI)的吸附.为进一步研究CoFe2O4@SiO2@PIL-AO对U(VI)吸附的热力学性质, 主要利用标准吉布斯自由能变化(ΔG0)、焓变(ΔH0)和熵变(ΔS0)3个参数来进行吸附过程的自发性研究.标准吉布斯自由能变化(ΔG0)、焓变(ΔH0)和熵变(ΔS0)热力学参数可以使用以下公式计算:
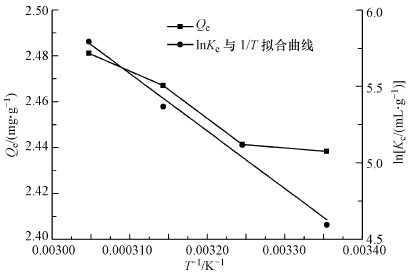 |
| 图 11 温度对吸附容量的影响及lnKc与1/T的拟合曲线图 Fig. 11 Effect of temperature on adsorption capacity and fitting curves for lnKc versus 1/T |

|
(8) |
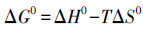
|
(9) |
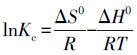
|
(10) |
式中, Kc是平衡常数(Qe/ce), T和R分别是绝对温度(K)和气体常数(8.314 J·mol-1·K-1).lnKc与1/T的拟合曲线如图 11所示.ΔS0和ΔH0可以从截距和斜率得到, 结果如表 4所示.吸附过程的焓变(ΔH0)和熵变(ΔS0)分别为31.308 kJ·mol-1和143.491 J·mol-1·K-1.ΔH0为正值表明U(VI)的吸附过程为吸热过程, 而ΔS0标志着吸附系统的稳定性, 其值为正数表明吸附过程是一个紊乱程度增加的过程, 表明反应向正方向进行.此外, 标准吉布斯自由能变化(ΔG0)的值均小于0, 表明CoFe2O4@SiO2@PIL-AO对U(VI)的吸附过程是自发进行的, 此外, 随着温度的升高ΔG0呈递减的趋势, 这表明温度的升高有利于U(VI)的吸附.
| 表 4 CoFe2O4@SiO2@PIL-AO吸附U(VI)的热力学参数 Table 4 Thermodynamic parameters for adsorption of U(VI) by CoFe2O4@SiO2@PIL-AO |
采用50 mL、0.1 mol·L-1 HCl对达到吸附平衡的CoFe2O4@SiO2@PIL-AO进行解吸, 解吸实验结果如图 12所示.5次循环使用后, CoFe2O4@SiO2@PIL-AO对U(VI)的吸附容量变化不大, 吸附容量仅下降了0.013 mg·g-1, 吸附容量下降可能是因为随着重复利用次数的增加, U(VI)占据吸附剂表面部分活性位点后, 不能被完全解吸下来.以上结果表明CoFe2O4@SiO2@PIL-AO具有良好的可重复利用性, 可作为一种经济有效的低浓度铀吸附剂.
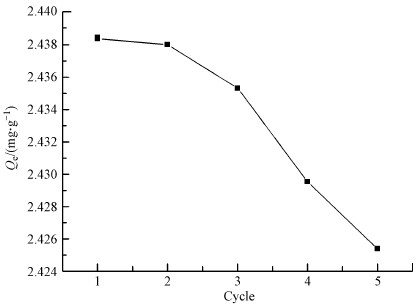 |
| 图 12 CoFe2O4@SiO2@PIL-AO的吸附-解吸循环实验结果 Fig. 12 Experimental results for adsorption-desorption cycles by CoFe2O4@SiO2@PIL-AO |
有文献报道, 偕胺肟基团上的胺基比普通胺基的活性强;偕胺肟基团(AO)中的肟基(:NOH)氧原子以及胺基(—NH2)氮原子上都含有未成键的孤对电子, 能与U(VI)形成稳定的五元环状结构(陈海军等, 2017; 杨姗也等, 2018; 梁宇等, 2017; Zeng et al., 2017).由此可以推断, CoFe2O4@SiO2@PIL-AO表面的偕胺肟基团(AO)中的肟基(:NOH)氧原子以及胺基(—NH2)氮原子亦能与铀形成稳定的五元环结构, 这也许就是CoFe2O4@SiO2@PIL-AO能高效吸附铀的机理.
4 结论(Conclusions)1) CoFe2O4@SiO2@PIL-AO能高效吸附低浓度废水中的U(VI), 高效吸附条件为c0=0.2 mg·L-1、pH=6.00±0.05、T=298.15 K、m=0.02 g、t=8 h, 吸附率为97.54%.
2) Freundlich等温吸附模型和准二级动力学模型能较好的拟合CoFe2O4@SiO2@PIL-AO对U(VI)的吸附过程, 该吸附属于化学吸附和多层吸附.热力学参数表明, 吸附是自发的吸热过程.
3) CoFe2O4@SiO2@PIL具有良好的可循环使用性, 循环使用5次后它对U(VI)的吸附容量没有明显下降.
Abney C W, Mayes R T, Piechowicz M, et al. 2016. XAFS investigation of polyamidoxime-bound uranyl contests the paradigm from small molecule studies[J]. Energy & Environmental Science, 9(2): 448–453.
|
Awwad N S, Daifullah A A M. 2005. Preconcentration of U (VI) from aqueous solutions after sorption using Sorel's cement in dynamic mode[J]. Journal of Radioanalytical and Nuclear Chemistry, 264(3): 623–628.
DOI:10.1007/s10967-005-0762-1
|
Bektaş N, Aǧim B A, Kara S. 2004. Kinetic and equilibrium studies in removing lead ions from aqueous solutions by natural sepiolite[J]. Journal of Hazardous Materials, 112(1/2): 115–122.
|
Bleise A, Danesi P R, Burkart W. 2003. Properties, use and health effects of depleted uranium (DU):a general overview[J]. Journal of Environmental Radioactivity, 64(2/3): 93.
|
Camacho L M, Deng S, Parra R R. 2010. Uranium removal from groundwater by natural clinoptilolite zeolite:effects of pH and initial feed concentration[J]. Journal of Hazardous Materials, 175(1/3): 393–398.
|
Cannas C, Musinu A, Ardu A, et al. 2010. CoFe2O4 and CoFe2O4/SiO2 core/shell nanoparticles:magnetic and spectroscopic study[J]. Chemistry of Materials, 22(11): 3353–3361.
DOI:10.1021/cm903837g
|
Carja G, Pui A, Gherca D. 2011. Characterization and magnetic properties of capped CoFe2O4 nanoparticles ferrite prepared in carboxymethylcelullose solution[J]. Digest Journal of Nanomaterials & Biostructures, 6(4): 173–1791.
|
陈海军, 黄舒怡, 张志宾, 等. 2017. 功能性纳米零价铁的构筑及其对环境放射性核素铀的富集应用研究进展[J]. 化学学报, 2017, 75(6): 560–574.
|
褚泰伟, 秦丽, 刘新起, 等. 2007. 离子液体用于溶剂萃取铀酰离子的初步研究[J]. 核化学与放射化学, 2007, 29(3): 146–150.
DOI:10.3969/j.issn.0253-9950.2007.03.004 |
Chen S, Hong J, Yang H, et al. 2013. Adsorption of uranium (VI) from aqueous solution using a novel graphene oxide-activated carbon felt composite[J]. Journal of Environmental Radioactivity, 126(4): 253–258.
|
Das S, Tsouris C, Zhang C, et al. 2015. Enhancing uranium uptake by amidoxime adsorbent in seawater:An investigation for optimum alkaline conditioning parameters[J]. Industrial & Engineering Chemistry Research, 3(15): 4294–4302.
|
Lee S J, Chung S G, Kim D J, et al. 2009. New method for determination of equilibrium/kinetic sorption parameters[J]. Current Applied Physics, 9(6): 1323–1325.
DOI:10.1016/j.cap.2008.12.016
|
Lin J, Zhan Y, Zhu Z. 2011. Adsorption characteristics of copper (Ⅱ) ions from aqueous solution onto humic acid-immobilized surfactant-modified zeolite[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 384(1/3): 9–16.
|
Liu Y, Li Q, Cao X, et al. 2013. Removal of uranium (VI) from aqueous solutions by CMK-3 and its polymer composite[J]. Applied Surface Science, 285: 258–266.
DOI:10.1016/j.apsusc.2013.08.048
|
梁宇, 顾鹏程, 姚文, 等. 2017. 碳基纳米材料对水环境中放射性元素铀的吸附[J]. 化学进展, 2017, 9: 1062–1071.
|
刘晨, 陈元涛, 张炜, 等. 2017. KH-550改性埃洛石对水中铀酰离子吸附性能的研究[J]. 环境科学学报, 2017, 37(1): 243–248.
|
李宏宇, 申利红, 张乐, 等. 2014. 咪唑型功能离子液体合成及其对铀的萃取[J]. 原子能科学技术, 2014, 48(3): 390–394.
|
Namasivayam S, Salman K, Mittal K, et al. 2007. Hypervascular hepatic focal lesions:spectrum of imaging features[J]. Curr Probl Diagn Radiol, 36(3): 107–123.
DOI:10.1067/j.cpradiol.2006.12.004
|
Pang C, Liu Y H, Cao X H, et al. 2011. Biosorption of uranium(VI) from aqueous solution by dead fungal biomass of Penicillium citrinum[J]. Chemical Engineering Journal, 170(1): 1–6.
DOI:10.1016/j.cej.2010.10.068
|
Saleh T A, Naeemullah, Tuzen M, et al. 2017. Polyethylenimine modified activated carbon as novel magnetic adsorbent for the removal of uranium from aqueous solution[J]. Chemical Engineering Research & Design, 117: 218–227.
|
Shin W, Oh J, Choung S, et al. 2016. Distribution and potential health risk of groundwater uranium in Korea[J]. Chemosphere, 163: 108–115.
DOI:10.1016/j.chemosphere.2016.08.021
|
Tan L, Liu Q, Jing X, et al. 2015. Removal of uranium(VI) ions from aqueous solution by magnetic cobalt ferrite/multiwalled carbon nanotubes composites[J]. Chemical Engineering Journal, 273(1): 307–315.
|
Tan L, Zhang X, Liu Q, et al. 2015. Synthesis of Fe3O4@TiO2 core-shell magnetic composites for highly efficient sorption of uranium (VI)[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 469: 279–286.
|
Tang D, Yuan R, Chai Y, et al. 2007. Magnetic-core/porous-shell CoFe2O4/SiO2 composite nanoparticles as immobilized affinity supports for clinical immunoassays[J]. Advanced Functional Materials, 17(6): 976–982.
DOI:10.1002/(ISSN)1616-3028
|
Tran H H, Roddick F A, O'Donnell J A. 1999. Comparison of chromatography and desiccant silica gels for the adsorption of metal ions-I.adsorption and kinetics[J]. Water Research, 33(13): 2992–3000.
DOI:10.1016/S0043-1354(99)00017-2
|
Wang C C, Chen I H, Lin C R. 2006. Preparation and characterization of hollow magnetic silica (CoFe2O4-SiO2) microspheres[J]. Journal of Magnetism & Magnetic Materials, 304(1): 451–453.
|
Wang F, Liu Q, Li R, et al. 2016. Selective adsorption of uranium(VI) onto prismatic sulfides from aqueous solution[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 490: 215–221.
|
Wei J, Zhang X, Liu Q, et al. 2014. Magnetic separation of uranium by CoFe2O4 hollow spheres[J]. Chemical Engineering Journal, 241: 228–234.
DOI:10.1016/j.cej.2013.12.035
|
Wen L, Xiao Z, Wang T, et al. 2016. Adsorption of U(VI) by multilayer titanate nanotubes:Effects of inorganic cations, carbonate and natural organic matter[J]. Chemical Engineering Journal, 286(2): 427–435.
|
魏广芝, 徐乐昌. 2007. 低浓度含铀废水的处理技术及其研究进展[J]. 铀矿冶, 2007, 26(2): 90–95.
DOI:10.3969/j.issn.1000-8063.2007.02.007 |
Xie S, Zhang C, Zhou X, et al. 2009. Removal of uranium (VI) from aqueous solution by adsorption of hematite[J]. Journal of Environmental Radioactivity, 99(2): 162–166.
|
杨姗也, 王祥学, 陈中山, 等. 2018. 四氧化三铁基纳米材料制备及对放射性元素和重金属离子的去除[J]. 化学进展, 2018, 30(2/3): 225–242.
|
Zeng J, Zhang H, Sui Y, et al. 2017. New amidoxime-based material TMP-g-AO for uranium adsorption under seawater conditions[J]. Industrial & Engineering Chemistry Research, 56(17): 5021–5032.
|
Zeng M, Huang Y, Zhang S, et al. 2014. Removal of uranium(VI) from aqueous solution by magnetic yolk-shell iron oxide@magnesium silicate microspheres[J]. Rsc Advances, 4(10): 5021–5029.
DOI:10.1039/c3ra45330h
|
Zhou L, Shang C, Liu Z, et al. 2012. Selective adsorption of uranium(VI) from aqueous solutions using the ion-imprinted magnetic chitosan resins[J]. Journal of Colloid & Interface Science, 366(1): 165–172.
|
 2018, Vol. 38
2018, Vol. 38


