2. 生态系统保护与恢复杭州市重点实验室, 杭州师范大学, 杭州 310036
2. Key Laboratory of Hangzhou City for Ecosystem Protection and Restoration, Hangzhou Normal University, Hangzhou 310036
纳米氧化锌(ZnO NPs)结合了典型纳米材料与氧化锌的物化特性, 在电子、磁学、光学、能源、传感器及材料学等领域得到了广泛应用(刘春光等, 2005), 但同时也增加了其与生物体接触的机会.生物链与呼吸道是常见的生物体暴露途径(张淑慧, 2015).ZnO NPs诱导的呼吸道毒性研究源于职业暴露氧化锌尘雾导致的肺部或全身性反应, 并进一步引起广泛关注(Drinker et al., 1927; Martin et al., 1999), 然而针对其机制的研究目前尚无定论.
气管上皮细胞是呼吸道的重要组成部分之一, 对于维持呼吸道黏膜的屏障功能至关重要.研究发现, 上皮细胞的动态变化, 包括细胞数目、形态变化、细胞间、细胞与基底之间连接、细胞迁移运动等变化均会增加有害物质进入细胞内的风险, 从而导致细胞毒性(Opp et al., 2009; Tarantola et al., 2009; Xiao et al., 2003). Giaever和Keese在Nature上首先提出的细胞阻抗测量(Electric Cell-substrate Impedance Sensing, ECIS)技术是一种先进的生物传感器技术(Giaever et al., 2008), 通过微电流传感器实时、定量、非介入性地测量由于细胞贴壁状态、位置、形态等方面变化导致的电流变化, 从而判断细胞动态变化情况, 能有效地分析纳米颗粒物导致的气管上皮细胞屏障损伤情况, 并已被应用于毒理学领域(Johnsen et al., 2011; Male et al., 2008; Opp, 2009).目前已有用细胞电阻抗检测技术进行纳米粒子毒性方面的研究, 例如, Sergent等(2012)采用细胞电阻抗检测技术研究了二氧化硅纳米粒子对HT-29人肠细胞的毒性.Tarantola等(2011)用细胞电阻抗实时检测系统研究了金纳米颗粒的毒性, 结果发现, 具有相同的表面功能的球形金纳米粒子比杆状粒子毒性更大. Kling等(2014)利用ECIS和MTT(细胞增长抑制率检测方法)两种方法检测暴露于叔丁基氢过氧化物(t-BOOH, 一种典型的能引起体外神经细胞氧化应激的物质)神经元细胞系(HT-22)时发现, 与对照组相比, 加入t-BOOH后细胞的阻抗值呈下降趋势, 当浓度分别为200和300 μmol·L-1时细胞阻抗值显著降低, 与MTT检测结果一致.已有很多研究证实了ZnO NPs具有细胞毒性作用, 细胞生长抑制和氧化损伤是其主要的作用机制(冯玲芳等, 2013; 徐莺莺等, 2013).有研究显示, 当ZnO NPs浓度分别为50和100 μg·mL-1时, 对Neuro-2A细胞生长具有抑制作用(Jeng et al., 2006). ZnO NPs能够进入到HAECs(人主动脉内皮细胞)细胞, 在ZnO NPs浓度为10 μg·mL-1时可造成HAECs细胞发生氧化应激反应, 随其暴露浓度的升高, ZnO NPs最终会导致HAECs细胞坏死(Gojova et al., 2007).对人肺腺癌细胞(A549)的毒性研究结果认为, ZnO NPs通过诱导A549细胞内ROS含量升高使其发生氧化应激反应, 导致细胞生长抑制率升高, 细胞毒性加剧(Lin et al., 2009).然而针对ZnO NPs诱导的细胞屏障损伤的机制值得进一步深入探究.
本研究采用大鼠气管上皮细胞(Rat tracheal epithelial cells, RTE cell)为靶细胞, 暴露于不同粒径(50和200 nm)和不同浓度(1和10 mg·L-1)的ZnO NPs中12 h, 利用ECIS检测ZnO NPs诱导的细胞动态变化, 通过检测细胞增殖抑制率、ROS和MDA水平, 初步分析其诱导的细胞毒性机制, 并分析影响细胞毒性差异的关键因素, 以期为ZnO NPs生物安全评估、纳米毒理学研究及其材料的安全应用提供一定的理论支持.
2 材料与方法(Materials and methods) 2.1 材料 2.1.1 细胞株与试剂RTE细胞株购自北京北纳生物有限公司;ZnO NPs(平均粒径为50和200 nm, 纯度为99.99%)购自上海阿拉丁试剂有限公司;DMEM高糖培养液、胎牛血清和胰蛋白酶购自美国Gibco公司;磷酸缓冲液(PBS)购自国药试剂有限公司;Cell Counting Kit 8试剂盒购自日本同仁化学研究所;活性氧(ROS)、丙二醛(MDA)和蛋白浓度定量(BCA)试剂盒购自南京建成生物有限公司;8W10E电极板(1盒)、细胞培养瓶.
2.1.2 仪器主要包括SHELLAB二氧化碳细胞培养箱、Invitrogen COUNTESS自动细胞计数仪、THERMO Varioskan Flash全波长多功能酶标仪、Nikon90i全自动正置荧光显微成像系统、NiKonTS100倒置荧光显微成像系统、BCM-1600A生物超净台(北京中科)、百典HHS-21-8型水浴锅、902-ULTS超低温冰箱(美国Thermo公司)、Optima L-90K超速落地冷冻离心机、guava easyCyte 8微流式细胞分析仪(美国默克密理博公司)、ECIS Zθ细胞电阻抗动态分析仪(美国Applied Biophysics公司).
2.2 方法 2.2.1 细胞培养取冻存的RTE细胞株于37 ℃水浴中快速融化, 在超净工作台中转移至装有2 mL DMEM高糖培养基(含10%胎牛血清、100 U·mL-1青霉素和100 μg·mL-1链霉素)的无菌离心管中, 1000 r·min-1下离心5 min, 弃上清, 并转移至含有5 mL完全培养基的细胞培养瓶中.培养箱条件为:温度37 ℃, 饱和湿度, CO2体积分数为5%.用倒置显微镜观察, 待细胞的汇合率达到80%~90%时, 吸出细胞培养瓶中的旧培养基, 然后加入2 mL PBS漂洗, 加入1 mL 0.25%的胰酶对细胞进行消化, 细胞回缩成圆形时, 弃去胰酶, 加入2 mL完全培养基终止消化, 吹打细胞瓶壁, 使所有细胞完全悬浮, 按1:2的比例传代接种细胞.
2.2.2 ZnO NPs处理RTE细胞分别配制不同粒径(50和200 nm)、浓度为1 mg·mL-1的ZnO NPs悬液, 混匀后超声20 min, 振幅为80 mm·s-1, 间隔2 s, 高压灭菌30 min.每次细胞染毒前先将ZnO NPs悬液再次置于超声波20 min, 然后用细胞培养液DMEM配制成浓度分别为1、10 mg·L-1的ZnO NPs悬液.
2.2.3 细胞动态变化检测利用ECIS Zθ细胞电阻抗动态分析仪进行细胞动态检测.取新的8W10E电极板, 用10 mmol·L-1半胱氨酸(每孔200 μL)室温孵育15 min, 之后用无菌水清洗2遍, 每孔加入200 μL包被蛋白液, 放入37 ℃培养箱中孵育30 min, 最后每孔用无菌水洗一遍, 再用400 μL完全培养基孵育过夜.在此期间, 连通ECIS Zθa仪器, 将孵育的电极板接入到载物台上, 检查电路, 调节电平衡.待平衡电阻和电容后, 启动仪器, 采用复合频率(MFT)模式, 获取20~30个基准线数据, 存储该数据以备模型分解使用.第2天选择汇合度较高(80%~90%)的细胞, 去掉培养基, 胰蛋白酶消化细胞, 然后加入4~6 mL的培养基重悬.利用Invitrogen COUNTESS自动细胞计数仪进行细胞浓度的计数, 稀释细胞浓度为5.0×105个·mL-1, 每孔铺板细胞悬液为400 μL.待细胞生长平稳、汇合度为70%~80%后, 每孔分别加入相应的ZnO NPs悬液, 以无血清培养基作为对照.持续监测约20 h, 导出数据进行分析.
2.2.4 细胞增殖抑制率检测取处于对数生长期的RTE细胞, 经0.25%胰蛋白酶消化后, 细胞计数稀释成4.0×104个·mL-1的细胞悬液, 接种于96孔板中, 每孔加入200 μL细胞悬液, 置于37 ℃培养箱.待细胞达到70%~80%汇合度后, 弃去上层培养液, 用PBS漂洗一次, 每孔分别加入200 μL纳米颗粒物工作液, 置于37 ℃、5% CO2的培养箱中遮光孵育, 12 h后取出.根据Cell Counting Kit 8试剂盒说明书指示操作, 使用酶标仪于450 nm波长处测其吸光度.最后根据公式R=(A对照-A加药)/(A对照-A空白)×100%, 计算细胞增殖抑制率R.
2.2.5 细胞内活性氧(ROS)含量测定将细胞悬液接种于细胞培养基的6孔板中, 并在暴露ZnO NPs 12 h之前孵育24 h(对照组用无血清的培养基培养).弃去上层培养液, 用PBS缓冲液漂洗2遍, 经胰蛋白酶消化, 再用PBS缓冲液将细胞重悬于1.5 mL的离心管中, 离心, 过40 μm的细胞网筛, 悬浮于预冷的PBS中, 随后加入DCFH-DA染料至终浓度为10 μmol·L-1, 然后室温下避光孵育20 min.用流式细胞仪测定ROS荧光强度.检测激发波长488 nm, 发射波长525 nm.
2.2.6 细胞内丙二醛(MDA)含量测定细胞内MDA含量用MDA试剂盒测定.将细胞以5.0×105个·孔-1的密度接种到6孔板中, 孵育24 h;再分别经浓度为1和10 mg·L-1的ZnO NPs悬液处理12 h;PBS漂洗3次, 经胰蛋白酶消化后用超声使其破碎, 然后按照MDA试剂盒说明书进行加样;最后用分光光度计于波长532 nm下测量吸光度, 根据公式C=(OD1/OD2)×S×B计算出RTE细胞内MDA含量, 其中, C为MDA含量, OD1和OD2分别样品对照、标准空白的OD值, B为稀释倍数, S为标准浓度, 取10 nmol·mL-1
3 结果(Results) 3.1 ZnO NPs诱导RTE细胞动态变化利用ECIS技术检测ZnO NPs诱导的RTE细胞动态变化, 结果如图 1所示.其中, 图 1a和1b分别表示50 nm和200 nm氧化锌颗粒物诱导的细胞电阻抗值变化.ZnO NPs暴露后, RTE细胞电阻抗值呈下降趋势, 说明细胞生长的抑制及细胞毒性的加剧.与对照组加入无血清培养基相比, 在分别加入ZnO NPs 1 h内, RTE细胞内的电阻抗均出现显著下调, 这是由于ZnO NPs的超强电化学性质使其在溶液中与电极板空隙结合, 减少了电极板电阻抗值, 这一现象在1 h后趋于平稳则说明纳米颗粒物沉淀并与RTE细胞相互作用稳定.自添加纳米颗粒物1 h起, RTE细胞电阻抗值下降实时地反映了细胞生长与屏障效应的变化.随着暴露浓度的升高, 其电阻值下降显著.在25.017 h, 50 nm暴露组的细胞电阻抗值分别为(3762±13)和(3599±21)Ω, 200 nm暴露组的细胞电阻抗值分别为(3224±12)和(3219±9)Ω.当暴露浓度为10 mg·L-1时, 其最大下调幅度约为20%, 50 nm暴露组最大下调幅度是200 nm暴露组的1.1倍;而当暴露浓度为1 mg·L-1时, 50 nm暴露组的最大下调幅度为18%, 是200 nm暴露组的1.2倍.
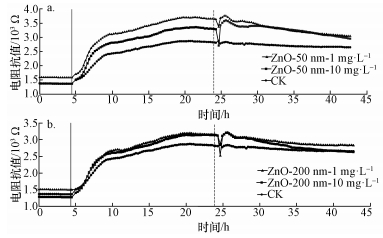 |
| 图 1 ZnO NPs诱导的RTE细胞电阻抗变化结果(a.50 nm氧化锌暴露组;b.200nm氧化锌暴露组;图中黑色实线表示投加RTE细胞悬液时间点, 黑色虚线为投加ZnO NPs悬液时间点;利用ECIS检测各组细胞电阻抗值) Fig. 1 Effects of ZnO NPs treatments on RTE cell electrical impedance changes.(a. 50 nm ZnO NPs exposure group; b. 200 nm ZnO NPs exposure group; Black line means the time point for adding RTE cells into the medium; Black dotted line means the time points for adding ZnO NPs into the medium; ECIS was used to analysis the electrical impedance of RTE cells) |
细胞电阻抗检测结果发现, ZnO NPs暴露下, RTE细胞生长和增殖受到明显抑制, 且具有浓度依赖效应;根据降幅比较发现, 50 nm氧化锌诱导的细胞动态变化较200 nm氧化锌暴露组更剧烈.
3.2 ZnO NPs抑制RTE细胞的增殖各组RTE细胞分别用粒径为50和200 nm、暴露浓度为1和10 mg·L-1的ZnO NPs处理12 h后, 利用CCK8试剂盒检测了纳米ZnO对RTE细胞增殖的抑制情况, 结果如图 2所示(计算时采用0 μg·L-1暴露浓度组为对照, 以培养基为空白).由图可知, 与空白组对比, 暴露于50和200 nm氧化锌颗粒物后, RTE细胞增殖抑制率随着暴露浓度的增加而增加(p < 0.01).尽管当暴露浓度为1 mg·L-1时, 200 nm氧化锌颗粒物诱导的细胞增殖抑制率为50 nm组的2.1倍, 但随着暴露浓度到达10 mg·L-1后, 50 nm暴露组的细胞增殖抑制率与200 nm暴露组无显著差异.当暴露浓度为10 mg·L-1时, 50 nm和200 nm暴露组细胞增殖抑制率分别为暴露浓度为1 mg·L-1时的2.9和1.4倍, 与1 mg·L-1暴露组相比具有显著差异(p < 0.01).
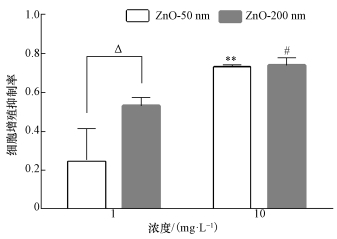 |
| 图 2 ZnO NPs对RTE细胞增殖抑制率的影响(**表示50 nm处理组与对照组比较有显著差异, p < 0.01;#表示200 nm处理组与对照组比较有显著差异, p < 0.01, Δ表示同一暴露浓度下, 50 nm处理组与200 nm处理组比较有显著差异, p < 0.01) Fig. 2 Effects of ZnO NPs treatments on RTE cell proliferation inhibition percentages changes (** means that there is significant difference between 50 nm ZnO NPs treament group and the control group, p < 0.01; ## means that there is significant difference between 200 nm ZnO NPs treament group and the control group, p < 0.01;Δ means that there is significant difference between 50 nm ZnO NPs treament group and 200 nm ZnO NPs treatment group, p < 0.01) |
CCK8实验结果显示, RTE细胞增殖抑制率随着暴露浓度的增加而增加, 具有浓度-依赖效应.在低暴露浓度(1 mg·L-1)下, 200 nm暴露组诱导的细胞增殖抑制率高于50 nm暴露组, 随着暴露浓度的增加, 50 nm暴露组诱导的细胞增殖抑制率与200 nm暴露组无显著差异.
3.3 ZnO NPs诱导RTE细胞内ROS含量变化ZnO NPs诱导的细胞内ROS水平变化利用流式细胞仪检测, 结果如图 3所示.随着ZnO NPs暴露浓度的升高, 细胞内ROS含量也逐渐升高. 50 nm暴露组诱导的RTE细胞内ROS水平显著上升(p < 0.01), 当浓度为1和10 mg·L-1时分别是对照组的2.8和3.7倍.当暴露浓度达到10 mg·L-1时, 200 nm暴露组诱导的细胞内ROS水平增加显著(p < 0.01), 是对照组的1.3倍.随着ZnO NPs粒径的减小, RTE细胞内ROS水平增加, 同一浓度下, 粒径越小的暴露组细胞内ROS含量越高, 当暴露浓度为1 mg·L-1时, 50 nm暴露组细胞内ROS含量是200 nm暴露组的1.7倍.当暴露浓度为10 mg·L-1时, 50 nm暴露组细胞内ROS含量是200 nm暴露组的1.7倍. ROS检测结果表明, ZnO NPs诱导的RTE细胞内ROS含量的升高具有剂量和粒径依赖性, 即粒径越小、浓度越高的暴露组RTE细胞内ROS含量越高.
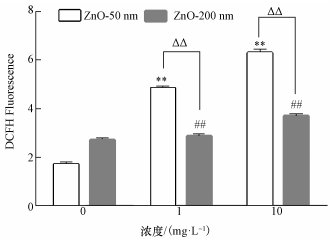 |
| 图 3 ZnO NPs诱导RTE细胞内ROS含量的变化结果(DCFH Fluorescence表征ROS含量, 采用0 μg·L-1暴露浓度组为对照; **表示50 nm处理组与对照组比较有显著差异, p < 0.01;##表示200 nm处理组与对照组比较有显著差异, p < 0.01; ΔΔ表示同一暴露浓度下, 50 nm处理组与200 nm处理组比较有显著差异, p < 0.01) Fig. 3 ZROS content changes in the RTE cells induced by ZnO NPs (DCFH Fluorescence was used to represent the concents of ROS; 0 μg·L-1exposure group was used as the control group; ** means that there is significant difference between 50 nm ZnO NPs treament group and the control group, p < 0.01; ## means that there is significant difference between 200 nm ZnO NPs treament group and the control group, p < 0.01;ΔΔ means that there is significant difference between 50 nm ZnO NPs treament group and 200 nm ZnO NPs treatment group, p < 0.01) |
由图 4可知, ZnO NPs诱导的RTE细胞内MDA含量显著上升(p < 0.01), 具有剂量-和粒径-依赖效应, 暴露浓度越高, 粒径越小, 细胞内MDA含量越高.50 nm粒径暴露下, 暴露浓度为1和10 mg·L-1时, 细胞内MDA含量分别是对照组的5.37和7.90倍. 200 nm粒径暴露下, 暴露浓度为1和10 mg·L-1时, 细胞内MDA含量分别是对照组的2.73和11.51倍.而在同一浓度下, 粒径较小的ZnO NPs暴露组细胞内MDA含量相对较高.MDA检测结果表明, 同种粒径下, 纳米ZnO暴露浓度越高RTE细胞内MDA含量越高, 而同一浓度下, 粒径越小的纳米ZnO暴露组RTE细胞内MDA含量越高.
 |
| 图 4 ZnO NPs诱导RTE细胞内MDA含量的变化结果(采用0 μg·L-1暴露浓度组为对照; **表示50 nm处理组与对照组比较有显著差异, p < 0.01;##表示200 nm处理组与对照组比较有显著差异, p < 0.01; ΔΔ表示同一暴露浓度下, 50 nm处理组与200 nm处理组比较有显著差异, p < 0.01) Fig. 4 MDA content changes in the RTE cells induced by ZnO NPs (0 μg·L-1exposure group was used as the control group; **means that there is significant difference between 50 nm ZnO NPs treament group and the control group, p < 0.01; ## means that there is significant difference between 200 nm ZnO NPs treament group and the control group, p < 0.01;ΔΔ means that there is significant difference between 50 nm ZnO NPs treament group and 200 nm ZnO NPs treatment group, p < 0.01) |
纳米材料具有极高的工业生产价值, 但其广泛应用也增加了环境蓄积量与生物体接触的机会, 进而增加了生物体的潜在健康风险.关于ZnO NPs的生物毒性效应目前已有广泛研究, 但针对呼吸道毒性效应, 尤其是呼吸道上皮细胞的研究尚不多见.因此, 本研究利用大鼠气管上皮细胞作为研究对象, 探究ZnO NPs对呼吸道细胞的毒性及作用机制.
呼吸道上皮细胞是抵挡有害物质侵袭的有效组织之一, 其功能损伤会直接或间接地导致细胞、组织和器官的毒性.本研究利用细胞电阻抗检测技术检测ZnO NPs诱导的RTE细胞动态变化, 结果发现, ZnO NPs暴露下, RTE细胞生长和增殖受到明显抑制, 且具有浓度-依赖效应;根据降幅比较发现, 50 nm氧化锌诱导的细胞动态变化较200 nm氧化锌暴露组更剧烈. Kling等(2014)利用ECIS技术检测内皮细胞形态变化发现, 添加凝血酶导致两种内皮细胞的阻抗值在短时间内呈现剂量依赖性的降低, 通过显微镜观察发现细胞发生收缩, 细胞间隙增大, 细胞屏障损伤, 结合MTT实验研究发现其与细胞毒性相关.Xie等(2012)在研究中利用细胞电阻抗体外评价了顺铂等4种细胞毒抗肿瘤药物对人肾细胞的毒性, 发现细胞电阻抗随着药物浓度的增加而下降, 与体外细胞活性实验结果一致.同时, 他指出ECIS有能力成为一种有效的、非侵入性的分析方法, 有利于更便捷地对体外对药物和环境毒素的细胞毒性进行直接、连续的早期评估.
本研究利用CCK8试剂盒检测了暴露于不同浓度、不同粒径ZnO NPs后RTE细胞的增殖抑制率, 结果发现, ZnO NPs诱导的RTE细胞增殖抑制率具有浓度-依赖效应.当暴露浓度为1 mg·L-1时, 50 nm暴露组的细胞增殖抑制率低于200 nm暴露组;当暴露浓度达到10 mg·L-1时, 50 nm氧化锌暴露下RTE细胞增殖抑制率显著升高.导致其差异性的主要原因是细胞粒径差异, 在低浓度时, 50 nm颗粒物因暴露浓度较低, 进入细胞的量较少, 因此, 对RTE细胞增殖抑制率的影响较小;50 nm颗粒物具有比200 nm颗粒物更高的内化效率, 进而导致其诱导的细胞增殖抑制率显著增加, 而当暴露浓度达到10 mg·L-1时, 50 nm处理组诱导的RTE细胞增值抑制率极显著增加.众多研究发现了相似的结论, Osaki等(2004)发现细胞内吞50 nm颗粒的效率最高.随后在金纳米颗粒(Chithrani et al., 2006)的实验中同样发现50 nm的球形颗粒具有最高的细胞内化效率.有关二氧化硅纳米颗粒的实验结果也显示, 50 nm的颗粒物具有最高的内化效率(Lu et al., 2009).研究人员在细胞摄取其他纳米颗粒的实验中发现了尺寸效应的存在(He et al., 2010; Huang et al., 2010).通过分析不同粒径ZnO NPs颗粒物诱导的细胞增殖抑制率变化可知, 氧化锌的内化效率是影响增殖率的主要因素. Deng等(2009)研究发现, ZnO NPs诱导的神经干细胞生长毒性具有显著的剂量-依赖效应, 随着暴露浓度的增加, 其毒性增强.王琳等(2009)研究发现, 粒径为(45±27) nm的氧化锌颗粒暴露于A549细胞, 浓度为1 μmol·mL-1、暴露时间为24 h时, 其生长抑制率约为25%. Sayes等(2007)利用L2大鼠肺上皮细胞暴露于粒径为90~283 nm的氧化锌颗粒发现, 当浓度分别为5.2和52 μg·mL-1, 培养4和24 h后, 细胞活性明显被抑制.对暴露于ZnO NPs的大鼠脑组织氧化应激水平的研究显示, PC2细胞经ZnO NPs暴露12 h后, 12~16 μg·mL-1暴露组细胞毒性显著升高, 且呈现剂量-依赖效应.课题组在前期研究中发现, 30和90 nm氧化锌诱导的RTE细胞增殖抑制率增加具有浓度和粒径-依赖效应, 随着浓度的增加, 粒径的减小, 其生长抑制率增加(陆香君等, 2018), 本研究结果与之基本相符.同时研究发现, ZnO NPs诱导细胞增殖毒性与其氧化损伤水平相关.随着细胞内ROS水平和MDA含量的增加, 其细胞增殖变化增加.
氧化应激是纳米材料主要的致毒机制之一(Ayres et al., 2008).氧化应激产生的原因是体内活性氧(ROS)的产生与抗氧化作用失衡, 氧化应激导致蛋白酶分泌水平增加, 从而在细胞内蓄积大量氧化中间产物, 如丙二醛(MDA).在研究中发现, 过量的ROS会使细胞内外发生一系列的变化, 通过影响细胞膜、线粒体等细胞器及DNA对细胞造成损害, 从而危害整个生物体(何湘伟等, 2015).本研究通过检测RTE细胞内ROS和MDA含量的变化, 发现ZnO NPs诱导的RTE内ROS水平和MDA含量变化具有显著的剂量和粒径依赖效应, 随着暴露浓度的增加, 粒径的减小, 其细胞内氧化应激水平越强.人肺上皮细胞(A549)暴露于70 nm和420 nm的ZnO NPs后, 细胞内ROS含量升高, 导致细胞内氧化应激反应, 而70 nm的氧化锌颗粒物通过诱导过量ROS进而诱导更强的细胞毒性(Lin et al., 2009). MDA是细胞脂质过氧化的重要指标之一, 研究表明, 暴露于ZnO NPs后, 大鼠脑组织细胞内MDA含量随暴露浓度的增加而升高, 其细胞内氧化应激具有明显的剂量依赖性(刘焕亮等, 2015).可见, ZnO NPs的粒径大小与暴露剂量是决定其诱导的RTE细胞氧化损伤的主要因素.
5 结论(Conclusions)纳米氧化锌是工业应用最广泛的纳米材料之一, 其对呼吸道细胞的影响越来越受到重视.本研究发现, ZnO NPs通过影响细胞动态变化, 破环RTE细胞的屏障并进入细胞, 诱导细胞内ROS和MDA水平升高, 进而抑制细胞的生长与增殖.在高暴露浓度(10 mg·L-1)条件下, 与200 nm氧化锌颗粒物相比, 50 nm氧化锌颗粒物具有更强的细胞内化率, 结合细胞增殖抑制率实验分析发现, ZnO NPs诱导的细胞增殖抑制率与氧化锌颗粒物粒径相关.同时, 本研究发现粒径与浓度是影响ZnO NPs诱导的RTE细胞动态变化和氧化应激的关键因素.但关于ZnO NPs诱导的RTE细胞氧化损伤介导的细胞动态变化的分子机理仍需要进一步研究.
Ayres J G, Borm P, Cassee F R, et al. 2008. Evaluating the toxicity of airborne particulate matter and nanoparticles by measuring oxidative stress potential-a workshop report and consensus statement[J]. Inhalation Toxicology, 20(1): 75–99.
DOI:10.1080/08958370701665517
|
Chithrani B D, Ghazani A A, Chan W C. 2006. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells[J]. Nano Letters, 6(4): 662–668.
DOI:10.1021/nl052396o
|
Deng X, Luan Q, Chen W, et al. 2009. Nanosized zinc oxide particles induce neural stem cell apoptosis[J]. Nanotechnology, 20(11): 115101.
DOI:10.1088/0957-4484/20/11/115101
|
Drinker P, Thomson R M, Finn J L. 1927. Metal fume fever:Ⅱ.Resistance acquired by inhalation of zinc oxide on two successive days[J]. Journal of Industrial Hygiene, 9: 98–105.
|
冯玲芳, 张幸. 2013. 金属纳米材料的毒性研究进展[J]. 浙江预防医学, 2013, 25(9): 32–35.
DOI:10.3969/j.issn.1007-0931.2013.09.010 |
Giaever I, Keese C R. Electrical wounding assay for cells in vitro[P]. U. S. Patent 7, 332, 313. 2008-02-19
|
Gojova A, Guo B, Kota R S, et al. 2007. Induction of inflammation in vascular endothelial cells by metal oxide nanoparticles:Effect of particle composition[J]. Environmental Health Perspectives, 115(3): 403–409.
DOI:10.1289/ehp.8497
|
何湘伟, 隋阳, 张雪莹, 等. 2015. 纳米材料毒性机制及其影响因素[J]. 西南民族大学学报(自然科学版), 2015, 41(3): 316–325.
|
He C, Hu Y, Yin L, et al. 2010. Effects of particle size and surface charge on cellular uptake and biodistribution of polymeric nanoparticles[J]. Biomaterials, 31(13): 3657–3666.
DOI:10.1016/j.biomaterials.2010.01.065
|
Huang J, Bu L, Xie J, et al. 2010. Effects of nanoparticle size on cellular uptake and liver MRI with PVP-coated iron oxide nanoparticles[J]. Acs Nano, 4(12): 7151–7160.
DOI:10.1021/nn101643u
|
Jeng H A, Swanson J. 2006. Toxicity of metal oxide nanoparticles in mammalian cells[J]. Journal of Environmental Science & Health Part A Toxic/hazardous Substances & Environmental Engineering, 41(12): 2699–2711.
|
Johnsen G K, Lütken C A, Martinsen O G, et al. 2011. Memristive model of electro-osmosis in skin[J]. Physical Review E Statistical Nonlinear & Soft Matter Physics, 83(1): 031916.
|
Kling B, Bücherl D, Palatzky P, et al. 2014. Flavonoids, flavonoid metabolites, and phenolic acids inhibit oxidative stress in the neuronal cell line HT-22 monitored by ECIS and MTT assay:a comparative study[J]. Journal of Natural Products, 77(3): 446–454.
DOI:10.1021/np400518k
|
Lin W, Xu Y, Huang C C, et al. 2009. Toxicity of nano-and micro-sized ZnO particles in human lung epithelial cells[J]. Journal of Nanoparticle Research, 11(1): 25–39.
DOI:10.1007/s11051-008-9419-7
|
刘春光, 罗青松. 2005. 纳米氧化锌的制备技术与应用进展[J]. 纳米科技, 2005(1): 13–16.
|
刘焕亮, 林本成, 刘晓华, 等. 2015. 3种典型纳米材料致大鼠中枢神经系统和多巴胺能神经元的毒性效应[C]. 中国毒理学会第七次全国毒理学大会暨第八届湖北科技论坛. 武汉
|
Lu F, Wu S H, Hung Y, et al. 2009. Size effect on cell uptake in well-suspended, uniform mesoporous silica nanoparticles[J]. Small, 5(12): 1408–1413.
DOI:10.1002/smll.v5:12
|
陆香君, 唐娟, 蔡恩祺, 等. 2018. 纳米氧化锌颗粒物通过氧化应激和离子通道失调诱导大鼠气管上皮细胞凋亡的机理[J]. 环境科学学报, 2018, 38(6): 2534–2544.
|
Male K B, Lachance B, Hrapovic S, et al. 2008. Assessment of cytotoxicity of quantum dots and gold nanoparticles using cell-based impedance spectroscopy[J]. Analytical Chemistry, 80(14): 5487–5493.
DOI:10.1021/ac8004555
|
Martin C J, Le X C, Guidotti T L, et al. 1999. Zinc exposure in Chinese foundry workers[J]. American Journal of Industrial Medicine, 35(6): 574–580.
DOI:10.1002/(ISSN)1097-0274
|
Opp D. 2009. ECIS assessment of Cytotoxicity and Trans-Endothelial Migration of Metastatic Cancer Cells[D]. Florida: University of South Florida
|
Opp D, Wafula B, Lim J, et al. 2009. Use of electric cell-substrate impedance sensing to assess in vitro cytotoxicity[J]. Biosensors and Bioelectronics, 24(8): 2625–2629.
DOI:10.1016/j.bios.2009.01.015
|
Osaki F, Kanamori T, Sando S, et al. 2004. A quantum dot conjugated sugar ball and its cellular uptake On the size effects of endocytosis in the subviral region[J]. Journal of the American Chemical Society, 126(21): 6520–6521.
DOI:10.1021/ja048792a
|
Sayes C M, Reed K L, Warheit D B. 2007. Assessing toxicity of fine and nanoparticles:Comparing in vitro measurements to in vivo pulmonary toxicity profiles[J]. Toxicological Sciences, 97(1): 163–180.
DOI:10.1093/toxsci/kfm018
|
Sergent J A, Paget V, Chevillard S. 2012. Toxicity and genotoxicity of nano-SiO2 on human epithelial intestinal HT-29 cell line[J]. Annals of occupational hygiene, 56(5): 622–630.
|
Tarantola M, Pietuch A, Schneider D, et al. 2011. Toxicity of gold-nanoparticles:Synergistic effects of shape and surface functionalization on micromotility of epithelial cells[J]. Nanotoxicology, 5(2): 254–268.
DOI:10.3109/17435390.2010.528847
|
Tarantola M, Schneider D, Sunnick E, et al. 2009. Cytotoxicity of metal and semiconductor nanoparticles indicated by cellular micromotility[J]. Acs Nano, 3(1): 213–222.
DOI:10.1021/nn800721j
|
王琳, 王莉娟, 张芳, 等. 2009. 纳米氧化锌对人肺腺癌细胞A549的毒性[J]. 中国科学院大学学报, 2009, 26(1): 83–90.
|
Xiao C, Luong J H. 2003. On-line monitoring of cell growth and cytotoxicity using electric cell-substrate impedance sensing(ECIS)[J]. Biotechnology Progress, 19(3): 1000–1005.
DOI:10.1021/bp025733x
|
Xie F, Xu Y, Wang L, et al. 2012. Use of cellular electrical impedance sensing to assess in vitro cytotoxicity of anticancer drugs in a human kidney cell nephrotoxicity model[J]. Analyst, 137(6): 1343–1350.
DOI:10.1039/c2an16141a
|
徐莺莺, 林晓影, 陈春英. 2013. 影响纳米材料毒性的关键因素[J]. 科学通报, 2013, 58(24): 2466–2478.
|
张淑慧. 2015. 纳米氧化锌对小鼠的毒性研究[D]. 洛阳: 河南科技大学
|
 2018, Vol. 38
2018, Vol. 38


