2. 清华大学环境学院, 北京 100084;
3. 中国科学院生态环境研究中心, 饮用水科学与技术重点实验室, 北京 100085
2. School of Environment, Tsinghua University, Beijing 100084;
3. China Key Laboratory of Drinking Water Science and Technology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
目前, 国内外对溴酸盐去除方法主要有物理吸附法(包括活性炭吸附(Yan et al., 2015; Xu et al., 2015; Zhang et al., 2015; Wu et al., 2013)、水滑石吸附(Zhang et al., 2014; 李鑫龙等, 2015)、蒙脱石吸附(Chitrakar et al., 2011))、化学还原法(零价铁还原法(Yang et al., 2013; 徐咏咏等, 2013)、亚铁离子还原法(Chitrakar et al., 2011; 唐敏康等, 2015))、生物降解法(Luo et al., 2015)等.催化还原溴酸盐是非常具有前景的去除途径之一.Chen等(2010)将Pd、Pt分别负载到Al2O3载体上催化加氢还原溴酸盐, 反应2 h后对溴酸盐的去除率分别达100%和80.2%.1996年, Mills等(1996)以Pt负载的TiO2为催化剂, 首次利用紫外光光催化还原溴酸盐, 发现负载的Pt能够捕获光照产生的具有还原性的光生电子(e-), 并将光生电子传递至TiO2颗粒表面从而将溴酸根还原为溴离子.Noguchi等(2002)进一步发现将Al负载在TiO2上与降低pH均可提高光催化剂TiO2的等电点, 增强了TiO2对溴酸盐的吸附, 从而促进溴酸盐的还原.Huang等(2014)发现二氧化钛和石墨烯复合材料能光催化还原溴酸盐, 光照1 h能降解99%溴酸盐且溴酸盐降解主要是由于紫外线的照射;该复合材料对去离子水中溴酸盐的降解效率高于其在自来水中溴酸盐的降解效率.
实验利用石墨相氮化碳作为可见光催化剂, 从甲醇氧化产生自由基的角度探究g-C3N4催化还原溴酸根的机理.
2 材料与方法(Materials and methods) 2.1 实验材料实验试剂:三聚氰胺[C3N3 (NH2)3, 99%]购于百灵威科技有限公司, 溴酸钠、硝酸、氢氧化钠、硫酸、硫酸钠、甲醇、无水乙醇均为分析纯, 购于国药集团化学试剂有限公司(北京);5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)[C6H11NO, 分析纯]购于Sigma-Aldrich公司.本实验用水均为Milli-Q water.
2.2 g-C3N4的制备采用热缩聚法制备石墨相氮化碳(g-C3N4):称取一定质量的三聚氰胺置于坩埚中并用铝箔纸封住放入马弗炉(SX2-2.5-12GT, 济南精密仪器仪表)中, 以2 ℃·min-1的升温速率从80 ℃升至550 ℃, 煅烧4 h, 待其自然冷却至室温后取出, 研磨, 过筛之后得到黄色粉末即为石墨相氮化碳.
2.3 样品的表征采用德国Bruker D8型X射线粉末衍射仪(XRD)对制备的g-C3N4进行物相分析;采用日本Hitachi H-800型透射电子显微镜(TEM)观察g-C3N4的微观形貌;采用美国Varian Gary 5000型紫外-可见-近红外分光光度计测定g-C3N4的紫外可见漫反射光谱(UV-vis DRS).
2.4 实验方法 2.4.1 吸附实验取50 mg g-C3N4样品超声30 min, 分散均匀后加入0.5 mg·L-1 NaBrO3溶液, 用HNO3调节不同pH, 避光吸附3 h.定时取样, 用0.22 μm针头过滤器过滤掉样品中残留的g-C3N4, 用离子色谱仪检测BrO3-的浓度.
2.4.2 光催化实验方法称取50 mg g-C3N4(超声30 min)至光催化反应器中, 加入0.5 mg·L-1 NaBrO3溶液, 用HNO3调pH, 避光搅拌30 min, 使g-C3N4和NaBrO3达到吸附平衡.将反应器置于300 W氙灯(北京中教金源CEL-HXF 300型)下, 保持灯口与反应器底部距离为14 cm, 灯口平均光功率密度为1700 mW·cm-3, 模拟可见光进行光催化实验.反应器外部接蠕动泵进行冷凝水循环降温, 以保持反应体系温度在25 ℃左右.光照2 h, 定时取样(设9个平行样), 经0.45 μm的滤膜过滤, 用离子色谱仪检测BrO3-的浓度(BrO3-的测定条件为:色谱柱:AS 19分析柱和AG 19保护柱;抑制器:ASRSULTRAII;淋洗液:KOH溶液, 浓度10.0 mmol·L-1, 流速1.0 mL·min-1;进样量:5 mL).
2.5 可见光催化剂还原机制研究 2.5.1 活性物种的检测利用电子自旋共振波谱仪(EPR)(A300, Bruker)对光催化过程中产生的活性物种进行原位检测, 并通过自由基捕获实验探究活性物种对光催化还原溴酸根的作用机制.
取5 mg·L-1 g-C3N4置于2 mL离心管, 加入1 mL 5 mg·L-1 NaBrO3溶液, 利用甲醇(MT)、乙醇(ET)对可能产生的羟基自由基(·OH)和空穴(·h+)等活性物种进行捕获, 原位检测不同时间段产生的活性物种.
2.5.2 电化学阻抗和光电流测试分析电化学性能测试在Interface 1000型电化学工作站上进行, 采用标准三电极体系, 以自制的氮化碳电极为工作电极, 0.5 mol·L-1 Na2SO4为电解液, 调pH=5, 原位光照进行电化学测试.
2.5.3 时间分辨荧光光谱分析时间分辨荧光衰减光谱分析利用时间分辨荧光光谱仪F900测得, 激发光源为纳秒脉冲激光器, 激发光波长为375 nm.
3 结果与讨论(Results and discussion) 3.1 g-C3N4的表征通过X射线粉末衍射仪表征所制备的g-C3N4的晶体结构, 如图 1a所示.可以看出, g-C3N4在27.54°和12.97°处出现两个特征衍射峰, 分别对应于(002)和(100)晶面, 说明产物具有类似石墨的层状结构(Yan et al., 2009).其中27.54°有最强峰, 归属于g-C3N4的(002)晶面, 是芳香环系统层间的堆垛峰, 由布拉格方程(2dsinθ=nλ, 其中, d为晶面间距, θ为入射线、反射线与反射晶面之间的夹角, λ为波长, n为反射级数)计算出层与层之间的距离大约为0.32 nm.12.97°处的弱峰, 归属于g-C3N4的(100)晶面, 对应的是氮化碳层内三嗪环周期性的排列(Li et al., 2016), 氮孔间距约为0.68 nm.通过透射电子显微镜观察g-C3N4的微观形貌, 如图 1a插图所示, 可以看出, g-C3N4表面光滑平整, 呈现无定型的层状堆叠结构, 与文献相符(Lan et al., 2017).
 |
| 图 1 g-C3N4材料表征(a.g-C3N4的XRD谱图, 插图为TEM, b.g-C3N4的UV/Vis-DRs) Fig. 1 Characterization of g-C3N4 materials |
半导体光催化剂的光学性质非常重要, 可评估催化剂的光学吸收能力.图 1b是g-C3N4的紫外可见漫反射光谱图, 由图可知它的最大吸收边约在440 nm, 与淡黄色对应.由(Ahv)对hv作图, 如图 1b, 由图可得g-C3N4的光学带隙为2.80 eV.根据公式Bandgap(eV)=1240/λ(λ为样品吸收带边的波长)可计算出禁带宽度约为2.80 eV, 与理论值相近(陈秀芳等, 2011; Yan et al., 2012).由光学带隙图谱结果可知, g-C3N4光学带隙较窄, 对可见光有良好的吸收和转化性能.
3.2 吸附性能测试光催化还原反应主要发生在催化剂的表面, 因此BrO3-催化还原效果与吸附作用有关.在进行光催化反应实验之前先探究了g-C3N4在不同pH条件下对BrO3-吸附量的大小, 如图 2所示为不同pH时溴酸根的浓度变化.由图可知, 大约吸附30 min后溴酸根的浓度基本不变, 即达到吸附平衡.为了突出光催化作用对溴酸根的去除效果, 减少吸附作用的影响, 本实验设定避光吸附30 min, pH=5为光催化反应初始条件.
 |
| 图 2 不同pH对g-C3N4吸附性能的影响 Fig. 2 Adsorption performance of g-C3N4 under different pH |
经避光吸附30 min后进行g-C3N4光催化还原实验, 溴酸根浓度变化如图 3所示.由图 3可以看出随着光照时间的延长溴酸根浓度基本不变, 表明光照g-C3N4产生的光生载流子不能直接还原溴酸盐.
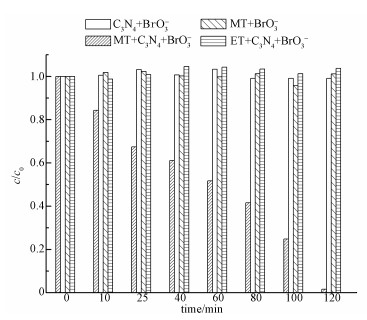 |
| 图 3 不同牺牲剂对光催化降解效果的影响 Fig. 3 Photocatalytic degradation rate of BrO3- under different sacrificial agents |
为了实现光催化还原溴酸根, 试向反应体系中加入自由基牺牲剂:甲醇(MT)、乙醇(ET).由图 3可以看出, 向g-C3N4的光催化反应体系加入甲醇, 初始30 min反应较快, 2 h后溴酸根的去除率达99%.而加入乙醇后溴酸根浓度基本不变.为了排除单一的甲醇对溴酸根去除的影响, 进行对照实验.
对照实验:在无g-C3N4有甲醇存在的条件下进行光照反应, 其它条件不变, 定时取样, 测定溴酸根浓度变化.由图 3可知, 溴酸根浓度基本不变, 表明单一的甲醇不能还原溴酸根.
3.4 g-C3N4光催化机制研究 3.4.1 活性物种的检测为了探究甲醇体系中, g-C3N4光催化还原溴酸根产生的中间活性物种, 向g-C3N4中加入不同种类的捕获剂进行自由基捕获实验, 结果如图 4所示.由图 4可知, 在甲醇存在的反应体系中, 120 min左右观察到非常明显的六重峰, 其超精细耦合常数AN=17 G, AHβ=23 G, 这是DMPO-CH3O·加合物的特征峰(Ueno et al.1993; Migita et al., 1989), 而乙醇体系中产生多个杂峰, 但不是DMPO-CH3O·的特征峰.表明烷基自由基(CH3O·)在光催化还原溴酸根的过程中起着重要作用.向g-C3N4体系中加入甲醇和溴酸根, 进行自由基捕获实验, 测定时间为30 min, 如图 4所示, 由图可知, g-C3N4、甲醇和溴酸根三者同时存在的体系中仍然产生CH3O·自由基六重特征峰, 但其相比于120 min时的峰值明显减弱, 说明在光催化还原BrO3-的过程中, CH3O·被消耗, 一方面甲醇和g-C3N4作用产生CH3O·自由基, 并逐渐积累;另一方面CH3O·将溴酸根还原为Br-同时CH3O·进一步被矿化为碳氧化物(Liu et al., 2017; Wachs et al., 1978; 丁延伟等, 2002).EPR实验表明光生电子(e-)不能直接还原溴酸根, CH3O·才是主要的活性还原物种, 此结果与光催化效果实验一致, 并且在反应初始30 min时BrO3-的去除较快, 随后变慢.g-C3N4带隙较窄其空穴氧化能力较弱, 在光催化过程中空穴只能将甲醇分子转化为CH3O·自由基, 该自由基具有较高的还原活性, 可迅速将水相中的溴酸根还原至溴离子, 同时由于甲醇分子的存在提升了光生载流子的分离效率, 加剧了自由基的累积.
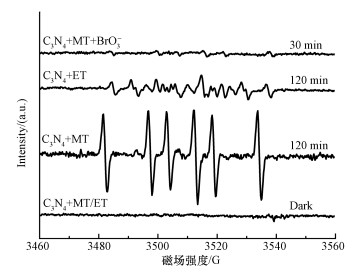 |
| 图 4 不同捕获剂的EPR信号 Fig. 4 EPR spectra under visible light in the presence of different scavengers |
光生电子和空穴的分离和传输效率是影响光催化活性的主要因素.光生电子通过电极传输到外电路, 产生光电流, 从而对光照产生瞬态响应.通过电化学阻抗和光电流测试来分析g-C3N4的光生电子和空穴分离和传输效率.图 5为甲醇存在时, g-C3N4的电化学阻抗EIS图谱.从图 5a中可以看出, 当加入溴酸根三者同时存在时, 阻抗环半径减小, 这表明加入溴酸根, g-C3N4电荷的传输阻力减弱了, 光生电子和空穴的分离效率增大.当工作电极受到可见光照射时, 会被激发产生电子-空穴对, 产生光电流.图 5b为甲醇存在时, g-C3N4的瞬态光电流密度曲线(i-t).由图可知, 加入溴酸根后, g-C3N4样品的光电流密度明显高于未加入溴酸根的样品, 说明g-C3N4、甲醇和溴酸根三者同时存在的体系中光生载流子分离效率显著提高, 与EIS图谱一致.
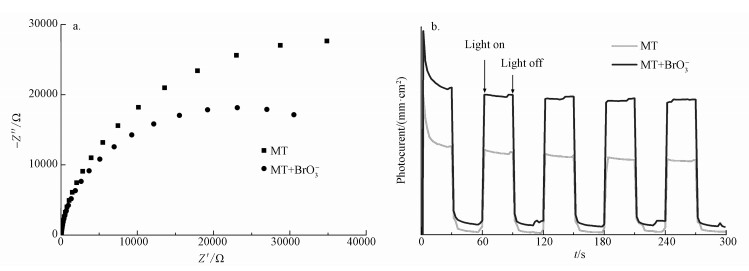 |
| 图 5 g-C3N4的EIS图谱(a) and i-t曲线(b) Fig. 5 EIS spectrum(a) and transient photocurrent curve (i-t) (b) of g-C3N4\ |
时间分辨荧光衰减光谱更能从本质上表征光生载流子光物理行为(王书岭, 2017).本实验采用时间分辨荧光衰减光谱仪F900测定g-C3N4的荧光寿命.荧光寿命指原子或分子在激发态平均停留的时间, 定义为衰减总速率的倒数(沈建超, 2015; 王维康, 2017).由此可见, 当载流子复合率较低时, 荧光寿命较长, 相反当载流子复合率较高时, 荧光寿命较短.在本实验中, 以纳秒脉冲激光器为激发光源, 激发光波长为375 nm.图 6为向g-C3N4分别入甲醇和溴酸根后的荧光衰减曲线(TR-PL).由图 6可知, 因催化剂材料相同均为氮化碳, 光生载流子分离效率差距不是很大, 但仍能看出向g-C3N4仅加入甲醇的体系中光生载流子衰减最慢, 分离效率最高, 说明甲醇促进了载流子的分离.结合EPR测试和电化学测试进一步证实, g-C3N4不能直接还原溴酸根, 即光生电子不能直接还原溴酸根(张燕等, 2015);g-C3N4、甲醇和溴酸根三者同时存在的体系中甲醇分子的存在产生CH3O·自由基, CH3O·迅速将溴酸根还原至溴离子, 从而促进了光生载流子分离.
 |
| 图 6 不同反应体系的TR-PL曲线 Fig. 6 TR-PL spectra of g-C3N4 with different reaction systems, excited at 375 nm |
通过以上分析, g-C3N4还原溴酸根的光催化机理过程如图 7所示.在可见光照射下, 具有可见光吸收能力的g-C3N4吸收能量后价带上的电子被激发到导带, 同时在价带上留下相同数量的空穴.因g-C3N4带隙较窄, 光照产生的空穴氧化能力较弱, 在光催化过程中空穴将甲醇分子氧化为CH3O·自由基.CH3O·自由基具有较高的还原活性, 可迅速将水相中的溴酸根还原至溴离子, 从而去除水中的溴酸盐.甲醇分子不断地被空穴氧化, CH3O·自由基逐渐累积, 光生载流子的分离效率得到提升.
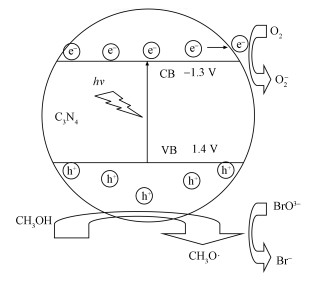 |
| 图 7 光催化还原机理示意图 Fig. 7 Schematic diagram of photocatalytic reduction mechanism |
1) 用三聚氰胺为前驱体成功制备出g-C3N4催化剂, 通过XRD、TEM、UV/Vis-DRS分析表明该材料对可见光具有较好的吸收能力.
2) 当pH=5时, g-C3N4避光吸附溴酸根能力较差, 约吸附30%;g-C3N4不能直接光催化还原溴酸盐, 当加入甲醇时, 光照2 h后溴酸根基本被去除;但加入乙醇光催化去除效果不明显.
3) 通过电子顺磁共振谱原位测定, 表明甲醇存在的体系中产生CH3O·自由基.光催化进程中g-C3N4因带隙较窄, 氧化能力较弱, 只能将甲醇氧化成中间体CH3O·自由基, 从而还原溴酸根;光催化产生的CH3O·是还原溴酸根的主要活性物种而非光生电子.
4) 光电化学测试和时间分辨荧光衰减光谱也表明溴酸根和甲醇的存在促进了光生电子和空穴的分离.
Chen H, Xu Z, Wan H, et al. 2010. Aqueous bromate reduction by catalytic hydrogenation over Pd/Al2O3 catalysts[J]. Applied Catalysis B Environmental, 96(3): 307–313.
|
陈秀芳. 2011. 石墨相氮化碳的制备、表征及其光催化性能研究[D]. 福州: 福州大学
|
Chitrakar R, Makita Y, Sonoda A, et al. 2011. Adsorption of trace levels of bromate from aqueous solution by organo-montmorillonite[J]. Applied Clay Science, 51(3): 375–379.
DOI:10.1016/j.clay.2010.11.033
|
Chitrakar R, Sonoda A, Makita Y, et al. 2011. Synthesis and bromate reduction of sulfate intercalated Fe(Ⅱ)-Al(Ⅲ) layered double hydroxides[J]. Separation & Purification Technology, 80(3): 652–657.
|
丁延伟, 吴缨, 范崇政. 2002. 甲醇在纳米TiO2作用下进行光催化氧化反应的机理研究[J]. 化学物理学报, 2002, 15(6): 465–470.
DOI:10.3969/j.issn.1674-0068.2002.06.012 |
Huang X, Wang L Y, Zhou J Z, et al. 2014. Photocatalytic decomposition of bromate ion by the UV/P25-Graphene processes[J]. Water Research, 57(57C): 1–7.
|
Lan H C, Li L L, An X Q, et al. 2017. Microstructure of carbon nitride affecting synergetic photocatalytic activity:Hydrogen bonds vs. structural defects[J]. Applied Catalysis B Environmental, 204: 49–57.
DOI:10.1016/j.apcatb.2016.11.022
|
Li S N, Dong G H, Hailili R, et al. 2016. Effective photocatalytic H2O2 production under visible light irradiation at g-C3N4 modulated by carbon vacancies[J]. Applied Catalysis B Environmental, 190(8): 26–35.
|
Liu F, Feng N, Wang Q, et al. 2017. Transfer Channel of Photoinduced Hole on TiO2 Surface as Revealed by Solid-state NMR and ESR Spectroscopy[J]. Journal of the American Chemical Society, 139(29): 10020–10028.
DOI:10.1021/jacs.7b04877
|
李鑫龙, 张燕, 刘宏远. 2015. 焙烧水滑石去除水中溴酸盐的试验研究[J]. 中国给水排水, 2015(15): 60–63.
|
Luo Y H, Chen R, Wen L L, et al. 2015. Complete perchlorate reduction using methane as the sole electron donor and carbon source[J]. Environmental Science & Technology, 49(4): 2341–2349.
|
Migita C T, Chaki S, Ogura K. 1989. ESR spectroscopic detection of methoxyl radicals formed in the photochemical gas-phase reaction of methane and water[J]. J Phys Chem, 93(17): 6368–6370.
DOI:10.1021/j100354a020
|
Mills A, Belghazi A, Rodman D. 1996. Bromate removal from drinking water by semiconductor photocatalysis[J]. Water Research, 30(9): 1973–1978.
DOI:10.1016/0043-1354(96)00012-7
|
Noguchi H, Nakajima A, Watanabe T, et al. 2002. Removal of bromate ion from water using TiO2 and alumina-loaded TiO2 photocatalysts[J]. Water Science & Technology, 46(11/12): 27–31.
|
沈建超. 2015. 二氧化钛/大尺寸多孔窄带隙半导体复合材料制备及其可见光催化性能研究[D]. 杭州: 浙江大学
|
唐敏康, 肖爱红, 许建红, 等. 2015. 活性炭负载亚铁离子去除水中溴酸盐研究[J]. 水处理技术, 2015(5): 58–62.
|
Ueno I, Hoshino M, Maitani T, et al. 1993. Luteoskyrin, an anthraquinoid hepatotoxin, and ascorbic acid generate hydroxyl radical in vitro in the presence of a trace amount of ferrous iron[J]. Free Radical Research Communications, 19(sup1): s95–s100.
DOI:10.3109/10715769309056s95
|
Wachs I E, Madix R J. 1978. The oxidation of methanol on a silver (110) catalyst[J]. Surface Science, 76(2): 531–558.
DOI:10.1016/0039-6028(78)90113-9
|
王书岭. 2017. Fe3O4/BiOI双功能磁-光催化剂的制备及性能研究[D]. 邯郸: 河北工程大学
|
王维康. 2017. 自修饰TiO2纳米材料的制备及其光催化性能研究[D]. 合肥: 中国科学技术大学
|
徐咏咏. 2013. 改性纳米零价铁去除水中溴酸盐的研究[D]. 杭州: 浙江大学
|
Wu X Q, Yang Q, Xu D C, et al. 2013. Simultaneous adsorption/reduction of bromate by nanoscale zerovalent iron supported on modified activated carbon[J]. Industrial & Engineering Chemistry Research, 52(35): 12574–12581.
|
Xu J H, Gao N Y, Zhao D Y, et al. 2015. Efficient reduction of bromate in water by nano-iron hydroxide impregnated granular activated carbon (Fe-GAC)[J]. Chemical Engineering Journal, 275: 189–197.
DOI:10.1016/j.cej.2015.03.110
|
Yan H J. 2012. Soft-templating synthesis of mesoporous graphitic carbon nitride with enhanced photocatalytic H2 evolution under visible light[J]. Chemical Communications (Cambridge, England), 48(28): 3430–3432.
DOI:10.1039/c2cc00001f
|
Yan H M, Du X J, Li P, et al. 2015. Adsorption of bromate from aqueous solutions by modified granular activated carbon:batch and column tests[J]. Ozone Science & Engineering, 37(4): 357–370.
|
Yan S C, Li Z S, Zou Z G. 2009. Photodegradation performance of g-C3N4 fabricated by directly heating melamine[J]. Langmuir the Acs Journal of Surfaces & Colloids, 25(17): 10397–10401.
|
Yang Q, Wu X Q, Zhong Y, et al. 2013. Removal of bromate using nanoscale zero-valent iron supported on activated carbon[J]. Journal of Hunan University Natural Sciences, 40(12): 97–102.
|
张燕, 李玲丹. 2015. 饮用水中溴酸盐的光催化去除机理及研究进展[J]. 环境科学与技术, 2015(s1): 186–189.
|
Zhang Y Q, Wu Q P, Zhang J M, et al. 2015. Removal of bromide and bromate from drinking water using granular activated carbon[J]. Journal of Water & Health, 13(1): 73–78.
|
Zhang Y, Li X. 2014. Preparation of Zn-Al CLDH to remove bromate from drinking water[J]. Journal of Environmental Engineering, 140(7): 4014018.
DOI:10.1061/(ASCE)EE.1943-7870.0000835
|
 2018, Vol. 38
2018, Vol. 38


