2. 复旦大学环境科学与工程系, 上海市大气颗粒物污染与防治重点实验室, 上海 200433
2. Shanghai Key Laboratory of Atmospheric Particle Pollution and Prevention, Department of Environmental Science and Engineering, Fudan University, Shanghai 200433
偶氮染料目前已被广泛应用于纺织、化妆品、纸浆和造纸等行业, 其生产废水具有量大、毒性强、致癌、致突变及难降解等特点(Wang et al., 2017).这些染料废水若不经处理直接排放, 将会对水生生物和人类健康造成巨大危害, 因此, 其降解技术也受到人们的广泛关注.基于羟基自由基(HO·)的传统高级氧化技术(AOPs)已经被广泛应用于染料废水的处理中, 并且取得了较好的降解效果(Rostamizadeh et al., 2018; Shen et al., 2017).与HO·(E0=1.9~2.7 V)相比, 硫酸根自由基(SO4·-)具有相似的氧化还原电位(E0=2.5~3.1 V) (Buxton et al., 1988; Neta et al., 1988)和更长的半衰期, 并且SO4·-的选择性更好.这意味着SO4·-与污染物的接触时间更长, 可能更有利于污染物的去除(Nie et al., 2014; 房聪等, 2018).
过一硫酸盐(Peroxymonosulfate, PMS)是常用的产生SO4·-的氧化剂, 而过渡金属离子可以活化PMS产生SO4·-.由于Fe2+具有低毒性、低成本、效果好等优点, 从而成为过渡金属中广泛使用的一种活化剂(Kurukutla et al., 2015).但过量的Fe2+能够淬灭SO4·-(Nie et al., 2015), 并且在pH > 4的情况下, Fe3+会生成氢氧化物沉淀, 因此, 随着pH值的增加其去除效率会显著降低(Nie et al., 2015).零价铁(Zerovalent iron, ZVI)被认为是Fe2+的一种有效来源, ZVI对PMS的活化反应不仅克服了Fe2+的缺陷, 同时避免了由于投加亚铁盐而导致其他阴离子的引入(如SO42-、Cl-、NO3-等);并且, ZVI能够循环Fe3+生成Fe2+, 从而减少Fe(OH)3沉淀的生成(Graça et al., 2017);此外, ZVI还能够通过电子转移诱导PMS分解产生SO4·-(Tan et al., 2018).因此, ZVI-PMS体系已经成功地运用到多种传统方法难以处理的有机化合物中(Tan et al., 2018; Zhou et al., 2018; Wang et al., 2017).
然而, 目前对ZVI-PMS体系的研究大多以纯水为基础(Tan et al., 2018; Zhou et al., 2018).在实际水体中, 除了目标污染物外, 还存在许多其他类型的共存物质, 如无机离子和溶解性有机质, 而这些物质可能会抑制或促进降解体系的效率.有研究表明, 水中的Cl-、CO32-、HCO3-、NO2-与SO4·-、HO·的反应速率较快(Li et al., 2015; Graça et al., 2017), 可能会影响ZVI-PMS体系的降解效率.此外, 还有一些物质, 如水中的磷酸盐会与铁离子(包括Fe2+和Fe3+)生成沉淀(Nie et al., 2015), 因此, 也有可能会影响到ZVI-PMS体系的降解效率.
基于此, 本研究以典型偶氮染料酸性橙7(AO7)为模型污染物, 将系统地探究Fe2+-PMS及ZVI-PMS体系中AO7的降解情况, 研究各因素(如活化剂剂量、PMS剂量、络合物、初始pH、多种无机离子、腐殖酸(HA))对AO7降解的影响, 并对比不同水体(超纯水、河水、湖水、污水处理厂出水)中AO7的去除效果.同时, 课题组前期工作表明, 水体中胶体物质所吸附的有机污染物的比例较高(Yan et al., 2015a; 2015b), 但目前仍然不清楚胶体是否会影响ZVI-PMS体系的降解效果.因此, 为了进一步研究水中胶体的影响, 将污水水样分离为过滤相、胶体相和真溶相, 并首次利用ZVI-PMS体系对不同相态污水中的AO7进行降解研究, 探讨ZVI-PMS体系在实际废水及含高浓度有机质废水应用中的可行性.此外, 还鉴定了ZVI-PMS体系中主要的氧化活性物种, 同时对AO7降解途径及其中间产物进行分析.以期为控制与消除水环境中的AO7污染提供数据支持.
2 材料与方法(Materials and methods) 2.1 实验材料AO7购于国药集团化学试剂有限公司;PMS购于Sigma-Aldrich;HA购于西亚试剂;二氯甲烷(HPLC级)购于CNW公司;其他试剂, 如ZVI、H2SO4、NaOH、FeSO4·7H2O等均至少为分析纯, 购于国药集团化学试剂有限公司;实验所有溶液都采用超纯水(电阻率18.2 MΩ·cm-1)配制.
2.2 实际水体的采集与处理实验涉及的实际水体包括赣江河水、鄱阳湖湖水、南昌市某污水处理厂出水.水样带回实验室后立即用玻璃纤维滤膜(1 μm)进行过滤得到过滤相(< 1 μm).采用切向超滤技术对过滤相中的胶体进行分离, 超滤膜孔径为1 kDa, 从而将污水处理厂出水分为胶体相(1 kDa~1 μm)和真溶相(< 1 kDa), 具体参照课题组前期工作中所述方法(聂明华等, 2018).
2.3 降解实验Fe2+和ZVI活化PMS降解水中AO7实验在500 mL锥形瓶中进行.加入一定浓度的AO7和PMS的混合溶液后, 在磁力搅拌器上持续搅拌(200 r·min-1), 投加相应浓度的活化物质(Fe2+或ZVI), 开始反应并计时, 在预定的时间点取样.样品迅速加入过量的亚硝酸钠, 以清除溶液中残余的活性自由基, 经过0.22 μm的滤膜过滤后, 采用紫外可见分光光度计进行分析测定AO7的残余浓度.除了考察pH值的影响时, 需要用稀H2SO4和NaOH溶液调至特定pH值, 其他体系的pH值均不做任何调节.
2.4 分析方法取样样品通过紫外可见分光光度计(UV-5500, 元析), 于AO7最大吸收波长484 nm处测得滤液的吸光度, 代入标准曲线中求得其浓度并计算其降解率.总有机碳(TOC)通过TOC测定仪(TOC-LCPH, 岛津)测定.
AO7的降解产物用二氯甲烷(DCM)液-液萃取后, 通过GC-MS(Trace1300-ISQ, 赛默飞世尔)检测.具体方法如下:取不同反应时刻反应液200 mL, 加入20 mL DCM, 剧烈振荡, 静置分层后吸取DCM萃取液, 蒸发浓缩至1 mL后, 使用GC-MS检测产物结构.GC-MS配置有30 m×0.25 mm×0.25 μm HP-5MS色谱柱, 以氦气为载气, 流速为1.0 mL·min-1.升温程序:初始温度为40 ℃, 保持2 min, 接着以15 ℃·min-1的升温速度升至100 ℃, 再以5 ℃·min-1的升温速度升至200 ℃, 保持2 min, 最后以20 ℃·min-1的升温速度升至280 ℃, 保持10 min.进样口温度为250 ℃, 荷质比扫描范围为m/z=50~600.通过对比NIST库推测产物结构.
3 结果与讨论(Results and discussion) 3.1 Fe2+-PMS体系降解AO7 3.1.1 Fe2+和PMS投加量的影响图 1a显示了AO7在不同反应体系中的降解效果.从图中可以看出, 单独Fe2+或PMS均不能有效地去除AO7, 反应60 min后, AO7的去除率低于4%.在Fe2+-PMS体系中, AO7在反应2 min之前的降解速率较快, 而2 min之后则几乎停滞.通过测定体系内Fe2+浓度随时间的变化, 发现加入到反应体系中的Fe2+会被迅速消耗而不能持续活化PMS(数据未显示).随着Fe2+浓度从0.05 mmol·L-1增加到1 mmol·L-1, AO7的去除率(2 min内)从13.84%增加到了56.25%(图 1b).这是因为Fe2+的浓度越大, 产生活性自由基就越多(Nie et al., 2015).随着PMS浓度从0.1 mmol·L-1增加到2 mmol·L-1, AO7的去除率从40.87%增加到了62.55%.而当PMS的投加量大于2 mmol·L-1时, 体系的降解效率随着PMS剂量的增加而显著降低(图 1c).有研究表明, 当PMS浓度过高时, 过量的PMS会消耗产生的SO4·-, 并且瞬间产生的大量的自由基会彼此湮灭(王莹等, 2017), 从而降低体系的效能.
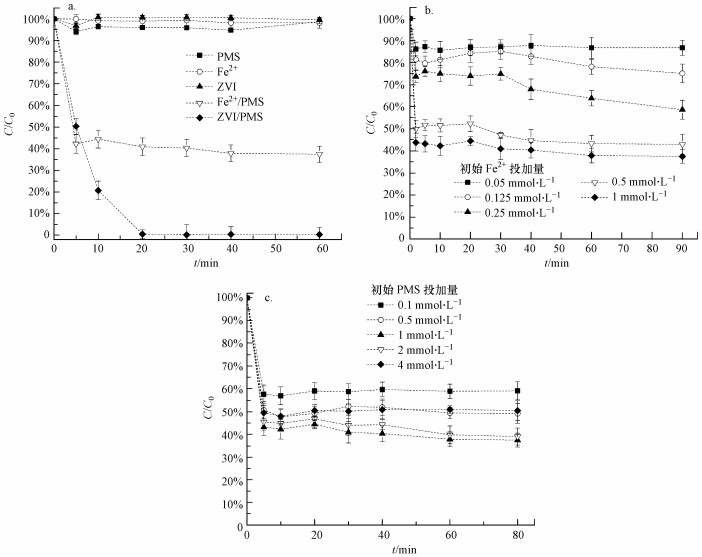 |
| 图 1 不同体系对AO7去除率的影响(a, [PMS]0=1 mmol·L-1, [Fe2+]0=1 mmol·L-1, [ZVI]0=0.5 mmol·L-1)及初始Fe2+(b, [PMS]0=1 mmol·L-1)和PMS(c, [Fe2+]0=1 mmol·L-1)投加量对AO7在Fe2+-PMS体系中的降解影响([AO7]0=0.05 mmol·L-1) Fig. 1 Effects of different conditions on removal efficiency of AO7(a), the effect of initial Fe2+ dosage(b) and initial PMS dosage(c) on AO7 degradation in Fe2+-PMS system |
Fe2+-PMS不能有效地去除水中AO7, 反应60 min后, 最高去除率只有62.55%.如上所述, Fe2+的快速消耗是导致体系效果不好的原因.为了解决这个问题, 酒石酸(TA)、柠檬酸(CA)、L-苹果酸(L-MA)和D-葡萄糖酸(D-GA)分别被引入到体系中, 以期形成稳定的Fe2+-络合物, 从而提高体系对AO7的氧化降解效率, 实验结果如图 2所示.可以看出, 引入络合物后, AO7的降解效率得到了一定的提升.其中, 引入TA和L-MA能够显著提高体系的降解效果, 使得AO7的去除率达到99.5%以上.Zhou等(2013)的研究发现, 络合物对敌草隆在Fe2+-过二硫酸盐系统中的降解起促进作用, 并且认为络合物与Fe2+结合后, 可以缓慢地释放Fe2+到溶液中去, 从而起到Fe2+库的作用.但当络合物的浓度过高时, 如CA和L-MA浓度超过0.5 mmol·L-1时, Fe2+与它们之间可能发生了强烈的络合作用, 使溶液中缺乏足够的Fe2+活化PMS(Liang et al., 2004).并且, CA和L-MA本身就是有机物, 相关研究表明, 有机络合剂与污染物间存在竞争活性自由基的现象(Rastogi et al., 2009; Nie et al., 2015), 从而导致高浓度的CA和L-MA抑制了Fe2+-PMS系统中AO7的降解速率.
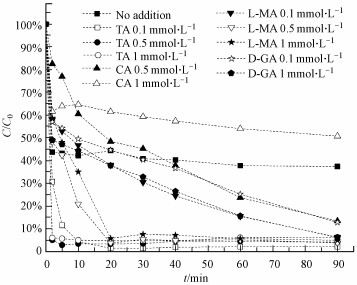 |
| 图 2 络合物对AO7在Fe2+-PMS体系中的降解影响([AO7]0=0.05 mmol·L-1, [PMS]0=1 mmol·L-1, [Fe2+]0 =1 mmol·L-1, [络合剂]0=0~1 mmol·L-1) Fig. 2 Effects of chelating agents on AO7 degradation in Fe2+-PMS system |
虽然Fe2+-PMS体系可以通过引入络合剂来提高AO7的降解效率, 但引入络合剂后必将增加体系的有机物含量, 并且成本也会相应提升.因此, 本研究采用ZVI代替Fe2+, 探讨ZVI-PMS体系中AO7的降解情况.如图 1a所示, 单独ZVI并不能有效去除水中AO7, 反应60 min后, AO7的去除率不足4%.ZVI的投加量对ZVI-PMS体系中AO7降解的影响如图 3a所示.当溶液中PMS的浓度不变时, ZVI投加量对AO7降解具有显著影响.随着ZVI的投加量从0.05 mmol·L-1增加至0.5 mmol·L-1, 反应30 min后, AO7的去除效率从19.48%提升至98.59%;但当ZVI投加量大于0.5 mmol·L-1时, AO7的去除率反而会降低, 如ZVI投加量分别为0.75和1 mmol·L-1时, AO7的去除率分别降至90.54%和89.88%.这可能是因为ZVI投加量较高时, 溶液中产生的Fe2+过多, 从而淬灭了溶液中的SO4·-, 进一步导致AO7的降解速率下降(Deng et al., 2014; Nie et al., 2015).
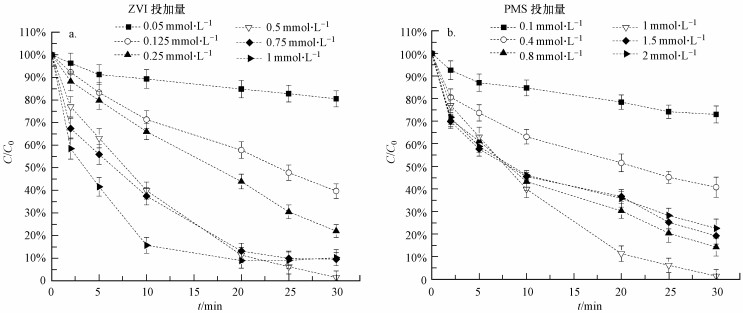 |
| 图 3 初始ZVI投加量(a, [PMS]0=1 mmol·L-1)和PMS投加量(b, [ZVI]0=0.5 mmol·L-1)对AO7在ZVI-PMS体系中的降解影响([AO7]0=0.05 mmol·L-1) Fig. 3 Effect of initial ZVI(a) and PMS (b) dosage on AO7 degradation in ZVI-PMS system |
PMS投加量对ZVI-PMS体系中AO7降解的影响如图 3b所示.随着PMS投加量的增加, AO7降解速率显著增加.当PMS投加量增加至1 mmol·L-1时, 反应30 min后, AO7的去除率达到最大(98.59%);但当PMS投加量大于1 mmol·L-1后, 由于SO4·-的大量消耗, 使得ZVI-PMS体系中AO7的去除率降低(Rao et al., 2014).因此, ZVI-PMS降解AO7的最佳条件下, ZVI及PMS的剂量分别为0.5 mmol·L-1和1 mmol·L-1.通过检测反应过程中溶液中Fe2+的浓度变化, 发现ZVI在PMS存在下被腐蚀, 并能够缓慢、持续不断地生成Fe2+(浓度保持在0.03~0.17 mmol·L-1之间), 从而保证了ZVI-PMS体系中AO7较高的降解速率.
3.2.2 pH值的影响溶液初始pH值对ZVI-PMS体系中AO7降解的影响如图 4所示.在较大的pH值范围内(pH=3~9), ZVI-PMS体系中AO7的去除效果均比较理想, 在60 min内, AO7的去除率均已超过99%.而在pH=11的溶液中, AO7的去除率也能达到59.3%.总体来说, 酸性和中性溶液中, 反应初期(0~20 min)AO7的降解速率较大.这是因为酸性条件有利于ZVI的分解, 并生成溶解态的Fe2+, 从而进一步激发产生AO7降解所需的SO4·-.而相比之下, 碱性条件下, 反应初期溶液中的Fe2+较少.但随着PMS的分解及羧酸产物的生成(Zou et al., 2014), 溶液的pH值会迅速降低.当初始pH为3~9时, 体系反应2 min后, 其pH迅速降至3.0~3.4, 并且在接下来的反应中稳定在3左右, 从而保证Fe2+可以从ZVI中不断地释放出来.比如, 反应30 min后, 初始pH=3~9的溶液中Fe2+浓度为0.04~0.12 mmol·L-1.但当溶液初始pH值为11时, 其pH值随着反应的进行缓慢降低, 最终只能降低到6.6, 反应30 min后溶液中Fe2+浓度仍低于0.01 mmol·L-1, 阻碍了PMS的活化, 从而降低了AO7的去除率.
 |
| 图 4 溶液初始pH值对AO7在ZVI-PMS体系中的降解影响([AO7]0=0.05 mmol·L-1, [PMS]0=1 mmol·L-1, [ZVI]0=0.5 mmol·L-1) Fig. 4 Effects of different initial pH of solution on the degradation of AO7 in ZVI-PMS system |
在活化PMS的体系中, 通常会产生SO4·-及HO·, 实验采用乙醇(EtOH)及叔丁醇(TBA)来鉴定对AO7降解起主导作用的活性自由基(SO4·-或HO·).EtOH对于SO4·-及HO·自由基来说, 均是有效的淬灭剂(kHO·=1.2×109~2.8×109 L·mol-1·s-1, kSO4·-=1.6×107~7.7×107 L·mol-1·s-1).TBA对HO·是一种有效的淬灭剂, 但与SO4·-只发生缓慢的反应(kHO·=3.8×108~7.6×108 L·mol-1·s-1, kSO4·-=4×105~9.1×105 L·mol-1·s-1)(Anipsitakis et al., 2004; Nie et al., 2015).图 5显示了淬灭剂的存在对ZVI-PMS体系中AO7降解的影响.实验结果表明, 投加EtOH的反应体系中, AO7的去除率较低, 并且随着EtOH剂量的增加, AO7的去除率不断降低, 说明体系中有SO4·-或HO·参与了AO7的氧化降解.而投加TBA的反应体系中, 60 min时, AO7依然可以降解95%以上, 表明体系中HO·对AO7的降解贡献不大, 而SO4·-在降解AO7时起主要作用.
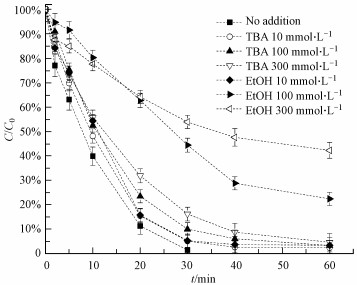 |
| 图 5 ZVI-PMS体系中自由基淬灭剂对AO7降解的影响([AO7]0=0.05 mmol·L-1, [PMS]0=1 mmol·L-1, [ZVI]0=0.5 mmol·L-1) Fig. 5 Effects of AO7 degradation on ZVI-PMS system in the presence of different radical scavengers |
考察了水中常见阴离子(Cl-、HCO3-/CO32-、H2PO4-、HPO42-、NO3-和NO2-)存在时AO7的降解情况, 其准一级反应速率(kobs)如图 6所示.可以看出, 体系中添加阴离子会显著影响AO7的降解速率, 并且不同阴离子的作用差异较大.
 |
| 图 6 共存阴离子对AO7在ZVI-PMS体系中降解的影响([AO7]0=0.05 mmol·L-1, [PMS]0=1 mmol·L-1, [ZVI]0=0.5 mmol·L-1, [阴离子]0=1~50 mmol·L-1) Fig. 6 Effects of coexisting anions on the degradation efficiency of AO7 in ZVI-PMS system |
Cl-会促进AO7的降解, 并且Cl-浓度越高, 降解速率越快(图 6).有研究表明, Cl-可以与PMS反应生成HOCl和Cl2(Yuan et al., 2011; Fang et al., 2016; Wang et al., 2017), 因此, 可以加速AO7的脱色.此外, Cl-还可以与SO4·-和HO·发生反应, SO4·-可以将Cl-转变成Cl·(k=3.2×108 L·mol-1·s-1).HO·先将Cl-转变成ClHO·-(k=4.3×109 L·mol-1·s-1), 随后ClHO·-可以迅速地通过去质子化转化为Cl·(k=4.3×1010 L·mol-1·s-1)(Buxton et al., 1988; Neta et al., 1988), 这些活性物种也可以参与AO7的降解.
HCO3-的存在抑制了AO7的降解, 并随HCO3-浓度的增加, AO7的降解速率减慢(图 6).加入HCO3-后, 溶液的pH值会改变(pH =7.1~8.5), 并且HCO3-的缓冲作用使反应期间溶液的pH值变化不大.从3.2.2节的讨论结果可知, AO7在碱性条件下的降解速率相较于其它pH值条件来说是偏低的, 因此, HCO3-可以通过升高体系pH值来抑制AO7的降解速率.此外, HCO3-和CO32-都可以与AO7竞争体系中的SO4·-(k分别为1.6×106和1.6×106 L·mol-1·s-1)和HO·(k分别为3.9×108和8.5×106 L·mol-1·s-1), 生成氧化能力较差的自由基, 如CO3·-和HCO3·(Buxton et al., 1988; Neta et al., 1988), 从而降低了体系的降解效率.
磷酸盐(即H2PO4-及HPO42-)的投加对AO7的降解起显著的抑制作用(图 6).铁离子(包括Fe2+及Fe3+)可通过化学沉淀将污水中的磷酸盐去除, 因此, 铁离子能够迅速与磷酸盐形成沉淀, 从而降低体系中Fe2+浓度(Zou et al., 2014; Ghauch et al., 2013).并且, 铁-磷酸盐复合物可以快速覆盖ZVI表面, 从而阻碍了ZVI与PMS的接触及其自身腐蚀, 这可能是导致AO7降解被抑制的另一主要原因(Nie et al., 2015; Ghauch et al., 2013).但值得注意的是, 随着HPO42-浓度的升高, 其抑制能力逐渐减弱, 这可能是因为高浓度的HPO42-可以直接活化PMS, 产生氧化性活性物种, 进而降解AO7(Lou et al., 2014).
NO2-对AO7的降解起显著抑制作用, 并且随NO2-浓度的增加, AO7的降解速率减慢(图 6), 这是因为NO2-对SO4·-及HO·具有较强的淬灭作用(Buxton et al., 1988; Neta et al., 1988).事实上, 很多基于SO4·-或HO·的AOPs, 都会使用NO2-作为反应终止剂(Ji et al., 2017).相较于NO2-, NO3-的影响力明显减弱.当NO3-投加量为1~10 mmol·L-1时, ZVI-PMS体系降解AO7的速率轻微变慢;而当NO3-投加量为50 mmol·L-1时, ZVI-PMS体系降解AO7的速率加快.这可能是因为低浓度(1~10 mmol·L-1)的NO3-会与AO7竞争SO4·-, 反应生成了氧化能力更弱的NO3·, 从而降低了该体系的氧化效能;但当NO3-浓度升高时(50 mmol·L-1), 虽然NO3-也会消耗一部分SO4·-, 但ZVI在高浓度NO3-的条件下更容易腐蚀, 生成更多的Fe2+(Zhang et al., 2017), 从而加速AO7的降解.
3.2.5 HA的影响HA是一种广泛存在于地表水和土壤中的天然有机质.由图 7可知, 当HA投入量分别为1、5、20 mg·L-1, 其对ZVI-PMS体系降解AO7几乎没有影响.虽然有研究表明, 加入的HA对氯霉素的降解起抑制作用, 并且随着HA浓度的增加, 抑制作用越明显(Nie et al., 2015).这主要归咎于HA能够与目标污染物竞争活性物种.然而本研究中, AO7降解效率并没有受到HA的影响.与HO·相比, SO4·-的选择性更好, 因此, 受到HA的影响较小, 这也验证了体系中的SO4·-是导致AO7降解的主要活性粒子.
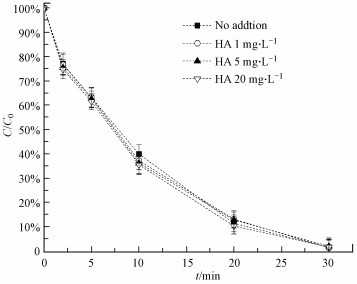 |
| 图 7 共存HA对AO7在ZVI-PMS体系中降解的影响([AO7]0=0.05 mmol·L-1, [PMS]0=1 mmol·L-1, [ZVI]0=0.5 mmol·L-1) Fig. 7 Effect of co-existing HA on the degradation efficiency of AO7 in ZVI-PMS system |
为了考察实际应用中ZVI-PMS去除AO7的效果, 选取了不同水体进行试验:超纯水、赣江河水、鄱阳湖湖水、南昌市某污水处理厂出水.相关水质指标信息及AO7在其中的反应速率常数如表 1所示.实验结果表明, AO7在不同水体中降解的速率为:超纯水 > 河水 > 湖水 > 污水厂出水.这可能是因为实际水样中含有较多的有机物和各种离子, 会与AO7竞争活性粒子, 从而抑制了AO7的降解, 并且水样pH和溶解性有机碳(DOC)含量越高, AO7的降解速率越慢.
| 表 1 不同水体的理化性质参数及AO7在其中的反应速率常数 Table 1 Physical and chemical property parameters of different waters and AO7 in which the reaction rate constant |
虽然污水厂出水中AO7的降解速率低于超纯水中的降解速率, 但反应90 min后, AO7仍然可以去除98.6%, 说明ZVI-PMS体系可以较好地应用在实际污水处理中.污水厂出水中不同相态水体的AO7降解速率排列次序依次为:真溶相>过滤相>胶体相, 这可能与胶体相和过滤相中相对较高的DOC含量有关.虽然HA对AO7的降解影响不大, 但污水厂出水中有机物种类复杂, 还包括多种阴阳离子, 因此, 可能会影响到AO7的去除效果.值得注意的是, 尽管污水水体中胶体相中AO7的氧化降解速率最慢, 但反应90 min后, AO7的去除率仍然可达87.6%.因此, ZVI-PMS可以有效地去除具有较高DOC含量的污水中的AO7.
3.2.7 ZVI-PMS体系中AO7降解中间产物的测定和TOC变化图 8为ZVI-PMS体系中AO7降解过程中TOC变化情况.在20、30和60 min时分别取样, 测得TOC去除率分别为6.69%、12.69%和18.85%.但与AO7的降解不同, 反应60 min后, AO7可以完全去除, 而TOC的去除率只有18.85%, 这是因为AO7没有完全矿化, 大部分只是转化成了其他较难矿化的有机中间产物.而且PMS浓度随着反应进行而不断降低, 产生的活性自由基数量逐渐减少, 使得TOC的去除速率慢慢降低.
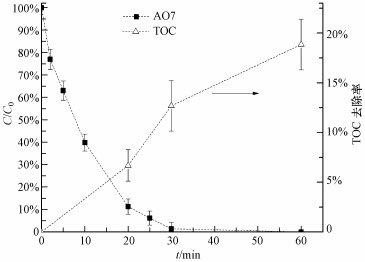 |
| 图 8 AO7溶液在ZVI-PMS体系氧化过程中的TOC变化([AO7]0=0.05 mmol·L-1, [PMS]0=1 mmol·L-1, [ZVI]0=0.5 mmol·L-1) Fig. 8 Variation of AO7 and TOC during the oxidation in ZVI-PMS system |
通过GC-MS对AO7的降解中间产物进行了测定.AO7的最大吸收峰在484 nm处, 这是由AO7分子结构中偶氮键决定的(Qi et al., 2016).根据AO7的脱色规律和降解产物, 可以推测ZVI-PMS体系产生的SO4·-和HO·可能首先会进攻AO7的偶氮键, 使其脱色, 同时生成4-氨基苯磺酸和1-氨基-2-萘酚(图 9).但4-氨基苯磺酸具有很高的热稳定性(熔点288 ℃, 不易气化), 1-氨基-2-萘酚在空气中不稳定, 容易被空气中的氧气氧化, 因此, GC-MS并没有检测到这两种物质(Qi et al., 2016).1-氨基-2-萘酚在体系内可能被氧化成邻苯二甲酰亚胺(产物Ⅰ)和邻苯二甲酸(产物Ⅱ).而4-氨基苯磺酸继续被氧化, 进而生成对苯醌(产物Ⅲ)(图 9).这些有机中间产物在各种氧化活性物种的作用下, 会被进一步氧化成小分子有机物, 最终矿化成CO2、H2O和无机离子.
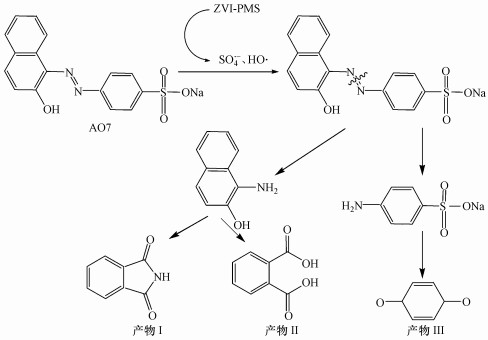 |
| 图 9 AO7在ZVI-PMS体系中的可能降解路径 Fig. 9 Possible degradation pathways of AO7 in the ZVI-PMS system |
1) Fe2+-PMS体系不能有效去除水中AO7, 但通过添加适量的络合剂, 可使AO7的去除率大幅提高.
2) ZVI-PMS体系可以快速有效地降解AO7, 酸性pH值条件下AO7的降解速率较快.同时, 淬灭实验结果表明, SO4·-是ZVI-PMS体系中的主要自由基, 对AO7的降解起主要作用.
3) 除了Cl-和高浓度(50 mmol·L-1)的NO3-能够促进AO7的降解外, 其他水中共存的阴离子对AO7在ZVI-PMS体系中的降解具有抑制作用, 其抑制能力排序为:NO2- > HPO42- > H2PO4- > HCO3-/CO32- > NO3-;此外, HA对AO7的降解无明显影响.
4) AO7在不同水体中降解的速率为:超纯水 > 河水 > 湖水 > 污水厂出水.反应90 min后, 污水厂出水过滤水和胶体浓缩液中的AO7分别可去除98.6%和87.6%.
5) 体系中共鉴定出3种中间产物, 主要是通过AO7偶氮键断键后的中间产物进一步氧化形成.此外, AO7降解过程中TOC在一定程度上降低, 说明部分AO7被矿化.
Anipsitakis G P, Dionysiou D D. 2004. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 38(13): 3705–3712.
|
Buxton G V, Greenstock C L, Helman W P, et al. 1988. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-) in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 17(2): 513–886.
DOI:10.1063/1.555805
|
Deng J, Shao Y, Gao N, et al. 2014. Zero-valent iron/persulfate (Fe0/PS) oxidation acetaminophen in water[J]. International Journal of Environmental Science and Technology, 11(4): 881–890.
DOI:10.1007/s13762-013-0284-2
|
Fang C, Xiao D, Liu W, et al. 2016. Enhanced AOX accumulation and aquatic toxicity during 2, 4, 6-trichlorophenol degradation in a Co(Ⅱ)/peroxymonosulfate/Cl- system[J]. Chemosphere, 144: 2415–2420.
DOI:10.1016/j.chemosphere.2015.11.030
|
房聪, 房烽, 张黎明, 等. 2018. 秸秆活性炭活化过一硫酸盐降解酸性橙7[J]. 环境科学学报, 2018, 38(1): 242–250.
|
Ghauch A, Ayoub G, Naim S. 2013. Degradation of sulfamethoxazole by persulfate assisted micrometric Fe0 in aqueous solution[J]. Chemical Engineering Journal, 228: 1168–1181.
DOI:10.1016/j.cej.2013.05.045
|
Graça C A L, Fugita L T N, de Velosa A C, et al. 2017. Amicarbazone degradation promoted by ZVI-activated persulfate:study of relevant variables for practical application[J]. Environmental Science and Pollution Research, 25(6): 5474–5483.
|
Ji Y, Wang L, Jiang M, et al. 2017. The role of nitrite in sulfate radical-based degradation of phenolic compounds:An unexpected nitration process relevant to groundwater remediation by in-situ chemical oxidation (ISCO)[J]. Water Research, 123: 249–257.
DOI:10.1016/j.watres.2017.06.081
|
Kurukutla A B, Kumar P S S, Anandan S, et al. 2015. Sonochemical degradation of rhodamine b using oxidants, hydrogen peroxide/peroxydisulfate/peroxymonosulfate, with Fe2+ ion:proposed pathway and kinetics[J]. Environmental Engineering Science, 32(2): 129–140.
DOI:10.1089/ees.2014.0328
|
Li H, Wan J, Ma Y, et al. 2015. Role of inorganic ions and dissolved natural organic matters on persulfate oxidation of acid orange 7 with zero-valent iron[J]. RSC Advances, 5(121): 99935–99943.
DOI:10.1039/C5RA16094D
|
Liang C, Bruell C J, Marley M C, et al. 2004. Persulfate oxidation for in situ remediation of TCE.Ⅱ.Activated by chelated ferrous ion[J]. Chemosphere, 55(9): 1225–1233.
DOI:10.1016/j.chemosphere.2004.01.030
|
Lou X, Wu L, Guo Y, et al. 2014. Peroxymonosulfate activation by phosphate anion for organics degradation in water[J]. Chemosphere, 117: 582–585.
DOI:10.1016/j.chemosphere.2014.09.046
|
Neta P, Huie R E, Ross A B. 1988. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 17(3): 1027–1284.
DOI:10.1063/1.555808
|
Nie M, Yan C, Li M, et al. 2015. Degradation of chloramphenicol by persulfate activated by Fe2+ and zerovalent iron[J]. Chemical Engineering Journal, 279: 507–515.
DOI:10.1016/j.cej.2015.05.055
|
Nie M, Yang Y, Zhang Z, et al. 2014. Degradation of chloramphenicol by thermally activated persulfate in aqueous solution[J]. Chemical Engineering Journal, 246: 373–382.
DOI:10.1016/j.cej.2014.02.047
|
聂明华, 刘慧慧, 熊小英, 等. 2018. 南昌市湖泊水体中不同粒径胶体的三维荧光光谱特征研究[J]. 环境科学学报, 2018, 38(5): 1929–1938.
|
Qi C, Liu X, Ma J, et al. 2016. Activation of peroxymonosulfate by base:implications for the degradation of organic pollutants[J]. Chemosphere, 151: 280–288.
DOI:10.1016/j.chemosphere.2016.02.089
|
Rao Y F, Qu L, Yang H, et al. 2014. Degradation of carbamazepine by Fe(Ⅱ)-activated persulfate process[J]. Journal of Hazardous Materials, 268: 23–32.
DOI:10.1016/j.jhazmat.2014.01.010
|
Rastogi A, Al-Abed S R, Dionysiou D D. 2009. Sulfate radical-based ferrous-peroxymonosulfate oxidative system for PCBs degradation in aqueous and sediment systems[J]. Applied Catalysis B:Environmental, 85(3): 171–179.
|
Rostamizadeh M, Jafarizad A, Gharibian S. 2018. High efficient decolorization of Reactive Red 120 azo dye over reusable Fe-ZSM-5 nanocatalyst in electro-Fenton reaction[J]. Separation and Purification Technology, 192: 340–347.
DOI:10.1016/j.seppur.2017.10.041
|
Shen J H, Horng J J, Wang Y S, et al. 2017. The use of reactive index of hydroxyl radicals to investigate the degradation of acid orange 7 by Fenton process[J]. Chemosphere, 182: 364–372.
DOI:10.1016/j.chemosphere.2017.05.043
|
Tan C, Dong Y, Fu D, et al. 2018. Chloramphenicol removal by zero valent iron activated peroxymonosulfate system:Kinetics and mechanism of radical generation[J]. Chemical Engineering Journal, 334: 1006–1015.
DOI:10.1016/j.cej.2017.10.020
|
Wang Z, Ai L, Huang Y, et al. 2017. Degradation of azo dye with activated peroxygens:when zero-valent iron meets chloride[J]. RSC Advances, 7(49): 30941–30948.
DOI:10.1039/C7RA03872K
|
王莹, 魏成耀, 黄天寅, 等. 2017. 氮掺杂碳纳米管活化过一硫酸盐降解酸性橙AO7[J]. 中国环境科学, 2017, 37(7): 2583–2590.
DOI:10.3969/j.issn.1000-6923.2017.07.021 |
Yan C, Nie M, Yang Y, et al. 2015b. Effect of colloids on the occurrence, distribution and photolysis of emerging organic contaminants in wastewaters[J]. Journal of Hazardous Materials, 299: 241–248.
DOI:10.1016/j.jhazmat.2015.06.022
|
Yan C, Yang Y, Zhou J, et al. 2015a. Selected emerging organic contaminants in the Yangtze Estuary, China:A comprehensive treatment of their association with aquatic colloids[J]. Journal of Hazardous Materials, 283: 14–23.
DOI:10.1016/j.jhazmat.2014.09.011
|
Yuan R, Ramjaun S N, Wang Z, et al. 2011. Effects of chloride ion on degradation of Acid Orange 7 by sulfate radical-based advanced oxidation process:implications for formation of chlorinated aromatic compounds[J]. Journal of Hazardous Materials, 196: 173–179.
DOI:10.1016/j.jhazmat.2011.09.007
|
Zhang Y, Douglas G B, Pu L, et al. 2017. Zero-valent iron-facilitated reduction of nitrate:Chemical kinetics and reaction pathways[J]. Science of the Total Environment, 598: 1140–1150.
DOI:10.1016/j.scitotenv.2017.04.071
|
Zhou L, Zheng W, Ji Y, et al. 2013. Ferrous-activated persulfate oxidation of arsenic (Ⅲ) and diuron in aquatic system[J]. Journal of Hazardous Materials, 263: 422–430.
DOI:10.1016/j.jhazmat.2013.09.056
|
Zhou P, Zhang J, Zhang Y, et al. 2018. Degradation of 2, 4-dichlorophenol by activating persulfate and peroxomonosulfate using micron or nanoscale zero-valent copper[J]. Journal of Hazardous Materials, 344: 1209–1219.
DOI:10.1016/j.jhazmat.2017.11.023
|
Zou X, Zhou T, Mao J, et al. 2014. Synergistic degradation of antibiotic sulfadiazine in a heterogeneous ultrasound-enhanced Fe0/persulfate Fenton-like system[J]. Chemical Engineering Journal, 257: 36–44.
DOI:10.1016/j.cej.2014.07.048
|
 2018, Vol. 38
2018, Vol. 38


