吲哚是一种典型的氮杂环芳烃化合物, 在焦化废水和畜牧废水中大量存在(Wei et al., 2012; Jensen et al., 1995).吲哚具有一定的生物活性, 是微生物与动植物种内与种间常见的信号分子, 在病原菌致病机理及真核生物免疫系统中扮演着重要角色(Lee et al., 2015; Lee et al., 2010).研究表明, 高浓度的吲哚不仅会显著抑制微生物的生长, 还会增加肠道炎症、糖尿病及神经系统疾病等的发生率(Jisun et al., 2015).因此, 对生物转化吲哚的机理进行研究具有重要的意义.目前针对微生物降解吲哚的研究主要有好氧和厌氧两种, 其中, 已报道的具有好氧降解吲哚能力的菌株主要集中在Pseudomonas、Alcaligenes、Curpriavidus等菌属, 较为单一, 亟需开发新型的菌株资源(Pankaj et al., 2015; Minsu et al., 2016).
此外, 研究发现, 很多吲哚降解菌可在外加芳烃诱导下转化吲哚合成靛蓝类色素(Kevin et al., 1998; Hilor et al., 2010).靛蓝被称作染料之王, 但化学合成靛蓝的过程带来了大量环境污染(韩晓红等, 2008).微生物合成靛蓝具有绿色环保的优点, 在20世纪末期曾实现短暂工业化应用(Murdock et al., 1993).将废水中的吲哚转化为靛蓝类色素不失为含吲哚废水生物处理和资源化的一种潜在途径(马桥等, 2012).然而, 生物合成效率低、成本较高等瓶颈问题却限制了生物合成靛蓝的工业化进程.因此, 开发新型微生物资源, 并对降解机制及合成过程进行系统研究, 将有助于实现其工业化应用.
本研究从近海泥沙中分离筛选得到一株能以吲哚为唯一碳源生长的高效吲哚降解菌DCX, 对菌株DCX形态及16S rRNA序列进行比对分析与鉴定, 考察不同环境因素对菌株降解吲哚效率的影响, 并利用HPLC/TOF-MS对吲哚代谢途径及其中间产物进行相关分析.最后, 在外加酵母浸粉的条件下, 利用表面响应法对该菌株转化吲哚合成靛蓝的条件进行优化, 以提高合成靛蓝产量.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 菌株收集近海泥沙样品, 用含100 mg·L-1吲哚的无机盐培养基进行驯化, 驯化2个月左右.然后取驯化后的样品反复进行平板涂布, 最后分离得到一株能以吲哚为唯一碳源生长的菌株, 命名为DCX.
2.1.2 培养基本实验所用培养基为LB培养基和无机盐培养基.其中, LB培养基组成为:NaCl 10 g·L-1, 蛋白胨10 g·L-1, 酵母粉5 g·L-1, pH=6.8.无机盐培养基组成为:(NH4)2SO4 2 g·L-1, KH2PO4 2 g·L-1, Na2HPO4·12H2O 3.3 g·L-1, FeCl3 0.25 mg·L-1, pH=6.8.固体培养基是在液体培养基中加入2 g·L-1琼脂粉.所有培养基均在121 ℃高压蒸汽中灭菌20 min后使用.
2.1.3 主要试剂与仪器靛蓝和吲哚均购自百灵威公司, 其余试剂均为国产分析纯.使用的主要仪器:Shimadzu LC-20A型高效液相色谱(HPLC, 日本)、Agilent 6244型液相色谱/飞行时间-质谱联用仪(LC/TOF-MS, 美国)、Metash UV-9000双光紫外-可见分光光度计.
2.2 实验方法 2.2.1 菌体形态的观察利用HITACHI SU8010扫描电子显微镜观察菌株DCX的细胞形态.样品预处理方法如下:将菌株DCX在100 mg·L-1吲哚、30 ℃和150 r·min-1的条件下培养48 h后, 取2 mL菌液, 8000 r·min-1离心5 min, 弃去上清; 用pH=7的PBS缓冲溶液清洗菌体沉淀2次后, 用5%的戊二醛溶液将菌体液悬, 在4 ℃条件下静置2 h, 随后在8000 r·min-1条件下离心5 min; 再依次利用30%、50%、70%、90%、95%、100%的乙醇将菌体液悬, 对菌细胞进行梯度脱水, 期间均在8000 r·min-1、4 ℃条件下各离心15 min.最后用无水乙醇溶液将菌体悬起保存, 待上机观察.
2.2.2 菌株DCX的16S rRNA序列分子鉴定利用菌体DCX的菌液作为模板, 选择16S rRNA基因的通用引物27F和1492R作为扩增引物.引物具体序列为:27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′.对菌株DCX的16S rRNA进行PCR扩增, 扩增产物送至上海生工公司测序.
2.2.3 菌株DCX菌体浓度的测定取2 mL菌液, 利用紫外-可见分光光度计在660 nm波长下测定菌体浓度, 用吸光度(OD660)来表示菌体浓度.
2.2.4 吲哚浓度的测定利用高效液相色谱(HPLC)对培养基中的吲哚浓度进行定量检测.取2 mL样品, 用等体积的乙酸乙酯对其进行振荡萃取, 静置30 min;然后用0.45 μm有机膜过滤后上机进行分析.本实验采用Hypersil OD32(5 μm, 250 nm×4.6 mm)型号的HPLC色谱柱, 流动相为甲醇/水, 检测条件为:85%甲醇(V/V), 15%超纯水(V/V), 进样量10 μL, 流速0.5 mL·min-1, 洗脱时间8 min, 检测波长为265 nm.
2.2.5 靛蓝产量的测定将合成的产物在10000 r·min-1条件下离心10 min, 沉淀用二甲基亚砜(DMSO)重悬, 超声30 min, 再次离心(10000 r·min-1, 10 min), 将得到的蓝色上清液利用紫外-可见分光光度计在616 nm波长下检测.
2.2.6 菌株DCX生长-吲哚降解曲线的测定以吲哚为唯一碳源的无机盐培养基中测定菌株的生长-吲哚降解曲线, 向培养基中加入100 mg·L-1吲哚, 于30 ℃、150 r·min-1条件下培养, 每4 h取样, 测定培养基中剩余的吲哚浓度及菌株DCX的菌体浓度(OD660).
2.2.7 菌株DCX转化吲哚合成靛蓝的条件优化为考察多种因素对菌株转化吲哚合成靛蓝的影响, 采用表面响应法中常用的一种水平实验设计方法—中心组合设计(Central Composite Design, CCD), 对条件优化的实验参数进行设计.中心组合设计是表面响应法中常用的基于最小二乘法的二阶设计方法, 由Box和Wilson提出, 常被用于环境修复领域(Ahmadi et al., 2005), 具有可以简便地体现各种环境因素之间的交互影响情况的优点.中心组合设计首先利用二阶多项式回归方程建立基础模型:

|
(1) |
式中, Y为响应值, A、B、C为3个独立变量.在中心组合设计中, 由预实验确定的独立变量被转换至无量纲代数(A、B、C).常数β0、一次常数βi、二次常数βii、交叉常数βij等则通过实验值确定.本实验中, 靛蓝产率为响应目标(Y), 考察的影响因素包括培养基中的吲哚浓度(因素A)、酵母浸粉浓度(因素B)及接菌量(因素C).使用软件Design Expert 8.0.6对实验进行设计和数据分析, 吲哚的浓度范围为200~300 mg·L-1, 酵母浸粉的浓度范围为1.0~5.0 g·L-1, 接菌量范围在1%~5%(V/V).得到设计条件如表 2所示.利用方差分析(ANOVA)对模型及各影响因素进行检验, p < 0.05表明该模型或相关影响因素具有显著性.
2.2.8 吲哚降解产物的分离与测定采用液相色谱/飞行时间-质谱联用(LC/TOF-MS)分析方法进行测定.预处理:菌株DCX在吲哚无机盐培养基中生长, 在接种12和24 h后取样, 分别在8000 r·min-1的条件下离心5 min.利用乙酸乙酯对上清液进行振荡萃取处理.利用DMSO对离心后的沉淀进行萃取, 振荡悬起后再次在8000 r·min-1的条件下离心5 min.上层有机液体经0.45 μm有机膜进行过滤后, 上机检测.MS采用电喷雾电离源(ESI), 扫描模式为负模式.
3 结果与讨论(Results and discussion) 3.1 菌株DCX的分离与鉴定经过反复平板涂布, 从近海泥沙中分离得到一株能以吲哚为唯一碳源生长的菌株, 命名为DCX.菌株DCX在无机盐固体培养基上的菌落呈现为浅黄色圆点状, 表面光滑, 边缘整齐.利用扫描电镜观察菌体形态, 菌株DCX为杆状(图 1a), 利用粒径分析软件计算其平均长度为1.45 μm, 无鞭毛.
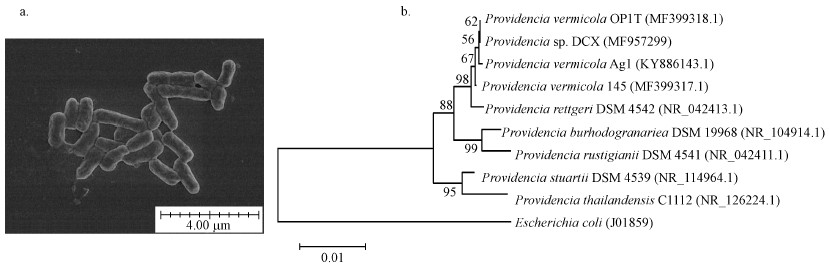 |
| 图 1 SEM (a)和菌株DCX系统发育树(b) Fig. 1 SEM image (a) and phylogenetic tree of strain DCX (b) |
菌株DCX的16S rRNA基因序列在GenBank数据库登陆的序列号为MF957299.利用NCBI中的BLAST工具将测序得到的菌株DCX的16S rRNA基因序列, 与GenBank数据库中的其他16S rRNA序列进行同源性比对.结果表明, 菌株DCX的16S rRNA基因序列与Providencia菌属的多株菌株同源性高达99%以上, 故将菌株DCX鉴定为Providencia菌属.为进一步分析菌株DCX的系统进化位置, 选取多株Providencia菌属的菌株构建菌株DCX的系统发育树, 结果如图 1b所示.
吲哚好氧降解的研究起源于20世纪20年代, 1928年, Gray在外加碳源存在情况下, 筛选出了第一株可以转化吲哚的菌株(Gray, 1928).截至目前已经有数十个吲哚好氧降解菌的报道, 但这些研究主要集中在Pseudomonas、Alcaligenes、Curpriavidus等菌属(Pankaj et al., 2015), 菌株较为单一.而关于Providencia菌属降解吲哚的研究尚未见报道, 属于新颖的菌株资源.
3.2 菌株DCX降解吲哚的机理推测由图 2中菌株DCX的生长及吲哚降解曲线可知, 菌株DCX在加入吲哚的无机盐培养基中培养时, 几乎没有停滞期.当菌株生长到对数期后, 吲哚降解速率也随之加快.在20~28 h期间, 菌株生长出现停滞, 反应体系的颜色由无色变为黄色.28 h黄色褪去后, 菌株重新以较快速度生长, 最终在32 h达到稳定期.推测菌株降解吲哚过程中生成了不易代谢的中间产物Ⅰ, 然后中间产物Ⅰ逐渐被转化为易于利用的中间产物Ⅱ, 菌株能够利用吲哚代谢的中间产物Ⅱ继续生长.该结果与前期对Burkholderia菌属降解吲哚的研究类似(刘紫嫣, 2017).
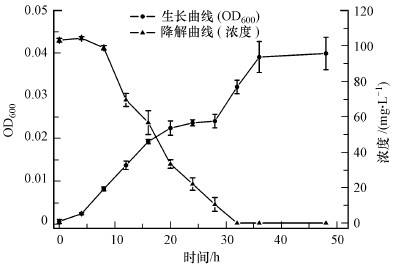 |
| 图 2 菌株DCX的生长-吲哚降解曲线 Fig. 2 Growth of strain DCX coupling with indole degradation |
利用LC/TOF-MS对菌株DCX降解吲哚的中间产物进行分析, 结果显示(图 3), 检测到了质荷比m/z为146.0260、164.0356、152.0346和261.0670的分子离子峰(M-H)-.通过与前期的文献(刘紫嫣, 2017)报道相比较, 确定中间产物为靛红、靛红酸、邻氨基苯甲酸和靛蓝这4种物质.
 |
| 图 3 菌株DCX降解吲哚中间产物质谱图(a.靛红;b.靛红酸;c.邻氨基苯甲酸; d.靛蓝) Fig. 3 Mass spectra of indole metabolic intermediates by strain DCX(a.Isatin, b.Isatin acid, c.Antranilate, d.Indigo) |
根据以上结果, 推测菌株DCX降解吲哚的可能途径如图 4所示.首先, 菌株将吲哚羟化为吲哚酚, 然后, 吲哚酚经两个分支途径进行代谢.其中, 途径Ⅰ是吲哚酚在空气中自发二聚合成靛蓝(马桥, 2017);而途径Ⅱ则是吲哚酚进一步在加氧酶的作用下生成2, 3-二羟基吲哚, 随后, 2, 3-二羟基吲哚转化为靛红.靛红一部分水解为靛红酸, 其余靛红则转化为邻氨基苯甲酸, 进入下游代谢途径TCA循环.
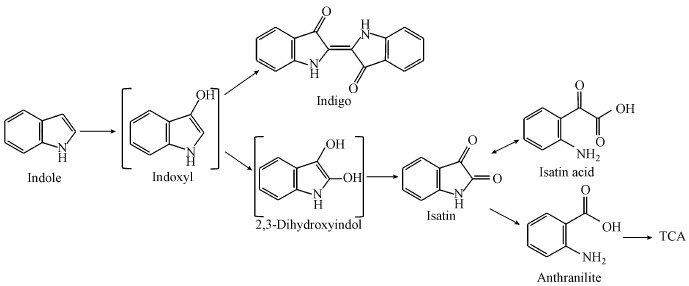 |
| 图 4 菌株DCX降解吲哚机理推测 Fig. 4 Pathway of indole degradation by strain DCX |
好氧降解吲哚可以分为以吲哚为唯一碳源和共代谢降解两种, 其中以吲哚为唯一碳源的菌株降解吲哚过程研究较为深入.1953年Sakaomto等对一株革兰氏阳性菌进行研究, 推测降解机理为吲哚→吲哚酚/2, 3-二羟基吲哚→靛红→邻氨基苯甲酸→水杨酸→邻苯二酚(Sakamoto et al., 1953), 这与2015年Fukuoka等对Cupriavidus sp. KK10推测的降解机理相似(Fukuoka et al., 2015).1997年, Doukyu等对Pseudomonas sp. ST-200降解吲哚的途径进行解析, 推测机理为吲哚→2, 3-二羟基吲哚→靛红→靛红酸(Doukyu et al., 1997).本研究中, 菌株Providencia sp. DCX以吲哚为唯一碳源的情况下, 靛蓝产量不高, 主要倾向于通过途径Ⅱ降解吲哚, 因此, 后续可以针对调控菌株降解途径进行进一步研究.
3.3 利用表面响应法优化靛蓝产率前期研究中, 菌株DCX在外加酵母浸粉时可以转化吲哚合成靛蓝.吲哚及酵母浸粉浓度可能对菌株合成靛蓝的过程有着重要影响, 此外, 菌株的接种量会影响菌株的生长.为此, 采用表面响应法考察酵母浸粉、吲哚浓度及初始接菌量对靛蓝产率的影响, 对菌株DCX合成靛蓝的条件进行优化.通过预实验确定优化范围, 吲哚的浓度范围为200~300 mg·L-1, 酵母浸粉浓度范围为1.0~5.0 g·L-1, 接菌量范围为1%~5%.利用Design Expert 8.0.6进行实验设计, 得到的设计条件及结果如表 1所示.
| 表 1 菌株DCX合成靛蓝的优化实验设计 Table 1 RSM design and the biosynthesis of indigo by strain DCX |
利用软件Design Expert 8.0.6对实验数据进行回归分析, 得到响应目标对各编码值的回归方程为:

|
(2) |
式中, Y为靛蓝产率, A为吲哚浓度, B为酵母浸粉浓度, C为接菌量.根据此回归方程计算得到的预测值列于表 1中.利用Design Expert 8.0.6对得到的回归方程进行ANOVA方差分析, 结果见表 2.模型的F值为8.99, p值小于0.05, 说明该模型具有显著性.模型的R2为0.89, 说明拟合的模型具有89%的可信度.此外, A、B、C的p值均小于0.05, 说明在菌株DCX转化吲哚合成靛蓝的过程中, 吲哚浓度、酵母浸粉浓度及接菌量对于响应值均是显著的影响因素.
| 表 2 模型的ANOVA方差分析 Table 2 ANOVA results for response surface model |
利用软件Design Expert 8.0.6得到各个变量对靛蓝产率影响的相互作用3D效果图(图 5).由图可知, 当吲哚浓度逐渐增加时, 靛蓝产率先增加后减小.由于吲哚是菌株合成靛蓝的底物, 所以当吲哚浓度在一定范围内增加时, 靛蓝产率得到提升;但由于吲哚对菌株具有毒性作用, 当吲哚浓度过高时, 靛蓝产率会下降;当酵母浸粉浓度和接菌量逐渐增加时, 靛蓝产率均先增加后减小.酵母浸粉中富含多种营养元素, 有利于菌株的生长, 从而增加了靛蓝的产率.但当酵母浸粉过多时, 菌株更偏向于利用酵母浸粉生长, 从而减少吲哚的转化;接菌量决定了培养基中的初始菌量, 而初始菌量决定了后续培养基中菌株生长的时间及速度等特性, 从而影响靛蓝产率.
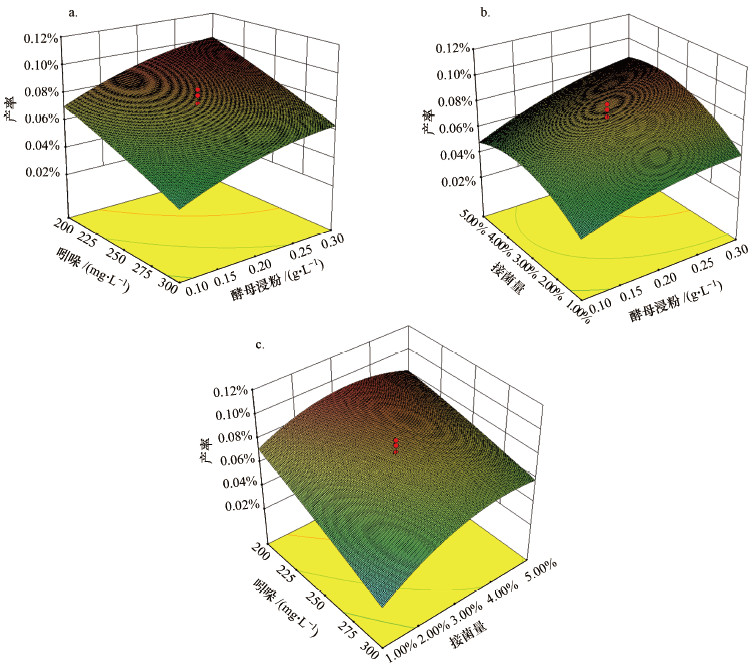 |
| 图 5 菌株DCX合成靛蓝过程中各因素相互作用的3D响应图(a.吲哚和酵母浸粉浓度;b.酵母浸粉浓度和接菌量;c.接菌量和吲哚浓度) Fig. 5 Response surface plot showing the effects of the three factors on indigo production by strain DCX(a. Indole and yeast extract; b. Indole and inoculum; c. Inoculum and yeast extract powder) |
根据模型分析, 得到菌株DCX降解吲哚合成靛蓝产率最高的条件为:吲哚207.49 mg·L-1, 酵母浸粉2.9 g·L-1, 接菌量4.23%, 在此条件下靛蓝产率为9.90%, 与初始条件下(吲哚100 mg·L-1, 酵母浸粉1.0 g·L-1, 接菌量5%)的产率(2.26%)相比, 提高了4.38倍.
Gray(1928)首次发现吲哚降解菌能够转化吲哚合成靛蓝类色素, 而后关于微生物转化吲哚合成靛蓝的研究一直持续至今(Tammy et al., 2018).例如, Pseudomonas putida、Arthrobacter sp.等菌属均被报道具有合成靛蓝的能力(Kim et al., 2003; Bhushan et al., 2000).迄今, Providencia菌属菌株能够降解吲哚及合成靛蓝的能力尚未见报道.因此, 通过对菌株DCX降解吲哚进行机制解析, 并对其合成靛蓝的条件进行优化, 能够为靛蓝类物质的生物合成提供新颖有效的菌株资源.
4 结论(Conclusions)1) 本研究筛选得到以吲哚为唯一碳源的菌株DCX, 通过16S rRNA基因序列分析比对, 结果表明, 菌株DCX属于Providencia sp., 并首次报道其具有降解吲哚及合成靛蓝的能力.
2) 利用LC/TOF/MS对菌株DCX降解吲哚的中间产物进行了分析, 结果显示, 中间产物有靛蓝、靛红、靛红酸及邻氨基苯甲酸.根据以上结果推测了降解机理包含两个途径:途径Ⅰ是吲哚酚在空气中自发二聚合成靛蓝;而途径Ⅱ则是吲哚酚进一步在加氧酶的作用下生成2, 3-二羟基吲哚, 随后2, 3-二羟基吲哚转化为靛红, 靛红一部分水解为靛红酸, 其余靛红则转化为邻氨基苯甲酸, 进入下游代谢途径二聚循环.
3) 利用表面响应法对菌株DCX合成靛蓝进行条件优化, 其最优条件为:吲哚207.49 mg·L-1, 酵母浸粉2.9 g·L-1, 接菌量4.23%, 在此条件下, 靛蓝产率为9.90%, 比初始条件提高了4.38倍.
Ahmadi M, Vahabzadeh F, Bonakdarpour B, et al. 2005. Application of the central composite design and response surface methodology to the advanced treatment of olive oil processing wastewater using Fenton's peroxidation[J]. Journal of Hazardous Materials, 123: 1–3.
DOI:10.1016/j.jhazmat.2005.01.034
|
Bhushan B, Samanta S K, Jain R K. 2000. Indigo production by naphthalene-degrading bacteria[J]. Letters in Applied Microbiology, 31: 5–9.
DOI:10.1046/j.1472-765x.2000.00754.x
|
Doukyu N, Aono R. 1997. Biodegradation of indole at high concentration by persolvent fermentation with Pseudomonas sp. ST-200[J]. Extremophiles, 1(2): 100–105.
DOI:10.1007/s007920050021
|
Doukyu N, Toyoda K, Aono R. 2003. Indigo production by Escherichia coli carrying the phenol hydroxylase gene from Acinetobacter sp.strain ST-550 in a water-organic solvent two-phase system[J]. Applied Microbiology and Biotechnology, 60(6): 720–725.
DOI:10.1007/s00253-002-1187-1
|
Ensley B D, Ratzkin B J, Osslund T D, et al. 1983. Expression of naphthalene oxidation genes in Escherichia coli results in the biosynthesis of indigo[J]. Science, 222: 167–169.
DOI:10.1126/science.6353574
|
Gray P H H. 1928. the formation of indigotin from indole by soil bacteria[J]. Proceedings of the Royal Society of London.Series B, Containing Papers of a Biological Character, 102(717): 263–280.
DOI:10.1098/rspb.1928.0003
|
Fukuoka K, Tanaka K, Ozeki Y, et al. 2015. Biotransformation of indole by Cupriavidus sp.strain KK10 proceeds through N-heterocyclic-and carbocyclic-aromatic ring cleavage and production of indigoids[J]. International Biodeterioration & Biodegradation, 97: 13–24.
|
Hilor P, Datta M. 2010. Biosynthesis of indigo dye by newly isolated naphthalene-degrading strain Pseudomonas sp.HOB1 and its application in dyeing cotton fabric[J]. Applied Biochemistry and Biotechnology, 160(6): 1616–1626.
DOI:10.1007/s12010-009-8638-4
|
韩晓红, 王伟, 肖兴国. 2008. 靛蓝及其同类色素的微生物生产与转化[J]. 生物工程报, 2008, 24(6): 921–926.
|
Jensen M T, Cox R P, Jensen B B. 1995. 3-Methylindole(skatole) and indole production by mixed populations of pig fecal bacteria[J]. Appl Environ Microbiol, 61(8): 3180–3184.
|
Lee J H, Thomas K W, Lee J. 2015. Roles of indole as an interspecies and interkingdom signaling molecule[J]. In Trends in Microbiology, 23(11): 707–718.
DOI:10.1016/j.tim.2015.08.001
|
Lee J H, Lee J. 2010. Indole as an intercellular signal in microbial communities[J]. FEMS Microbiology Reviews, 34(4): 426–444.
DOI:10.1111/j.1574-6976.2009.00204.x
|
刘紫嫣. 2017. Burkholderia sp. IDO3转化吲哚研究[D]. 大连: 大连理工大学
|
Jisun K, Woojun P. 2015. Indole:a signaling molecule or a mere metabolic by product that alters bacterial physiology at a high concentration[J]. Journal of Microbiology, 53(7): 421–428.
DOI:10.1007/s12275-015-5273-3
|
Kevin E, O'Connor, Sybe H. 1998. Indigo formation by aromatic hydrocarbon-degrading bacteria[J]. Biotechnology Letters, 2(3): 219–223.
|
Kim J Y, Lee K, Kim Y, et al. 2003. Production of dyestuffs from indole derivatives by naphthalene dioxygenase and toluene dioxygenase[J]. Letters in Applied Microbiology, 36: 343–348.
DOI:10.1046/j.1472-765X.2003.01279.x
|
Minsu K, Lee J H, Eonmi K, et al. 2016. Isolation of indole utilizing bacteria Arthrobacter sp.and Alcaligenes sp. from livestock waste[J]. Indian Journal of Microbiology, 56(2): 158–166.
DOI:10.1007/s12088-016-0570-z
|
Mikas S, Justas V, Renata G, et al. 2017. Gentic and biochemical characterization of indole biodegradation in Acinetobacter sp. strain O153[J]. Applied and Environmental Microbiology: 01453–17.
|
马桥, 曲媛媛, 张旭旺, 等. 2012. 靛蓝的微生物合成研究新进展[J]. 应用与环境生物学报, 2012, 18(2): 344–350.
|
马桥. 2017. 吲哚好氧转化微生物群落结构及功能基因解析[D]. 大连: 大连理工大学
http://cdmd.cnki.com.cn/Article/CDMD-10141-1017243530.htm |
Pankaj K A, Ashutosh S, Hanhong B. 2015. Microbial degradation of indole and its derivatives[J]. Journal of Chemistry.
DOI:10.1155/2015/129159
|
Philp J C, Ritchie R J, Allan J E M. 2013. Biobased chemicals:the convergence of green chemistry with industrial biotechnology[J]. Trends in Biotechnology, 31: 219–222.
DOI:10.1016/j.tibtech.2012.12.007
|
Qu Y Y, Zhang X W, Ma Q, et al. 2012. Indigo biosynthesis by Comamonas sp.MQ[J]. Biotechnology Letters, 34(2): 353–357.
DOI:10.1007/s10529-011-0778-2
|
Sakamoto Y, Uchida M, Ichihara K. 1953. The bacterial decomposition of indole.I.Studies on its metabolic pathway by successive adaptation[J]. Medical Journal of Osaka University, 3: 477–486.
|
Wei X X, Zhang Z Y, Fan Q L, et al. 2012. The effect of treatment stages on the coking wastewater hazardous compounds and their toxicity[J]. In Journal of Hazardous Materials, 135(141): 239–240.
|
 2018, Vol. 38
2018, Vol. 38


