2. 中国科学院广州地球化学研究所, 广州 510640;
3. 华南师范大学环境研究院, 广州 510006;
4. 广东省水与大气污染防治重点实验室, 广州 510655
2. Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640;
3. Environmental Research Institute, South China Normal University, Guangzhou 510006;
4. Key Lab of Water & Air Pollution Control of Guangdong Province, Guangzhou 510655
近年来, 我国水体中有机物污染问题日益突出, 其中部分有机物是难降解的有毒有害有机物, 对水生态环境带来严重危害.难降解的有毒有害有机污染物通过常规的物理、化学及生物处理方法难以有效去除, 而高级氧化技术是解决这个问题的一种有效途径, 其中基于硫酸根自由基(SO4· -)的氧化技术是近年来兴起的一种新型高级氧化技术, 已引起国内外学者越来越广泛的关注.SO4· -因具有极强的氧化能力(E0= 2.5 ~3.1 V), 并可与有机污染物发生抽氢反应、加成反应和电子转移过程, 因此可有效将难降解的大分子有机污染物氧化分解成小分子, 甚至最终矿化为CO2和H2O.目前, 该方法已被应用于土壤原位化学氧化修复(Medina et al., 2018; Tsitonaki et al., 2010)和废水中有机污染物的氧化去除过程(Devi et al., 2016), 并取得较好的效果.
国内外研究者采用过渡金属(Liang et al., 2004b)、热(Huang et al., 2002)、光(Yang et al., 2010)、碱(Furman et al., 2010)等多种方式活化过硫酸盐(PS)产生SO4· -, 其中, 通过过渡金属Fe2+活化所需活化能仅为14.8 kcal · mol-1, 低于热活化等其他活化方式(Fordham et al., 1951; Kolthoff et al., 1951), 能够更迅速活化PS产生SO4· -, 因此被认为是最经济有效的活化方法.但研究发现Fe2+活化PS过程受pH影响较大, 在酸性极低或中碱性条件下活化效果较差(Xu et al., 2010;左传梅2012), 同时由于活化过程非常迅速, Fe2+在反应初期就被快速彻底消耗, 导致PS活化持续效果较差(Crimi et al., 2007; Liang et al., 2004a), 另外大量游离态的还原性Fe2+对活化产生的SO4· -产生强烈的淬灭作用, 对SO4· -氧化降解有机污染物产生不利影响(Liang et al. 2004b).针对上述问题, 近年来, 有研究者通过分次投加Fe2+的方法来降低Fe2+的消耗及对SO4· -的淬灭(Jiang et al., 2013; Killian et al., 2007), 同时也有研究者(Cui et al., 2017; Dong et al., 2017; Han et al., 2015; Yu et al., 2018)尝试采用络合剂络合Fe2+, 通过络合剂对Fe2+的屏蔽效应, 提高Fe2+对pH的耐受性, 并调控Fe2+参与反应的速率, 从而提高了Fe2+活化PS氧化降解有机污染物的效率.然而上述方法仍未彻底解决Fe2+因浓度衰减并产生大量Fe3+累积导致PS活化持续效果较差的问题.
为此, 本研究基于络合Fe2+活化PS过程, 提出通过采用UV光照促进反应体系中累积的Fe3+向Fe2+循环转化来提高Fe2+持续活化PS氧化降解有机污染物的能力.采用了具有较好光化学活性并广泛存在于自然界中的草酸作为络合剂, 选择具有强致癌、致畸、致突变效应的重要化工中间体苯胺作为模型污染物, 研究了UV光照强化草酸络合Fe2+活化PS去除苯胺的主要作用机制及其主要影响因素.
2 实验部分(Experimental section) 2.1 主要试剂草酸(C2H2O4 · 2H2O)、5, 5-二甲基-1-吡咯啉氮氧化物(C6H11NO, DMPO, 97%)、三氯化铁(FeCl3 · 6H2O)购自阿拉丁化学试剂有限公司, 过硫酸钠(Na2S2O8)购自天津市科密欧化学试剂有限公司, 硫酸亚铁(FeSO4 · 7H2O)购自国药集团化学试剂有限公司、碘化钾(KI)购自天津市天大化学试剂厂, 以上试剂均为分析纯.
2.2 实验仪器高效液相色谱仪(LC-20A, 日本Shimadzu)、电子顺磁共振波谱仪(EMX-8/2.7C, 德国BRUKER)、紫外可见分光光度计(UV-2310Ⅱ, 上海天美科技有限公司)、低压汞灯(8 W, 28 μW · cm-2;15 W, 44 μW · cm-2;20 W, 75 μW · cm-2;40 W, 117 μW · cm-2, Philips)、pH仪(pH510, 美国Eutech).
2.3 实验方法 2.3.1 苯胺氧化降解实验分别将25 mL所需浓度的草酸、苯胺及过硫酸钠溶液加入到150 mL石英烧杯中, 混合均匀后用NaOH (0.1 mol · L-1)和H2SO4 (0.1 mol · L-1)溶液调节混合溶液的pH至所需pH值.将石英烧杯置于低压汞灯下方(图 1), 控制液面与光源垂直距离为5 cm.向该溶液中加入25 mL新制备的所需浓度FeSO4溶液并同步开启紫外灯开始反应, 在取样时间点进行取样并立即测定溶液中的PS和苯胺浓度.在无草酸、FeSO4或PS的反应中, 采用相应体积的蒸馏水代替.以上所有反应过程中均使用磁力搅拌器持续搅拌混合溶液, 所有溶液均使用蒸馏水进行配制, 蒸馏水在使用前需充入30 min N2.
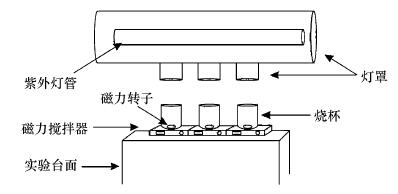 |
| 图 1 光化学反应实验装置图 Fig. 1 The device of photochemical reaction |
将新制备的50 mL 5 mmol · L-1草酸溶液和50 mL 5 mmol · L-1氯化铁溶液加入150 mL的石英烧杯中, 使用NaOH (0.1 mol · L-1)和H2SO4 (0.1 mol · L-1)调节溶液pH=3.将石英烧杯置于低压汞灯下方, 控制液面与光源垂直距离为5 cm, 开启紫外灯反应开始计时, 在取样时间点进行取样并立即测定溶液中的Fe2+浓度.
2.4 检测分析方法 2.4.1 检测方法按照Liang等(2008)提出的KI显色法测定PS的浓度;采用邻菲啰啉显色法(Tamura et al., 1974)测定Fe2+的浓度;采用高效液相色谱法检测苯胺浓度, 测试条件为:反相C-18柱(5 mm×250 mm×4.6 mm), 流动相为乙腈/水(V/V)=55/45, 柱温为40 ℃, 流速为0.50 mL · min-1, 紫外检测波长为231 nm, 苯胺的出峰时间在7.7 min附近;使用DMPO作为自由基的捕捉剂, 采用电子自旋共振波谱法(ESR)检测自由基的产生(Zhao et al., 2013), 检测条件如表 1所示.
| 表 1 ESR检测条件 Table 1 ESR determination conditions |
为了分析苯胺降解反应动力学过程, 本研究分别采用了准一级反应和二级反应动力学模型(式(1)~(2))对苯胺降解过程进行拟合.
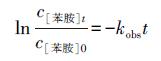
|
(1) |
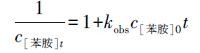
|
(2) |
式中, c[苯胺]0和c[苯胺]t分别表示苯胺初始浓度和反应t时间后的浓度(mmol · L-1), kobs为根据拟合结果得到的表观反应动力学常数, 单位分别为min-1和L · mol-1 · min-1.
本研究定义了PS有效利用率为单位浓度的PS分解所能够去除的苯胺浓度, 用以表征PS分解产生自由基参与苯胺降解反应的效率, 用ηPS表示, 计算方式如式(3)所示.

|
(3) |
式中, c0和ct分别表示该物质初始浓度和反应t时间后的浓度.
3 结果与讨论(Results and discussion) 3.1 UV对草酸络合Fe2+活化PS氧化降解苯胺的影响图 2显示了草酸/Fe2+/PS体系在引入光照前后PS活化和苯胺降解的情况.在未采用UV光照的反应体系中, PS活化和苯胺降解过程均呈现出一个快速反应阶段和一个慢速反应阶段, 上述两个反应阶段中的苯胺降解过程均分别符合一级反应动力学模型, 反应速率常数分别为2.2×10-3 min-1, 2×10-4 min-1, 反应180 min后, PS的活化分解率及苯胺的降解率分别仅有31%和6%.根据前期研究结果(Han et al., 2015), 这是由于本研究中选用的草酸络合剂分子尺寸较小, 与Fe2+形成的络合物对Fe2+的屏蔽和缓冲作用相对较弱, 导致Fe2+在反应中易被迅速消耗.而当采用UV光照后, 反应过程不再表现出明显的两个阶段, PS活化和苯胺降解持续时间延长, 反应120 min后, PS可被完全活化分解, 苯胺的降解率提高到47%.对该反应前120 min苯胺降解过程进行反应动力学研究结果显示(表 1), 此时苯胺的降解过程符合二级反应动力学模型, 反应速率常数为6.1 L · mol-1min-1.
 |
| 图 2 不同反应体系中苯胺和PS浓度随时间的变化 (反应条件:初始pH = 3, c[PS]0=5 mmol · L-1, c[Fe2+]0=2.5 mmol · L-1, c[草酸]0=2.5 mmol · L-1, c[苯胺]0= 1.25 mmol · L-1) Fig. 2 Aniline and PS concentration in various processes along with the reaction |
| 表 2 不同反应体系中的苯胺降解反应速率常数及氧化剂效率(ηPS) Table 2 Rate constants of aniline degradation and oxidants efficiency in various processes |
为了研究UV促进草酸络合Fe2+活化PS氧化降解苯胺的作用机制, 本研究首先考察了UV光照促进Fe2+的转化过程.考虑到UV/草酸/Fe2+/PS体系在反应过程中亚铁离子处于剧烈的动态转化过程, 因此本研究选择在UV光照下的草酸络合Fe3+溶液中观察Fe2+浓度变化情况.结果显示(图 3), 随着UV光照的进行, 草酸络合Fe3+溶液中不断生成了Fe2+, 且最高时可达0.32 mmol · L-1, 转化率达到13%.此外, Fe2+浓度先后经历了快速增加、保持稳定和快速下降3个阶段, 该变化过程可能是因为光化学反应过程中草酸根离子不断发生分解, Fe2+生成速率逐渐降低, 同时体系中可能产生了Fenton反应进一步消耗了Fe2+(Balmer et al., 1999; Zuo et al., 1992)(式(4)~(9)).由此推测, 在UV/草酸/Fe2+/PS反应体系中, 随着Fe3+的累积, UV光照同样会有效促进铁离子循环转化, 并提高PS的活化效果.
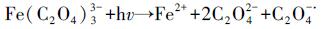
|
(4) |
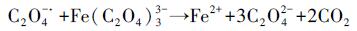
|
(5) |
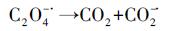
|
(6) |
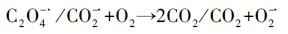
|
(7) |

|
(8) |
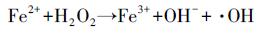
|
(9) |
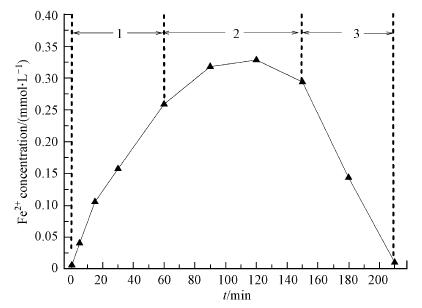 |
| 图 3 草酸络合Fe3+体系中Fe2+浓度的变化 (反应条件:初始pH = 3, c[Fe3+]0=2.5 mmol · L-1, c[草酸]0=2.5 mmol · L-1) Fig. 3 Variation of Fe2+ concentration in ferric oxalate process |
本研究还考察了UV直接光解, UV/草酸/Fe2+光化学反应, UV活化PS等过程对苯胺降解的作用, 结果如图 4所示.在仅有UV光照的体系中, 反应180 min后, 4%的苯胺被分解, 且分解过程符合准一级反应动力学模型, 速率常数为2×10-4 min-1.有研究(Khan et al., 2014)指出含苯环类的物质在UV波长254 nm条件下可被激发, 并通过降解形成新的物质从而达到稳态.此外, 本研究中使用的UV光源为低压汞灯(254 nm, 185 nm), 其中185 nm处的紫外光可能通过光解或光电离水分子产生了氧化性的· OH(Imoberdorf et al., 2012) (式(10)~(11)), 进而氧化降解苯胺, 但实验光源仅有约10%的辐射在185 nm处, 所以上述作用发生的效率也较低.由此推断, 在UV/草酸/Fe2+/PS反应体系中, 通过UV直接辐射降解苯胺的作用并不显著.
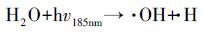
|
(10) |
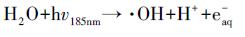
|
(11) |
 |
| 图 4 不同反应体系中(a)苯胺(b) PS浓度的变化 (反应条件:初始pH = 3, c[PS]0=5 mmol · L-1, c[Fe2+]0=2.5 mmol · L-1, c[草酸]0=2.5 mmol · L-1, c[苯胺]0= 1.25 mmol · L-1) Fig. 4 (a) Aniline and (b) PS concentration variation in various processes |
| 表 3 不同反应体系中的苯胺降解反应速率常数及氧化剂效率(ηPS) Table 3 Rate constants of aniline degradation and oxidants efficiency in various processes |
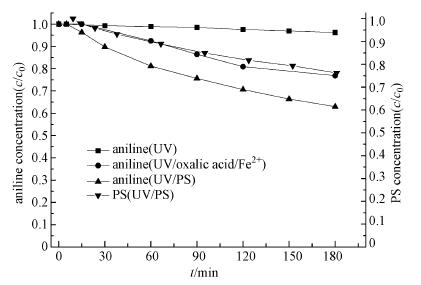
UV/草酸/Fe2+反应体系中的苯胺降解率相比UV体系从4%提高到23%, 并远高于草酸/Fe2+/PS体系.苯胺的降解过程符合二级反应动力学模型, 反应速率常数为1.2 L · mol-1min-1.这可能是因为在草酸铁的光化学反应过程中产生了Fenton反应, 形成强氧化性的· OH(式(4)~(9)).为了进一步证明该反应条件下自由基的产生情况, 本研究采用ESR技术对反应溶液进行了自由基定性检测, 结果如图 5图谱所示, 通过对ESR图谱的超精细分裂常数分析, 检测到了· OH的DMPO加合物(DMPO-OH:AN = 14.96, AH = 14.78)信号.由此推断, 在UV/草酸/Fe2+/PS反应体系中, 光化学反应过程中生成的· OH对苯胺的降解具有一定效果.
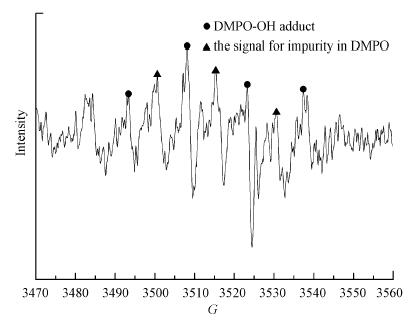 |
| 图 5 UV-草酸络合Fe2+体系中自由基的ESR图谱 Fig. 5 Radicals generation in the UV-oxalic acid- Fe2+ process |
在UV/PS体系中, PS可持续被UV活化分解, 反应180 min时的PS活化率达到24%, 苯胺降解率可达到37%, 高于UV体系和UV/草酸/Fe2+体系.苯胺降解过程符合二级反应动力学模型, 反应速率常数为2.4 L · mol-1min-1, 约为UV/草酸/Fe2+体系中苯胺降解速率常数的2倍.由于UV直接活化PS过程本身不受络合剂和铁离子的影响, 因此该过程在UV/PS/草酸/Fe2+体系中也对PS活化分解发挥了重要作用.此外, 反应180 min时ηPS为0.389远大于UV/PS/草酸/Fe2+体系(0.118), 这表明UV/PS体系中活化产生的SO 4· -参与的副反应较少, 能更充分地被苯胺分子利用.
综上所述, 在UV/PS/草酸/Fe2+反应体系中, UV可通过多种作用促进苯胺的降解, 但最终的去除效果并不是各种作用的简单叠加组合, 例如UV/PS/草酸/Fe2+反应体系中的苯胺降解率远低于UV/PS体系和UV/草酸/Fe2+体系中的苯胺去除率之和.这是因为在UV/PS/草酸/Fe2+反应体系中, 各个单独的反应体系之间会产生相互影响, 例如C2O42-的加入会消耗部分UV/PS体系中产生的自由基, 同时UV促进转化生成的Fe2+及其活化PS产生了的SO 4· -又会与UV/PS体系中产生的SO 4· -发生相互淬灭.同时, 由于反应初始的PS浓度远高于UV/草酸/Fe2+光化学反应过程产生的H2O2浓度, 因此PS对Fe2+具有更强的竞争力, 降低了通过发生Fenton反应氧化苯胺的效率.然而, 通过对比不同体系反应120 min时的PS分解率仍可发现, UV/PS/草酸/Fe2+体系中的PS分解率(98%)远远大于UV/PS(18%)和PS/草酸/Fe2+体系(31%)中PS分解率之和, 由此推断, 在UV/PS/草酸/Fe2+体系中, 通过促进Fe2+转化仍是强化PS活化分解和苯胺降解的首要原因, 但同时由于发生了激烈的副反应, 导致PS效率显著降低.
3.3 反应条件对PS活化及苯胺降解的影响 3.3.1 初始pH的影响本研究考察了初始pH分别为3、5、7、9条件下UV/草酸/Fe2+/PS体系中的PS活化和苯胺降解效果.结果显示(图 6), 酸性条件下的PS活化分解速率明显大于中碱性条件, 并且从反应开始阶段就开始迅速活化, 而在中碱性条件下, PS在快速分解之前经历了一个缓慢分解阶段, 且随着初始pH升高, 缓慢阶段持续时间增加.另外, 当初始pH=5时, PS活化分解率仅在反应前60 min低于pH=3的反应体系, 随后PS活化分解率差距逐渐缩小, 并在反应90 min后超过了pH=3的反应体系.通过检测反应过程中的pH变化发现, 因为反应过程中未对pH进行缓冲控制, 同时由于PS活化分解是一个释放H+的过程(Lin et al., 2014), 当初始pH分别为3、5、7、9时, 反应120 min后溶液pH分别下降到1.75、2.34、2.79和3.87.同时有研究(Balmer et al., 1999; Kusic et al., 2011)指出, 溶液中C2O42-与Fe3+在不同pH条件下会以Fe(OH)3、Fe(OH)2+、Fe(C2O4)+、Fe(C2O4)2-, Fe(C2O4)33-等形式存在, 且在强酸性和中碱性条件下, 不利于Fe(C2O4)33-和Fe(C2O4)2-等具有较强光化学活性的铁离子络合物形成.由此推断, 当初始pH分别为7、9时, 起始阶段通过光化学反应生成Fe2+的速率较低, 但随着初始Fe2+以及UV直接活化分解PS降低了溶液pH, Fe(C2O4)33-和Fe(C2O4)2-等铁离子络合物浓度逐渐增大, Fe2+转化效率也随之增加, 促进了后续的PS活化过程.而在pH=3条件下, 反应体系pH进一步降低影响了具有较强光化学活性的铁离子络合物形成, 从而降低了Fe2+生成速率和PS活化速率.上述结果再次证明Fe2+转化过程是促进UV/草酸/Fe2+/PS体系中PS活化的关键原因.苯胺降解结果显示, 反应180 min后的苯胺的降解率大小顺序为pH=9 < pH=7 < pH=3 < pH=5, 与PS活化速率的大小顺序一致, 此时pH=5反应体系中的PS活化率和苯胺降解率分别为73%和86%.
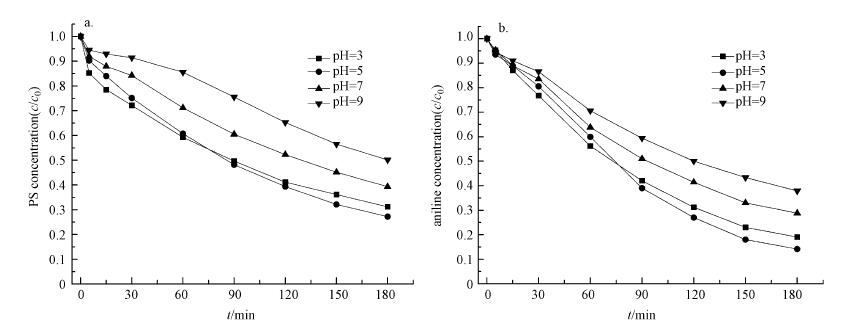 |
| 图 6 不同pH反应体系中PS (a)及苯胺(b)浓度的变化 (反应条件:c[PS]0=10 mmol · L-1, c[Fe2+]0=2.5 mmol · L-1, c[草酸]0=2.5 mmol · L-1, c[苯胺]0= 1.25 mmol · L-1) Fig. 6 PS (a) and Aniline (b) concentration variation in processes with different initial pH |
由于草酸根离子与铁离子的络合系数为3, 为了更直观反映草酸浓度的影响, 本研究考察了草酸浓度分别为0.5、1.5、2.5、3.5、5 mmol · L-1等Fe2+未充分络合条件下PS活化和苯胺降解情况.结果显示(图 7), 随着草酸浓度的增加, PS活化效果不断增强, 且当浓度为5 mmol · L-1时, PS在反应150 min后可被彻底活化分解.这是因为随着草酸浓度增加, 形成的草酸络合铁离子浓度也随之增大, 当草酸浓度达到一定程度时, 更多的草酸根离子可按照3个草酸根离子与1个Fe3+形成六配位络合物的方式形成Fe(C2O4)33-, 此时反应体系的光化学反应活性进一步增强.然而, 由于高浓度的草酸同时对部分自由基产生了更强烈的竞争消耗, 导致草酸浓度为3.5和5 mmol · L-1的反应体系虽然可更有效活化分解PS, 但苯胺降解率却出现下降, 不同反应体系中苯胺降解率大小顺序为0.5 < 5 < 1.5 < 3.5 < 2.5 mmol · L-1.
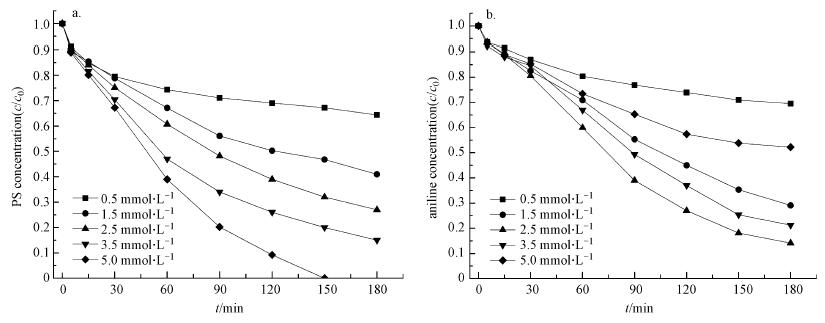 |
| 图 7 不同草酸浓度反应体系PS (a)及苯胺(b)浓度的变化 (反应条件:初始pH=5, c[PS]0=10 mmol · L-1, c[Fe2+]0=2.5 mmol · L-1, c[苯胺]0= 1.25 mmol · L-1) Fig. 7 PS (a) and Aniline (b) concentration variation in processes with different oxalic acid concentration |
本研究考察了紫外光强度分别为28、44、75、117 μW · cm-2时, 草酸络合Fe2+活化PS及苯胺的降解效果.结果显示(图 8), 由于增加光强度可以有效提高草酸络合Fe3+的光化学反应速率, 同时也强化了UV光照直接活化分解PS的速率, 因此PS活化速率与苯胺的降解率均随紫外光强度增加不断提高, 且当紫外光强度为117 μW · cm-2时, PS在反应150 min时即可完全活化分解, 此时苯胺亦可被彻底氧化降解.
 |
| 图 8 不同UV光照强度反应体系中PS (a)及苯胺(b)浓度的变化 (反应条件:初始pH=5, c[PS]0=10 mmol · L-1, c[Fe2+]0=2.5 mmol · L-1, c[草酸]0=2.5 mmol · L-1, c[苯胺]0= 1.25 mmol · L-1) Fig. 8 PS (a) and Aniline (b) concentration variation in processes with different UV irradiation intensity |
1) UV光照显著促进了草酸络合Fe2+活化PS氧化降解苯胺的效果, 但自由基参与的副反应也随之加强, 导致PS有效利用率出现一定程度的降低.
2) 在UV/草酸络合Fe2+活化PS氧化降解苯胺过程中, UV、UV/草酸/Fe2+、UV/PS等反应体系均对苯胺有一定的去除效果, 但通过UV促进Fe3+向Fe2+转化从而持续活化PS是提高苯胺降解效果的首要作用机制.
3) UV/草酸络合Fe2+活化PS体系对初始pH具有较好的适应性, 即使在初始pH为中碱性条件下, PS也可被有效活化;增加草酸浓度可显著促进PS活化分解, 但过量浓度草酸会降低苯胺去除率;紫外光照强度增大会显著促进PS的活化分解和苯胺的分解.
Balmer M E, Sulzberger B. 1999. Atrazine degradation in irradiated iron oxalate systems:Effects of pH and oxalate[J]. Environmental Science & Technology, 33(14): 2418–2424.
|
Crimi M L, Taylor J. 2007. Experimental evaluation of catalyzed hydrogen peroxide and sodium persulfate for destruction of BTEX contaminants[J]. Soil and Sediment Contamination:An International Journal, 16(1): 29–45.
DOI:10.1080/15320380601077792
|
Cui H, Gu X, Lu S, et al. 2017. Degradation of ethylbenzene in aqueous solution by sodium percarbonate activated with EDDS-Fe(Ⅲ) complex[J]. Chemical Engineering Journal, 309: 80–88.
DOI:10.1016/j.cej.2016.10.029
|
Devi P, Das U, Dalai A K. 2016. In-situ chemical oxidation:Principle and applications of peroxide and persulfate treatments in wastewater systems[J]. Science of the Total Environment, 571: 643–657.
DOI:10.1016/j.scitotenv.2016.07.032
|
Dong H, Qiang Z, Hu J, et al. 2017. Accelerated degradation of iopamidol in iron activated persulfate systems:Roles of complexing agents[J]. Chemical Engineering Journal, 316: 288–295.
DOI:10.1016/j.cej.2017.01.099
|
Fordham J W L, Williams H L. 1951. The persulfate-iron(Ⅱ) initiator system for free radical polymerizations[J]. Journal of the American Chemical Society, 73(10): 4855–4859.
DOI:10.1021/ja01154a114
|
Furman O S, Teel A L, Watts R J. 2010. Mechanism of base activation of persulfate[J]. Environmental Science & Technology, 44(16): 6423–6428.
|
Han D, Wan J, Ma Y, et al. 2015. New insights into the role of organic chelating agents in Fe(Ⅱ) activated persulfate processes[J]. Chemical Engineering Journal, 269(Supplement C): 425–433.
|
Huang K C, Couttenye R A, Hoag G E. 2002. Kinetics of heat-assisted persulfate oxidation of methyl tert-butyl ether (MTBE)[J]. Chemosphere, 49(4): 413–420.
DOI:10.1016/S0045-6535(02)00330-2
|
Imoberdorf G, Mohseni M. 2012. Kinetic study and modeling of the vacuum-UV photoinduced degradation of 2, 4-D[J]. Chemical Engineering Journal, 187: 114–122.
DOI:10.1016/j.cej.2012.01.107
|
Jiang X X, Wu Y L, Wang P, et al. 2013. Degradation of bisphenol A in aqueous solution by persulfate activated with ferrous ion[J]. Environmental Science and Pollution Research, 20(7): 4947–4953.
DOI:10.1007/s11356-013-1468-5
|
Khan J A, He X, Shah N S, et al. 2014. Kinetic and mechanism investigation on the photochemical degradation of atrazine with activated H2O2, S2O82- and HSO5[J]. Chemical Engineering Journal, 252: 393–403.
DOI:10.1016/j.cej.2014.04.104
|
Killian P F, Bruell C J, Liang C, et al. 2007. Iron (Ⅱ) activated persulfate oxidation of MGP contaminated Soil[J]. Soil and Sediment Contamination:An International Journal, 16(6): 523–537.
DOI:10.1080/15320380701623206
|
Kolthoff I M, Miller I K. 1951. The chemistry of persulfate. Ⅰ. the kinetics and mechanism of the decomposition of the persulfate ion in aqueous medium1[J]. Journal of the American Chemical Society, 73(7): 3055–3059.
DOI:10.1021/ja01151a024
|
Kusic H, Peternel I, Ukic S, et al. 2011. Modeling of iron activated persulfate oxidation treating reactive azo dye in water matrix[J]. Chemical Engineering Journal, 172(1): 109–121.
DOI:10.1016/j.cej.2011.05.076
|
Liang C, Bruell C J, Marley M C, et al. 2004a. Persulfate oxidation for in situ remediation of TCE. Ⅱ. Activated by chelated ferrous ion[J]. Chemosphere, 55(9): 1225–1233.
DOI:10.1016/j.chemosphere.2004.01.030
|
Liang C J, Bruell C J, Marley M C, et al. 2004b. Persulfate oxidation for in situ remediation of TCE. Ⅰ. Activated by ferrous ion with and without a persulfate-thiosulfate redox couple[J]. Chemosphere, 55(9): 1213–1223.
DOI:10.1016/j.chemosphere.2004.01.029
|
Liang C J, Huang C F, Mohanty N, et al. 2008. A rapid spectrophotometric determination of persulfate anion in ISCO[J]. Chemosphere, 73(9): 1540–1543.
DOI:10.1016/j.chemosphere.2008.08.043
|
Lin C C, Wu M S. 2014. Degradation of ciprofloxacin by UV/S2O82- process in a large photoreactor[J]. Journal of Photochemistry and Photobiology A:Chemistry, 285(0): 1–6.
|
Medina R, David Gara P M, Fernández-González A J, et al. 2018. Remediation of a soil chronically contaminated with hydrocarbons through persulfate oxidation and bioremediation[J]. Science of the Total Environment, 618: 518–530.
DOI:10.1016/j.scitotenv.2017.10.326
|
Tamura H, Goto K, Yotsuyanagi T, et al. 1974. Spectrophotometric determination of iron(Ⅱ) with 1, 10-phenanthroline in the presence of large amounts of iron(Ⅲ)[J]. Talanta, 21(4): 314–318.
DOI:10.1016/0039-9140(74)80012-3
|
Tsitonaki A, Petri B, Crimi M, et al. 2010. In Situ chemical oxidation of contaminated soil and groundwater using persulfate:A review[J]. Critical Reviews in Environmental Science and Technology, 40(1): 55–91.
DOI:10.1080/10643380802039303
|
Xu X, Li X. 2010. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion[J]. Separation and Purification Technology, 72(1): 105–111.
DOI:10.1016/j.seppur.2010.01.012
|
Yang S, Wang P, Yang X, et al. 2010. Degradation efficiencies of azo dye Acid Orange 7 by the interaction of heat, UV and anions with common oxidants:Persulfate, peroxymonosulfate and hydrogen peroxide[J]. Journal of Hazardous Materials, 179(1/3): 552–558.
|
Yu S, Gu X, Lu S, et al. 2018. Degradation of phenanthrene in aqueous solution by a persulfate/percarbonate system activated with CA chelated-Fe(Ⅱ)[J]. Chemical Engineering Journal, 333: 122–131.
DOI:10.1016/j.cej.2017.09.158
|
Zhao D, Liao X Y, Yan X L, et al. 2013. Effect and mechanism of persulfate activated by different methods for PAHs removal in soil[J]. Journal of Hazardous Materials, 254: 228–235.
|
Zuo Y, Hoigne J. 1992. Formation of hydrogen peroxide and depletion of oxalic acid in atmospheric water by photolysis of iron(Ⅲ)-oxalato complexes[J]. Environmental Science & Technology, 26(5): 1014–1022.
|
左传梅. 2012. Fe(Ⅱ)活化过硫酸盐高级氧化技术处理染料废水研究[D]. 重庆: 重庆大学
|
 2018, Vol. 38
2018, Vol. 38


