2. 清华大学深圳研究生院, 深圳 518055
2. Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055
水下生产系统对装配空间和承载能力限制极少, 是经济高效开发深海油田和边际油田的重要技术, 水下油田注水处理系统开发的重要性也日益凸显(Robinson, 2010).腐生菌、铁细菌和硫酸盐还原菌等微生物的存在可能会引起注水设备与管线的腐蚀, 堵塞管道, 造成安全隐患;此外, 微生物的活动也可能导致油田内产气增加, 开采效率降低(辛青, 2009).因此, 有必要开发高效可靠的水下杀菌技术以保证水下注水系统的高效性和稳定性.
陆上油田注水系统常采用化学方式对注水进行消毒, 但深海环境具有低温高压的特点, 且生态环境复杂多变, 易被化学物质破坏(Zheng et al., 2016).紫外线杀菌方法与传统杀菌方法相比具有广谱性, 且不需要投加化学药剂, 不产生有害消毒副产物, 能够满足水下石油注水清洁高效的要求(Jenny et al., 2015).紫外LED作为新型紫外光源, 可以发射特定杀菌波长的紫外光, 其波长的多样性使得选择高效灭菌波段成为可能, 且相比于传统汞灯能耗更低, 使用寿命更长(Sholtes et al., 2016;Wurtele et al., 2011).此外, 紫外LED无汞环保、结构便携、低功耗、低电压等优点使其相较于易碎的传统汞灯更适合应用于深海环境.
目前, 关于紫外LED消毒效果的研究多集中于小型生活饮用水或市政污水处理, 对油田注水的相关研究较少.紫外线对微生物的灭活曲线是消毒工艺设计运行的基础, 但紫外LED的造价、使用寿命及电光转换效率仍是限制其广泛应用的主要原因(Lui et al., 2016;Song et al., 2016).由于不同波长紫外LED的电光转换效率差异较大, 有必要考察达到相同消毒效果时各波长紫外LED所需能耗, 以确保达到目标灭活率的同时耗能最低.除了能耗因素的影响, 水质因素会改变紫外线透射率和细菌分布进而影响紫外LED的消毒效果(Chevremont et al., 2012a;Ho et al., 1998);此外, 由于不同波段的紫外光的穿透能力存在差异, 不同波长紫外LED受水质因素影响的程度也可能对消毒效果造成影响.
本文拟利用255、280、350 nm 3种波长的紫外LED对腐生菌、铁细菌、硫酸盐还原菌进行消毒效果研究, 探究紫外LED应用于深海石油注水的可行性, 并在此基础上, 分析能耗因素和颗粒物、铁离子浓度、微生物负荷3种水质因素对不同紫外LED灭活腐生菌的消毒效果影响, 从而为紫外LED在深海油田注水消毒方向的工程应用提供理论参考和技术支持.
2 材料与方法(Materials and methods) 2.1 实验装置与操作条件实验装置如图 1所示, 将20 mL菌液置于Ø 50 mm的加盖石英培养皿中, 紫外LED与水样表面的距离为1 cm, 照射过程中使用磁力搅拌器匀速搅拌, 搅拌速度为菌液表面不出现涡旋的最大转速.为避免紫外LED发热导致的光通量下降, 实验过程中使用风扇对紫外LED进行冷却.
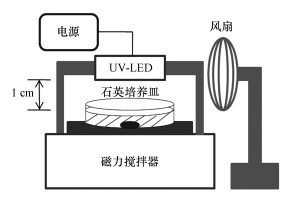 |
| 图 1 紫外LED消毒装置示意图 Fig. 1 Scheme of the UV-LEDs irradiation device |
实验中使用中心波长分别为255、280和350 nm的3颗UVClean大功率紫外LED灯珠(Sensor Electronic Technology, Inc.)进行消毒实验研究, 使用QDUV-200直流电源(Sensor Electronic Technology, Inc.)供电.实验中各紫外LED的光学及能耗参数如表 1所示.
| 表 1 消毒实验所用紫外LED主要光学及能耗参数 Table 1 Optical and electrical energy properties of UV-LEDs used during disinfection experiments |
实验所用紫外线剂量D(mJ·cm-2)由平均紫外强度I(mW·cm-2)与照射时间t(s)的乘积得出.虽然未采用准平行辐射装置, 但使用草酸铁钾化学光露计测量平均紫外强度, 可直接得到溶液吸收的紫外辐射剂量, 不必进行反射等条件的校准(Oguma et al., 2016).每次取30 mmol·L-1的草酸铁钾溶液20 mL置于加盖石英培养皿中, 分别在各波长紫外LED下接受1~4 min的辐射.每次照射结束后取1 mL草酸铁钾溶液与1.5 mL缓冲溶液(0.05 mol·L-1 H2SO4, 0.1 mol·L-1CH3COONa)、2 mL邻菲咯啉溶液混合, 并将混合溶液稀释至总体积20 mL后静置30 min, 测量混合液在510 nm处的吸光度.所有操作均在暗室条件下进行.使用草酸铁钾化学光露计测量平均紫外强度的计算公式如下所示(Chevremont et al., 2012a).
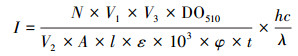
|
(1) |
式中, N为阿伏伽德罗常数, V1为照射样品体积(cm3), V2为用于光露计反应的被辐射样品体积(cm3), V3为光露计反应后所得检测样品体积(cm3), A为受辐射的液体面积(cm2), l为受辐射样品的光学路径长度(cm), DO5 10为光露计反应后所得混合液在510 nm下的吸光度, ε为络合产物邻二氮杂菲亚铁在510 nm的摩尔吸光系数(11100 mol-1·L1·cm-1), φ为紫外光源的量子产率, t为紫外线照射时间(s), h为普朗克常数, c为光速(m·s-1), λ为紫外光源的中心波长(nm).测量结果显示, 实验过程中各波长紫外LED平均紫外强度均无明显衰减.平均辐射强度测量结果使用碘化钾-碘酸钾化学光露计进行校准, 结果无显著差异(Goldstein et al., 2008;Bolton et al., 2011).
2.2 实验水样腐生菌和铁细菌从取自徐闻的海水分离纯化所得, 硫酸盐还原菌从深圳西丽再生水厂进水中分离纯化所得.3种细菌经液体培养基富集后, 经6000 r·min-1离心5 min, 弃去上清液, 将沉淀物重新溶解于无菌生理盐水中, 配置成浓度为107 cfu·mL-1的菌液, 并根据实验需要进一步稀释为103 cfu·mL-1或105 cfu·mL-1的实验水样.此外, 向实验水样中投加高岭土或FeCl3调节实验水样中高岭土浓度(0~75 mg·mL-1)及Fe3+浓度(0~1.5 mg·L-1), 考察水质因素对紫外LED消毒效果的影响.实验中所有水样均使用Milli-Q超纯水配置.
腐生菌的计数采用平板计数法, 铁细菌和硫酸盐还原菌的计数采用SY/T 5329-2012《碎屑岩油藏注水水质指标及分析方法》中规定的绝迹稀释法.每项独立实验均设置一组未照射空白样本以减少培养基污染带来的误差.紫外线透射率采用岛津UV-1780紫外-可见光光度计进行检测.
2.3 数据分析与表达细菌灭活效率以对数灭活率lg(N0/Nt)表示, 其中, N0是受辐射水样的初始细菌浓度, Nt是经过照射时间t后水样中的细菌浓度.根据Chick-Watson定律, 对数灭活率与紫外线剂量J之间呈线性关系, 灭活速率常数kD的计算公式如式(2)所示(Hijnen et al., 2006).
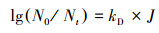
|
(2) |
使用单位消毒效果能耗(EEO)表示达到单位对数灭活率所需能耗(kWh·m-3), 其计算公式如式(3)所示(Beck et al., 2017).
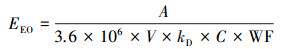
|
(3) |
式中, A为受辐射面积(cm2), V为样品体积(cm3), kD为对数灭活速率(cm2·mJ-1), C为紫外LED的电光转换效率, 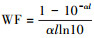
各消毒实验均独立重复至少3次, 所得结果以平均值±标准差的形式表示.实验数据的统计分析采用SPSS 20软件进行.
3 结果与讨论(Results and discussion) 3.1 波长与照射剂量对紫外LED消毒效果的影响使用255、280、350 nm紫外LED在不同照射时间(54、107、160、214、267 s)下对微生物含量约为105 cfu·mL-1的实验水样进行消毒实验, 考察紫外线波长和照射剂量对腐生菌、铁细菌、硫酸盐还原菌消毒效果的影响.为避免平均紫外强度差异带来的偏差, 分别使用80、23、15 mA的电流驱动255、280和350 nm紫外LED, 使其平均紫外强度均为0.051 mW·cm-2 (Bowker et al., 2011;Sommer et al., 1998).同时, 考察了驱动电流均为80 mA时各波长紫外LED对3种细菌的消毒效果.以上实验均在25 ℃室温下进行, 每次实验均设置一组不接受紫外辐射的菌液作为空白样, 实验前后空白样品中细菌含量无显著变化.各工作情况下紫外LED对腐生菌、铁细菌、硫酸盐还原菌的灭活曲线如图 2所示.此外, 以照射剂量为基准的灭活速率常数kD可以客观地评价各波长紫外线对腐生菌、铁细菌和硫酸盐还原菌的灭活效率.结合表 1中各紫外LED在不同工况下的平均紫外强度及其照射时间-对数灭活率曲线计算各工况下3种紫外LED的kD值并列于表 2.
 |
| 图 2 各波长紫外LED的照射时间-对数灭活率关系曲线(a.腐生菌, b.铁细菌, c.硫酸盐还原菌) Fig. 2 Log reduction of saprophytic bacteria (a), iron bacteria (b) and sulfate reducing bacteria (c) vs. UV Dose |
| 表 2 腐生菌、铁细菌、硫酸盐还原菌的灭活速率常数kD (Mean±SD) Table 2 Inactivation rate constants (kD) of saprophytic bacteria, iron bacteria and sulfate reducing bacteria |
不同波长紫外线的时间-响应曲线存在显著差异.3种波长紫外LED对腐生菌的对数灭活率与照射时间(图 2a)具有良好的线性关系(R2 > 0.98), 仅255 nm的灭活曲线在较高剂量时出现轻微的拖尾现象, 即在较高剂量时, 照射剂量对消毒效果的影响减弱, 灭活曲线趋于平缓.这可能是由于细菌种群分布不均匀, 造成部分细菌被隐蔽后无法被紫外线照射到(兰效宁等, 2014;Loge et al., 2001).对比280 nm紫外LED分别使用23 mA和80 mA电流驱动时的剂量响应数据发现, 驱动电流为23 mA时280 nm紫外LED的kD值可达到0.194, 而驱动电流为80 mA时则降为0.156, 说明280 nm紫外线在照射剂量升高后也会出现拖尾现象.造成这一现象除了细菌种群的分布原因外, 还可能是由于使用80 mA电流驱动的280 nm紫外LED平均紫外强度较高, 而水样菌液浓度较低, 造成了光能的浪费.综合对比350 nm紫外LED在15 mA和80 mA的kD值可以发现, 350 nm紫外LED的消毒曲线在高剂量时也会出现拖尾.
对比图 2a中各紫外LED平均紫外强度相同时的灭活曲线可以客观评价各波长紫外线对腐生菌的消毒效率:255 nm紫外线的灭活效率高于280 nm紫外线, 对数灭活率达到3, 255 nm紫外线仅需8.5 mJ·cm-2的照射剂量, 而280 nm紫外线则需要15.5 mJ·cm-2;350 nm紫外线的消毒效果则极弱, 经过13.6 mJ·cm-2的照射后对数灭活率仍未达到0.5.这是因为255 nm和280 nm所在的UVC波段是起消毒作用的主要紫外波段, 通过攻击微生物体内的DNA和RNA, 阻碍细胞分裂和复制的进行, 从而对微生物造成致死性损伤, 而DNA在260 nm附近存在吸收峰, 因此, 腐生菌的DNA和RNA对255 nm紫外线更敏感(Chen et al., 2009;Sinha et al., 2002).350 nm紫外线主要通过破坏tRNA使其丧失转运能力以造成微生物延迟生长等亚致死伤害(Oppezzo et al., 2001);虽然该波长紫外线还能够通过光化学氧化产生过氧化氢或羟基自由基等活性粒子对微生物造成致死性伤害, 但对微生物的灭活效率远低于UVC波段(Lui et al., 2016).驱动电流相同时各紫外LED输入功率相近, 对比该条件下的时间-响应曲线可以从能耗与消毒效率两方面综合评价紫外LED的消毒效果:350 nm紫外LED使用80 mA和15mA电流驱动的消毒效果没有显著差异;80 mA电流驱动的280 nm紫外LED照射使对数灭活率达到3虽然需要19.2 mJ·cm-2, 但其所需照射时间(105 s)远小于255 nm紫外LED所需时间(181 s).
铁细菌和硫酸盐还原菌对255 nm紫外LED的灭活曲线与腐生菌相似, 在剂量较高时出现拖尾现象;对比280 nm紫外LED分别以23、80 mA电流驱动和350 nm紫外LED分别以15、80 mA电流驱动时的kD值, 可以发现280 nm和350 nm紫外线的灭活曲线在高剂量时也出现拖尾现象.对比图 2b和图 2c中各波长紫外LED平均紫外强度相同时的灭活曲线, 可以发现255 nm紫外线对铁细菌的灭活能力强于280 nm紫外线, 二者对数灭活率达到3所需剂量分别为9.3 mJ·cm-2和13.2 mJ·cm-2;硫酸盐还原菌对255 nm和280 nm紫外线的灭活曲线则与腐生菌和铁细菌存在较大差异, 虽然255 nm紫外线对于硫酸盐还原菌的灭活速率常数略高于280 nm紫外线, 但该差异不具有统计学意义(p>0.05), 二者使对数灭活率达到3均需约10 mJ·cm-2的照射剂量, 这可能是由于硫酸盐还原菌的DNA吸收峰位于255 nm与280 nm之间;此外, 350 nm紫外线对于铁细菌的灭活能力显著高于对腐生菌和硫酸盐还原菌的灭活能力, 经过13.6 mJ·cm-2的照射后可以使对数灭活率达到0.89, 这可能是由于腐生菌的细胞结构更容易受到350 nm紫外线的破坏.而紫外LED驱动电流相同时, 280 nm紫外LED对铁细菌和硫酸盐还原菌达到一定灭活率所需的时间远小于255 nm和350 nm紫外LED.
上述结果说明不同波长的紫外线对不同菌种的灭活效果存在差异.255 nm紫外线对腐生菌、铁细菌和硫酸盐还原菌的灭活能力依次递减, 280 nm紫外线对这3种细菌的灭活能力则依次递增;此外, 350 nm紫外线对3种细菌的灭活能力都显著弱于255 nm和280 nm紫外线.如果仅考虑波长与照射剂量的影响因素, 255 nm紫外线对腐生菌、铁细菌和硫酸盐还原菌的灭活效率最高.当水样中细菌浓度为104~105 cfu·mL-1时, 15 mJ·cm-2的255 nm紫外线照射剂量绝大多数情况下可保证处理后水样中细菌浓度满足SY/T 5239-2012中对处理水作为油藏注水的要求.但当综合考虑照射时间、能量消耗等消毒成本时, 280 nm紫外LED在80 mA电流驱动条件下对腐生菌、铁细菌和硫酸盐还原菌的消毒效果都要显著优于255 nm和350 nm紫外LED.
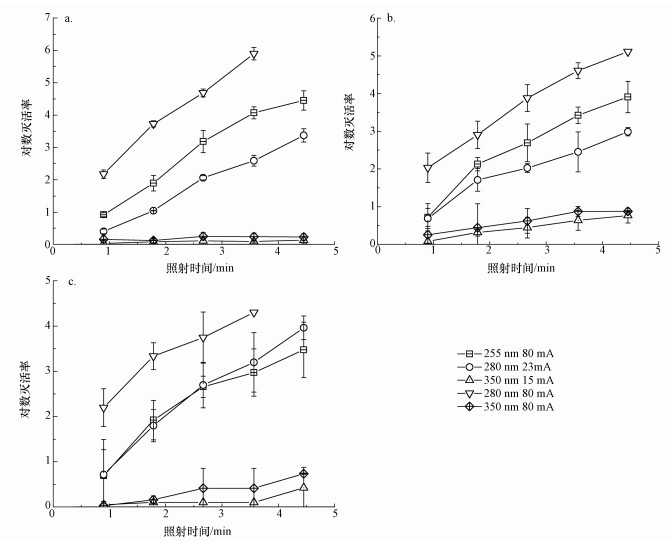
3.2 能耗对紫外LED消毒效率的影响由图 3可知, 各波长紫外LED的EEO具有显著差异.280 nm紫外LED对腐生菌、铁细菌、硫酸盐还原菌的的单位灭活率能耗都显著低于255 nm紫外LED, 这主要是由各紫外LED之间的电光转换效率差异造成的(王军喜等, 2015;Rantalankila et al., 2016).在平均紫外强度相同时, 255 nm紫外线对微生物的灭活效率最高, 其对腐生菌、铁细菌和硫酸盐还原菌的灭活速率常数分别为280 nm紫外线的1.82、1.42、1.02倍, 但实验中所使用的255 nm紫外LED的电光转换效率仅为280 nm紫外LED的1/4.在驱动电流相同时, 虽然280 nm紫外LED对腐生菌、铁细菌和硫酸盐还原菌的灭活速率常数由于细菌灭活曲线的拖尾现象较23 mA驱动电流条件有所下降, 导致EEO的小幅升高, 但仍显著低于255 nm紫外LED.除了经济性优势外, 在实验中还发现, 280 nm紫外LED还可抑制微生物的光复活与暗修复, 改善紫外线消毒过程中的常见弊端(Li et al., 2017).这主要是由于蛋白质在280 nm附近存在吸收峰, 280 nm紫外线的照射可能会对修复酶等结构造成破坏, 从而抑制细菌的复活(Chevremont et al., 2012b).
 |
| 图 3 255、280和350 nm紫外LED对腐生菌、铁细菌、硫酸盐还原菌的单位灭活率能耗 Fig. 3 Electrical energy per order (EEO) of reduction of saprophytic bacteria, iron bacteria and sulfate reducing bacteria for the three UV LEDs |
350 nm紫外线对细菌的灭活能力显著弱于255和280 nm紫外线, 但350 nm紫外LED由于制造技术成熟, 电光转换效率可达到255 nm紫外LED的10倍及280 nm紫外LED的2.5倍.当处理腐生菌或硫酸盐还原菌这类对350 nm紫外线不敏感的菌种时, 由于350 nm紫外线和255 nm紫外线对细菌的灭活速率常数相差10倍以上, 350 nm紫外LED的低能耗很难弥补其灭活效率低的缺点;而当处理铁细菌时, 虽然各紫外LED平均紫外强度相同时350 nm紫外LED的EEO甚至能够高于255 nm紫外LED, 但进一步增加照射剂量却未能显著加强350 nm紫外线的灭活作用, 导致80 mA电流驱动的350 nm紫外LED的EEO显著高于255和280 nm紫外LED.综合考虑消毒效率与所需能耗, 由于350 nm紫外LED对腐生菌、铁细菌和硫酸盐还原菌的灭活能力有限, 不适宜用于深海油田注水杀菌.
3.3 水质因素对紫外LED消毒效果的影响为了准确评估适宜用于深海石油注水杀菌的紫外LED的杀菌效果, 考察了颗粒物浓度、铁离子浓度对255、280 nm紫外线透射率的影响, 并考察颗粒物浓度、铁离子浓度及细菌初始浓度单独作用时对255、280 nm紫外LED灭活腐生菌效果的影响.
3.3.1 颗粒物和铁离子浓度对紫外线透射率的影响颗粒物和铁离子浓度对255和280 nm紫外线透射率的影响如图 4所示.由图可见, 255和280 nm紫外线透射率与颗粒物和铁离子均呈现强线性关系(R2 > 0.98), 随颗粒物及铁离子浓度的增加紫外线透射率均出现了明显下降.当颗粒物浓度从0 mg·L-1增加至75 mg·L-1, 255 nm紫外线透射率从99.66%降至57.12%, 280 nm紫外线透射率从99.76%降至58.21%;当铁离子浓度从0 mg·L-1增加至1.5 mg·L-1, 255 nm紫外线透射率从99.79%降至97.41%, 280 nm紫外线透射率从99.85%降至97.34%.此外, 颗粒物和铁离子浓度对255和280 nm紫外线透射率的影响不存在显著差异, 这可能是因为二者波长相近, 水质因素对其穿透力的影响并无明显差异.
 |
| 图 4 颗粒物和铁离子对紫外线透射率的影响 Fig. 4 Effects of particulates and ferric ion on UV transmittance |
由于不同波长紫外LED的电光转换效率存在差异, 综合杀菌效率和能耗的影响, 使用255、280 nm的紫外LED以80 mA的驱动电流在不同照射时间(54、107、160、214、267 s)下对腐生菌含量相同但颗粒物、铁离子浓度不同的实验水样进行消毒实验, 从而考察颗粒物和铁离子浓度对不同波长紫外LED消毒效果的影响.
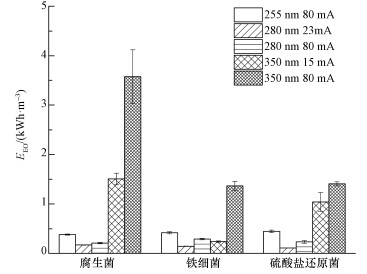
颗粒物主要通过两种方式影响紫外消毒的效果:①通过吸收或散射紫外光, 增加紫外线光程, 降低紫外线透过率, 使可用于杀菌的紫外剂量减少;②细菌可能吸附到颗粒物表面或隐藏于颗粒物内部, 这种富集作用会使颗粒物为细菌提供屏蔽作用, 导致细菌无法被紫外线照射到从而难以被杀灭(Cantwell et al., 2011;张永吉等, 2006;孙文俊等, 2008).颗粒物浓度对紫外LED灭活腐生菌效果的影响如图 5所示.使用255 nm紫外LED对细菌浓度为6.6×105 cfu·mL-1的样品进行消毒实验(图 5a), 可以发现, 在各浓度下均出现拖尾现象;使用280 nm紫外LED对细菌浓度为4.63×105 cfu·mL-1的样品进行消毒实验(图 5b), 则发现在不同颗粒物浓度条件下的灭活曲线则均表现出良好的线性关系.此外, 从图 5中还可以发现, 颗粒物浓度在30 mg·L-1以下时, 剂量响应曲线之间的差异较小;颗粒物浓度为75 mg·L-1时的剂量-响应曲线与颗粒物浓度低于30 mg·L-1时的剂量-响应曲线差异较大.这种现象可能是由于颗粒物浓度达到75 mg·L-1时, 水样浊度大幅上升, 紫外线透射率显著降低, 使实际可用于杀菌的紫外线照射剂量显著减少;同时, 高浓度颗粒物为腐生菌提供了更多的屏蔽作用, 使得隐藏在颗粒物周围的细菌无法被杀灭.
 |
| 图 5 颗粒物浓度对不同波长紫外LED (80 mA驱动电流)灭活腐生菌的影响(a. 255 nm紫外LED, b.280 nm紫外LED) Fig. 5 Effect of particulates on disinfection efficiency of saprophytic bacteria using UV LEDs |
铁离子也会对紫外LED消毒效果产生影响:一方面, Fe3+是紫外线的强吸收体, 其存在会降低紫外线透射率(Ho et al., 1998);另一方面, 由于水体中的Fe3+易形成絮体, 细菌易聚集或被吸附至多孔絮体内, 絮体对细菌的包裹作用也会使部分细菌不易受到紫外线的伤害(郭美婷等, 2007).铁离子浓度对紫外LED灭活腐生菌效果的影响如图 6所示.使用255 nm紫外LED对细菌浓度为2.86×105 cfu·mL-1的样品进行消毒实验(图 6a), 使用280 nm紫外LED对细菌浓度为3.8×105 cfu·mL-1的样品进行消毒实验(图 5b), 可以发现, 在研究范围内的铁离子浓度对灭活效果的影响并不显著.这是由于实验研究范围内Fe3+对紫外线透射率影响较小, 对可用于杀菌的紫外线剂量未产生显著影响;另一方面, 由于Fe3+絮体对细菌的包裹作用有限, 提升Fe3+浓度无法使其对紫外消毒效果的影响也相应提升.
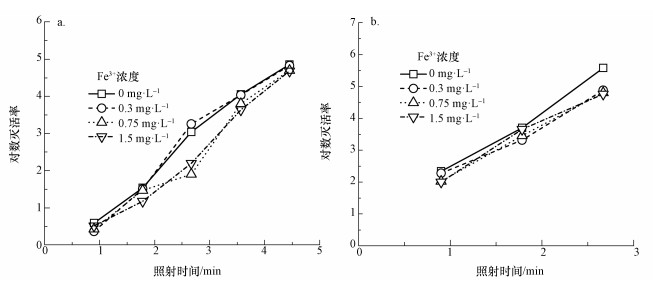 |
| 图 6 铁离子浓度对不同波长紫外LED (80 mA驱动电流)灭活腐生菌的影响(a.255 nm紫外LED, b.280 nm紫外LED) Fig. 6 Effect of ferric ion on disinfection efficiency of saprophytic bacteria using UV LEDs |
综合考察颗粒物与铁离子浓度对不同波长紫外LED灭活腐生菌效果的影响与二者对紫外线透射率的影响, 发现颗粒物和铁离子主要通过影响紫外线透射率对腐生菌的灭活效果产生影响, 在紫外线透射率高于80%时, 这种影响对腐生菌的剂量响应曲线影响不大;而在透射率进一步下降时, 这种影响会导致紫外线灭活效果的明显弱化.此外, 由于铁离子和颗粒物对255和280 nm紫外线透射率的影响程度相近, 二者对255和280 nm紫外LED的消毒效果影响程度也相近.对于深海石油注水, 如果直接使用海水作为注水水源, 由于其水质较为稳定且紫外线透射率高, 可在过滤步骤后直接选择使用280 nm紫外LED进行消毒处理;若选择海水与回注水的混合液作为注水水源, 由于回注水水质多变, 紫外线透射率对UVC LED的消毒效果影响可能较大, 可考虑采用UVC LED与UVA LED联合使用的方法, 同时利用UVC的高杀菌效率和UVA的强穿透力达到协同消毒的效果(Zheng et al., 2016;Chevremont et al., 2012a).
3.3.3 细菌负荷对紫外LED消毒效果的影响实际水体中细菌负荷可能对紫外LED的消毒效果造成影响, 本研究还考察了255 nm紫外LED和280 nm紫外LED在80 mA的电流驱动条件下对初始细菌含量为104、105、107 cfu·mL-1水样的消毒效果, 所得结果如图 7所示.255和280 nm紫外LED对不同初始浓度腐生菌的灭活率在低剂量时相同, 但在高剂量时会随细菌浓度的升高而显著提高.这可能是因为细菌负荷决定了水样中紫外线的最高消耗量, 高浓度的菌液提高了紫外线的实际利用率, 从而带来了更高的灭活效率.需要注意的是, 在80 mA的电流驱动条件下, 280 nm紫外LED的输入功率仍低于255 nm的紫外LED, 但其平均辐射强度为0.181 mW·cm-2, 达到255 nm紫外LED的3.5倍.对于初始浓度107 cfu·mL-1的腐生菌样品, 255 nm紫外LED在照射267 s后对数灭活率仅达到5.4, 280 nm紫外LED在照射214 s后对数灭活率即达到7.5, 这是因为280 nm紫外LED在与255 nm紫外LED消耗相同能量的条件下可以提供更高的平均辐射通量, 而高浓度的菌液可以更充分地利用高剂量的280 nm紫外线, 证明280 nm紫外LED对高浓度菌液的消毒更有优势.
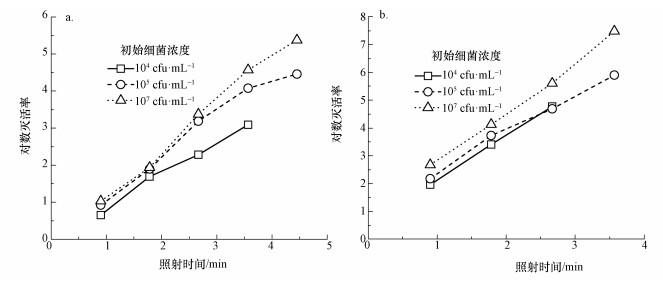 |
| 图 7 微生物初始浓度对不同波长紫外LED (80 mA驱动电流)灭活腐生菌的影响(a.255 nm紫外LED, b.280 nm紫外LED) Fig. 7 Effect of bacteria load on disinfection efficiency of saprophytic bacteria using UV LEDs |
1) 波长和照射剂量对紫外线消毒效果具有显著影响.各紫外LED平均辐射强度相同时, 255 nm和280 nm紫外线对腐生菌、铁细菌和硫酸盐还原菌的消毒效果显著优于350 nm紫外线, 且255 nm紫外线对3种细菌的灭活速率常数均略大于280 nm紫外线;各紫外LED驱动电流相同时, 虽然255 nm紫外LED的灭活速率常数最大, 但280 nm紫外LED平均紫外强度更高, 达到相同灭活率时所需时间最短.
2) 紫外LED的电光转化效率是紫外LED消毒效果的重要影响因素, 与对应波长的紫外线的灭活速率常数共同决定达到单位灭活率所需要的能耗.综合考虑波长与能耗对消毒效率的影响, 280 nm紫外LED对腐生菌、铁细菌和硫酸盐还原菌均具有最低的单位灭活率能耗, 是应用于深海油田注水紫外消毒的最优选择.
3) 颗粒物和铁离子等水质因素会对该波长紫外LED对微生物的灭活曲线造成影响.颗粒物和铁离子对255 nm和280 nm紫外线透射率的影响程度相似.紫外线透射率较高时对紫外LED的消毒效果影响较小, 较低时影响较大.在实际应用过程中应适当对水源水进行前处理, 以减少紫外线透射率降低对消毒效果的影响.
4) 细菌负荷对消毒效率的影响程度与紫外LED的平均辐射强度有关.在实际应用中应根据进水的细菌负荷决定实际采用的紫外LED平均辐射强度, 提高紫外线利用率.
Beck S E, Ryu H, Boczek L A, et al. 2017. Evaluating UV-C LED disinfection performance and investigating potential dual-wavelength synergy[J]. Water Res, 109: 207–216.
DOI:10.1016/j.watres.2016.11.024
|
Bolton J R, Stefan M I, Shaw P S, et al. 2011. Determination of the quantum yields of the potassium ferrioxalate and potassium iodide-iodate actinometers and a method for the calibration of radiometer detectors[J]. Journal of Photochemistry and Photobiology A:Chemistry, 222: 166–169.
DOI:10.1016/j.jphotochem.2011.05.017
|
Bowker C, Sain A, Shatalov M, et al. 2011. Microbial UV fluence-response assessment using a novel UV-LED collimated beam system[J]. Water Res, 45: 2011–2019.
DOI:10.1016/j.watres.2010.12.005
|
Cantwell R E, Hofmann R. 2011. Ultraviolet absorption properties of suspended particulate matter in untreated surface waters[J]. Water Research, 45: 1322–1328.
DOI:10.1016/j.watres.2010.10.020
|
Chen R Z, Craik S A, Bolton J R. 2009. Comparison of the action spectra and relative DNA absorbance spectra of microorganisms:information important for the determination of germicidal fluence (UV dose) in an ultraviolet disinfection of water[J]. Water Res, 43: 5087–5096.
DOI:10.1016/j.watres.2009.08.032
|
Chevremont A C, Farnet A M, Coulomb B, et al. 2012a. Effect of coupled UV-A and UV-C LEDs on both microbiological and chemical pollution of urban wastewaters[J]. Sci Total Environ, 426: 304–310.
DOI:10.1016/j.scitotenv.2012.03.043
|
Chevremont A C, Farnet A M, Sergent M, et al. 2012b. Multivariate optimization of fecal bioindicator inactivation by coupling UV-A and UV-C LEDs[J]. Desalination, 285: 219–225.
DOI:10.1016/j.desal.2011.10.006
|
Ho C F H, Pitt P, Mamais D, et al. 1998. Evaluation of UV disinfection systems for large-scale secondary effluent[J]. Water Environment Research, 70(6): 1142–1150.
DOI:10.2175/106143098X123264
|
Goldstein S, Rabani J. 2008. The ferrioxalate and iodide-iodate actinometers in the UV region[J]. Journal of Photochemistry and Photobiology A:Chemistry, 193: 50–55.
DOI:10.1016/j.jphotochem.2007.06.006
|
郭美婷, 胡洪营, 李莉. 2007. 污水紫外线消毒工艺的影响因素研究[J]. 中国环境科学, 2007, 27(4): 534–538.
DOI:10.3321/j.issn:1000-6923.2007.04.021 |
Hijnen W A, Beerendonk E F, Medema G J. 2006. Inactivation credit of UV radiation for viruses, bacteria and protozoan (oo)cysts in water:a review[J]. Water Research, 40: 3–22.
DOI:10.1016/j.watres.2005.10.030
|
Jenny R M, Jasper M N, Simmons O D, et al. 2015. Heuristic optimization of a continuous flow point-of-use UV-LED disinfection reactor using computational fluid dynamics[J]. Water Research, 83: 310–318.
DOI:10.1016/j.watres.2015.06.031
|
Oguma K, Rattanakul S, Bolton J R. 2016. Application of UV light-emitting Diodes to adenovirus in water[J]. Journal of Environmental Engineering, 142(3): 04015082.
DOI:10.1061/(ASCE)EE.1943-7870.0001061
|
兰效宁, 刘宏菊, 卢红梅. 2014. 炼化企业中水紫外线消毒及其影响因素[J]. 环境工程学报, 2014, 8(1): 222–229.
|
Li G Q, Wang W L, Huo Z Y, et al. 2017. Comparison of UV-LED and low pressure UV for water disinfection:Photoreactivation and dark repair of Escherichia coli[J]. Water Research, 126: 134–143.
DOI:10.1016/j.watres.2017.09.030
|
Loge F J, Bourgeous K, Emerick R W, et al. 2001. Variations in wastewater quality parameters influencing UV disinfection performance:relative impact of filtration[J]. Journal of Environmental Engineering, 127: 832–837.
DOI:10.1061/(ASCE)0733-9372(2001)127:9(832)
|
Lui G Y, Roser D, Corkish R, et al. 2016. Point-of-use water disinfection using ultraviolet and visible light-emitting diodes[J]. Science of Total Environment, 553: 626–635.
DOI:10.1016/j.scitotenv.2016.02.039
|
Oppezzo O J, Pizarro R A. 2001. Sublethal effects of ultraviolet A radiation on Enterobacter cloacae[J]. Journal of Photochemistry and Photobiology B:biology, 62(3): 158–165.
DOI:10.1016/S1011-1344(01)00180-4
|
Rantalankila M, Koivistoinen H, Sarvasidze L, et al. 2016. Inactivation of Asterionellopsis glacialis in seawater using combinations of deep ultraviolet light emitting diodes[J]. Separation and Purification Technology, 169: 247–252.
DOI:10.1016/j.seppur.2016.05.045
|
Robinson D. 2010. Oil and gas:Water treatment in oil and gas production-does it matter?[J]. Filtration & Separation, 47(1): 14–18.
|
Sholtes K A, Lowe K, Walters G W, et al. 2016. Comparison of ultraviolet light-emitting diodes and low-pressure mercury-arc lamps for disinfection of water[J]. Environmental Technology, 37: 2183–2188.
DOI:10.1080/09593330.2016.1144798
|
Sinha R P, Häder D P. 2002. UV-induced DNA damage and repair:a review[J]. Photochemical & Photobiological Sciences, 1(4): 225–236.
|
Sommer R, Haider T, Cabaj A, et al. 1998. Time dose reciprocity in UV disinfection of water[J]. Water Science and Technology, 38(12): 145–150.
DOI:10.2166/wst.1998.0526
|
Song K, Mohseni M, Taghipour F. 2016. Application of ultraviolet light-emitting diodes (UV-LEDs) for water disinfection:A review[J]. Water Research, 94: 341–349.
DOI:10.1016/j.watres.2016.03.003
|
孙文俊, 刘文君, 胡田甜, 等. 2008. 紫外线消毒系统中强度分布的理论计算与生物验证对比[J]. 环境科学学报, 2008, 28(3): 563–567.
DOI:10.3321/j.issn:0253-2468.2008.03.024 |
王军喜, 闫建昌, 郭亚楠, 等. 2015. 氮化物深紫外LED研究新进展[J]. 中国科学:物理学力学天文学, 2015, 45(6): 067303.
|
Wurtele M A, Kolbe T, Lipsz M, et al. 2011. Application of GaN-based ultraviolet-C light emitting diodes——UV LEDs——for water disinfection[J]. Water Research, 45: 1481–1489.
DOI:10.1016/j.watres.2010.11.015
|
辛青. 2009. 脉冲电场/脉冲等离子体新型杀菌技术研究[D]. 杭州: 浙江大学
|
张永吉, 刘文君. 2006. 浊度对紫外灭活大肠杆菌和MS-2噬菌体的影响[J]. 中国给水排水, 2006, 22(1): 27–31.
DOI:10.3321/j.issn:1000-4602.2006.01.007 |
Zheng J, Chen B, Thanyamanta W, et al. 2016. Offshore produced water management:A review of current practice and challenges in harsh/Arctic environments[J]. Marine Pollution Bulletin, 104(1/2): 7–19.
|
 2018, Vol. 38
2018, Vol. 38


