2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
厌氧氨氧化反应指在厌氧或缺氧条件下, 厌氧氨氧化菌以亚硝酸盐作为电子受体将氨氮直接氧化为氮气的过程, 避免了强温室气体氧化亚氮(N2O)的产生并完成封闭的产氮气循环过程(Kartal et al., 2011).自从1995年首次在人工中试反硝化流化床中被发现后(Mulder et al., 1995), 厌氧氨氧化的存在与作用陆续在各类自然生态系统中被证实.在海洋生态系统中, 厌氧氨氧化广泛存在于水体及沉积物中(Dalsgaard et al., 2003, 2012; Kuypers et al., 2003; 2005; Thamdrup et al., 2002), 其中氧最小区域(oxygen minimum zones, OMZs)是厌氧氨氧化作用的热区, 其脱氮贡献率可达到50%以上(Hamersley et al., 2007;Lam et al., 2011).在淡水生态系统中, 厌氧氨氧化不连续地分布于各类湖泊、河流及淡水湿地等(Penton et al., 2006; Schubert et al., 2006; Zhu et al., 2010; 2015).但在陆地生态系统中, 厌氧氨氧化的发生具有很强的异质性, 不同土壤深度厌氧氨氧化的分布不同(Humbert et al., 2010), 且在陆地表层土壤, 除了间歇性水淹的稻田土壤(Zhu et al., 2011), 均未检测到厌氧氨氧化的发生.
厌氧氨氧化菌体内有一双分子层的厌氧氨氧化体, 其占细胞总体积的50%~80%, 是厌氧氨氧化反应进行的场所.厌氧氨氧化体由厌氧氨氧化体膜包围, 该膜含有一特殊成分——阶梯烷膜脂, 阶梯烷膜脂的存在使厌氧氨氧化体膜具有高密度、低渗透的特点, 可有效阻止厌氧氨氧化反应有毒中间代谢产物联氨的扩散.厌氧氨氧化菌独特的生理构造也使得其具有广阔的生态位, 有能力存在于广泛的土壤生态系统中.相关研究表明, 氨氮硝氮底物、温度、pH, 有机质含量等环境因子均不是决定厌氧氨氧化菌生存及反应发生的关键因素(Kartal et al., 2007; 2012; Byrne et al., 2009; Zhu et al., 2015), 同时结合在一些陆地水生态系统中, 水位的波动对厌氧氨氧化的影响以及水土交界面厌氧氨氧化反应的强化(Zhu et al., 2013; Wang et al., 2017), 推测水分可能是陆地生态系统中厌氧氨氧化发生的关键限制因子.
厌氧氨氧化菌目前已探明有6个属, 即Brocadia, Kuenenia, Scalindua, Jettenia, Anammoxoglobus, 及Anammoximicrobium, 均属于一分支很深的浮霉状菌门, 各种属具有特征生态位, 故在不同环境中, 厌氧氨氧化菌群落结构具有明显差异性(Oshiki et al., 2016).针对厌氧氨氧化菌的多样性分布, 有研究表明盐度是影响厌氧氨氧化菌群落组成的关键因子(Sonthiphand et al., 2014).
为了研究水分变化是否会对陆地土壤厌氧氨氧化的发生及菌群生长产生重要影响, 我们选择了西澳Kalgoorlie地区典型旱地深层土壤作为采样点, 该区地质历史演化时间长, 且土壤环境相对封闭, 人为干扰少.选取不同深度不同发育程度的土壤样品, 进行纯水及盐水的分别加入培养, 研究厌氧氨氧化菌群落结构在时间和空间的双维度上对不同处理方式的响应变化.同时, 结合土壤的地质历史背景, 及培养过程中相伴随的全细菌群落结构的响应变化, 进一步研究拓展对不同生境中厌氧氨氧化菌生理特性的认识.
2 材料与方法(Materials and methods) 2.1 区域背景及样品的采集保存本研究选取西澳大陆Kalgoorlie地区典型旱地土壤进行采样, 该地区年降水量约260 mm, 且具有长达44亿年的地质演化历史, 多数区域起源于海湖等水域环境, 而后经板块抬升、收缩及碰撞, 形成了当今的陆地环境.该区域土壤发育时间漫长, 具有成熟的土壤分层架构, 且相对封闭, 受外界干扰较少.钻探所得土壤深度可达60 m, 由上层的淋滤层至下部的淀积层, 再到底部的母质层, 颜色也由红棕色逐渐过渡到灰褐色.在钻探所得60 m深层土壤中, 分别选取了21~24 m红棕色淀积层土壤和45~48 m灰褐色母质层土壤进行了对比研究.所有土壤样品采用破坏性取样, 淀积层和母质层分别重复采集3份平行土样, 采集后密封储存于聚乙烯无菌密封袋中, 4 ℃下运送至实验室.去除碎石残基后, 每层的3份平行土样充分混合作一份新土样, 新土样一部分过2 mm筛后测定相关理化性质, 另一部分-80 ℃冻存用作分子实验, 其余样品进行相关培养实验.
2.2 土壤理化指标的测定土壤样品的理化指标依照《土壤农化分析》(鮑士旦, 2000)中的方法进行.其中pH值是向土壤中加入超纯水使土壤与水的质量比为1:5后测定;含水率(Moisture Content, MC)以土壤在105 ℃下的失水量计算;土壤有机质(SOM)以土壤在550 ℃下的烧失量计算(张文河等, 2007);氨氮、亚硝氮、硝氮等是将土壤样品经2 mol·L-1的KCl溶液浸提1 h后, 用0.45 μm微孔滤膜过滤后用连续流动分析仪(SAN plus, Skalar Analytical B.V., Breda, the Netherlands)进行测定.总碳(TC)、总氮(TN)和总磷(TP)是将土壤冷干研磨过筛后用元素分析仪测定.所有理化指标都进行3次重复测定, 最终结果取平均值.
2.3 土壤样品的加水培养培养方式选择纯水培养与盐水培养两种, 均为水土质量比1:1地混合加入.纯水为灭菌后的超纯水, 盐水为灭菌后的3.5%盐度的NaCl溶液, 用于模拟海洋水域的盐环境.培养瓶采用60 mL玻璃血清瓶, 每瓶加入10.00 g新鲜均质土壤, 及10.00 g经氦气吹脱后的灭菌超纯水或盐水.水土混匀后约占培养瓶体积的1/5.加入培养样品后的培养瓶抽真空营造相对厌氧的环境, 后置于恒温培养箱无光培养, 于计划时间点取出平行培养瓶, 在无菌条件下进行破坏性取样.
2.4 样品DNA的提取开瓶取样后, 土样经冷冻干燥处理, 分别称取约0.33 g样品, 使用FastDNA Spin Kit for Soil DNA提取试剂盒(MP Biomedicals, USA)提取样品总DNA, 并用1%凝胶电泳检测DNA质量, 用Nano Drop 2000 UV-Vis Spectrophotometer(Thermo Fisher Scientific, USA)测定其浓度.
2.5 PCR扩增及高通量测序针对厌氧氨氧化菌的功能基因hzsB基因, 采用带有Barcode信息的HSBeta396F/HSBeta742R引物进行扩增(Kartal et al., 2011; Wang et al., 2012; Harhangi et al., 2012), 扩增所得PCR产物经Promega Agarose Gel DNA (Promega, Madison, WI)纯化试剂盒纯化, 再经NanoDrop 2000测定浓度后, 等物质的量混合并通过Hiseq 2500平台(Illumina, SanDiego, CA, USA)进行测序.选择细菌16S rRNA的V4区作为全细菌的测序区域, 使用带有Barcode信息的515F-806R进行扩增, 根据PCR产物浓度进行等浓度混样, 充分混匀后纯化处理, 再通过Illumina专用建库试剂盒进行文库构建, 经过Qubit定量和文库检验合格后, 进行Hiseq上机测序并分析(诺禾致源生物信息科技有限公司, 北京).测序得到的hzsB序列经过质控处理后, 通过自写Perl脚本, QIIME, Mothur等系统进行生物信息分析(Zhao et al., 2017).
2.6 数据分析OTUs水平上的热图通过HemI软件处理得到.相关性分析利用SPSS 19.0软件得到,均采用Pearson相关系数.利用Origin 8.5软件作图.
3 结果(Results) 3.1 深层土壤的理化背景在该西澳大陆Kalgoorlie地区深层土壤中, 我们选取了21~24 m淀积层土壤(红棕色粘土)和45~48 m母质层土壤(灰褐色腐泥土)进行加水培养实验.由表 1可知, 两层土壤均偏酸性, 上层淀积层土壤在有机质、总碳、总氮、总磷等指标上均要高于下层母质层, 但母质层的氨氮、硝氮等厌氧氨氧化作用底物含量要高于淀积层.
| 表 1 旱地深层土壤的理化性质 Table 1 Physicochemical characteristics of the deep dryland soils in Kalgoorlie district |
最初的21~24 m淀积层土壤和45~48 m母质层土壤中, 均未有厌氧氨氧化菌的检出, 随后分别加入纯水和3.5%盐度的盐水培养后, 于第3个月开始有厌氧氨氧化菌的定性检出, 且第4个月可继续检出.故抽取纯水培养中第3个月的21~24 m土壤样品(A1)和45~48 m土壤样品(B1), 第4个月的21~24 m土壤样品(A2)和45~48 m土壤样品(B2);及盐水培养中第3个月的21~24 m土壤样品(C1)和45~48 m土壤样品(D1), 第4个月的21~24 m土壤样品(C2)和45~48 m土壤样品(D2), 提取DNA后, 针对厌氧氨氧化hzsB基因进行PCR扩增并在Illumina 2500 Hiseq平台上进行高通量测序.经过序列质控后, 每个样品取10000条高质量序列进行分析.在NCBI(National Center of Biotechnology Information)获取纯培养和非冗余环境样品hzsB的基因序列, 并建立本地hzsB基因序列库进行BLAST(Basic Local Alignment Search Tool)比对, 结果表明质控后的高质量序列均为厌氧氨氧化菌的序列, 且在相似度90%的条件下进行聚类, 得到各样品的OTUs数及覆盖率.样品OTUs数的范围为20~40, 覆盖率均在99.9%以上.
同时稀释性曲线的结果(图 1)表明, 各样品OTUs数随着测序量的增长起初迅速增加, 而后渐趋于平缓, 稀释性曲线的平滑程度高, 各培养样品高通量测序的结果覆盖度高, 取样量充足, 结果与覆盖率指数相一致.
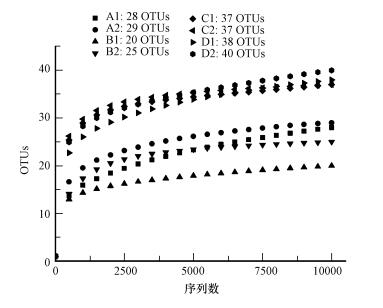 |
| 图 1 各培养样品厌氧氨氧化菌的稀释性曲线 Fig. 1 Rarefaction Curve of hzsB OTUs in soil samples |
本研究选取了Chao值, Simpson值和Shannon值等指标来反映α-多样性, 其中Chao值为丰富度指数, 用来表征一个群落或生境里物种数目的复杂度, 其值越高说明群落内物种数目越多;Simpson值为优势度指数, 表征一个群落或生境里优势种的地位和作用, 其值越高说明优势种的地位越突出, 物种分布越不均匀;Shannon值为多样性指数, 综合表征群落中物种的丰富度与均匀度.由表 2可知, 在厌氧氨氧化菌最开始被检出的第3个月, 其菌群多样性在盐水培养中(C1, Shannon值:2.11;D1, Shannon值:1.92)要高于纯水培养的结果(A1, Shannon值:0.79;B1, Shannon值:0.97), 且盐水培养中, 淀积层厌氧氨氧化菌群多样性要高于母质层, 而在纯水培养中, 母质层厌氧氨氧化菌群多样性要高于淀积层.继续培养一个月后, 盐水培养和纯水培养中各样品的厌氧氨氧化菌群多样性指数均有增加, 且盐水培养中厌氧氨氧化菌群多样性依旧要高于纯水培养的结果.同时, 纯水培养和盐水培养中, 淀积层厌氧氨氧化菌群多样性(A2, Shannon指数:1.12;C2, Shannon指数:2.12)均要低于母质层结果(B2, Shannon指数:1.36; D2, Shannon指数:2.24).
| 表 2 各培养样品厌氧氨氧化菌的α-多样性指数 Table 2 α-diversity index of anammox bacteria in soil samples |
在OTUs水平计算培养过程中各样品的Bray-Curtis差异度矩阵, 进行厌氧氨氧化菌的群落排序.如图 2所示, PCoA两轴对排序结果的解释度分别为28.02%和23.76%, 纯水培养中, 淀积层和母质层的厌氧氨氧化菌群落结构在第3个月初次被检出时, 具有较强的相似性(A1和B1), 而后继续培养一个月后, 两者出现明显分化(A2和B2);盐水培养中, 淀积层和母质层的厌氧氨氧化菌群落结构一直存在较大的差异性(C1和D1, C2和D2).同时, 相比较盐水培养和纯水培养中的厌氧氨氧化菌群落结构, 两者一直存在较大的差异性.
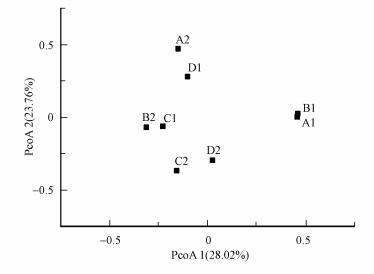 |
| 图 2 各培养样品厌氧氨氧化菌群落的PCoA排序 Fig. 2 Principal coordinates analysis of soil samples displayed with Bray-Curtis distance |
培养过程各样品的厌氧氨氧化菌所有序列在90%的相似度下进行聚类共得到49个OTUs, 以每个OTUs的代表氨基酸序列与已知纯培养厌氧氨氧化菌的hzsB基因氨基酸序列作比对, 得到各类厌氧氨氧化菌种属在不同培养样品中的分布, 通过在线Circos Table Viewer的可视化表达, 可以得到培养过程中厌氧氨氧化菌的群落组成变化, 如图 3所示.
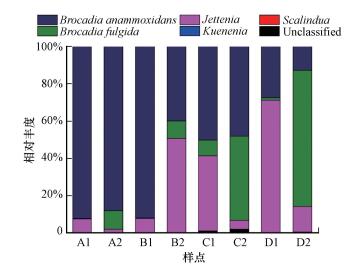 |
| 图 3 各培养样品厌氧氨氧化菌的群落组成 Fig. 3 The community compositions of anammox bacteria in soil samples |
纯水培养中, 培养第3个月时, Candidatus ‘Brocadia anammoxidans’在淀积层(92.09%)和母质层(91.94%)中均首先大量出现, 为绝对主导种属.另有一定量的Candidatus ‘Jettenia sp.’被检出(淀积层:7.43%;母质层:7.89%), 此时, 淀积层和母质层的厌氧氨氧化菌群落组成类似.随后继续培养一个月后, 淀积层中Candidatus ‘Brocadia fulgida’相对丰度出现一定量的增长, 达到10.14%, Candidatus ‘Jettenia sp.’和Candidatus ‘Brocadia anammoxidans’的相对丰度均出现一定量的减少, 分别降至1.59%和87.88%.母质层中Candidatus ‘Jettenia sp.’增长明显, 达到50.90%, 取代Candidatus ‘Brocadia anammoxidans’(39.92%)成为主导种属, 同时Candidatus ‘Brocadia fulgida’出现一定量增长, 达到9.18%.此时, 淀积层和母质层的厌氧氨氧化菌群落组成已经呈现明显差异.
盐水培养中, 培养第3个月时, 淀积层主导种属为Candidatus ‘Brocadia anammoxidans’ (50.03%)和Candidatus ‘Jettenia sp.’ (40.25%), 另有少量Candidatus ‘Brocadia fulgida’ (8.52%).母质层主导种属为Candidatus ‘Jettenia sp.’ (71.20%), Candidatus ‘Brocadia anammoxidans’和Candidatus ‘Brocadia fulgida’分别占比27.4%和1.29%, 此时, 淀积层和母质层厌氧氨氧化菌群落组成已呈现较大差异, 且与纯水培养的结果也存在明显分化.随后继续培养一个月后, Candidatus ‘Brocadia fulgida’在两层土壤中均出现较大增长, 淀积层中其增至45.19%, 与Candidatus ‘Brocadia anammoxidans’ (47.99%)共同主导菌群;而在母质层中其增至73.14%, 取代Candidatus ‘Jettenia sp.’ (13.65%)成为主导种属.此时, 两层土壤厌氧氨氧化菌群落结构依旧呈现较大差异, 且明显区别于同期纯水培养的结果.
同时, 根据OTUs水平下厌氧氨氧化菌群落结构在各培养样品中的分布, 构建热图显示如图 4所示, 其中每个方块代表一个OTUs, 方块的颜色代表该OTUs下分配得到的序列丰度水平, 结合左边的注释结果, 可以更直观地看到培养过程中厌氧氨氧化菌的多样性在盐水培养中要高于纯水培养的结果, 且不同时间, 不同土壤层厌氧氨氧化菌多样性及群落组成均有明显差异化表现.
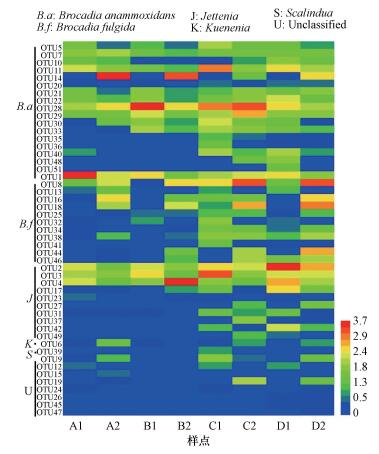 |
| 图 4 各培养样品厌氧氨氧化菌群落分布热图 Fig. 4 The heatmap of anammox bacterial community distributions in soil samples |
为了进一步研究加水培养过程中其他细菌群落结构的响应变化及其与厌氧氨氧化菌的生长关系, 我们选取了45~48 m母质层土壤, 针对其在纯水和盐水培养过程中细菌的16S rRNA进行了高通量测序.如图 5所示, 纯水培养中, 培养第3个月时, 厌氧或兼性厌氧的变形菌门Proteobacteria占绝对主导, 整体占比达95.45%, 其中大部分为盐单胞菌科Halomonadaceae(57.24%), 属于海洋螺菌目Oceanospirillales, 多为海水营生.同样为海洋营生的希万氏菌科Shewanellaceae占比次之, 达29.87%, 属于交替单胞菌目Alteromonadales.另有一些与植物固氮相关的根瘤菌目, 如甲基杆菌科Methylobacteriaceae, 占比3.62%.其他一些陆地土壤较普遍的变形菌属占比4.72%(图 6);除变形菌门外, 酸杆菌门Acidobacteria占比达2.27%, 放线菌门Actinobacteria占比达1.41%, 厚壁菌门Firmicutes占比达0.42%, 芽单胞菌门Gemmatimonadetes占比达0.19%, 绿弯菌门Chloroflexi占比达0.15%, 拟杆菌门Bacteroidetes占比达0.01%.继续培养一个月后, 厚壁菌门相对丰度变化较大, 其占比增至7.45%, 包含各类葡萄球菌科, 毛螺菌科, 梭菌科等, 该类菌可产生芽孢, 抵抗脱水和极端环境.一些陆地环境较普遍菌类如放线菌门, 占比达6.76%;酸杆菌门占比达2.25%;拟杆菌门占比达1.28%;芽单胞菌门占比达0.21%.绿弯菌门占比依旧较低, 且有所下降, 达0.10%.主导菌类依旧为变形菌门, 占比有所下降, 达81.84%, 其中属于海洋螺菌目Oceanospirillales的盐单胞菌科Halomonadaceae占比最大, 达50.63%, 属于交替单胞菌目Alteromonadales的希万氏菌科Shewanellaceae占比次之, 达22.42%, 另外一些陆地土壤较普遍的变形菌类占比8.79%(图 6).
 |
| 图 5 母质层土壤样品培养过程全细菌群落组成变化(门水平) Fig. 5 The bacterial community compositions (phylum level) in soil samples at parent material layer |
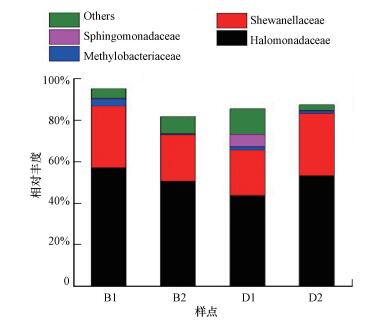 |
| 图 6 母质层土壤样品培养过程中变形菌门下各菌科的分布 Fig. 6 The distributions of Proteobacteria at family level in soil samples at parent material layer |
盐水培养中, 培养第3个月时, 与同期纯水培养结果一致, 由厌氧或兼性厌氧的变形菌门占主导, 整体占比达85.83%, 较纯水结果略低(图 5).其中海洋营生的盐单胞菌科Halomonadaceae(43.87%)和希万氏菌科Shewanellaceae(21.82%)同样占主导地位, 另有鞘脂单胞菌科Sphingomonadaceae(5.98%)、甲基杆菌科Methylobacteriaceae(1.73%)等, 合计占比20.14%(图 6);放线菌门Actinobacteria相对丰度较同期纯水结果(1.41%)要高, 占比达9.37%, 酸杆菌门Acidobacteria相对丰度较同期纯水结果(2.27%)要高, 达3.09%.另有少量厚壁菌门Firmicutes(1.04%), 芽单胞菌门Gemmatimonadetes(0.60%)和绿弯菌门Chloroflexi(0.03%).继续培养一个月后, 与同期纯水培养结果类似, 厚壁菌门相对丰度出现明显增长, 达7.19%;放线菌门和酸杆菌门相对丰度分别降至3.20%和1.04%;变形菌门依旧为主导菌类, 占比略增, 达87.68%, 其中海洋营生的盐单胞菌科Halomonadaceae(53.42%)和希万氏菌科Shewanellaceae(29.99%)依旧占主导地位, 且较第3个月的相对丰度均有增加.另有甲基杆菌科Methylobacteriaceae等, 合计占比4.27%(图 6).
结合培养过程中全细菌群落组成与厌氧氨氧化菌群落组成的协同变化, 进行Pearson相关性分析, 得到门水平上, 不同细菌相对丰度的变化与厌氧氨氧化菌群落组成的变化关系.其中Candidatus ‘Jettenia sp.’与放线菌门Actinobacteria的相对丰度变化显著正相关(r=0.991, p=0.009).同时细分占比最大的变形菌门Proteobacteria, 得到在科的水平上, Candidatus ‘Jettenia sp.’与海洋营生的希万氏菌科Shewanellaceae的相对丰度变化显著负相关(r=-0.971, p=0.029).
4 讨论(Discussion)本研究中的加水实验成功“唤醒”了旱地深层土壤中的厌氧氨氧化菌, 在培养第3个月时, 实现了厌氧氨氧化菌在定性检测上的“从无到有”.培养过程中相伴随的全细菌群落组成一直呈现较单一的状态, 以变形菌门Proteobacteria为主导, 占比达80%以上, 此点与其他环境样品中相对均匀的分布完全不同(Lipson et al., 2004; Nogales et al., 2001), 这也证明了采样点土壤背景的特殊性.同时, 细分占比最大的变形菌门Proteobacteria, 可知盐单胞菌科Halomonadaceae和希瓦氏菌科Shewanellaceae占比最大, 而两者多为海洋营生(Franzmann et al., 1988; Lee et al., 2006).考虑到该地区海陆变迁的地质历史, 及深层土壤的相对封闭性, 我们有理由推测原土壤样品继承自数亿年前的海洋环境, 且微生物群落组成保持相对稳定, 直到人工实验的加入.培养过程中, 厚壁菌门的相对丰度在纯水和盐水中均有明显增长, 而大多厚壁菌门可产生芽孢, 抵抗脱水与极端环境, 其相对丰度的增长可能与培养后期环境开始出现恶化有关.另外结合厌氧氨氧化菌属组成和全细菌菌群结构的变化关系, 可初步发现一些其他菌种对特定厌氧氨氧化菌属生长的协同或抑制作用.如放线菌门Actinobacteria与Candidatus ‘Jettenia sp.’的相对丰度变化显著正相关, 可能因为一些放线菌在厌氧环境下利用Fe3+作为电子受体, 将NH4+氧化为NO2- (Huang et al., 2014), 而Candidatus ‘Jettenia sp.’除了可利用NO2-生成NO, 还可在特征功能基因nrfA的作用下, 进行氨化作用(Ali et al., 2015), 由此与放线菌门Actinobacteria的生长具有耦合作用的关系.限于本研究的深度和方法, 相关作用机制的探究和具体阐释还有待更进一步的研究.
培养过程中加入的纯水与盐水虽然都成功“唤醒”了深层土壤中的厌氧氨氧化菌, 证明了陆地生态系统中水分的变化对厌氧氨氧化发生与分布的重要影响, 但两种处理方式所引起的厌氧氨氧化菌群落结构的变化响应不尽相同, 这也证明了盐度对不同厌氧氨氧化菌种的生长选择性.纯水培养中, 母质层与淀积层中最先出现的主导菌种均为Candidatus‘ Brocadia anammoxidans’, 而盐水培养中, Candidatus ‘Brocadia anammoxidans’ 和Candidatus ‘Jettenia sp.’一起大量出现, 以往纯培养研究中被证明偏好盐水环境的Candidatus‘Scalindua sp.’(Oshiki et al., 2016)并未在纯水与盐水培养中体现生长差异, 反而以往纯培养中被认为偏好淡水环境的Candidatus ‘Jettenia sp.’ (Ali et al., 2015)在盐水培养中最开始出现生长优势, 但继续培养一个月后, Candidatus ‘Brocadia fulgida’开始在盐水培养中出现明显的相对丰度增长, Candidatus ‘Jettenia sp.’开始在母质层纯水培养中出现明显的相对丰度增长.厌氧氨氧化菌已被证实具有多功能代谢途径, 除了以NO2-为电子受体, 将NH4+氧化为N2的过程外, 厌氧氨氧化菌还可以甲酸、乙酸、丙酸、甲胺、二价铁和氢等为电子供体, 参与NO3-的还原过程.同时厌氧氨氧化菌还可以铁锰氧化物为电子受体, 氧化甲酸、乙酸和丙酸等简单有机物(Oshiki et al., 2016).鉴于此, 厌氧氨氧化菌虽然为自养菌, 但一些特定的简单有机物(以甲酸、乙酸、丙酸为主), 仍会在一定程度上促进厌氧氨氧化菌的生长.如在丙酸存在情况下, 厌氧氨氧化菌可以NO2-或NO3-为电子受体, 同时氧化丙酸和氨, 且在丙酸的竞争利用上还要强于异养的反硝化菌(Guven et al., 2005).培养后期, 一些异养微生物代谢所产生的一些简单有机物会得到积累, 如甲酸、乙酸、丙酸等, 而这些简单有机酸对不同厌氧氨氧化菌属的生长具有较强的选择促进性.如丙酸的存在可增强Candidatus ‘Jettenia sp.’的生长竞争性(Ali et al., 2015), 而甲酸或乙酸可促进Candidatus ‘Brocadia fulgida’的生长(Kartal et al., 2008; Oshiki et al., 2016), 故此类小分子酸或影响到培养过程中厌氧氨氧化群落组成的变化.
同大多数细菌一样, 厌氧氨氧化菌在种内交流及调控相关功能基因表达的过程中, 具有明显的群聚效应, 且在过程中释放相关化学信号分子AHLs (Water et al., 2005;Miller et al., 2001;Tang et al., 2015).群聚效应有助于厌氧氨氧化菌的复苏与生长, 培养过程中水分的加入可能促进了传质, 且由于厌氧氨氧化菌具有疏水性, 加水培养后更利于其团聚体的形成, 达到规模化生长的效果.同时, 不同厌氧氨氧化菌属在AHLs的合成分泌上具有特异性, 对厌氧氨氧化菌的整体生长也具有不同的效果, 高活性厌氧氨氧化菌属的出现或加入可有效促进整体厌氧氨氧化菌群的生长(Liu et al., 2015), 而有些合成分泌的AHLs, 如C12-HSL, 则会抑制生长(Tang et al., 2015).培养过程中厌氧氨氧化菌的“从无到有”可能来源于最初大量出现的Candidatus ‘Brocadia anammoxidans’和Candidatus ‘Jettenia sp.’在群聚效应上的正向反馈作用:两者率先出现并有一定生长积累后, 会合成分泌一些外源AHLs, 刺激整体厌氧氨氧化菌群的内源表达, 增强厌氧氨氧化反应, 从而后续产生更多的AHLs的合成分泌(Xu et al., 2006; Tang et al., 2015).培养前期厌氧氨氧化菌群的多样性较低, 在群聚效应的积累增强之后, 其多样性也有了明显提升.
本文揭示了水分对旱地深层土壤厌氧氨氧化菌发生与生长的关键作用, 同时对比研究了不同深度不同发育程度的旱地土壤在纯水和盐水培养过程中厌氧氨氧化菌群落结构的响应变化, 以及相伴随的全细菌群落结构的响应变化, 拓展了对不同生境里厌氧氨氧化菌生理特性的认识.
Ali M, Oshiki M, Awata T, et al. 2015. Physiological characterization of anaerobic ammonium oxidizing bacterium 'Candidatus Jettenia caeni'[J]. Environmental Microbiology, 17(6): 2172–2189.
DOI:10.1111/1462-2920.12674
|
鮑士旦. 2000. 土壤农化分析(第3版)[M]. 北京: 中国农业出版社.
|
Byrne N, Strous M, Crépeau V, et al. 2009. Presence and activity of anaerobic ammonium-oxidizing bacteria at deep-sea hydrothermal vents[J]. The ISME Journal, 3: 117–123.
|
Dalsgaard T, Canfield D E, Petersen J, et al. 2003. N2 production by the anammox reaction in the anoxic water column of Golfo Dulce, Costa Rica[J]. Nature, 422: 606–608.
|
Dalsgaard T, Thamdrup B, Farias L, et al. 2012. Anammox and denitrification in the oxygen minimum zone of the eastern South Pacific[J]. Limnol Oceanogr, 57: 1331–1346.
DOI:10.4319/lo.2012.57.5.1331
|
Franzmann P D, Wehmeyer U, Stackebrandt E. 1988. Halomonadaceae fam. nov., a New Family of the Class Proteobacteria to Accommodate the Genera Halomonas and Deleya[J]. Systematic & Applied Microbiology, 11(1): 16–19.
|
Guven D, Dapena A, Kartal B, et al. 2005. Propionate Oxidation by and Methanol Inhibition of Anaerobic Ammonium-Oxidizing Bacteria[J]. Applied & Environmental Microbiology, 71(2): 1066–1071.
|
Hamersley M R, Lavik G, Woebken D, et al. 2007. Anaerobic ammonium oxidation in the Peruvian oxygen minimum zone[J]. Limnology and Oceanography, 52: 923–933.
|
Harhangi H R, Le R M, Van A T, et al. 2012. Hydrazine synthase, a unique phylomarker with which to study the presence and biodiversity of anammox bacteria[J]. Applied & Environmental Microbiology, 78(3): 752–758.
|
Humbert S, Tarnawski S, Fromin N, et al. 2010. Molecular detection of anammox bacteria in terrestrial ecosystems:distribution and diversity[J]. The ISEM Journal, 4(3): 450–454.
|
Huang S, Jaffe P R. 2014. Identification of an Actinobacteria species capable to oxidize ammonium under iron reducing conditions[J]. Biogeosciences Discussions, 11(8): 12295–12321.
|
Kartal B, Niftrik van L, Rattray J. 2008. Candidatus 'Brocadia fulgida':anauto uorescent anaerobic ammoniumoxidizing bacterium[J]. FEMS Microbiology Ecology, 63: 46–55.
|
Kartal B, van Niftrik L, Keltjens J T, et al. 2012. Anammox-growth physiology, cell biology, and metabolism[J]. Advances in Microbial Physiology, 60: 212–262.
|
Kartal B, Kuypers M M M, Schalk J. 2007. Anammox bacteria disguised as denitrifiers:nitrate reduction to dinitrogen gas via nitrite and ammonium[J]. Environmental Microbiology, 9: 635–642.
|
Kartal B, Maalcke W J, de Almeida N M, et al. 2011. Molecular mechanism of anaerobic ammonium oxidation[J]. Nature, 479(7371): 127–130.
|
Kuypers M M M, Sliekers A O, Lavik G, et al. 2003. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J]. Nature, 422: 608–611.
DOI:10.1038/nature01472
|
Kuypers M M M, Lavik G, Woebken D, et al. 2005. Massive nitrogen loss from the Benguela upwelling system through anaerobic ammonium oxidation[J]. Proc Natl Acad Sci U S A, 102: 6478–6483.
DOI:10.1073/pnas.0502088102
|
Lipson D A, Schmidt S K. 2004. Seasonal changes in an alpine soil bacterial community in the colorado rocky mountains[J]. Applied & Environmental Microbiology, 70(5): 2867–2879.
|
Lam P, Kuypers M M M. 2011. Microbial nitrogen cycling processes in oxygen minimum zones[J]. Annual Review of Marine Science, 3(362): 317–345.
|
Liu S, Jiang B. 2015. Quorum sensing of anammox bacteria during the startup of anammox Reactor[J]. Journal of Beijing University of Technology, 41: 1456–1461.
|
Lee O O, Lau S C, Tsoi M M, et al. 2006. Shewanella irciniae sp nov., a novel member of the family Shewanellaceae, isolated from the marine sponge Ircinia dendroides in the Bay of Villefranche, Mediterranean Sea[J]. International Journal of Systematic & Evolutionary Microbiology, 56(12): 2871–2877.
|
Miller M B, Bassler B L. 2001. Quorum sensing in bacteria[J]. Annual Review of Microbiology, 55: 165–199.
DOI:10.1146/annurev.micro.55.1.165
|
Mulder A, Graaf A, Robertson L, et al. 1995. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor[J]. FEMS Microbiology Ecology, 16(3): 177–184.
DOI:10.1111/fem.1995.16.issue-3
|
Nogales B, Moore E R, Llobetbrossa E, et al. 2001. Combined use of 16S ribosomal DNA and 16S rRNA to study the bacterial community of polychlorinated biphenyl-polluted soil[J]. Applied & Environmental Microbiology, 67(4): 1874–1884.
|
Oshiki M, Satoh H, Okabe S. 2016. Ecology and physiology of anaerobic ammonium oxidizing bacteria[J]. Environmental Microbiology, 18(9): 2784–2796.
|
Penton C R, Devol A H, Tiedje J M. 2006. Molecular evidence for the broad distribution of anaerobic ammonium oxidizing bacteria in freshwater andmarine sediments[J]. Applied and Environmental Microbiology, 72(10): 6829–6832.
DOI:10.1128/AEM.01254-06
|
Sonthiphand P, Hall M W, Neufeld J D. 2014. Biogeography of anaerobic ammonia-oxidizing (anammox) bacteria[J]. Frontiers in Microbiology, 5: 399.
|
Schubert C J, Durisch Kaiser E, Wehrli B, et al. 2006. Anaerobic ammonium oxidation in a tropical freshwater system (Lake Tanganyika)[J]. Environmental Microbiology, 8(10): 1857–1863.
|
Tang X, Liu S, Zhang Z, et al. 2015. Identification of the release and effects of AHLs in anammox culture for bacteria communication[J]. Chemical Engineering Journal, 273: 184–191.
|
Thamdrup B, Dalsgaard T. 2002. Production of N2 through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments[J]. Applied & Environmental Microbiology, 68: 1312–1318.
|
Wang S, Radny D, Huang S, et al. 2017. Nitrogen loss by anaerobic ammonium oxidation in unconfined aquifer soils[J]. Scientific Reports, 7: 40173.
DOI:10.1038/srep40173
|
Wang Y, Zhu G, Harhangi H R, et al. 2012. Co-occurrence and distribution of nitrite-dependent anaerobic ammonium and methane-oxidizing bacteria in a paddy soil[J]. Fems Microbiology Letters, 336(2): 79–88.
DOI:10.1111/fml.2012.336.issue-2
|
Waters C M, Bassler B L. 2005. Quorum sensing:cell-to-cell communication in bacteria[J]. Annual Review of Cell and Developmental Biology, 21: 319–346.
DOI:10.1146/annurev.cellbio.21.012704.131001
|
Xu K, Li L, Xing H, et al. 2006. Quorum sensing system of bacteria[J]. Chinese Journal of Infectious Disesases, 24: 356–358.
|
Zhu G, Jetten M S, Kuschk P, et al. 2010. Potential roles of anaerobic ammonium and methane oxidation in the nitrogen cycle of wetland ecosystems[J]. Applied Microbiology and Biotechnology, 86(4): 1043–1055.
DOI:10.1007/s00253-010-2451-4
|
Zhu G, Wang S, Zhou L, et al. 2015. Ubiquitous anaerobic ammonium oxidation in inland waters of China:an overlooked nitrous oxide mitigation process[J]. Scientific Reports.
DOI:10.1038/srep17306
|
Zhu G, Wang S, Wang Y, et al. 2011. Anaerobic ammonia oxidation in a fertilized paddy soil[J]. The ISME Journal, 5(12): 1905–1912.
|
Zhu G, Xia C, Wang S, et al. 2015. Occurrence, activity and contribution of anammox in some freshwater extreme environments[J]. Environmental Microbiology Reports, 7(6): 961–969.
|
Zhu G, Wang S, Wang W, et al. 2013. Hotspots of anaerobic ammonia oxidation in land-freshwater interfaces[J]. Nature Geoscience, 6: 103–107.
|
张文河, 穆桂金. 2007. 烧失法测定有机质和碳酸盐的精度控制[J]. 干旱区地理, 2007, 30(3): 455–459.
DOI:10.3321/j.issn:1000-6060.2007.03.021 |
Zhao S, Zhuang L, Wang C, et al. 2017. HigH-throughput analysis of anammox bacteria in wetland and dryland soils along the altitudinal gradient in Qinghai-Tibet Plateau[J]. MicrobiologyOpen: e556.
|
 2018, Vol. 38
2018, Vol. 38


