2. 山西大学生物医学研究学院, 太原 030006;
3. 山西大学生命科学学院, 太原 030006;
4. 山西省人民医院精准医学中心, 太原 030012
2. Institutes of Biomedical Sciences, Shanxi University, Taiyuan 030006;
3. School of Life Science, Shanxi University, Taiyuan 030006;
4. Precision Medicine Center, Shanxi Provincial People's Hospital, Taiyuan 030012
四溴双酚A(TBBPA)是目前全球生产量和使用量最大的溴代阻燃剂之一, 也是新型潜在的拟增热点POPs和环境内分泌干扰物, 被广泛应用于电子电器产品、纺织品、泡沫家具及建筑材料等, 以提高阻燃性(Abou-Elwafa et al., 2016).目前一些研究表明, 在空气、土壤、水体和水体沉积物等环境中已检测到TBBPA的存在(Covaci et al., 2006).Mäkinen等(2009)的研究表明, 废弃电子产品工厂的空气中TBBPA的含量接近14600 ng·m-3.Sánchezbrunete等(2009)检测工业土壤样品中TBBPA的含量变化范围为3.4~32.2 ng·g-1, 而农业土壤样品中TBBPA含量为0.3 ng·g-1.受到污染的Skene河, 其下游水体检测到TBBPA平均含量为25 ng·g-1(Zhang et al., 2009).Feng等(2009)检测到在珠江三角洲表层沉积物中, TBBPA含量为0.03~31.6 ng·g-1(干重).然而, 另外一些证据表明在人体中能够检测到TBBPA的存在.Shi等(2009)在北京市乳汁样本中检测到TBBPA平均含量为0.10 ng·g-1(湿重), 且婴儿通过母乳摄入TBBPA的剂量为2.34 ng·kg-1·d-1.Cariou等(2005)检测出法国普通女性血清中TBBPA平均含量为3.0 ng·kg-1.而Wu等(2016)检测到中国台州的儿童每天TBBPA的摄入量范围为0.31~58.54 ng·kg-1.因此, 研究TBBPA暴露与人体健康风险的相关性, 对于评价环境污染具有重要的理论意义.
TBBPA已经被国际癌症研究机构(IARC)列为可能的2A级致癌物质, 风险相关性最显著的是子宫内膜癌(Grosse et al., 2016).子宫内膜癌是全球较为常见的生殖道恶性肿瘤之一, 其发病率约占女性恶性肿瘤的20%左右, 并且具有较高的病死率(张翠玲等, 2013).近些年子宫内膜癌发病年龄也逐渐年轻化, 其侵袭及转移直接影响病人的预后康复, 严重威胁女性人群的生命健康安全(安欣等, 2017).此外, 有研究也证明TBBPA可促进子宫内膜癌的发生.例如, Dunnick等(2015)证明了慢性暴露TBBPA后, Wistar Han大鼠和B6C3F1小鼠出现宫颈上皮细胞增生, 并且明显增加了子宫癌的发病率.然而到目前为止, 关于TBBPA促进子宫内膜癌恶化的研究尚不完善, 其相关的机理仍不清楚.
上皮间充质转化(EMT)在肿瘤侵袭和转移中发挥着重要作用(Tsuji et al., 2009; Thiery et al., 2002).在EMT过程中, EMT相关上游因子包括Snail-1、Snail-2和Twist等多种转录因子选择性表达, 调控EMT标志蛋白E-cadherin、Vimentin、N-cadherin的表达与活性, 进而在肿瘤侵袭和转移过程中发挥重要作用(Batlle et al., 2000).因此, 本研究主要探讨低浓度的TBBPA暴露促进Ishikawa细胞恶化的毒性效应, 以阐明TBBPA暴露对Ishikawa细胞EMT的影响及可能的分子机理, 为评价TBBPA关于子宫癌的促瘤效应提供理论基础.
2 材料与方法(Materials and methods) 2.1 材料与试剂及仪器 2.1.1 细胞亚洲人子宫内膜腺癌(Ishikawa)细胞购自BioVector质粒载体菌种细胞基因保藏中心-NTCC典型培养物保藏中心.
2.1.2 主要试剂和仪器四溴双酚A(TBBPA, 99.0%)购于德国Dr. Ehrenstorfer公司;RPMI-1640培养基和特级胎牛血清均购自美国GIBCO公司;BCA蛋白定量试剂盒、WB/IP细胞裂解液和细胞膜蛋白提取试剂盒均购自中国Beyotime公司;ECL发光液购自中国Engreen公司;Trizol、PrimeScript RT reagent Kit及SYBR green PCR master mix试剂均购自日本Takara公司;Snail-1抗体购自美国Cell signaling公司;E-cadherin抗体购自中国Sino Biological公司;N-cadherin, Vimentin和Twist抗体均购自美国Bioworld公司;GAPDH抗体购自中国Abmart公司;辣根过氧化物标记的羊抗小鼠和羊抗兔二抗购自美国Santa Cruz公司; 荧光定量PCR引物购自上海生工公司;二氧化碳培养箱购自德国Eppendorf公司;倒置显微镜购自日本Nikon公司;超净工作台购自中国亚泰科隆公司;SDS-PAGE电泳、电转设备及荧光定量PCR仪购自美国Bio-Rad公司;酶标仪购自美国BioTek公司;全功能发光及荧光生物图像分析系统购自中国上海复日科技有限公司.
2.2 实验方法 2.2.1 细胞培养将人子宫内膜癌细胞Ishikawa培养于含10%胎牛血清的RPMI 1640培养基中, 于37 ℃、5% CO2条件下培养, 每隔2~3 d进行换液或传代.
2.2.2 药物处理将粉末状TBBPA溶于DMSO溶液中配成储备液(浓度为1 mol·L-1), 使用前用RPMI 1640培养基稀释至相应的工作浓度.检测TBBPA对Ishikawa细胞存活的影响时, Ishikawa细胞培养于含有终浓度分别为1.00×10-9、1.00×10-8、1.00×10-7、1.00×10-6、1.00×10-5、1.00×10-4 mol·L-1 TBBPA的RPMI 1640培养基中, 对照组用含0.1% DMSO的RPMI 1640培养基培养;而在本研究的其余实验中, Ishikawa细胞用浓度为1.00×10-9、1.00×10-8、1.00×10-7 mol·L-1 TBBPA处理.
2.2.3 MTT法检测选取对数生长期状态良好的Ishikawa细胞, 接种于4组96孔培养板中, 每孔2000个细胞.12~16 h细胞贴壁后, 实验组用浓度为1.00×10-9、1.00×10-8、1.00×10-7、1.00×10-9、1.00×10-5、1.00×10-4 mol·L-1的TBBPA处理, 对照组用0.1% DMSO处理.药物处理12、24、36、48 h后, 每孔再加入20 μL的MTT溶液(5 mg·mL-1), 37 ℃孵育4 h, 然后吸出上清, 每孔加入150 μL DMSO溶液, 摇床上低速振荡10 min, 使结晶物充分溶解, 在酶标仪570 nm处测量各孔的吸光值.细胞存活率R=(A570, exp-A570, ck)/ A570, ck×100%, 每组设置6个平行.
2.2.4 细胞形态观察选取对数生长期的Ishikawa细胞, 按每孔2×104个细胞接种于12孔板, 在37 ℃、5% CO2条件下用RPMI 1640培养基培养.24 h贴壁后用不同浓度为的TBBPA(0、1.00×10-9、1.00×10-8、1.00×10-7 mol·L-1)暴露细胞, 在不同时间段内(0、12、24、36 h)利用倒置显微镜观察细胞形态变化并拍照.
2.2.5 划痕实验将Ishikawa细胞接种于24孔板中, 每孔1×106个细胞.当细胞融合度达到90%左右时, 换成无血清RPMI 1640培养基饥饿处理细胞12 h;然后用无菌的20 μL移液枪枪头在每孔中心轴处划痕, PBS清洗去除漂浮的细胞.之后加入终浓度为0、1.00×10-9、1.00×10-8、1.00×10-7 mol·L-1的TBBPA, 并在暴露0、12、24、36 h时, 倒置显微镜下进行观察与拍照.在0 h选取每孔中划痕宽度一致的视野, 标记该视野在孔中的位置并记录该孔的初始划痕面积;经不同时间暴露后, 在初始视野相同的位置记录该时间下的划痕面积, 细胞划痕愈合率HR=(SA0-SAt)/SA0, 其中, SA0为0 h时每个孔细胞的划痕面积, SAt为t时刻每个孔细胞的划痕面积, t取值分别为12、24、36 h.
2.2.6 Transwell侵袭实验将对数生长期细胞接种于2组6孔板中, 每孔中分别加入终浓度为0、1.00×10-9、1.00×10-8、1.00×10-7 mol·L-1的TBBPA, 2组细胞分别暴露48、96 h, 收集细胞, Transwell板上室预先铺50 μL Matrigel基质胶并凝固待用.暴露后的Ishikawa细胞悬浮于无血清RPMI 1640培养基, 接种于铺有基质胶的Transwell板上室, 每室10000个细胞, 下室的24孔板中加入含有10%胎牛血清的RPMI 1640培养基作为趋化因素.37 ℃下培养48 h后取出, 用棉签弃去上层细胞, 下层细胞用免疫染色固定液固定20 min, 0.1%的结晶紫染色20 min, Ishikawa细胞核被染成紫色, 之后PBS清洗3次, 倒置相差显微镜下拍照, 任选5个视野进行定量统计.实验重复3次.
2.2.7 Transwell迁移实验如2.2.6节方法提前暴露细胞48、96 h, 暴露后的细胞用无血清RPMI 1640培养基制成细胞悬液, 每室10000个细胞接种于24孔板的Transwell上室, 下室的24孔板中加入含有10%胎牛血清的RPMI 1640培养基作为趋化因素.细胞常规培养48 h, 之后用棉签弃去上层细胞, 下层细胞用免疫染色固定液固定20 min, 0.1%的结晶紫染色20 min, Ishikawa细胞核被染成紫色, 之后PBS洗3次.将固定染色后的细胞置于倒置相差显微镜下拍照并任选5个视野进行计数, 取平均值.实验重复3次.
2.2.8 实时荧光定量PCR将Ishikawa细胞按照每孔1×105个细胞接种于6孔板中, 细胞贴壁后, 不同浓度的TBBPA(0、1.00×10-9、1.00×10-8、1.00×10-7 mol·L-1)暴露细胞72 h, 收集细胞, 加入Trizol提取总RNA.利用反转录试剂盒, 将RNA逆转录合成cDNA, 然后于荧光定量PCR仪进行qPCR分析.内参GAPDH基因将目的基因mRNA表达量进行均一化处理.基因表达变化的计算采用倍增变化率表示, 倍增变化率=2-△△Ct(ΔCt为目的基因和内参照基因Ct值的差值).实验所用的引物如表 1所示.
| 表 1 引物序列 Table 1 Primer sequences |
在60 mm培养皿中接种1×106个Ishikawa细胞, 终浓度为0、1.00×10-9、1.00×10-8、1.00×10-7 mol·L-1的TBBPA暴露细胞72 h, 之后收集细胞, 加入含1% PMSF的裂解液裂解, 冰浴30 min, 13000 r·min-1、4 ℃下离心15 min收集上清.采用BCA法测定蛋白浓度.将变性后的蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离, 电泳结束后分离的蛋白印迹转移至硝酸纤维素膜, 室温下用含5%脱脂奶粉的TBST封闭1 h, 特异性一抗4 ℃孵育过夜.次日TBST洗膜3次后, 孵育二抗2 h, 随后TBST洗膜3次, 最后于暗室进行化学发光液处理, 经过显影、定影后观察目的蛋白的表达变化.用全功能发光及荧光生物图像分析系统扫描蛋白印迹并保存图像, 使用Image J分析软件对蛋白条带进行灰度值分析.
2.2.10 统计学分析实验数据采用SPSS 17.0软件进行分析, 用t检验对样本均数进行比较, 以平均值±标准差(Mean±SD)表示实验结果, p < 0.05表示差异有统计学意义.
3 实验结果(Results) 3.1 TBBPA暴露对Ishikawa细胞活力的影响在不同时间内, 将Ishikawa细胞暴露于不同浓度的TBBPA, 用MTT法测定细胞存活率.由于TBBPA在低浓度和高浓度水平对细胞的毒性效应有差异, 因此, 本实验设置了较宽的浓度梯度, 结果如图 1所示.由图可知, 与对照组相比, TBBPA浓度为0~1.00×10-7 mol·L-1时, 细胞存活率显著升高, 并且细胞存活率随着时间的增加而升高.然而, TBBPA浓度范围大于1.00×10-7 mol·L-1时, 细胞存活率随着浓度的增加而下降.结果表明, 低浓度的TBBPA(1.00×10-9、1.00×10-8、1.00×10-7 mol·L-1)可促进Ishikawa细胞存活率的升高.而已知人体血液中TBBPA的剂量大约是1.3×10-8~9.5×10-12 mol·L-1(Hagmar et al., 2000; Hayama et al., 2004).因此, 后续实验选择的TBBPA浓度分别为1.00×10-9、1.00×10-8、1.00×10-7 mol·L-1.
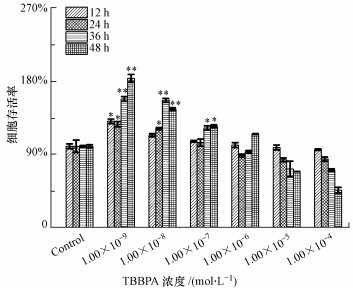 |
| 图 1 TBBPA暴露对Ishikawa细胞存活率的影响(与对照组相比, *p < 0.05, **p < 0.01) Fig. 1 Effect of TBBPA exposure on Ishikawa cells viability rate(Compared with the control, *p < 0.05, **p < 0.01) |
TBBPA不同浓度和时间暴露Ishikawa细胞后, 细胞形态变化如图 2所示.由图 2可知, 对照组细胞形态呈正常卵石状, 细胞均一, 生长良好;经不同浓度的TBBPA(1.00×10-9、1.00×10-8、1.00×10-7 mol·L-1)暴露36 h后, Ishikawa细胞的数量变化不明显, 但细胞间隙变宽, 少数细胞出现丝状伪足(图 2a).随着浓度为1.00×10-7 mol·L-1的TBBPA暴露时间(0、12、24、36 h)的增加, Ishikawa细胞数量逐渐增多, 除此以外, 细胞出现丝状伪足并且部分呈现长梭形间质细胞的形态(图 2b).以上结果说明, 细胞形态由上皮向间质转化, 利于肿瘤恶化的发生.
 |
| 图 2 TBBPA暴露对Ishikawa细胞形态结构变化的影响(a.不同浓度TBBPA暴露后Ishikawa细胞的形态变化;b.不同时间TBBPA暴露后Ishikawa细胞的形态变化;白色箭头指示为细胞伪足) Fig. 2 Effect of TBBPA exposure on morphological change of endometrial cancer Ishikawa cells (a. The morphological changes of Ishikawa cells were observed after TBBPA exposure of different doses; b.Morphological changes of Ishikawa cells were observed after TBBPA exposure in different time; White arrows showed pseudopod of cells) |
肿瘤细胞的侵袭是癌症转移及恶化的重要过程之一.在TBBPA暴露的不同浓度和时间下, Transwell检测Ishikawa细胞侵袭率的结果如图 3所示.与正常对照组相比, 随着TBBPA暴露浓度的增加, 细胞侵袭率升高, 并且在TBBPA浓度为1.00×10-7 mol·L-1组中, 细胞侵袭率达到最大值, 分别为150%(48 h)、190%(96 h).此外, 在TBBPA相同浓度的暴露组中, 96 h的细胞侵袭率明显高于48 h.
 |
| 图 3 TBBPA暴露对Ishikawa细胞侵袭的影响(a. Transwell法检测TBBPA暴露后Ishikawa细胞的侵袭情况;b. Ishikawa细胞的侵袭情况的定量统计;与对照组相比, *p < 0.05, **p < 0.01) Fig. 3 Effect of TBBPA exposure on Ishikawa cell invasion(a. The invasion of Ishikawa cells after TBBPA exposure was detected by Transwell; b. The invasion of Ishikawa cells was analyzed quantitatively; Compared with the control, *p < 0.05, **p < 0.01) |
已知癌细胞的转移是肿瘤恶化的主要原因.本研究用不同浓度的TBBPA在不同时间下暴露Ishikawa细胞, 细胞划痕实验与Transwell检测迁移率结果如图 4所示.由图 4a、4b可知, 在TBBPA暴露的实验组中, 细胞划痕愈合率与对照组相比显著升高, 并且在TBBPA浓度为1.00×10-7 mol·L-1组中, 细胞划痕愈合率达到68%.随着TBBPA暴露的时间的增加, 细胞划痕愈合率升高(图 4c、4d), 在36 h的TBBPA暴露组中, 细胞划痕愈合率是对照组的2.3倍.此外, TBBPA暴露显著地促进了Ishikawa细胞迁移率的升高(图 4e、4f), 呈浓度依赖性;并且在TBBPA浓度为1.00×10-7 mol·L-1组中, 96 h的细胞迁移率略高于48 h.
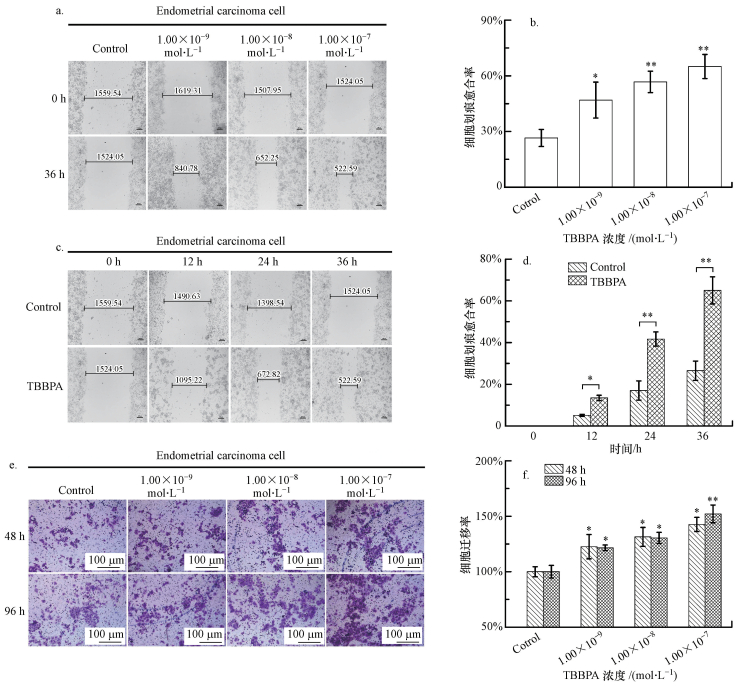 |
| 图 4 TBBPA暴露对Ishikawa细胞迁移的影响(a, b.不同浓度的TBBPA暴露后Ishikawa细胞的划痕情况;c, d. TBBPA暴露不同时间后Ishikawa细胞的划痕情况;e, f. Transwell法检测TBBPA暴露后Ishikawa细胞的侵袭情况;与对照组相比, *p < 0.05, **p < 0.01) Fig. 4 Effect of TBBPA exposure on Ishikawa cell migration(a, b.Wound healing of Ishikawa cells was detected after TBBPA exposure of different concentrations; c, d. Wound healing of Ishikawa cells was detected after TBBPA exposure in different time; e, f. The migration of Ishikawa cells after TBBPA exposure was detected by Transwell; Compared with the control, *p < 0.05, **p < 0.01) |
EMT是肿瘤细胞侵袭与迁移的前提, 其变化是肿瘤恶化的重要机制之一.不同浓度的TBBPA暴露后, Ishikawa细胞的EMT标志物及转录因子表达情况如图 5所示.由图 5a~c可知, 与对照组相比, EMT标志物E-cadherin的mRNA与蛋白的表达明显下降, 而Vimentin的mRNA和蛋白表达显著升高.与此同时, N-cadherin的mRNA表达显著升高, 并在TBBPA最高浓度组(1.00×10-7 mol·L-1)中, mRNA的表达量比对照组高2.5倍, 这与N-cadherin的蛋白水平的结果相一致.由图 5d~f可知, 在TBBPA暴露组中, EMT转录因子Snail-1的mRNA与蛋白水平显著上升.Twist的mRNA与蛋白水平在TBBPA浓度为1.00×10-8、1.00×10-7 mol·L-1组中比对照组明显上升.以上结果表明, TBBPA能促进Ishikawa细胞EMT的发生.
 |
| 图 5 TBBPA暴露对Ishikawa细胞EMT的影响(a. TBBPA暴露诱导EMT标志物在mRNA水平的表达;b, c. TBBPA暴露诱导EMT标志物在蛋白水平的表达;d. TBBPA暴露诱导EMT转录因子在mRNA水平的表达;e, f. TBBPA暴露诱导EMT转录因子在蛋白水平的表达;与对照组相比, *p < 0.05, **p < 0.01) Fig. 5 Effect of TBBPA exposure on Ishikawa cell EMT(a. TBBPA exposure induced expression of EMT markers in mRNA level; b, c. TBBPA exposure induced expression of EMT markers in protein level; d. TBBPA exposure induced expression of transcription factor of EMT in mRNA level; e, f. TBBPA exposure induced expression of transcription factor of EMT in protein level; Compared with the control, *p < 0.05, **p < 0.01) |
流行病学研究表明, TBBPA暴露引起肝母细胞瘤、血管肉瘤和大肠肿瘤的发病率增加, 并导致子宫腺癌和恶性混合苗勒氏子宫肿瘤恶化(Dunnick et al., 2015).多种肿瘤恶化机理与EMT相关(Cha et al., 2015), 但TBBPA对子宫内膜癌EMT的影响及可能机理还不是很清楚.
肿瘤的侵袭转移是导致恶性肿瘤患者死亡的主要原因, 而EMT与肿瘤细胞的侵袭转移关系密切(Fischer et al., 2015).在EMT过程中, 肿瘤组织中的上皮细胞失去极性, 转化为无极性的间质细胞, 细胞间和细胞与基底膜之间的黏附作用减弱, 良性肿瘤侵袭与迁移的能力增加, 并发展成转移性肿瘤(Acloque et al., 2008; Chang et al., 2007; Micalizzi et al., 2010).同时, 肿瘤能够靶向作用于器官, 黏附于血管壁上并建立新的微环境, 通过侵袭与迁移作用扩散至远端器官, 最终促进肿瘤恶化(Smyth et al., 2014).因此, EMT调控的肿瘤侵袭和迁移在肿瘤恶化过程中起着重要的作用.本研究探讨了TBBPA暴露促进子宫内膜癌的侵袭与迁移的能力, 结果显示, TBBPA暴露导致Ishikawa细胞侵袭率显著升高, 并随着暴露时间的增加而升高.其次, TBBPA暴露促进Ishikawa细胞划痕愈合率增加, 并且二者呈时间依赖性关系.此外, Transwell检测细胞迁移率的结果表明, TBBPA暴露促进Ishikawa细胞迁移率增加, 这与细胞划痕的结果相一致.因此, 本研究证实了TBBPA暴露通过促进Ishikawa细胞的侵袭与迁移, 导致子宫内膜癌恶化.
EMT是由多种因子参与调控的过程, 其中, E-cadherin、Vimentin、N-cadherin是肿瘤细胞发生EMT的标志蛋白(Iwamaru et al., 2007).E-cadherin被视为EMT的主要调控者, 维持正常上皮细胞的极性, E-cadherin表达缺失会导致细胞丧失上皮表型, 降低细胞粘附, 易于转移(Rivat et al., 2004).Vimentin、N-cadherin是间质表型特征分子, 调节细胞骨架蛋白、细胞粘附分子等蛋白间的相互作用(Delfortrie et al., 2011).在EMT过程中, E-cadherin表达降低, 细胞极性消失, 细胞间的粘附减弱, 而与细胞骨架相关的Vimentin及N-cadherin的表达反而升高以便维持长梭形的间质细胞形态, 这与本研究结果一致(Voulgaei et al., 2009).在本研究中, TBBPA暴露后, Ishikawa细胞存活率显著升高并且形态明显改变, 由原来的卵圆形向长梭形转变, 细胞间间隙明显增宽, 少数出现丝状伪足.与此同时, Q-PCR与Western blotting结果表明, 在mRNA和蛋白水平上, E-cadherin表达显著降低, 而Vimentin和N-cadherin表达显著升高.因此, TBBPA暴露促进Ishikawa细胞EMT的发生与其影响E-cadherin、Vimentin和N-cadherin的表达有关.
有研究表明, 多种转录因子靶向调控EMT下游基因, 促进肿瘤的侵袭和转移, 其中包括Snail和Twist(Batlle et al., 2000 ).Snail是一种锌指蛋白, Twist是一种高度保守的碱性螺旋-环-螺旋转录因子, 二者可特异性识别E-cadherin启动子区的E-box, 抑制E-cadherin的表达并诱导N-cadherin、Vimentin的表达, 促进EMT的发生(Batlle et al., 2000; Smit et al., 2009).此外, Twist也能够上调Snail的表达(Casas et al., 2011).本研究发现, TBBPA暴露明显上调了Twist与Snail-1的mRNA与蛋白的表达量, 表明EMT标志物的变化与二者的表达有关, 进而二者共同作用促进了Ishikawa细胞EMT的发生, 但TBBPA暴露后EMT介导子宫内膜癌恶化的机理还需深入研究.
5 结论(Conclusions)1) 低浓度的TBBPA暴露可促进细胞侵袭和迁移的发生, 进而导致子宫内膜癌的恶化.
2) TBBPA通过激活EMT, 促进子宫内膜癌的侵袭和迁移.
3) TBBPA激活EMT的过程与转录因子Twist与Snail-1的表达有关, 这一过程可能是TBBPA暴露促进子宫内膜癌恶化的关键机理之一.
Abou-Elwafa Abdallah M. 2016. Environmental occurrence, analysis and human exposure to the flame retardant tetrabromobisphenol-A(TBBP-A)-A review[J]. Environment International, 94: 235–250.
DOI:10.1016/j.envint.2016.05.026
|
安欣, 崔志利, 路三军, 等. 2017. DAPK、c-mcy、P53、Caspase-3在子宫内膜癌中的表达[J]. 中国妇幼健康研究, 2017, 28(2): 117.
|
Acloque H, Thiery J P, Nieto M A. 2008. The physiology and pathology of the EMT.Meeting on the epithelial-mesenchymal transition[J]. EMBO Reports, 9(4): 322–326.
DOI:10.1038/embor.2008.30
|
Batlle E, Sancho E, Franci C, et al. 2000. The transcription factor snail is a repressor of E-cadherin gene expression in epithelial tumour cells[J]. Nature cell biology, 2(2): 84–89.
DOI:10.1038/35000034
|
Covaci A, Gerecke A C, Law R J, et al. 2006. Hexabromocyclododecanes (HBCDs) inthe environmentandhumans:a review[J]. Environ Sci Technol, 40(17): 3679–3688.
|
Cariou R, Antignac J P, Zalko D, et al. 2008. Exposure assessment of French women and their newborns to tetrabromobisphenol A:occurrence measurements in maternal adipose tissue, serum, breast milk and cord serum[J]. Chemosphere, 73(7): 1036–1041.
DOI:10.1016/j.chemosphere.2008.07.084
|
Cha Y H, Yook J I, Kim H S, et al. 2015. Catabolic metabolism during cancer EMT[J]. Archives of Pharmacal Research, 38(3): 313–320.
DOI:10.1007/s12272-015-0567-x
|
Chang J Y, Wright J M, Svoboda K K. 2007. Signal transduction pathways involved in epithelial-mesenchymal transition in oral cancer compared with other cancers[J]. Cells Tissues Organs, 185(1/3): 40–47.
|
Casas E, Kim J, Bendesky A, et al. 2011. Snail2 is an essential mediator of Twist1-induced epithelial mesenchymal transition and metastasis[J]. Cancer Research, 71(1): 245–254.
DOI:10.1158/0008-5472.CAN-10-2330
|
Cariou R, Antignac J P, Marchand P, et al. 2005. New multiresidue analytical method dedicated to trace level measurement of brominated flame retardants in human biological matrices[J]. Journal of Chromatography A, 1100(2): 144–152.
DOI:10.1016/j.chroma.2005.09.040
|
Dunnick J K, Sanders J M, Kissling G E, et al. 2015. Environmental chemical exposure may contribute to uterine cancer development:Studies with tetrabromobisphenol A[J]. Toxicologic Pathology, 43(4): 464–473.
DOI:10.1177/0192623314557335
|
Delfortrie S, Pinte S, Mattot V, et al. 2011. Egfl7 promotes tumor escape fromimmunity by repressing endothelial cell activation[J]. Cancer Research, 71(23): 7176–7186.
DOI:10.1158/0008-5472.CAN-11-1301
|
Feng A H, Chen S J, Chen M Y, et al. 2012. Hexabromocyclododecane(HBCD) and tetrabromobisphenol A(TBBPA) in riverine and estuarine sediments of the Pearl River Delta in southern China, with emphasis on spatial variability in diastereoisomer-and enantiomer-specific distribution of HBCD[J]. Marine Pollution Bulletin, 64(5): 919–925.
DOI:10.1016/j.marpolbul.2012.03.008
|
Fischer K R, Durrans A, Lee S, et al. 2015. Epithelial-to-mesenchymal transition is not required for lung metas-tasis but contributes to chemoresistance[J]. Nature, 527(7579): 472–476.
DOI:10.1038/nature15748
|
Grosse Y, Loomis D, Guyton K Z, et al. 2016. International agency for research on cancer monograph working group.Carcinogenicity of some industrial chemicals[J]. Lancet Oncology, 17(4): 419–420.
DOI:10.1016/S1470-2045(16)00137-6
|
Hayama T, Yoshida H, Onimaru S, et al. 2004. Determination of tetrabromobisphenol A in human serum by liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Journal of Chromatography B, 809(1): 131–136.
DOI:10.1016/j.jchromb.2004.06.013
|
Hagmar L, Jakobsson K, Thureason K, et al. 2000. Computer technicians are occupationally exposed to polybrominated diphenyl ethers and tetrabromobisphenol A[J]. Organohalogen Comp, 47: 202–205.
|
Iwamaru A, Szymanski S, Iwado E, et al. 2007. A novel inhibitor of the STAT3 pathway induces apoptosis in malignant glioma cells both in vitro and in vivo[J]. Oncogene, 26(17): 2435–2444.
DOI:10.1038/sj.onc.1210031
|
Mäkinen M S E, Mäkinen M R A, Koistinen J T B, et al. 2009. Respiratory and dermal exposure to organo phosphorus flame retardants and tetrabromobisphenolA at five work environments[J]. Environmental Science & Technology, 43(3): 941–947.
|
Micalizzi D S, Farabaugh S M, Ford H L. 2010. Epithelia-mesenchymal transition in cancer:parallels between normal development and tumor progression[J]. Journal of Mammary Gland Biology & Neoplasia, 15(2): 117–134.
|
Rivat C, De Wever O, Bruyneel E, et al. 2004. Disruption of STAT3 signaling leads to tumor cell invasion through alterations of homotypic cell-cell adhesion complexes[J]. Oncogene, 23(19): 3317–3327.
DOI:10.1038/sj.onc.1207437
|
Sánchezbrunete C, Miguel E, Tadeo J L. 2009. Determination of tetra-bromobisphenol-A, tetrachlorobisphenol-A and bisphenol-A insoil by ultrasonic assisted extraction and gas chromatography mass spectrometry[J]. Journal of Chromatography A, 1216(290): 5497–5503.
|
Shi Z X, Wu Y N, Li J G, et al. 2009. Dietary exposure assessment of Chinese adults and nursing infants to tetrabromobisphenol A and hexabromocyclododecanes:Occurrence measurements in foods and human milk[J]. Environmental Science & Technology, 43(12): 4314–4319.
|
Smyth E C, Sclafani F, Cunningham D. 2014. Emerging molecular targets in oncology:clinical potential of MET/hepatocyte growth-factorinhibitors[J]. Oncotargets & Therapy, 7: 1001–1014.
|
Smit M A, Gerger T R, Song J Y, et al. 2009. A twist-snail axis critical for trkb-induced epithelial-mesenchymal transition-like transformation, anoikis resistance, and metastasis[J]. Molecular & Cellular Biology, 29(13): 3722–3737.
|
Tsuji T, baragi S, Hu G F. 2009. Epithelial-mesenchymal transition and cell cooperativity in metastasis[J]. Cancer Research, 69(18): 7135–7139.
DOI:10.1158/0008-5472.CAN-09-1618
|
Thiery J P. 2002. Epithelial-mesenchymal transitions in tumour progression[J]. Nature Reviews Cancer, 2(6): 442–454.
DOI:10.1038/nrc822
|
Wu Y Y, Li Y Y, Kang D, et al. 2016. Tetrabromobisphenol A and heavy metal exposure via dust ingestion in an e-waste recycling region in Southeast China[J]. Science of the Total Environment, 541: 356–364.
DOI:10.1016/j.scitotenv.2015.09.038
|
Voulgaei A, Pintzas A. 2009. Epithelial-mesenchymal transition in cancer metastasis:mechanisms, markers and strategies to overcome drug resistance in the clinic[J]. Biochimica et Biophysica Acta, 1796(2): 75–90.
|
Zhang X L, Luo X J, Chen S J, et al. 2009. Spatial distribution and vertical profile of polybrominated diphenylethers, tetrabromobisphenol A, and decabromodiphenylethane in river sediment from an industrialized region of South China[J]. Environmental Pollution, 157(6): 1917–1923.
DOI:10.1016/j.envpol.2009.01.016
|
张翠玲, 王树鹤, 孙藜. 2013. c-mcy、cyclin E在绝经前期子宫内膜息肉中的表达[J]. 武警医学, 2013, 24(1): 29–32.
DOI:10.3969/j.issn.1004-3594.2013.01.010 |
 2018, Vol. 38
2018, Vol. 38


