2. 安徽省高校生物环境与生态安全省级重点实验室, 芜湖 241000
2. Key Laboratory of Biotic Environment and Ecological Safety in Anhui Province, Wuhu 241000
近年来, 全球变暖和水体污染问题越来越受到国内外研究者的关注.随着全球气温的持续升高, 由此引发的富营养化水体中蓝藻水华逐渐加剧.随着有毒藻细胞的衰老、死亡和裂解, 胞内藻毒素释放于水体中并持续存在一段时间, 这严重影响了水生生物的生长、发育和繁殖等生命活动, 甚至能够通过食物链间接危害人体健康(Carmichael et al., 1990; Berry et al., 2010; Barrios et al., 2015).铜绿微囊藻(Microcystis aeruginosa)是水华蓝藻中的主要优势藻种, 其产生的微囊藻毒素(Microcystins, MCs), 尤其是微囊藻毒素-LR(MC-LR)成为污染水体中分布广、含量高及毒性强的肝毒素类环境污染物(Codd, 2000; Frazão et al., 2010).此前的研究表明, 自然水体中藻毒素的浓度范围从痕量至1.8 mg·L-1, 甚至更高(Jones et al., 1994; Chorus et al., 1999).在芬兰, 自然环境中有毒微囊藻毒素的浓度偶尔会高达5.2 mg·L-1(Lepistö et al., 2005; Rapala et al., 2005).在荷兰的一个饮用水水库(De Gijster)中, 浮渣表面的微囊藻毒素浓度可达到极高值52 mg·L-1(Hoogenboezem et al., 2004).轮虫是浮游动物重要类群之一, 因其具有繁殖迅速、世代时间短及对环境污染物敏感等优点, 从而成为生态毒理学和水环境监测的理想模式生物之一, 其暴露于环境毒物下的生理生态学效应可作为污染物生态风险评估的重要依据.
蛋白质是生命最重要的物质基础, 在生物的生长、发育、繁殖、运动、衰老和死亡等过程中起到非常重要的作用.当生物体受到外界环境变化所带来的压力胁迫时, 生物体可通过调节体内相关蛋白质的表达来帮助机体更好地适应环境.热激蛋白(Heat shock proteins, Hsps)是一类在分子进化上保守性很高、普遍存在于生物体内的蛋白质.热激蛋白的种类繁多, 根据分子量大小通常将其分为六大家族, 即Hsp110、Hsp90、Hsp70、Hsp60、Hsp40和小分子smHsps(分子量为12~43 kDa).Hsps作为分子伴侣主要参与蛋白质的折叠、转运和组装过程, 并能够促使错误折叠的蛋白质进行修复或进入降解途径而消除(Hartl, 1996; Bukau et al., 1998).在应激状态下, Hsps在保护细胞内蛋白质免受应激损伤、提高生物体耐热性及耐冷性、调节机体或细胞生理反应等方面也起到了至关重要的作用.诱导热激蛋白表达的应激因素繁多, 外源性因素包括温度、pH值、重金属、紫外照射强度、蛋白合成抑制剂、化学试剂及各种有毒物质等.研究发现, 大部分环境胁迫因子均可诱导热激蛋白表达量增加(Wheelock et al., 1998; Rios-Arana et al., 2005; Seo et al., 2006; Dahms et al., 2011), 其中, Hsp70在应激反应中最为敏感, 其基因的表达水平普遍上调(Denlinger et al., 1998;Chen et al., 2004; Rinehart et al., 2007; 谢翎等, 2009).已有研究表明, 0.8 mg·L-1的微囊藻毒素-LR(MC-LR)可显著增加幼年斑马鱼(Danio rerio)多个热激蛋白(Hsp90、Hsp70、Hsp60和Hsp27)的转录表达(Li et al., 2009);对3种鱼(白鲢Hypophthalmichthys molitrix、草鱼Ctenopharyngodon idellus和尼罗罗非鱼Oreochromis nilotica)进行腹膜腔内注射MC-LR(50 μg·kg-1体重), 8 h后的尼罗罗非鱼Hsp70显著增加, 而其它两者的Hsp70未见显著性差异(He et al., 2010);通过灌胃对小鼠进行蓝藻水华粗提物暴露研究发现, 在最高浓度组(93 μg·kg-1体重)时, Hsp70的表达水平显著提高(黄朴等, 2009).就轮虫而言, 许多环境胁迫因子均可诱导其体内热激蛋白(Hsp60和Hsp70)的转录表达, 如原油水溶性成分(Water-accommodated fraction of crude oil, WAF)、分散油(Dispersed oil, DO)、重金属(Cr、Cu、Ni、Pb和Zn)、H2O2、孕酮、高温和低温、UV-B辐射及限制摄食等(Wheelock et al., 2002; Rios-Arana et al., 2005; Kim et al., 2011; Yang et al., 2014; 季亚培, 2016; Xiang et al., 2017a).虽然微囊藻毒素MC-LR或有毒蓝藻对轮虫的生长、繁殖和发育影响已有研究, 并表现出显著的长期慢性毒害作用(Paerl et al., 2001; Lürling, 2003; Zhang et al., 2012; Huang et al., 2012; Xiang et al., 2017b), 然而, 微囊藻毒素对轮虫热激蛋白Hsp70水平的影响如何尚未见报道.
本研究采用Western blot技术探究在不同温度下萼花臂尾轮虫(Brachionus calyciflorus)经微囊藻毒素-LR(MC-LR)处理后, 其热激蛋白Hsp70含量的变化情况.此研究的开展有利于进一步探究热激蛋白水平对外源性应激因素的响应规律, 为深入了解水生生物在生理水平上应对环境污染物胁迫的适应机制提供理论依据.
2 材料与方法(Materials and methods) 2.1 轮虫的采集与培养实验用萼花臂尾轮虫采自青海省西宁市药水潭(36°39′N, 101°42′E).将采集的轮虫活体带回实验室置于(24±1) ℃、自然光照条件下(光照强度约130 lx, L:D=14 h:10 h)的恒温培养箱中进行“克隆”培养.培养液采用EPA配方(Peltier et al., 1985), 并采用HB-4培养基(黎尚豪等, 1959)培养的处于指数增长期的斜生栅藻(Scenedesmus obliquus)作为轮虫饵料, 每24 h投喂一次饵料及更换一次培养液, 投喂藻类密度为1.0×106 cells·mL-1.培养时间在1个月以上.
2.2 轮虫的MC-LR处理实验用微囊藻毒素MC-LR(纯度95%)购自于依普瑞斯科技有限公司(北京), 由台湾藻研有限公司(Taiwan Algal Science Inc.)生产的MC-LR(Microcystin-LR, MCYL1GAM004)分装所得.根据微囊藻毒素在全球自然水体中的含量, 本研究将微囊藻毒素浓度设置为2.0、4.0和6.0 mg·L-1.实验前, 用蒸馏水配制50 mg·L-1的MC-LR母液, 于4 ℃冰箱中备用;实验时用EPA培养基将其逐步稀释成所需浓度的测试液;母液每3 d配制一次.本实验中温度梯度设置为4组, 即16、20、24和28 ℃.故实验共计设置16组(4个温度×3个MC-LR浓度+4个对照组), 每组3个重复.将预培养的轮虫分别置于上述48个50 mL烧杯中(初始密度约为80只· mL-1, 每个重复约4000只轮虫个体), 期间不投喂食物, 胁迫12 h后, 用预热至相同温度的EPA培养液过滤冲洗并收集轮虫, 用于后续的Western blot实验.
2.3 轮虫蛋白质的提取将收集的轮虫样品立即置于-80 ℃冷冻致死(约3 h以上), 之后取出轮虫并梯度融化用于蛋白质提取.蛋白质提取液包含1 mL Lysis buffer、1 μL蛋白酶抑制剂、5 μL磷酸酶抑制剂和10 μL苯甲基磺酰氟(PMSF), 混匀后置于冰盒中备用.将梯度融化后的轮虫进行高速离心5 min(6000 r·min-1, 4 ℃), 弃去上清液, 再加入500 μL蛋白质提取液混匀, 置于冰盒上进行超声波破碎处理.将处理后的蛋白质粗提取液进行高速离心10 min(13000 r·min-1, 4 ℃), 小心吸取上清液至干净的1.5 mL离心管中, 即轮虫全蛋白提取物, 然后置于-20 ℃冰箱中保存待用.
2.4 轮虫Hsp70含量的检测—Western blot取上述10 μL蛋白提取液与等量的2×SDS上样缓冲液充分混匀, 于98 ℃金属浴上进行蛋白质变性处理10 min, 取出后冷却至室温;将蛋白质样和双色预染蛋白Marker(cat. no. C610011;Sangon Biotech)在10%的聚丙烯酰胺凝胶上进行电泳(80 V电压30 min, 120 V电压90 min).电泳结束后, 在350 mA恒流下转膜90 min, PVDF膜为Millipore公司的Immobilon系列(cat. No. IPVH00010, 0.45 μm).将转有蛋白质的PVDF膜置于5%的脱脂奶粉TBST溶液中4 ℃封闭处理12 h, 将清洗后的PVDF膜分成两部分(热激蛋白Hsp70部分和内参蛋白β-Actin部分), 分别于特异性抗体稀释液中4 ℃下孵育10 h, Hsp70抗体为兔抗HSPA1L多克隆抗体(cat. no. D154145;BBI), 孵育β-Actin的抗体为兔抗β-Actin多克隆抗体(cat. no. D110001;BBI).接着, 取出PVDF膜并用漂洗液TBST漂洗, 再向放有PVDF膜的孵育盒中加入二抗稀释液(HRP标记的山羊抗兔IgG, cat. no. D110058;BBI), 28 ℃摇床上孵育2 h(60 r·min-1), 用漂洗液TBST漂洗PVDF膜.然后, 将配置好的高灵敏ECL发光试剂(cat. no. C500044;Sangon Biotech)滴加在PVDF膜上, 暗室中室温孵育1 min.将孵育后的PVDF膜置于X光片盒中, 在暗室中小心压上X光片(X-OMAT BT, Carestream), 曝光1 min, 然后进行显影和定影.扫描晾干的X光片, 保存图片待处理分析.
2.5 数据分析采用Image J软件对X光片上的蛋白质条带累积光密度进行半定量分析, 计算相对灰度值(Hsp70和β-Actin条带总灰度值的比值).用SPSS 19.0软件对实验数据作正态性分布检验(Kolmogorov-Smirnov)后, 对符合正态分布的各组数据进行方差齐性检验(Levene), 并对无温度胁迫下(24 ℃)MC-LR浓度对轮虫Hsp70含量的影响、无MC-LR胁迫下(0 mg·L-1)温度变化对轮虫Hsp70含量的影响进行单因素方差分析, 对温度与MC-LR的交互作用对轮虫热激蛋白Hsp70含量的影响进行双因素方差分析.采用多重比较(SNK-q检验)分析Hsp70含量的平均数在各组间(温度间和MC-LR浓度间)的差异显著性.
3 结果与讨论(Results and discussion) 3.1 萼花臂尾轮虫热激蛋白Hsp70条带的相对灰度值测定萼花臂尾轮虫在不同温度胁迫下经MC-LR处理后, 其热激蛋白Hsp70含量的Western blot检测结果如图 1所示(仅示一个重复组).采用Image J软件对热激蛋白Hsp70和内参蛋白β-Actin(分子量为42 kD)的蛋白条带进行了半定量分析, 计算各蛋白条带的灰度值(平均值)(表 1).总体来看, 低温下(16 ℃)和未经温度胁迫(24 ℃)的两组萼花臂尾轮虫的Hsp70蛋白质含量较低, 28 ℃下最高, 20 ℃时居中.微囊藻毒素浓度中, 6 mg·L-1的MC-LR处理组的轮虫热激蛋白含量最高, 其它3个浓度下轮虫的Hsp70蛋白含量随温度的变化而存在差异.其中, 相对灰度值在16 ℃、未添加MC-LR(0 mg·L-1)时最低, 仅为0.73±0.05;而最高值在28 ℃、6 mg·L-1的MC-LR胁迫条件下出现, 高达9.56±0.44.
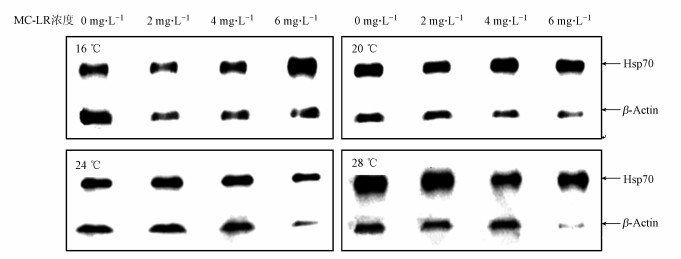 |
| 图 1 经不同温度和MC-LR胁迫处理12 h后萼花臂尾轮虫Hsp70水平的Western blot结果 Fig. 1 The levels of Hsp70 in B. calyciflorus after exposure to MC-LR for 12 h under four temperatures by Western blot detection |
| 表 1 经不同温度和MC-LR胁迫处理12 h后萼花臂尾轮虫Hsp70含量分析(均值±标准误) Table 1 The analyses of Hsp70 levels in B. calyciflorus after exposure to MC-LR for 12 h under four temperatures by Western blot detection (Means ± SE) |
有关纯化的微囊藻毒素对生物的生态毒理学研究已有报道, 而浮游动物是生态毒理学研究中的重要受试生物之一.轮虫常被用于急慢性毒理实验研究, 但与枝角类或桡足类相比, 有关微囊藻毒素(尤其是微囊藻毒素和温度的交互作用)对轮虫的毒性作用研究甚少(Xiang et al., 2017b).热激蛋白是一组高度保守的蛋白质, 在生物体或细胞受环境胁迫因子诱导而表达的一类应激蛋白, 如温度、物理损伤及有毒物质等胁迫均能诱导Hsp基因高效表达(Wheelock et al., 1998; Kalmar et al., 2009).通过本研究发现, 在应激状态下, 轮虫体内热激蛋白的含量较对照组有显著增加(p<0.01), 因此, Hsps的含量变化情况可为评估环境中应激因素的波动状况及胁迫程度提供科学依据.
3.2 微囊藻毒素对萼花臂尾轮虫Hsp70含量的影响本研究中, 在16 ℃下, 2.0和4.0 mg·L-1 MC-LR实验组之间的轮虫Hsp70含量无明显差异, 但显著高于0 mg·L-1实验组, 6.0 mg·L-1 MC-LR胁迫下轮虫的Hsp70蛋白条带的相对灰度值(相较于内参蛋白β-Actin, 下同)为2.26±0.17, 较0、2.0和4.0 mg·L-1实验组均有显著增加(表 2).在20 ℃下, 4.0和6.0 mg·L-1 MC-LR处理组的轮虫Hsp70蛋白条带的相对灰度值分别为3.24±0.13和5.65±0.95, 两处理组之间具有明显差异性, 且均显著高于对照组和2.0 mg·L-1 MC-LR处理组(表 2).在温度对照组下, 即保种培养温度24 ℃下, 0 mg·L-1 MC-LR处理组的轮虫Hsp70蛋白条带的相对灰度值为1.19±0.01, 6.0 mg·L-1 MC-LR处理组的轮虫Hsp70含量显著升高(p<0.01), 相对灰度值为3.81±0.22, 而2.0和4.0 mg·L-1 MC-LR处理组的轮虫Hsp70含量与空白对照组无显著差异(表 3).可见, 24 ℃下高剂量MC-LR可明显促进轮虫Hsp70水平上调.在28 ℃胁迫下, 3个不同剂量的MC-LR处理组(2.0、4.0和6.0 mg·L-1)之间的轮虫Hsp70水平具有显著差异性, 其中, 2.0和6.0 mg·L-1 MC-LR处理组的Hsp70蛋白条带的相对灰度值分别为4.76±0.74和9.56±0.44, 均高于对照组(3.41±0.34), 而经4.0 mg·L-1 MC-LR胁迫后的相对灰度值为2.44±0.30, 较2.0 mg·L-1 MC-LR条件下有所下降, 但与0 mg·L-1 MC-LR处理组间未见显著性差异, 且该Hsp70含量相较于24 ℃、4.0 mg·L-1 MC-LR处理组而言, 仍然是上调表达的(表 2), 这说明温度的升高在轮虫Hsp70调节过程中起到了至关重要的作用;另外, 生物体内不同家族热激蛋白对不同胁迫处理的响应机制各异, 且不同蛋白之间具有相互协调作用, 即在某种条件胁迫后Hsp70水平会减少, 而其他家族热激蛋白如Hsp20、Hsp40、Hsp60或Hsp90等基因水平可能会增加(季亚培, 2016).
| 表 2 温度和MC-LR对萼花臂尾轮虫Hsp70含量的影响(多重比较) Table 2 Effects of temperature and MC-LR on the Hsp70 levels in B. calyciflorus(Multiple comparison) |
| 表 3 温度(T)、MC-LR及其交互作用对萼花臂尾轮虫Hsp70含量的影响(双因素方差分析) Table 3 Effects of temperature, MC-LR and their interactions on the Hsp70 levels in B. calyciflorus (Two-way ANOVA) |
环境污染物如重金属、环境激素及各种化学物质等能够诱导热激蛋白Hsps基因的表达, 且污染水体中轮虫、鱼类和软体动物等多种水生生物体内热激蛋白Hsps基因表达水平与污染物毒性有关(Cochrane et al., 1991; Rios-Arana et al., 2005; Rhee et al., 2011; Lauritano et al., 2013).大量研究证明, MCs对生物具有器官毒性、遗传毒性、神经毒性、免疫毒性和潜在的促癌性, 并能够引起受试生物出现发育异常现象(Eriksson et al., 1990; Chen et al., 2005; Onstad et al., 2007).Jiang等(2012)研究发现, 鲤鱼(Cyprinus carpio L.)的肝脏组织中Hsp70的表达显著受到了MC-LR的诱导, 直至在5.0 μg·L-1 MC-LR下达到最高.Yuan等(2016)将小龙虾(Procambarus clarkii)暴露于不同浓度的MC-LR溶液中, 发现Hsp60、Hsp70和Hsp90的水平均显著上调.李媛(2009)研究了两个剂量(0.2和0.8 mg·L-1)的MC-LR对斑马鱼Hsps表达水平的影响, 结果发现, 高浓度MC-LR更易诱导斑马鱼Hsps表达量的增加, 且Hsp60和Hsp27对毒素应激最为敏感.本研究发现, 高浓度微囊藻毒素MC-LR也能诱导萼花臂尾轮虫体内Hsp70含量的上调.在预培养温度24 ℃下, 经6 mg·L-1 MC-LR胁迫后的轮虫, 其体内Hsp70的含量显著增加, 而两组低剂量的MC-LR未能诱导轮虫Hsp70水平的显著上升.这可能是因为在24 ℃下, 低剂量MC-LR尚未达到诱导Hsp70水平上调的阈值范围.
3.3 温度及其与MC-LR的交互作用对萼花臂尾轮虫Hsp70含量的影响已有大量研究发现, 温度胁迫可诱导生物体Hsps含量的增加, 但低于或超出诱导Hsps的温度阈值或最高温度时, 热激蛋白表达水平受到抑制.Yang等(2014)对萼花臂尾轮虫4种热激蛋白在不同温度下的表达水平进行了研究, 结果发现, 高温(37 ℃)暴露0.5 h可显著上调萼花臂尾轮虫Hsp40、Hsp60和Hsp70的表达量, 此后在一定时间内达到最大值, 随着时间的延续这3种热激蛋白的表达水平又逐渐回归到正常水平;但Hsp90在高温(37 ℃)暴露0.5 h后出现暂时性上调, 紧接着立即回调至对照组水平, 且低温胁迫(15 ℃)对Hsp90表达水平无显著影响.Smith等(2012)也研究发现, 一种褶皱臂尾轮虫(B. manjavacas)的4个热激蛋白家族对温度诱导的响应也不相同.本课题组此前的研究(Xiang et al., 2017)表明, 高温(40 ℃)和低温(16 ℃)均可诱导一种蛭态类轮虫(转轮虫Rotaria rotatoria)Hsp70的持续表达.可见, 不同轮虫种类或轮虫体内不同热激蛋白家族对温度胁迫的分子机制存在较大差异, 诱导不同热激蛋白表达的温度阈值也各不相同.除轮虫外, 该现象在其它类群中也常有发生.4种分布于高潮带、中潮带和低潮带的笠贝(Lottia)热激蛋白Hsp70对温度具有不同的响应策略(Dong et al., 2008).Kummasook等(2007)研究发现, 马尔尼菲青霉(Penicillium marneffi)受39 ℃高温胁迫后, 其Hsp70的表达量上升, 但过高的应激温度(如42 ℃)反而抑制了菌体Hsp70基因的转录表达.崔旭红等(2007)研究发现, 在37~41 ℃温度范围内, 热激处理后的烟粉虱(Bemisia tabaci)成虫体内Hsp70表达水平随着温度的升高而上升, 但过高的温度胁迫(如高于41 ℃)时, 反而会降低粉虱体内的Hsp70水平.这些研究表明, 生物机体仅可在一定温度范围内, 通过增加应激细胞中Hsps基因的表达量来提高自身对温度胁迫的耐受能力.
本研究中, 在无MC-LR胁迫下(0 mg·L-1), 轮虫经20和28 ℃胁迫处理12 h后, 轮虫Hsp70的含量均显著性增加(p<0.001), 相对灰度值分别达到1.82±0.06和3.41±0.34(表 2).这说明在低于或高于常规培养温度时, 轮虫体内的热激蛋白均可被诱导表达, 这与本课题组此前的研究结果完全一致(Xiang et al., 2017a).然而, 经16 ℃低温胁迫12 h后, 其热激蛋白Hsp70条带的相对灰度值为0.73±0.05, 与24 ℃时实验组相比虽然有所减少(24 ℃为1.19±0.01), 但两者间无统计学显著性意义;可见, 无MC-LR胁迫时, 该轮虫的Hsp70水平在低温16 ℃下与保种温度24 ℃无显著差异, 但20和28 ℃的胁迫显著提高了热激蛋白的表达.这可能与诱导生物体Hsp70水平的温度阈值或机体因长期进化所具有的适应环境温度变化的调节机制有关.本研究中的萼花臂尾轮虫采自青海省西宁市, 该地域为高原气候区, 年均气温为7 ℃, 该轮虫品系可能具有更快的适应低温环境的分子调控机制, 因此, 低温16 ℃和对照温度24 ℃的处理未能诱导体内热激蛋白Hsp70的上调表达.
环境胁迫因子间的交互作用可显著上调Hsps水平.Wheelock等(1998; 2002)研究发现, 石油和Cu2+的联合胁迫及石油和营养水平的交互作用可显著诱导褶皱臂尾轮虫(B. plicatilis)Hsp60含量的增加, 其热激蛋白水平较单因素处理组有明显上升.Rios等(2005)研究发现, 砷与重金属(铜、镍、铬、铅和锌)及其相互作用均能够诱导十指扁甲轮虫(Plationus patulus)Hsp60基因的转录表达, 且Hsp60基因对应激因素之间的交互作用响应更加强烈, 同时随着胁迫因子浓度的增加而增强.本研究中, 双因素方差分析结果表明, 温度和MC-LR的交互作用对轮虫热激蛋白Hsp70表达具有极显著性影响(表 3, p<0.001), 表明两个胁迫因子的交互作用可提高轮虫对综合应激环境的胁迫耐受性.多重比较(SNK-q检验)结果显示, 在相同温度胁迫下, 轮虫Hsp70含量随MC-LR浓度的增大呈上升趋势(除28 ℃ 4 mg·L-1 MC-LR实验组外);在相同的MC-LR浓度处理时, 20和28 ℃温度胁迫下的轮虫Hsp70含量较对照组(24 ℃)均明显增加, 尤其是在高温28 ℃胁迫下, 轮虫Hsp70基因对6.0 mg·L-1 MC-LR的应激反应最为敏感, 其蛋白条带的相对灰度值达到9.56±0.44, 是空白对照组(1.19±0.01)的8倍, 而16 ℃实验组与对照组(24 ℃)之间无显著差异(表 2).
4 结论(Conclusions)萼花臂尾轮虫热激蛋白Hsp70可作为检测环境微囊藻毒素(MC-LR)胁迫效应的良好分子标记.温度和微囊藻毒素对萼花臂尾轮虫热激蛋白Hsp70表达具有极显著性影响, 两者的交互作用对Hsp70上调表达的影响更为强烈, 可提高轮虫对综合应激因素的胁迫耐受性.在4个温度下, MC-LR均诱导了轮虫Hsp70的水平上调, 尤其是高剂量MC-LR(6 mg·L-1)对热激蛋白水平的影响极为显著.在20和28 ℃两个温度下, 萼花臂尾轮虫的Hsp70含量均比对照组(24 ℃)显著增加, 但16 ℃实验组与24 ℃对照组间未见显著差异, 这与诱导轮虫Hsp70表达的环境温度阈值或机体对低温环境的长期适应性进化和调节机制有关.
Bukau B, Horwich A L. 1998. The Hsp70 and Hsp60 chaperone machines[J]. Cell, 92(3): 351–366.
DOI:10.1016/S0092-8674(00)80928-9
|
Chen J, Xie P, Guo L, et al. 2005. Tissue distributions and seasonal dynamics of the hepatotoxic microcystins-LR and -RR in a freshwater snail (Bellamya aeruginosa) from a large shallow, eutrophic lake of the subtropical China[J]. Environmental Pollution, 134(3): 423–430.
DOI:10.1016/j.envpol.2004.09.014
|
Chen K Y, Chen Z C. 2004. Heat shock proteins of thermophilic and thermotolerant fungi from Taiwan[J]. Botanical Bulletin of Academia Sinica, 45(3): 247–257.
|
Chorus I, Bartram J. 1999. Toxic Cyanobacteria in Water.A Guide to Their Public Health Consequences, Monitoring, and Management[M]. London: E & FN Spon.
|
Cochrane B J, Irby R B, Snell T W. 1991. Effects of copper and tributyltin on stress protein abundance in the rotifer Brachionus plicatilis[J]. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology and Toxicology, 98(2/3): 385.
|
Codd G A. 2000. Cyanobacterial toxins, the perception of water quality, and the prioritization of eutrophication control[J]. Ecological Engineering, 16(1): 51–60.
DOI:10.1016/S0925-8574(00)00089-6
|
崔旭红, 谢明, 万方浩. 2007. 高温胁迫下b型烟粉虱热激蛋白基因Hsp70表达量的变化[J]. 昆虫学报, 2007, 50(11): 1087–1091.
DOI:10.3321/j.issn:0454-6296.2007.11.001 |
Dahms H U, Hagiwara A, Lee J S. 2011. Ecotoxicology, ecophysiology, and mechanistic studies with rotifers[J]. Aquatic Toxicology, 101(1): 1–12.
|
Denlinger D L, Yocum G D. 1998. Physiology of Heat Sensitivity//Hallman G J, Denlinger D L. Temperature Sensitivity in Insects and Application in Integrated Pest Management[M]. Boulder, Colorado, USA: Westview Press. 7-54
|
Dong Y, Miller L P, Sanders J G, et al. 2008. Heat-shock protein 70 (Hsp70) expression in four limpets of the genus Lottia:interspecific variation in constitutive and inducible synthesis correlates with in situexposure to heat stress[J]. Biology Bulletin, 215(2): 173–181.
DOI:10.2307/25470698
|
Eriksson J E, Grönberg L, Nygård S, et al. 1990. Hepatocellular uptake of 3H-dihydromicrocystin-LR, a cyclic peptide toxin[J]. Biochimica et Biophysica Acta, 1025(1): 60–66.
DOI:10.1016/0005-2736(90)90190-Y
|
Frazão B, Martins R, Vasconcelos V. 2010. Are known cyanotoxins involved in the toxicity of picoplanktonic and filamentous north Atlantic marine cyanobacteria?[J]. Marine Drugs, 8(6): 1908–1919.
DOI:10.3390/md8061908
|
Hartl F U. 1996. Molecular chaperones in cellular protein folding[J]. Nature, 381(6583): 571–580.
DOI:10.1038/381571a0
|
He S, Liang X F, Li R Q, et al. 2010. Molecular characterization of heat shock protein 70 genes in the liver of three warm freshwater fishes with differential tolerance to microcystin-LR[J]. Journal of Biochemical and Molecular Toxicology, 24(5): 293–302.
DOI:10.1002/jbt.v24:5
|
Hoogenboezem W, Wagenvoort A J, Blaauboer K. 2004. The occurence of toxic cyanobacteria: in some Dutch surface waters used for the production of drinking water[R]. Nieuwegein: RIWA report
|
黄朴, 孙瑜, 李覃, 等. 2009. 蓝藻水华粗提物对小鼠肝脏HSP70, GRP78表达的影响[J]. 环境科学学报, 2009, 29(6): 1278–1282.
|
Huang L, Xi Y L, Xu X P, et al. 2012. Responses in population growth and reproduction of the freshwater rotifer Brachionus calyciflorus to microcystin-LR at different temperatures[J]. Annales de Limnologie - International Journal of Limnology, 48(4): 383–390.
DOI:10.1051/limn/2012029
|
季亚培. 2016. 孕酮对萼花臂尾轮虫(B. calyciflorus)生殖及热休克蛋白基因表达的影响[D]. 南京: 南京师范大学
http://cdmd.cnki.com.cn/Article/CDMD-10319-1016295601.htm |
李媛. 2009. 微囊藻毒素-LR对鱼类分子毒性效应的研究[D]. 武汉: 华中科技大学
http://cdmd.cnki.com.cn/Article/CDMD-10487-2009173717.htm |
Jiang J, Shi Y, Shan Z, et al. 2012. Bioaccumulation, oxidative stress and HSP70 expression in Cyprinus carpio L.exposed to microcystin-LR under laboratory conditions[J]. Comparative Biochemistry and Physiology, Part C, 155(3): 483–490.
|
Jones G J, Orr P T. 1994. Release and degradation of microcystin following algicide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhibition assay[J]. Water Research, 28(4): 871–876.
DOI:10.1016/0043-1354(94)90093-0
|
Kalmar B, Greensmith L. 2009. Induction of heat shock proteins for protection against oxidative stress[J]. Advanced Drug Delivery Reviews, 61(4): 310–318.
DOI:10.1016/j.addr.2009.02.003
|
Kim R O, Rhee J S, Won E J, et al. 2011. Ultraviolet B retards growth, induces oxidative stress, and modulates DNA repair-related gene and heat shock protein gene expression in the monogonont rotifer, Brachionus sp.[J]. Aquatic Toxicology, 101(3/4): 529–539.
|
Kummasook A, Kummasook A, Pongpom P, et al. 2007. Cloning, characterization and differential expression of an gene from the pathogenic dimorphic fungus[J]. Mitochondrial DNA, 18(5): 385–394.
|
Lauritano C, Carotenuto Y, Procaccini G, et al. 2013. Changes in expression of stress genes in copepods feeding upon a non-brevetoxin-producing strain of the dinoflagellate Karenia brevis[J]. Harmful Algae, 28(28): 23–30.
|
Lepistö L, Rapala J, Lyra C, et al. 2005. Occurrence and toxicity of cyanobacterial blooms dominated by Anabaena lemmermannii P.Richter and Aphanizomenon spp.in boreal lakes in 2003[J]. Algological Studies, 117(1): 315–328.
DOI:10.1127/1864-1318/2005/0117-0315
|
黎尚豪, 朱蕙, 夏宜琤, 等. 1959. 单细胞绿藻的大量培养试验[J]. 水生生物学集刊, 1959(4): 462–472.
|
Li Y, Sun B J, Wu H J, et al. 2009. Effects of pure microcystin-LR on the transcription of immune related genes and heat shock proteins in larval stage of zebrafish (Danio rerio)[J]. Aquaculture, 289(1/2): 154–160.
|
Lürling M. 2003. Daphniagrowth on microcystin-producing and microcystin-free Microcystis aeruginosain different mixtures with the green alga Scenedesmus obliques[J]. Limnology and Oceanography, 48(6): 2214–2220.
DOI:10.4319/lo.2003.48.6.2214
|
Onstad G D, Strauch S, Meriluoto J, et al. 2007. Selective oxidation of key functional groups in cyanotoxins during drinking water ozonation[J]. Environmental Science and Technology, 41(12): 4397–4404.
DOI:10.1021/es0625327
|
Paerl H W, Rd F R, Moisander P H, et al. 2001. Harmful freshwater algal blooms, with an emphasis on cyanobacteria[J]. The Scientific World Journal, 1(1): 76–113.
|
Peltier W H, Weber C I. 1985. Methods for measuring the acute toxicity of effluents to freshwater and marine organisms, EPA/600/4-85/013[S]. Cincinnati, Ohio: United States Environmental Protect Agency
|
Rapala J, Robertson A, Negri A P, et al. 2005. First report of saxitoxin in Finnish Lakes and possible associated effects on human health[J]. Environmental Toxicology, 20(3): 331–340.
DOI:10.1002/(ISSN)1522-7278
|
Rhee J S, Kim R O, Choi H G, et al. 2011. Molecular and biochemical modulation of heat shock protein 20 (Hsp20) gene by temperature stress and hydrogen peroxide (H2O2) in the monogonont rotifer, Brachionussp.[J]. Comparative Biochemistry and Physiology Part C Toxicology and Pharmacology, 154(1): 19–27.
DOI:10.1016/j.cbpc.2011.02.009
|
Rinehart J P, Li A, Yocum G D, et al. 2007. Up-regulation of heat shock proteins is essential for cold survival during insect diapause[J]. Proceedings of the National Academy of Sciences of the United States of America, 104(27): 11130–11137.
DOI:10.1073/pnas.0703538104
|
Rios-Arana J V, Gardea-Torresdey J L, Webb R, et al. 2005. Heat shock protein 60 (Hsp60) response of Plationus patulus, (Rotifera:Monogononta) to combined exposures of arsenic and heavy metals[J]. Hydrobiologia, 546(1): 577–585.
DOI:10.1007/s10750-005-4308-x
|
Seo J S, Lee Y M, Park H G, et al. 2006. The intertidal copepod Tigriopus japonicus small heat shock protein 20 gene (Hsp20) enhances thermotolerance of transformed Escherichia coli[J]. Biochemical and Biophysical Research Communications, 340(3): 901–908.
DOI:10.1016/j.bbrc.2005.12.086
|
Smith H A, Burns A R, Shearer T L, et al. 2012. Three heat shock proteins are essential for rotifer thermotolerance[J]. Journal of Experimental Marine Biology and Ecology, 413: 1–6.
DOI:10.1016/j.jembe.2011.11.027
|
Wheelock C E, Baumgartner T A, Newman J W, et al. 2002. Effect of nutritional state on Hsp60 levels in the rotifer Brachionus plicatilis following toxicant exposure[J]. Aquatic Toxicology, 61(1/2): 89–93.
|
Wheelock C E, Wolfe M F, Olsen H, et al. 1998. Characterization of Hsp60 response in the rotifer, Brachionus plicatilis exposed to multiple environmental contaminants[J]. Marine Environmental Research, 46(1/5): 453–456.
|
Xiang X L, Jiang R M, Chen Y Y, et al. 2017a. Regulation of heat shock protein 70 (Hsp70) levels in the bdelloid rotifer Rotaria rotatoria under temperature stress[J]. Israel Journal of Ecology and Evolution, 64(1): 69–77.
|
Xiang X L, Chen Y Y, Xu Q L, et al. 2017b. Combined effects of temperature and the microcystin MC-LR on the feeding behavior of the rotifer Brachionus calyciflorus[J]. Bulletin of Environmental Contamination and Toxicology, 99(4): 493–499.
DOI:10.1007/s00128-017-2172-9
|
谢翎, 陈红梅, 汤强, 等. 2009. 实时荧光定量PCR检测球孢白僵菌热休克蛋白基因Hsp70在几种胁迫条件下的表达[J]. 菌物学报, 2009, 28(6): 806–812.
|
Yang J, Mu Y, Dong S, et al. 2014. Changes in the expression of four heat shock proteins during the aging process in Brachionus calyciflorus (rotifera)[J]. Cell Stress and Chaperones, 19(1): 33–52.
DOI:10.1007/s12192-013-0432-0
|
Yuan J, Gu Z, Zheng Y, et al. 2016. Accumulation and detoxification dynamics of microcystin-LR andantioxidant responses in male red swamp crayfish Procambarus clarkii[J]. Aquatic Toxicology, 177: 8–18.
DOI:10.1016/j.aquatox.2016.05.004
|
Zhang X, Geng H. 2012. Effect of Microcystis aeruginosa on the rotifer Brachionus calyciflorus at different temperatures[J]. Bulletin of Environmental Contamination and Toxicology, 88(1): 20–24.
DOI:10.1007/s00128-011-0450-5
|
 2018, Vol. 38
2018, Vol. 38


