河岸带湿地是介于河流与陆地之间的半陆生生态系统, 通过地表径流和地下潜流的水文过程连接地上陆生系统和水生系统, 并直接或者间接受到河流水位变动的影响(Rood, 2006; 杨胜天等, 2007).河岸带在流域生态系统中面积比例不高, 但在水和生源要素等进入河流水体的过程中却发挥着不可取代的作用, 如截留面源污染、保持河岸的稳定性、提升毗邻地区的微气候、构建河流有机体的栖息生境和促进河流与其周围环境的连通性等(杨胜天等, 2007; Naimanand and Décamps, 1997).河岸带湿地具有独特的过滤功能和缓冲功能等特性, 被认为是流域管理的最佳方案(Lowrance et al., 1997).河岸带湿地微生境的变化对于有效N (Gold et al., 1998; Jacinthe et al., 1998)、P(Reddy et al., 2008)、S(Devito and Hill, 2015; Eimers et al., 2004)、有机质(OM)(Jacinthe et al., 2003; Gurwick et al., 2008)和农药(Benoit et al., 1999; Krutz et al., 2010)等的迁移转化产生了重要作用.
溶解有机质(Dissolved organic matter, DOM)广泛存在于河流生态系统中, 包括水体, 沉积物和河岸带湿地, 在水环境中起到重要作用(Leenheer and Croué, 2003), 影响水体的颜色和气味, 改变了污染物的迁移转化过程, 影响了DOC和DON的循环, 同时也是微生物的碳源和能源, 控制着水体溶解氧(DO)水平、N、P、S和诸多痕量元素含量, 从而影响水域生态健康.在淡水水域污染生态学中, DOM对水体营养状态和对污染物的迁移转化过程备受关注.
河岸带湿地土壤DOM是湿地土壤有机质重要的一部分, 存在于土壤固相中, 在适当的环境条件下可以进入液相, 具有移动性.DOM是一种具有芳香族和脂肪族结构的混合物, 在紫外区或短波长的可见光中具有特定的波谱, 同时具有发射一定荧光特性的荧光基团.因此在DOM诸多分析方法中, 紫外-可见吸收光谱和三维荧光光谱被广泛用于DOM的组成特征研究, 但DOM的光谱方法在分析其化学组成方面却无能为力.近年来, 随着技术的发展, 液相四级杆飞行质谱(Liquid chromatography quadrupole time-of-flight mass spectrometry, LC-Q-TOF-MS)在检测复杂化合物中的应用得到飞速发展, 由于其精确性、灵敏性和具有较高的重复率, LC-Q-TOF-MS已经运用到农药检测(Ferrer and Thurman, 2007)、有机污染物的分析(Masiá et al., 2012)和代谢组学的研究(Ciborowski et al., 2010).本研究拟利用LC-Q-TOF-MS技术, 分析河岸带湿地土壤DOM的化学结构和组成, 探讨不同河岸带湿地土壤DOM组成的差异, 并从分子水平综合分析河岸带土壤DOM可能的主要来源, 其研究结果为深化复杂化合物的化学结构解析方法和河岸带湿地的管理提供新思路.
2 材料与方法(Materials and methods) 2.1 研究区域与样品采集崇明岛地处东海沿岸(121°9.5′E~121°54′E, 31°27′N~31°51.25′N), 是中国的第三大岛, 也是世界上最大的河口冲积岛.岛内地势比较平坦, 水系发达, 河网密集, 全岛水域面积109.42 km2, 占岛域总面积的9.0%.崇明岛岛内现有市县级骨干河道33条, 总长约为390.22 km.降雨量一般在1000~1200 mm, 多年年平均蒸发量为1041.3 mm.崇明岛经济格局以农业为主, 其中东部为生态农业区, 北部为传统农业区, 而崇明岛的西部由于产业格局的调整, 主要为分散农业区, 50%的本地居民则主要集中在崇明岛中部.
河岸带湿地土壤(0~15 cm)样品采集于崇明岛10条受人为活动干扰较少的河岸带湿地, 每条河流以等距离设置采样区域(1 m × 3 m, 硬质护岸带除外), 于2016年4月中旬采集于采样区域内(图 1), 该区域内每个样品采集3个平行样品, 样品当场混合均匀, 剔除石块和植物残体, 分装于灭菌的铝盒中带回实验室, 样品冷冻干燥, 过筛(2 mm和0.107 mm), 于4 ℃保存备用(不超过15 d).
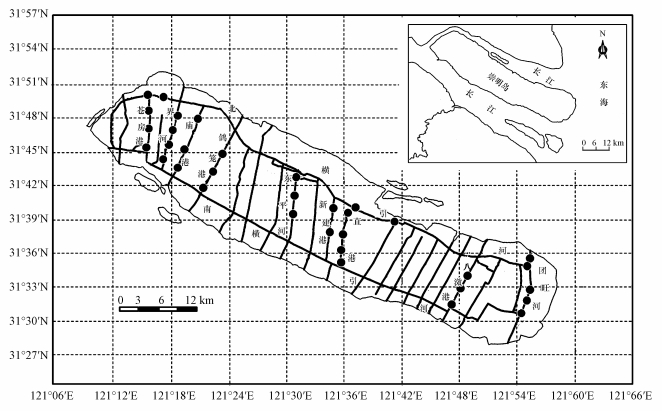 |
| 图 1 研究区域及崇明岛河岸带湿地土壤采样站点图 Fig. 1 Study area and sampling locations in the riparian wetlands from Chongming Island |
河岸带湿地土壤采用Ohno的方法获取DOM母液(Ohno and Bro, 2006).经冷冻干燥后湿地土壤样品过0.107 mm筛.准确称取5 g土壤样品, 加入50 mL去离子水, 在20 ℃条件下以150 r·min-1的速度水平振荡24 h.混合溶液在4 ℃条件下, 以8000 r·min-1的速度离心20 min, 取上清液过0.7 μm GF/F滤膜(Whatman, 美国)(经450 ℃高温灼烧5 h), 滤液即为DOM溶液.
DOM母液测定DOC的含量, 用于表征DOM的含量.DOC含量采用总有机碳分析仪(TOC-VCPH, 岛津, 日本)高温燃烧法测定.每个样品重复3~5次测定, 保证其测定结果变异系数 < 2%.土壤含水率和电导率采用土壤三参数仪(WET-2, 英国)进行原位测定, 土壤盐度和pH值采用哈希水质分析仪(HQ40, 美国)对DOM母液测定, 土壤容重通过原位土壤样品直接烘干(105 ℃)分析测定, 土壤有机氮采用差减法进行测定.所有被测土壤类型均为砂质结构的钙质冲积类型土壤, 其河岸带湿地土壤DOC含量为(0.10~0.20) g·kg-1, pH值为7.34~8.91, 土壤含水率为46.02%~52.78%, 容重为(1.38~1.61) g·cm-3, 有机氮含量范围为(0.41~1.95) g·kg-1.
2.3 DOM的LC-Q-TOF-MS分析DOM母液进一步进行以下预处理, 取母液10 mL, 加入等倍量的正丁醇溶剂进行萃取, 涡旋30 s后静置分层, 取上层溶液, 蒸干, 取2 mL 50%甲醇复溶, 过滤后, 进行LC-Q-TOF-MS分析.
LC条件:色谱柱, C18色谱柱(1.8 μm, 2.1 mm×100 mm, Agilent, 美国);柱温, 45 ℃;进样量, 5 μL;流动相, A相为去离子水, B相为乙腈.梯度洗脱程序为, 0 min, 3% B;3 min, 20% B;6 min, 60% B;12 min, 60% B;13 min, 80% B;14 min, 98% B;21 min, 98% B, 平衡时间为4 min;流速为0.3 mL·min-1.
Q-TOF-MS条件:离子源, 电喷雾电离源(ESI, Agilent, 美国);扫描方式, 正、负离子全扫描;全扫描范围, m/z为50~1200;干燥气(氮气)流速为8 L·min-1;气体温度为330 ℃;喷雾气压力为2.41×108 Pa;真空电压为4000 V;检测电压为65 V;二级碎片的碰撞能量为5~40 V.数据采集和处理通过Agilent Mass Hunter Qualitative Analysis Software (安捷伦, 美国)软件完成.数据分析前所有样品数据进行归一化处理.
2.4 数据处理统计分析, 包括湿地土壤理化性质的平均值、不同采样点质谱数据的主成分分析、不同土地利用类型物质含量的差异分析以及76种鉴定DOM分子的分层聚类及判别, 均在SPSS软件(Version 13.0)中进行.4个采样分区(A、B、C和D)多种参数的差异性采用t-检验, 置信水平分别设置为p = 0.05和0.01;不同区域间土壤DOM分子的判别分析在SIMCA-P软件(Version 11)中进行, VIP(Variable importance projection)值> 1表示具有差异性, VIP值越大, 相差越明显.
3 结果(Results) 3.1 崇明岛河岸带湿地土壤DOM的化学组成特征本研究采用LC-Q-TOF-MS技术成功分离了河岸带土壤DOM的化合物(图 2), 33个河岸带土壤样品共检测到超过12000种化合物信号, 其中, 正离子模式下检测到9000余种化合物信号, 负离子模式下检测到3300余种化合物信号.从图 2b中可以看出, Q-TOF技术可以获得DOM样品中大量单个化合物信息.为了获取更多化合物的信息, 我们在一级和二级质谱信息的基础上, 对相对峰高≥ 1.5%的峰在数据库(http://metlin.scripps.edu; http://www.chemspider.com)中进行对比, 获取单个化合物的可能推理结构.如相对分子质量(m/z)为166.0857(图 2c, 2d), 通过对比分析我们推断该化合物为L-苯基丙氨酸(L-phenylalanine).
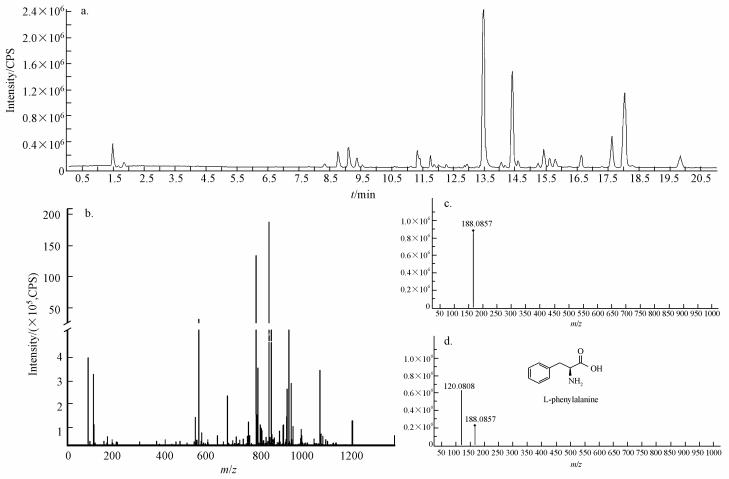 |
| 图 2 河岸带土壤DOM的LC-Q-TOF-MS质谱信息(以33号样品正离子模式为例), CPS为单位时间内光电子数目 Fig. 2 LC-Q-TOF-MS spectrum for riparian wetland soil DOM (for No.33 sample under ESI+ model), CPS means counts per second |
33个河岸带湿地土壤DOM样品中, 我们针对相对峰高≥ 1.5%的峰, 共鉴定出76种化合物的可能结构.根据其功能基团特征, 将这些化合物分成氨基酸类、羰基化合物类、脂肪酸类、脂类、蛋白质类和糖类6大类化合物(表 1).这6类不同化合物所占比例存在明显差异.脂类化合物是崇明岛河岸带土壤DOM的主要组分, 占到28.87%~ 43.87%, 其次为蛋白类物质和羰基类化合物, 分别占到总DOM的17.46%~ 36.54%和19.13%~31.28%, 最少的是脂肪酸类、糖类和氨基酸类物质, 其三者之和仅为12%左右.
| 表 1 基于LC-Q-TOF-MS技术鉴定的76种河岸带湿地土壤DOM分子信息 Table 1 The chemical information for the 76 soil DOM molecules identified by LC-Q-TOF-MS |
基于12327个被分离化合物的峰面积, 利用主成分分析法将33个采样点分为4组(图 3), 分别为生态农业区(A组)、传统农业区(B组)、分散农业区(C组)和居民聚集区(D组).其中A组包括来自八滧港和团旺河的7个采样点, 该组位于崇明岛东部, 区域内主要是生态农业区, 具有农药、商用化肥施用量少的特点;B组由北横引河的4个采样点组成, 北横引河是贯穿崇明岛北部传统农业区的一条市级河道, 该区域受强烈的传统农业和畜牧养殖等影响.因而, 大量的农业面源径流和畜牧养殖废水进入毗邻的河岸带土壤.C组位于崇明岛西部, 聚集了苍房港和界河的采样点, C组区域的土地利用类型为分散的农业, 甚至局部河岸带也被种植了农作物.D组包括来自崇明岛中部的庙港、鸽笼港、东平河、直河和新建港的15个采样点.
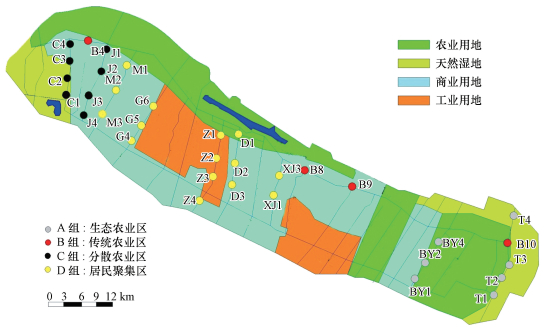 |
| 图 3 基于土壤DOM化学组成的主成分分析结果 Fig. 3 PCA results of assembled sites groups based on chemical composition of soil DOM |
土地利用类型对崇明岛河岸带湿地土壤6种DOM化学组分的相对含量影响差异显著(p < 0.05, 图 4).传统农业区(B组)河岸带土壤DOM中氨基酸类和糖类化合物含量明显高于其它区域(图 4a, 4f), 而居民聚集区(D组)河岸带土壤DOM中羰基化合物、脂肪酸类和蛋白质类化合物明显高于其他3个区域(图 4b, 4c, 4e).然而DOM中脂类物质在不同区域之间差异并不明显(p < 0.05, 图 4d).
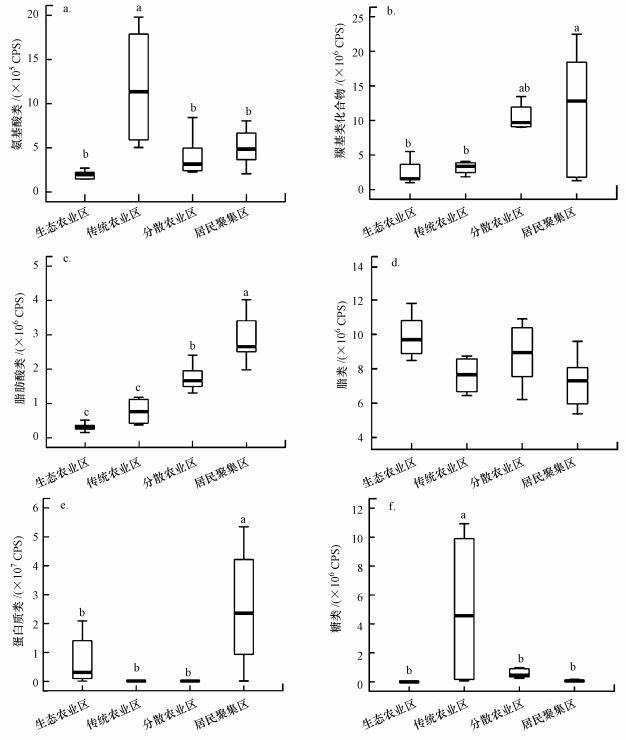 |
| 图 4 不同区域河岸带土壤DOM化学组分分布特征 (CPS为单位时间内光电子数目) Fig. 4 Distribution of soil DOM chemical fractions in different groups, CPS means counts per second |
在土壤微生物和太阳光辐射(主要为紫外光)的作用下, 流域内由于人为活动(如农业生产和畜牧养殖等)和植物残体经一系列的生物地球化学作用转化成为土壤DOM, 其化学组成复杂化学结构多样.本研究对已鉴定的76种化合物通过文献检索探究其来源(表 1), 并利用聚类分析(Cluster analysis, CA)进行分类(图 5).在ESI+模式下, 第一组分共包含22种化合物, 进一步分成两类, 分别为植物来源, 面源污染和点源溢流(图 5a).例如光甘草酸(glabric acid)是来源于甘草(licorice)的根部分泌物(Weinberg et al., 1993), 属于植物来源;而2, 4-二氯苯酚乙酸(2, 4-Dichlorbenzoate)作为除草剂被广泛应用, 则为面源污染和点源溢流来源.第2组和第3组也均为植物来源, 面源污染和点源溢流来源, 所有的化合物均为植物残体、径流和生活废水中的物质成分或其代谢中产物.与ESI+模式类似, 所有DOM中分子均来自植物残体、生活污水和工业废水(图 5b).
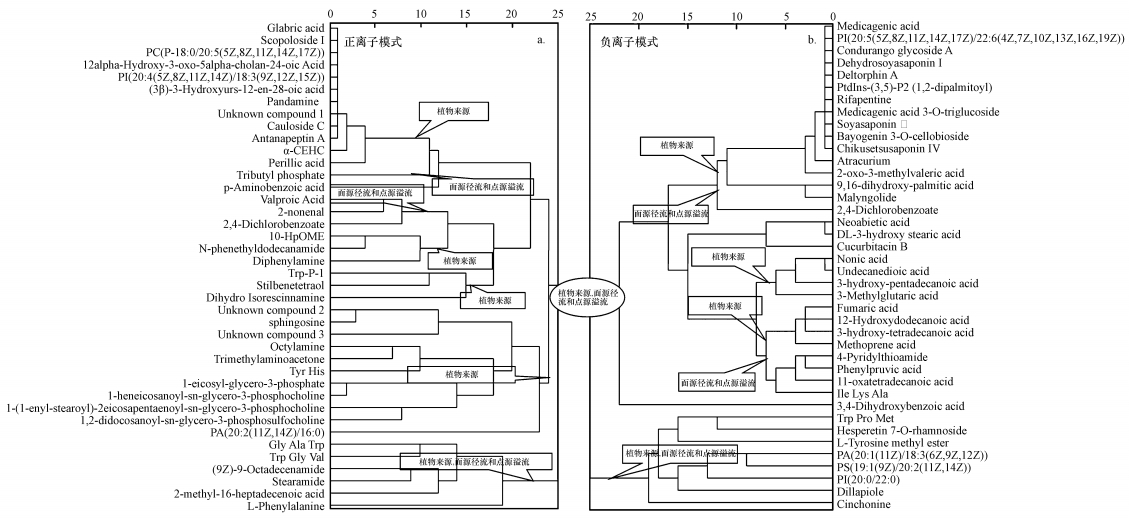 |
| 图 5 基于分子水平崇明岛河岸带湿地土壤DOM的来源 Fig. 5 The sources of soil DOM derived from riparian wetland at molecuar level |
总体上来说, 河岸带湿地土壤DOM的来源主要由两部分组成.一部分是由于河岸带内部产生的来源, 主要为河岸带的植被所产生, 包括植物残体、根系分泌物及其微生物代谢产物;另一部分为人为活动所产生的外源, 包括人为活动的农业径流、生活污水和工业废水及其代谢中产物经降雨径流流入河岸带的部分.
4.2 河岸带湿地土壤DOM分子组成的空间差异基于崇明岛河岸带土壤DOM质谱数据的空间聚类分析, 我们发现主成分分析结果与地理位置具有高度的一致性(图 3), 这表明河岸带土壤DOM的化学组分特征受土地利用类型的影响较大.本研究采用偏最小二乘法判别分析方法(Partial least squares-discriminant analysis, PLS-DA)从76种化合物中筛选了20种差异化合物(表 2), 进一步分析了导致不同区域之间DOM化学组分含量差异的原因.Marcus等(1991)报道豆科植物(soybean)内含有大量的蛋白质类物质, 如Gly Ala Trp, Trp Gly Val和Tyr His化合物.崇明岛的东部(A组)和中部(D组)大面积的种植豆科植物导致了A组中Gly Ala Trp, Trp Gly Val和Tyr His化合物含量均高于B组含量, 其变量重要性投影值(variable importance projection, VIP)分别为1、2和3.D组中Trp Gly Val含量高于C组含量, VIP值为2.Cucurbitacin B (葫芦素B), 是一种三萜(烯)化合物(triterpene), 主要来自葫芦科植物(cucurbitaceae family)(Stuppner et al., 1991), 崇明岛西部(C组)河岸带土壤DOM中葫芦素B含量明显高于中部(D组)可能是因为西部分散式农业种植葫芦科植物较多的原因.另外, 东部河岸带土壤DOM中p-Aminobenzoic acid含量明显低于中部(VIP=6), 因为p-Aminobenzoic acid是化妆品中一种重要的物质, 崇明岛中部(D组)居住50%以上人口是这种现象的主要原因.同样, 来源于农业径流的农药(4-Pyridylthioamide)在传统农业区含量明显高于生态农业区含量(VIP=6), 也说明了农业径流是导致4-Pyridylthioamide含量在不同区域河岸带DOM差异的主要因素.因此, 基于PLS-DA分析的20种土壤DOM差异化合物证明了流域内土地利用类型及其人为活动是导致河岸带湿地土壤DOM化学组成空间差异的主要因素.
| 表 2 不同土地利用区域内河岸带湿地土壤DOM的差异化合物 Table 2 Discriminant DOM molecules between every two groups and their VIP values |
河岸带湿地土壤DOM的含量主要来源于河岸带自身生态系统的内源生产和外源输入.内源生产包括河岸带植被、动物区系DOM的生产;而外源输入取决于河流陆上区域的土地利用、土地利用变化及管理政策, 也包括人为活动(如农业活动、畜牧养殖、工业生产等)的面源或点源输入.另一方面, 河岸带湿地DOM也能在降雨或水文活动作用下向水体输送, 导致河流水体DOM组成和含量的变化.因此, 河岸带湿地是毗邻集水区DOM的“汇”, 也是河流水体DOM的“源”.由于河岸带湿地土壤的湿度、氧化还原电位、植被和温度等在河流垂向断面的显著变化, 导致生源要素有效氮、磷, 有机质和有毒有害物质等(Eimers et al., 2004; Gurwick et al., 2008; Krutz et al., 2010)从陆上区域向水体迁移过程中产生了重要作用(图 6).
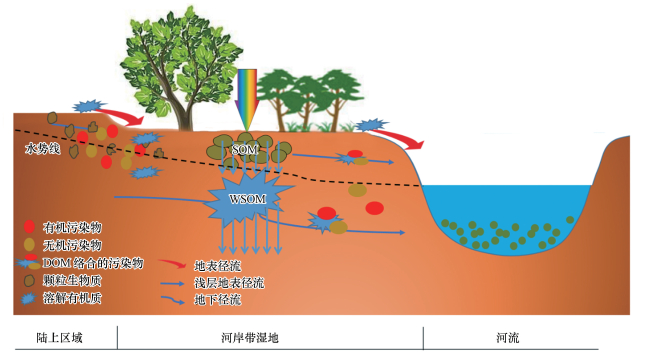 |
| 图 6 河岸带湿地土壤有机质迁移概念模型 Fig. 6 Conceptual model for the transport of soil DOM in riparian wetland |
河岸带湿地处在陆生生态系统和水生生态系统之间, 尽管在流域中只有较小的面积, 但在面源污染控制、生源要素及污染物向水体迁移等方面发挥了重要作用.鉴于河岸带湿地的重要作用, 结合当前河岸带湿地建设的存在的问题, 提出以下几个方面关于河岸带湿地建设和维护的建议.
① 对于河岸带湿地较宽的河流, 考虑到河岸带湿地土壤DOM内源生产主要依赖于河岸带湿生植物的光合作用, 建议从陆上区域到河流水体依次设置草本植物, 灌木和乔木, 并且定期对草本植物进行收割.这主要是因为乔木发达的根系能增强河岸带的结构稳定性, 还能有效削减陆上区域径流的入河负荷.
② 河流的泛洪平原需要增强保护.这主要是因为泛洪平原在河岸带湿地中是一个生物地球化学反应速率非常快和效率非常高的区域, 控制着湿地土壤DOM发生转化和迁移的时间, 进而控制了河岸带湿地土壤的滞留时间(Vidon et al., 2010).
③ 对于河岸带湿地建设空间受限的河流, 防止陆上区域径流携带的DOM通过地表径流直接入河, 建议在河岸带湿地加强陆上区域径流的截留措施(如生态沟渠、植草沟), DOM的定向吸附和原位强化净化措施(如定向吸附型河岸带湿地基质设置, 原位微生物强化脱氮除磷)等.
5 结论(Conclusions)1) 河岸带湿地土壤DOM组成复杂, LC-Q-TOF-MS解析出超过10000种化合物信号.针对相对峰高≥ 1.5%的峰进行可能分子结构鉴定, 本研究成功鉴定出76种化合物分子组成和可能分子结构.根据其功能团划分, 可分为氨基酸类、羰基化合物类、脂肪酸类、蛋白质类、脂类和糖类化合物, 其中脂类化合物是崇明岛河岸带湿地土壤DOM的主要组分, 占到28.87%~43.87%, 其次为蛋白类物质和羰基类化合物, 分别占到总DOM的17.46%~36.54%和19.13%~31.28%, 最少的是脂肪酸类、糖类和氨基酸类物质, 其三者之和仅为12%左右.
2) 通过文献对比对76种已鉴定的化合物进行源解析, 河岸带湿地土壤DOM的主要来源于河岸带湿地内部生产(包括植物残体、根系分泌物及其微生物代谢产物)和陆上区域农业径流、生活污水和工业废水溢流经降雨径流输入的有机质.化合物信息主成分分析结果和差异化合物判别分析结果均表明河岸带湿地DOM化学组成结构受其毗邻空间土地利用类型影响.
Benoit P, Barriuso E, Vidon P, et al. 1999. Isoproturon sorption and degradation in a soil from grassed buffer strip[J]. Journal of Environmental Quality, 28(1): 121–129.
|
Ciborowski M, Javier Rupérez F, Martínez-Alcázar M P, et al. 2010. Metabolomic approach with LC- S reveals significant effect of pressure on Diver's Plasma[J]. Journal of Proteome Research, 9(8): 4131–4137.
DOI:10.1021/pr100331j
|
Devito K J, Hill A R. 2015. Sulphate dynamics in relation to groundwater-surface water interactions in headwater wetlands of the southern Canadian Shield[J]. Hydrological Processes, 11(5): 485–500.
|
Eimers M C, Dillon P J, Schiff S L. 2004. A S-isotope approach to determine the relative contribution of redox processes to net SO4 export from upland, and wetland-dominated catchments[J]. Geochimica et Cosmochimica Acta, 68(18): 3665–3674.
DOI:10.1016/j.gca.2004.03.010
|
Ferrer I, Thurman E M. 2007. Multi-residue method for the analysis of 101 pesticides and their degradates in food and water samples by liquid chromatography/time-of-flight mass spectrometry[J]. Journal of Chromatography A, 1175(1): 24–37.
DOI:10.1016/j.chroma.2007.09.092
|
Gold A J, Jacinthe P A, Groffman P M, et al. 1998. Patchiness in groundwater nitrate removal in a riparian forest[J]. Journal of Environmental Quality, 27(1): 2946–2953.
|
Gurwick N P, Groffman P M, Yavitt J B, et al. 2008. Microbially available carbon in buried riparian soils in a glaciated landscape[J]. Soil Biology & Biochemistry, 40(1): 85–96.
|
Jacinthe P A, Groffman P M, Gold A J, et al. 1998. Patchiness in microbial nitrogen transformations in groundwater in a riparian forest[J]. Journal of Environmental Quality, 27(1): 156–164.
|
Jacinthe P A, Groffman P M, Gold A J. 2003. Dissolved organic carbon dynamics in a riparian aquifer:effects of hydrology and nitrate enrichment[J]. Journal of Environmental Quality, 32(4): 1365–1374.
DOI:10.2134/jeq2003.1365
|
Krutz L J, Gentry T J, Senseman S A, et al. 2010. Mineralisation of atrazine, metolachlor and their respective metabolites in vegetated filter strip and cultivated soil[J]. Pest Management Science, 62(6): 505–514.
|
Leenheer J A, Croué J P. 2003. Peer Reviewed:Characterizing aquatic dissolved organic matter[J]. Environmental Science & Technology, 37(1): 18–26.
|
Lowrance R, Altier L S, Newbold J D, et al. 1997. Water quality functions of riparian forest buffers in Chesapeake Bay watersheds[J]. Environmental Management, 21(5): 687–712.
DOI:10.1007/s002679900060
|
Marcus A, Greenberg J, Averyhart-Fullard V. 1991. Repetitive proline-rich proteins in the extracellular matrix of the plant cell[J]. Physiologia Plantarum, 81(2): 273–279.
DOI:10.1111/ppl.1991.81.issue-2
|
Masiá A, Ibáñez M, Blasco C, et al. 2012. Combined use of liquid chromatography triple quadrupole mass spectrometry and liquid chromatography quadrupole time-of-flight mass spectrometry in systematic screening of pesticides and other contaminants in water samples[J]. Analytica Chimica Acta, 761(2): 117–127.
|
Naimanand R J, Décamps H. 1997. The ecology of interfaces:Riparian Zones[J]. Annual Review of Ecology & Systematics, 28(1): 621–658.
|
Ohno T, Bro R. 2006. Dissolved organic matter characterization using multi-way spectral decomposition of fluorescence landscapes[J]. Soil Science Society of America Journal, 70(6): 2028–2037.
DOI:10.2136/sssaj2006.0005
|
Reddy K R, DeLaune R D. 2008. Biogeochemistry of wetlands:science and applications[M]. Boca Raton: CRC Press: 779–782.
|
Rood S B. 2006. Riparian:Ecology, conservation, and management of streamside communities[J]. Bioscience, 56(4): 353–354.
DOI:10.1641/0006-3568(2006)56[353:FL]2.0.CO;2
|
Stuppner H, Müller E P, Wagner H. 1991. Cucurbitacins from Picrorhiza kurrooa[J]. Phytochemistry, 30(1): 305–310.
DOI:10.1016/0031-9422(91)84143-G
|
Vidon P, Allan C, Burns D, et al. 2010. Hot spots and hot moments in riparian zones:Potential for improved water quality management[J]. Journal of the American Water Resources Association, 46(2): 278–298.
DOI:10.1111/j.1752-1688.2010.00420.x
|
Weinberg D S, Mainer M L, Richardson M D, et al. 1993. Identification and quantification of isoflavonoid and triterpenoid compliance markers in a licorice-root extract powder[J]. Journal of Agricultural and Food Chemistry, 41(1): 42–47.
DOI:10.1021/jf00025a009
|
杨胜天, 王雪蕾, 刘昌明, 等. 2007. 岸边带生态系统研究进展[J]. 环境科学学报, 2007, 27(6): 894–905.
|
 2018, Vol. 38
2018, Vol. 38


