二氧化硫(SO2)是最常见的大气污染物之一,环境中高浓度的SO2可抑制植物的光合和呼吸过程,引起叶片失绿坏死,诱导细胞毒性,造成细胞核固缩、DNA断裂、细胞活力下降,甚至导致细胞死亡(Yi et al., 2012; Choi et al., 2014).SO2气体遇水产生亚硫酸根(SO32-)和亚硫酸氢根(HSO3-),两种分子物质的量的比为3:1(Shapiro, 1977).大气中的SO2经气孔进入植物体内,主要通过水解形成SO32-和HSO3-对组织和细胞产生毒性.在研究SO2对植物细胞的毒性效应时,常用衍生物(Na2SO3和NaHSO3混合液,物质的量的比3:1)作为SO2供体(付宝春等, 2015; Yi et al., 2012; Wei et al., 2013; 2015).目前关于SO2对植物的毒性效应研究大多集中在草本植物中,课题组前期利用生长在我国西北地区的高大乔木树种—胡杨的细胞为材料,研究发现一定浓度的SO2衍生物可诱导胡杨细胞死亡,并使胞内NO和H2O2水平升高(韩彦莎等,2016).
脱落酸(Abscisic acid,ABA)是一种植物激素,普遍存在于植物体内,在植物生长发育和响应逆境胁迫的过程中发挥重要作用(Vishwakarma et al., 2017).外源施加ABA可明显提高植物抵抗干旱、盐渍、重金属等环境胁迫的能力(Zhu, 2002; Yang et al., 2014; Han et al., 2016).例如,干旱胁迫下,外源ABA可诱导植物气孔关闭,减少水分蒸腾(Desikan et al., 2004).近期本课题组发现,外源ABA能够提高镉胁迫下胡杨细胞的抗氧化酶活性,从而减少细胞中的活性氧积累,有效缓解镉诱导的氧化损伤(Han et al., 2016).有研究表明,外施ABA溶液可通过调节叶片气孔开度来控制SO2气体进入,在一定程度上提高植物对SO2的防御能力(Kondo et al., 1978;刘荣坤等,1983;韩素梅,2001).但迄今为止,关于ABA在植物细胞SO2毒性缓解中的具体作用及相关机制尚未见报道.
本文通过研究外源ABA对SO2胁迫下胡杨细胞死亡率、细胞电解质外渗率、胞内NO和H2O2水平的影响,旨在从细胞水平上揭示ABA缓解植物SO2毒性的作用和机制,这对其应用于植物防御SO2毒害具有重要意义.
2 材料与方法(Materials and methods) 2.1 植物材料以胡杨新鲜幼嫩叶片作为外植体,在含0.5 mg·L-16-BA和0.5 mg·L-1 NAA的Murashige & Skoog (MS)固体培养基(pH=5.7)上诱导产生愈伤组织,并在含0.25 mg·L-1 6-BA和0.5 mg·L-1 NAA的MS固体培养基上继代增殖.继代培养15 d后,选择颜色淡黄、生长旺盛的愈伤细胞进行处理和实验.
2.2 实验处理采用SO2衍生物处理(Na2SO3:NaHSO3=3:1,mmol·L-1/mmol·L-1),SO2衍生物浓度以混合液中的总S含量计算.根据本课题组前期在胡杨细胞中的研究结果,用2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,细胞死亡率达45%~50%(韩彦莎等,2016),本文使用该处理浓度和时间.将生长15 d的愈伤细胞转至MS液体培养基(pH=5.7)中,平衡6 h后,分别按以下方法进行处理.
① 分别用0 mmol·L-1 SO2、2 mmol·L-1 SO2、0.5 μmol·L-1 ABA、5 μmol·L-1 ABA、20 μmol·L-1 ABA、2 mmol·L-1 SO2+0.5 μmol·L-1 ABA、2 mmol·L-1 SO2+5 μmol·L-1 ABA、2 mmol·L-1 SO2+20 μmol·L-1 ABA处理细胞,9 h后检测细胞死亡率和电解质外渗率.
② 分别用2 mmol·L-1 SO2、5 μmol·L-1 ABA、5 μmol·L-1 ABA+2 mmol·L-1 SO2处理细胞,以MS液体培养基中的细胞作为对照,9 h后检测胞内H2O2和NO水平、抗氧化酶活性、硝酸还原酶活性及相关基因表达水平.
2.3 细胞死亡率检测利用Fluorescein Diacetate(FDA, Sigma-Aldrich,USA)荧光染料检测胡杨细胞死亡率.将细胞在20 μg·mL-1 FDA溶液中避光孵育5 min后,在荧光显微镜(BX51,Olympus,Japan)下检测细胞荧光.发亮绿色荧光的为活细胞,不发绿色荧光或绿色较暗的为死细胞.每个重复随机观察5个视野,每个视野至少观察100个细胞.细胞死亡率为死细胞数目与细胞总数之比.
2.4 电解质外渗率测定取0.2 g胡杨细胞,在5 mL重蒸水中振荡培养30 min后,利用电导率仪检测水中的电解质电导率(C1).之后在沸水中煮沸细胞30 min,待冷却后检测电导率(C2).电解质外渗率E=C1/C2×100%.
2.5 抗氧化酶活性测定具体方法参照文献(韩彦莎等,2016).利用Pierce BCA Protein Assay Kit(Thermo,USA)检测细胞提取液的蛋白浓度.
2.6 H2O2和NO水平检测分别利用2, 7-dichlorodihydrofluorescein diacetate(H2DCFDA, Sigma-Aldrich,USA)、4-Amino-5- Methylamino-2, 7-Difluoro-fluorescein Diacetate(DAF-FM DA, Sigma-Aldrich,USA)荧光探针检测胡杨细胞内的H2O2和NO水平.具体方法参照文献(韩彦莎等,2016).利用Image-Pro Plus version 6.0软件分析细胞荧光强度.
2.7 硝酸还原酶(NR)活性测定利用磺胺比色法检测胡杨细胞的NR活性,具体方法参照文献(刘洁等,2010).
2.8 基因表达水平检测利用Trizol法提取胡杨细胞总RNA,通过M-MLV逆转录酶(Promega,USA)反转录合成cDNA.以cDNA为模板,使用SYBR Green Kit(Bio-Rad,USA)进行Real-Time PCR扩增.以Actin作为内参基因,引物序列见表 1.PCR反应条件为:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min.
| 表 1 本文中使用的引物序列 Table 1 Primers used in this study |
利用SPSS17.0软件对数据进行方差分析(ANOVA),通过Duncan方法对不同处理组之间的数据进行多重比较,不同字母表示组间差异显著(p < 0.05).
3 结果(Results) 3.1 ABA缓解SO2衍生物对胡杨细胞的毒性植物细胞遭受逆境胁迫时,细胞膜破坏,膜透性增大,使电解质外渗.2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,电解质外渗率明显增加,为对照的2.1倍(图 1A),细胞死亡率达到47.3%(图 1B).外源施加不同浓度的ABA(0.5、5、20 μmol·L-1)后,与SO2单独处理组相比,电解质外渗率和细胞死亡率均有不同程度的下降,其中,5 μmol·L-1 ABA作用最为显著.以上结果表明,ABA(5 μmol·L-1)能够明显缓解SO2衍生物对胡杨细胞的毒性.在后续实验中,选取5 μmol·L-1作为ABA处理浓度.
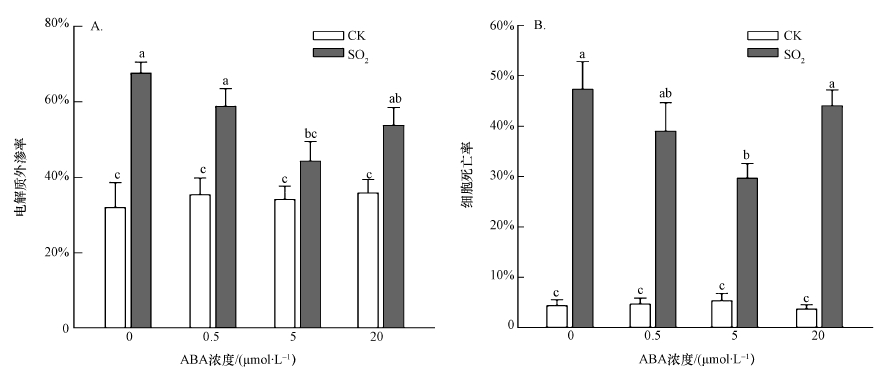 |
| 图 1 不同浓度外源ABA对SO2胁迫下胡杨细胞电解质外渗率(A)和细胞死亡率(B)的影响 (不同小写字母表示不同处理间差异显著(p < 0.05)) Fig. 1 Effects of different concentration of exogenous ABA on electrolyte leakage rate (A) and cell death rate(B) of SO2-stressed P. euphratica |
前期研究表明,H2O2和NO参与调控SO2诱导的胡杨细胞死亡(韩彦莎等,2016).APX和CAT是植物细胞内负责清除H2O2的两种重要抗氧化酶.2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,与对照相比,细胞APX活性(以mg protein每分钟消耗的ASA量(nmol)表示)和CAT活性(以mg protein每分钟分解的H2O2量(nmol)计))显著下降(图 2),胞内H2O2水平明显升高(图 3A),H2O2荧光强度是对照的4.4倍(图 3B).与SO2单独处理组相比,外源ABA的添加使细胞的APX和CAT活性分别提高了23.9%和48.0%(图 2),胞内H2O2荧光强度降低了31.6%(图 3B).ABA单一处理组的APX和CAT活性、H2O2水平与对照组之间无明显差异(图 2、3).
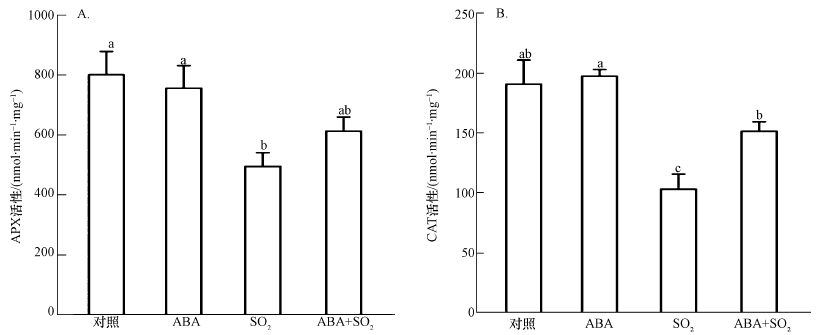 |
| 图 2 外源ABA对SO2胁迫下胡杨细胞APX(A)和CAT(B)活性的影响 Fig. 2 Effects of exogenous ABA on APX(A) and CAT(B) activity of SO2-stressed P. euphratica cells |
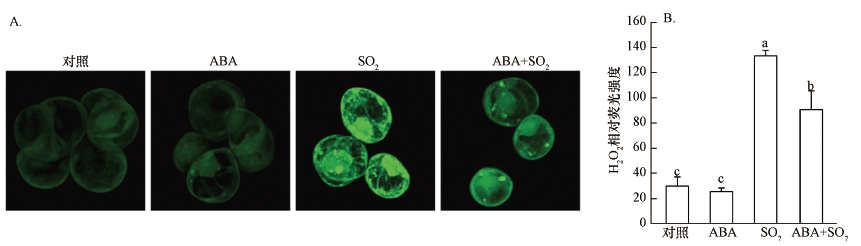 |
| 图 3 外源ABA对SO2衍生物处理后胡杨细胞内H2O2水平的影响 (A:代表性荧光图片;B:利用Image J软件计算的H2O2相对荧光强度;不同字母表示不同处理间差异显著(p < 0.05)) Fig. 3 Effects of exogenous ABA on H2O2 level within P. euphratica cells after SO2 derivatives treatment |
硝酸还原酶(NR)途径介导的NO合成是植物细胞内NO产生的重要来源.2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,与对照相比,细胞NR活性显著提高(图 4),胞内NO水平明显增加(图 5A),NO荧光强度是对照的3.3倍(图 5B).进一步的荧光定量PCR实验结果显示,SO2胁迫下,硝酸还原酶的两个编码基因PeNia1、PeNia2表达显著上调(图 6).与SO2单一处理组相比,ABA+SO2处理组的细胞NR活性明显下降(图 4),胞内NO荧光强度降低了24.2%(图 5B),PeNia1和PeNia2基因表达水平分别比SO2单一处理时下降了34.3%和25.8%(图 6).
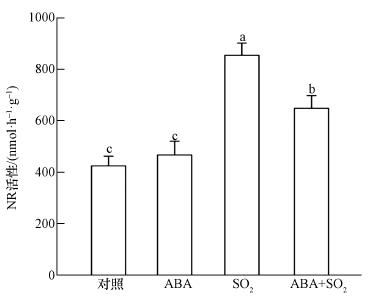 |
| 图 4 外源ABA对SO2胁迫下胡杨细胞硝酸还原酶活性的影响 (不同小写字母表示不同处理间差异显著(p < 0.05)) Fig. 4 Effects of exogenous ABA on the nitrate reductase activity of SO2-stressed P. euphratica cells |
 |
| 图 5 外源ABA对SO2衍生物处理后胡杨细胞内NO水平的影响 (A.代表性荧光图片;B.利用Image J软件计算的NO相对荧光强度;不同小写字母表示不同处理间差异显著(p < 0.05)) Fig. 5 Effects of exogenous ABA on NO level within P. euphratica cells after SO2 derivatives treatment |
 |
| 图 6 外源ABA对SO2胁迫下胡杨细胞PeNia1(A)、PeNia2(B)基因表达的影响 Fig. 6 Effects of exogenous ABA on PeNia1(A) and PeNia2(B) gene expression in SO2-stressed P. euphratica cells |
SO2是一种有毒的大气污染物.环境中高浓度的SO2对植物具有毒害效应,可破坏叶绿体结构、分解叶绿素、干扰植物光合过程、引起叶片失绿坏死(刘荣坤,1989;Swanepoel et al., 2007);还可诱发不可逆的遗传损伤,造成细胞核固缩、DNA断裂、染色体畸变率增高(Yi et al., 2012; Choi et al., 2014).研究表明,一定浓度的SO2衍生物能够诱导蚕豆、萱草、万寿菊等植物的保卫细胞凋亡(Yi et al., 2012; Wei et al., 2013;2015).SO2衍生物处理植物细胞时,进入胞内的SO32-被氧化形成硫酸根(SO42-),该过程伴随活性氧产生,从而导致胞内活性氧水平升高.胞内活性氧水平升高后,一方面可引发膜质过氧化,破坏细胞膜结构,导致电解质外渗;另一方面能够激活下游的Caspase途径,诱导细胞死亡(Yi et al., 2012; Brychkova et al., 2013; Zhao et al., 2014).课题组前期研究发现,1~5 mmol·L-1 SO2衍生物暴露使胡杨细胞死亡率显著上升,且处理时间越长,细胞死亡率越高(韩彦莎等,2016).本文利用2 mmol·L-1 SO2衍生物处理胡杨细胞9 h后,电解质外渗率明显增加(图 1A),细胞死亡率达到47.3%(图 1B).
ABA是一种逆境激素,能够通过调节气孔开度、诱导抗氧化防御系统、调控相关基因表达等过程来提高植物对干旱、盐渍、低温、重金属等多种胁迫的适应性(Zhu, 2002; Yang et al., 2014; Guo et al., 2012; Han et al., 2016).早期研究表明,叶片涂抹ABA溶液可明显提高植物对SO2的抗性(Kondo et al., 1978;刘荣坤等,1983; 1985;韩素梅,2001).外源ABA一方面能够通过促进气孔关闭而减少SO2气体进入植物(刘荣坤等,1983;韩素梅,2001);另一方面还能够抑制叶片K+渗出,有效减轻SO2对植物的损伤(刘荣坤等,1985).本研究发现,外源ABA对于胡杨细胞SO2毒害也具有保护效应.外施ABA可明显缓解SO2衍生物对胡杨细胞的毒性,显著降低胡杨细胞在SO2胁迫下的电解质外渗率和细胞死亡率,但这种缓解作用具有浓度依赖性,其中,5 μmol·L-1ABA的缓解效应最为明显(图 1),这与镉胁迫下胡杨细胞中的研究结果类似(Han et al., 2016).较高的ABA浓度(20 μmol·L-1)可能会抑制胡杨细胞在SO2胁迫下的生理响应,导致缓解作用下降,但具体机制尚待进一步研究.
H2O2和NO是植物体内两种重要的信号分子.植物细胞遭受环境胁迫时,胞内H2O2和NO快速积累,诱导细胞毒性(De Michele et al., 2009; Jiao et al., 2013; Sun et al., 2014).本课题组的前期研究表明,H2O2和NO参与调控SO2诱导的胡杨细胞死亡;使用外源H2O2清除剂、NO清除剂或合成抑制剂降低胞内H2O2、NO水平后,胡杨细胞死亡率明显降低(韩彦莎等,2016).APX和CAT是植物体内负责清除H2O2的两种关键抗氧化酶.本研究发现,SO2胁迫下,外源ABA能够提高胡杨细胞的APX、CAT活性(图 2),从而降低胞内H2O2水平(图 3).与此类似,本课题组前期在对胡杨细胞的研究中发现,通过外源施加ABA有助于增强镉胁迫下胡杨细胞APX、CAT等抗氧化酶的活性,减少胞内H2O2积累,从而缓解镉对细胞的毒性(Han et al., 2016).此外,Guo等(2012)在受冷害胁迫的辣椒中也发现ABA的类似作用.
硝酸还原酶(NR)途径介导的NO合成是植物细胞内NO产生的重要来源.课题组前期在拟南芥中的研究发现,SO2胁迫可诱导拟南芥保卫细胞的NR途径增强,使NR的两个编码基因AtNia1、AtNia2表达上调,导致胞内NO水平升高(赵均等,2014).本研究显示,SO2衍生物处理后,胡杨细胞中的NR活性明显提高(图 4),NR途径中的关键基因PeNia1、PeNia2均转录上调(图 6),导致胞内NO水平显著上升(图 5).外源ABA可抑制SO2胁迫下胡杨细胞的PeNia1、PeNia2基因表达,降低细胞NR活性,从而减少胞内NO生成(图 4~6).
综上,本文初步证明了外源ABA缓解胡杨细胞SO2毒性的作用,但对于其中具体的分子机制,以及内源ABA、H2O2、NO三者在SO2诱导胡杨细胞毒性中的相互关系仍需进一步研究.
5 结论(Conclusions)SO2胁迫下,外源ABA一方面能够通过提高胡杨细胞APX、CAT活性来减少胞内H2O2积累;另一方面,还可以抑制细胞PeNia1、PeNia2基因表达,降低细胞NR活性,从而减少胞内NO生成.综上,外源施加ABA可有效降低胡杨细胞内H2O2和NO水平,缓解SO2对胡杨细胞的毒性,降低细胞死亡率和电解质外渗率.
Brychkova G, Grishkevich V, Fluhr R, et al. 2013. An essential role for tomato sulfite oxidase and enzymes of the sulfite network in maintaining leaf sulfite homeostasis[J]. Plant Physiology, 161(1): 148–164.
DOI:10.1104/pp.112.208660
|
Choi D, Toda H, Kim Y, et al. 2014. Effect of sulfur dioxide (SO2) on growth and physiological activity in Alnus sieboldiana at Miyakejima Island in Japan[J]. Ecological Research, 29(1): 103–110.
DOI:10.1007/s11284-013-1103-4
|
De Michele R, Vurro E, Rigo C, et al. 2009. Nitric oxide is involved in cadmium-induced programmed cell death in Arabidopsis suspension cultures[J]. Plant Physiology, 150(1): 217–228.
DOI:10.1104/pp.108.133397
|
Desikan R, Cheung M K, Bright J, et al. 2004. ABA, hydrogen peroxide and nitric oxide signalling in stomatal guard cells[J]. Journal of Experimental Botany, 55(395): 205–212.
|
付宝春, 魏爱丽, 翟晓燕, 等. 2015. NO、ROS对诱导的万寿菊保卫细胞凋亡的调控[J]. 环境科学学报, 2015, 35(7): 2289–2296.
|
Guo W, Chen R, Gong Z, et al. 2012. Exogenous abscisic acid increases antioxidant enzymes and related gene expression in pepper (Capsicum annuum) leaves subjected to chilling stress[J]. Genetics and Molecular Research, 11(4): 4063–4080.
DOI:10.4238/2012.September.10.5
|
Han Y, Wang S, Zhao N, et al. 2016. Exogenous abscisic acid alleviates cadmium toxicity by restricting Cd2+ influx in Populus euphratica cells[J]. Journal of Plant Growth Regulation, 35(3): 827–837.
DOI:10.1007/s00344-016-9585-2
|
韩彦莎, 李琳, 王朝阳, 等. 2016. H2O2和NO互作调控SO2诱导的胡杨细胞死亡[J]. 环境科学学报, 2016, 36(8): 3073–3080.
|
韩素梅. 2001. 树木气孔浸润级与SO2伤害及ABA的防护作用[J]. 应用生态学报, 2001, 12(3): 425–428.
|
Jiao J, Zhou B, Zhu X, et al. 2013. Fusaric acid induction of programmed cell death modulated through nitric oxide signalling in tobacco suspension cells[J]. Planta, 238(4): 727–737.
DOI:10.1007/s00425-013-1928-7
|
Kondo N, Sugahara K. 1978. Changes in transpiration rate of SO2-resistant and -sensitive plants with SO2 fumigation and the participation of abscisic acid[J]. Plant & Cell Physiology, 19(3): 365–373.
|
刘洁, 王省芬, 张桂寅, 等. 2010. 棉花叶片硝酸还原酶活性的测定方法[J]. 河北农业大学学报, 2010, 33(4): 1–4.
|
刘荣坤, 沈英娃, 刘小洁. 1983. 植物对二氧化硫生理反应的研究Ⅱ植物气孔与SO2伤害及ABA(脱落酸)的保护效应[J]. 植物生理学通讯, 1983(4): 25–28.
|
刘荣坤, 曾晓非. 1985. ABA(脱落酸)对植物二氧化硫伤害的保护作用[J]. 辽宁大学学报(自然科学版), 1985(1): 64–69.
|
刘荣坤. 1989. 二氧化硫对植物光合色素伤害的机理[J]. 生态学进展, 1989, 6(2): 102–109.
|
Shapiro R. 1977. Genetic effects of bisulfite[J]. Mutation Research, 39: 149–176.
DOI:10.1016/0165-1110(77)90020-3
|
Sun J, Yu Y, Li Z, et al. 2014. 1-Butanol triggers programmed cell death in Populus euphratica cell cultures[J]. Plant Growth Regulation, 74(1): 33–45.
DOI:10.1007/s10725-014-9894-z
|
Swanepoel J W, Ghj K, Pdr V H. 2007. Effects of sulphur dioxide on photosynthesis in the succulent Augea capensis Thunb[J]. Journal of Arid Environments, 70(2): 208–221.
DOI:10.1016/j.jaridenv.2006.12.014
|
Vishwakarma K, Upadhyay N, Kumar N, et al. 2017. Abscisic acid signaling and abiotic stress tolerance in plants:a review on current knowledge and future prospects[J]. Frontiers in Plant Science, 8(120): 161.
|
Wei A, Xin X, Wang Y, et al. 2013. Signal regulation involved in sulfur dioxide-induced guard cell apoptosis in Hemerocallis fulva[J]. Ecotoxicology and Environmental Safety, 98(1): 41–45.
|
Wei A, Fu B, Wang Y, et al. 2015. Involvement of NO and ROS in sulfur dioxide induced guard cells apoptosis in Tagetes erecta[J]. Ecotoxicology and Environmental Safety, 114: 198–203.
DOI:10.1016/j.ecoenv.2015.01.024
|
Yang R, Yang T, Zhang H, et al. 2014. Hormone profiling and transcription analysis reveal a major role of ABA in tomato salt tolerance[J]. Plant Physiology and Biochemistry, 77(2): 23–34.
|
Yi H, Yin J, Liu X, et al. 2012. Sulfur dioxide induced programmed cell death in Vicia guard cells[J]. Ecotoxicology and Environmental Safety, 78(1): 281–286.
|
赵均, 薛美昭, 白鹤丽, 等. 2014. 硝酸还原酶介导的NO合成参于SO2引发的拟南芥气孔运动的调节[J]. 环境科学学报, 2014, 34(3): 796–800.
|
Zhao J, Yi H. 2014. Genome wide transcriptome analysis of Arabidopsis response to sulfur dioxide fumigation[J]. Molecular Genetics and Genomics, 289(5): 989–999.
DOI:10.1007/s00438-014-0870-0
|
Zhu J K. 2002. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology, 53: 247–273.
DOI:10.1146/annurev.arplant.53.091401.143329
|
 2018, Vol. 38
2018, Vol. 38


