2. 农业农村部南方产地污染防控重点实验室, 长沙 410128
2. Key Laboratory of Southern Original Agro-Environmental Pollution Prevention and Control, Ministry of Agriculture, Changsha 410128
砷(Arsenic)是一种毒性极强的类金属元素, 砷及砷的化合物在自然界中广泛存在.研究发现, 无机砷的毒性远大于有机砷, 而三价砷毒性比五价砷强(Clancy et al., 2013).目前, 针对水体中砷污染的处理方法包括去除分离和氧化降毒两个方向, 吸附法因具有绿色可行、便捷高效的特点而被国内外学者关注, 逐渐成为一种去除砷的重要方法(Mohan et al., 2011), 但开发和改进吸附材料是目前研究的难点.海藻酸钠是一种天然多糖, 因具有无毒、无害的特点而被较早地作为药物抑制剂应用于医药领域(Mahdavinia et al., 2014).近年来, 海藻酸钠也被广泛应用在重金属处理领域.例如, 张初进等(2010)以海藻酸钠作为包埋剂固定化包埋活性炭和多粘性芽孢杆菌并应用于重金属Pb2+的去除, 结果发现, 包埋剂的引入极大缩短了吸附平衡的传质过程, 提升了复合材料的吸附性能和稳定性.Park等(2010)报道了应用各种海藻酸盐凝胶基吸附剂去除重金属铅, 发现海藻酸盐凝胶基对重金属的结合能力归因于胶基核心溶液中的黄原胶, 表面吸附的重金属离子能够扩散并迁移到胶基内部.研究还发现, 海藻酸钠溶液可以与很多二价和三价阳离子反应形成凝胶, 离子交联反应主要通过海藻酸钠中古罗糖酸的钠离子与其他二价、三价阳离子进行不可逆交换(Qi et al., 2012).
目前, 利用铁氧化物处理含砷废水已经有一定的研究基础, 如And等(1997)较早地提出铁氧化物对砷具有高亲和力, 较高的表面电荷和大比表面积赋予了铁氧化物良好的吸附能力.海藻酸聚合物负载的铁氧化物基复合吸附剂近来得到了较多的关注, 凭借其较高的生物相容性极大地缩短了吸附过程的传质时间, 发挥了铁氧化物的最优性能(Sigdel et al., 2016).例如, Swain等(2013)将Fe、Zr等掺入藻酸盐体系中制备了FZCA杂化材料用于处理水体重氟离子;Sohfong等(2009)将磁性吸附剂磁铁矿(Fe3O4)颗粒利用包埋的方式掺入到海藻酸钙溶胶体系中, 探究了材料对两种价态含砷废水的吸附效果.综上不难发现, 目前的研究多集中于利用海藻钙这一稳定凝胶体系, 并通过溶凝、浸渍、共沉淀等方式制备铁氧化物复合材料.基于此, 本研究以海藻酸钠作为前驱材料, 利用海藻酸钠易与阳离子发生共价交联的特性在海藻酸钠前驱体表面原位负载氧化铁纳米颗粒, 成功制备海藻酸铁凝胶小球, 并在制备过程中利用尿素作为制孔剂参与到微球合成当中, 以实现纳米铁在前驱材料表面的原位合成.同时, 通过对材料的有条件高温裂解制备超顺磁性海藻酸铁介孔碳微球(MAMC), 在前期基础上较为全面地分析复合材料对As(Ⅲ)和As(Ⅴ)的吸附性能.在对材料性质进行较为细致的表征后, 发现海藻酸钠前驱溶液为纳米铁氧化物提供了稳定的骨架支称和稳固载点, 加大了纳米铁氧化物颗粒的分散性与稳定性.最后, 探究投加量、pH值、时间和初始污染物浓度等对材料吸附性能的影响.
2 实验与方法(Materials and methods) 2.1 试剂与仪器试剂:海藻酸钠、尿素、九水硝酸铁、亚砷酸钠、砷酸钠、氢氧化钠、浓盐酸均为分析纯, 购于国药化学试剂有限公司, 去离子水为实验室自制.
仪器:90-1型磁力搅拌器(上海雷磁)、KQ-100B超声波清洗器(上海昆山舒美仪器厂)、便携式pH计(上海雷磁)、电感耦合等离子质谱仪(ICP-MS, 美国珀金埃尔默)、H1650台式高速离心机(湖南湘仪仪器设备有限公司)、CHA-S气浴恒温振荡箱(常州国华仪器设备厂)、BR-14NT真空高温管式炉(博纳热炉有限公司).
2.2 材料的制备 2.2.1 磁性海藻酸铁介孔炭的制备磁性海藻酸铁介孔碳微球(MAMC)的制备流程如图 1所示.准确称取1.0 g海藻酸钠粉末溶解于100 mL去离子水中, 并于水浴中加热使固体粉末充分溶解, 制备成海藻酸钠饱和溶液;将尿素加入到饱和溶液中作为制孔剂(陈敏等, 2016), 其中, 尿素和MAMC的质量比为1:1, 磁力搅拌30 min后冷却待用(记做SAC前驱溶液);准确称取2.02 g九水硝酸铁固体粉末, 溶解于100 mL去离子水中, 配置成5%的硝酸铁溶液;使用医用注射器(孔径0.34 mm)将冷却至室温的SAC溶液移入注射器中, 并以20滴· min-1的速率逐滴加入到硝酸铁溶液中(反应过程保持不断搅拌).当SAC溶液遇到硝酸铁溶液时会形成水滴状的小颗粒, 磁力搅拌器形成的水波漩涡会把形成的小颗粒旋入溶液底部, 确保后续形成的颗粒不产生粘连现象.反应完毕后将烧杯密封, 放置于室温下陈化48 h;陈化完毕后将形成的颗粒物取出, 并用去离子水搭配超声波清洗器清洗12~15次, 直到清洗液中检测无Fe3+渗出;清洗完全后将材料放入真空冷冻干燥器中冷冻干燥48 h, 形成不含水分的黄褐色固体颗粒(SA@Fe Particles);将SA@Fe颗粒放置于管式炉中, 在通入氮气的条件下按照1 ℃·min-1的升温速度在300 ℃加热3 h, 自然冷却后形成磁性海藻酸铁介孔碳微球(MAMC).
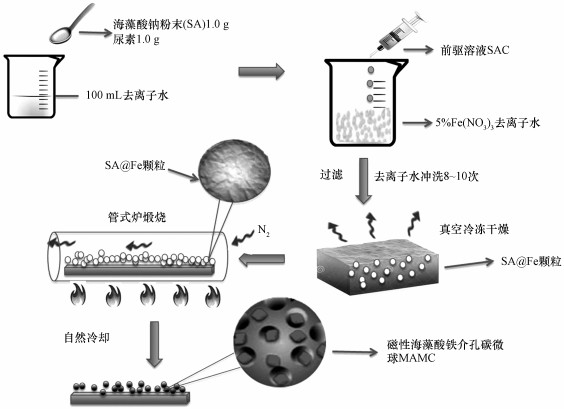 |
| 图 1 MAMC制备流程图 Fig. 1 The synthetic procedures of MAMC |
MAMC的形态和外貌采用热场发射扫描电镜显微镜(QUANTA430, 美国FEI公司)观测, X射线光电子能谱通过Thermo ESCALAB 250XIX射线光电子能谱仪(美国赛默飞世尔科技)测定, 材料的热稳定性由热重分析仪(Q500, 美国TA公司)测定, 材料的磁性测试由磁学测量系统MPMS (SQUID) XL(美国Quantum Design公司)获得.
2.4 材料吸附、脱附实验材料的吸附实验分为投加量实验、pH值控制实验、吸附动力学实验、等温吸附实验、脱附和再生实验5个部分, 吸附平衡后的滤液采用电感耦合等离子发射光谱测定溶液中剩余砷的浓度.相同条件下设置空白对照组进行参考对照, 考察多种因素对吸附量的影响, 其中, 吸附中人工废水的各种浓度梯度均由砷酸钠(Na3AsO3)、亚砷酸纳(NaAsO2)配制的母液稀释而成.为了量化材料的吸附效果, MAMC的吸附量和去除率按照以下公式进行计算:
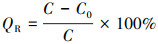
|
(1) |
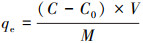
|
(2) |
式中, QR为材料的去除率;C0为砷的初始浓度(mg· L-1);C为处理后溶液中砷的浓度(mg· L-1);V为溶液的体积(L);M为吸附剂的用量(g);qe为平衡时的吸附量(mg· g-1).
2.4.1 投加量实验准确称取一定量的MAMC, 按照0.5、1、2、3 g· L-1...(依此规律增加至10 g· L-1)的投加量加入到50 mL的离心管中, 往离心管中加入25 mL浓度为20 mg· L-1的含As废液, 放置于气浴恒温振荡箱中振荡直到吸附平衡, 3200 r· min-1离心后过滤分离, 滤出液稀释待测.
2.4.2 pH值控制实验准确称取0.100 g MAMC样品于多个50 mL塑料离心管中, 按照实验要求使用0.1 mol· L-1的NaOH和HCl调节废液pH值, 其中, 含As废液浓度均为150 mg· L-1, 调节pH值至2、3、4、5、6、7、8、9、10、11, 充分振荡24 h后3200 r· min-1离心, 使用医用注射器安装0.45 μm滤膜过滤, 滤出液稀释待测.
2.4.3 吸附动力学实验吸附动力学实验中吸附剂的用量沿用前期实验获得的最佳结果(投加量为1 g· L-1, pH=6.5), 溶液体积为25 mL, 设置多个平行样品, 同时放置于气浴恒温震荡箱中, 按照时间序列先后间隔取出As(Ⅲ)、As(Ⅴ)样品, 过滤离心后检测溶液中砷的浓度并进行动力学拟合.
2.4.4 等温吸附实验等温吸附实验中准确设置初始废液浓度为20、50、100、200、300、500 mg· L-1, 反应时间和pH同样沿用前期最优值(反应时间500 min, pH=6.5), 通过改变初始废液的浓度考察材料的吸附性能, 并对吸附过程进行两种等温模型的拟合.
2.4.5 脱附再生实验将吸附饱和的材料通过外加磁场进行固液分离, 将分离出来的材料用去离子水充分浸洗, 冷冻干燥后, 分别放入到0.01、0.1、1 mol· L-1的NaOH解吸液中进行脱附和再生实验, 脱附和再生完毕后进行相同分离步骤, 干燥后所得样品分别投加到150 mg· L-1的含As(Ⅲ)、As(Ⅴ)废液中考察脱附后材料的吸附量.
3 实验结果与分析(Results and analysis) 3.1 材料的表征 3.1.1 SEM分析冷场发射扫描电子显微镜的观察结果如图 2所示, 其中, 图 2A、B为MAMC吸附As前的电镜图片, 图 2C、D为MAMC吸附As后的电镜图片.从图中可以看出, 材料表面有很多不规则的孔隙(图 2B中阴影状), 材料吸附前分散程度较高;此外, 可以较为明显地观察到图 2B中材料表面负载了大量的颗粒状的物体, 配套EDS能谱元素成分分析表明(图 2E), 颗粒状物体为铁氧化物的可能性较大, 图 2B中插图a显示出铁氧化物颗粒密集地负载到了材料层间夹层孔隙中.综上所述, SEM图像能够较为清晰地表明氧化铁颗粒已经成功负载到了海藻酸盐前驱体的表面;EDS数据表明, 材料铁元素的占比高达52.32%以上, 且材料吸附前的As含量接近于0, 丰富的铁氧化物为以砷酸根、亚砷酸根形式存在的砷离子提供了较为丰富的吸附位点.此外, 通过图 2A、2B与图 2C、2D的对比发现, 吸附后材料表面较为明显的孔隙已经被大量絮状物(圆杆状)覆盖, 材料的分散性降低, 并发生了较为明显的团聚现象, 也进一步证实了吸附行为的发生.
 |
| 图 2 MAMC吸附前(A、B、a)、后(C、D)不同放大倍数电镜照片和MAMC吸附后的EDS能谱及元素含量分布(E) Fig. 2 The SEM images of MAMC before (A, B, a, at different magnification) and after adsorbing As (C, D) and the EDS spectrum and elemental content after adsorbing As(E) |
材料的BET和孔径分析结果如图 3a所示, MAMC的比表面积约为62.583 m2· g-1, 孔径为12.96 nm, 证明材料属于介孔材料范畴(孔径介于2 ~50 nm之间).在氮气环境下, 通过改变压力并利用BJH法绘制了材料的吸附、脱附曲线, 可以明显观察到迟滞环在P/P0=0.63处出现(Liu et al., 2005).较高相对压力区域MAMC没有表现出任何吸附限制, 说明MAMC是一种吸附性能优越、空隙和比表面较为发达的介孔材料.热重分析称取样品3.2 mg, 在氮气环境下以10 ℃· min-1的升温速度测试了材料的热稳定性.从图 3b中可以看出, 材料的总质量随着温度的升高逐渐降低, 热解主要分为两个阶段:在0~300 ℃的温度下热解现象较为平缓, 热稳定性较强;但温度达到400 ℃以上时海藻酸钠包埋前驱受热分解挥发, 造成材料的热解速率增加, 质量变化较为明显(Tao et al., 2017).
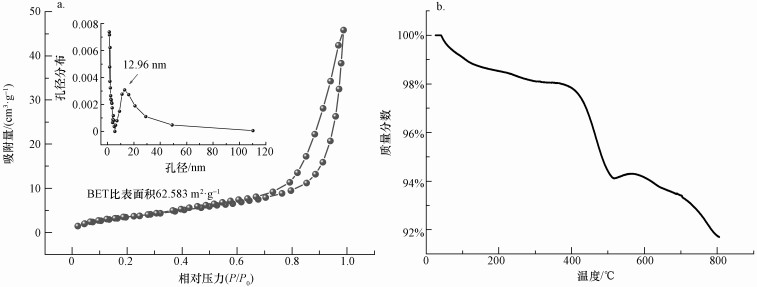 |
| 图 3 MAMC孔径分布和BHJ曲线(a)及MAMC热失重(TGA)曲线(b) Fig. 3 The pore size distribution and BHJ curve of MAMC (a) and the thermal weight loss (TGA) results for MAMC (b) |
通过对MAMC吸附前后XPS能谱—C元素的核心轨道结合能进行分峰处理, 捕捉到3个可见峰, 将其归类为C—C/C—H(芳香族)、C—O/C—O—C(醇式羟基和醚)、C=O(羰基)(Badruddoza et al., 2011).利用XPSspeak软件对照RWA值及峰面积进行分析, 发现C—C/C—H、C—O/C—O—C发生了较为明显的峰面积改变, 原因与生成的络合物附带有机基团附着于材料表面有关(聚丙二醇PPG/甲酯类聚合物及其同素异形体)(Zheng et al., 2009).通过对Fe、Na的核心轨道结合能分析可以看出, 吸附前后两种离子的峰面积发生了比较明显的改变, Na元素来源于海藻酸钠盐体系中, 材料在进行到制备、陈化过程时, 海藻酸钠中的古罗糖酸的Na+与Fe3+发生不可逆离子交联, 但反应过程中形成的凝胶膜阻碍了一部分Na+的溶出, 冷冻干燥和高温烧结后, Na+依旧存在于MAMC中并占据部分吸附点位;高温烧结过程使得MAMC形成了介孔空隙, 一定程度上扩大了离子交换通道, Na+在加入到含As废液中时, 大部分Na+进入到溶液体系中并且释放吸附位点, 导致XPS测试结果中吸附后材料体系当中Na+峰的变化.Fe的核心轨道峰面积在吸附后减少改变一部分归因于吸附过程中砷酸铁(FeAsO4)的生成和部分Fe3+发生水解生成Fe(OH)3而被剥离出材料.图 4e反映了材料吸附含砷废液前后的XPS能谱, 图谱表明, MAMC在吸附前后峰面积发生较为明显的波动, 这也再次印证了MAMC吸附As(Ⅲ)和As(Ⅴ)行为的发生.
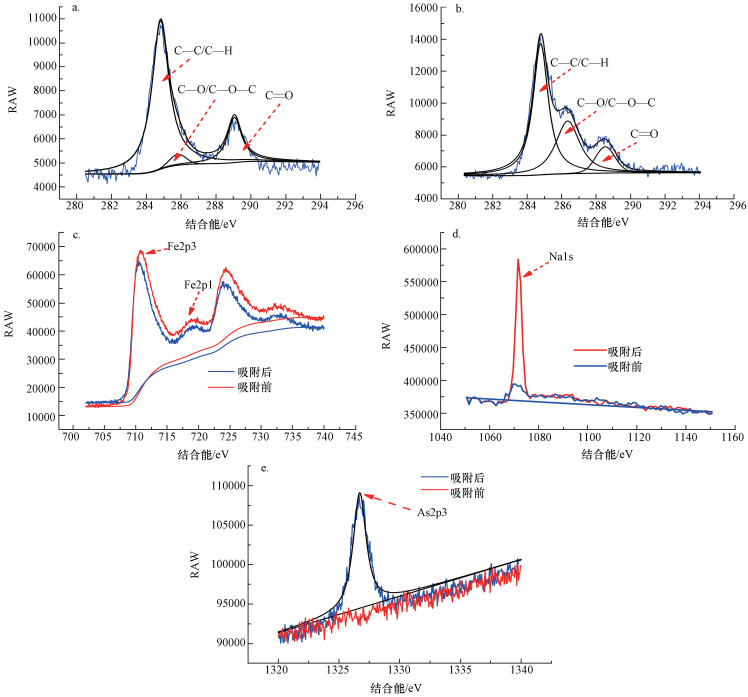 |
| 图 4 碳(a.吸附前, b.吸附后)、铁(c)、钠(d)、砷(e)元素核心轨道吸附前后的XPS图像 Fig. 4 C1s(a.before, b.after), Fe2p(c), Na1s(d) and As2p(e) orbit before and after As adsorption |
通过材料的磁性测试绘制了MAMC的磁滞回线, 在材料的吸附过程中施加磁场对溶液溶质进行磁分离(图 5).材料的饱和磁化强度为20.86 emu· g-1, 矫顽力Hc=51.64 Oe, 吸附剂具有超强的顺磁性(Mahdavinia et al., 2016), 能够实现饱和吸附后介质之间的分离(磁场分离测试如图 5左上角插图所示), 磁滞回线的局部放大图(右下角插图)表明材料的磁滞后现象比较微弱, 理论上可以作为一种性能优越的永磁材料(矫顽力Hc>30 A· m-1)(Li et al., 2012).
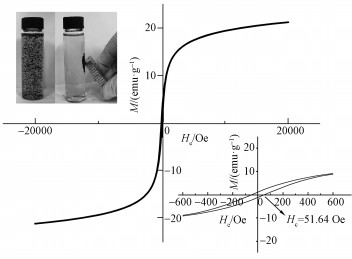 |
| 图 5 磁滞回线、磁滞局部回线放大图(右下)和磁场施加分离结果(左上) Fig. 5 The hysteresis loop and hysteresis local loop zoom lines (lower right), magnetic field was applied to separation (top left) |
从投加量实验的结果(图 6)可以看出, 当含As废液浓度为50 mg· L-1时, 溶液中As的去除率随着材料投加量的增加而增大, 前期的斜率较大, 变化率较明显, 但当投加量趋近于1.0 g· L-1(固液比为1:25)时, 材料发挥出自身的最大效率, 此时图中反映出来的去除率也接近最优.
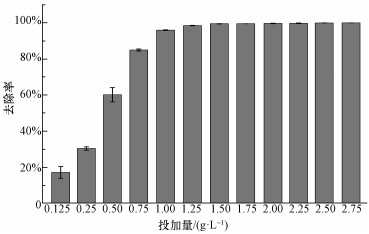 |
| 图 6 MAMC投加量实验 Fig. 6 MAMC dosage experiment |
分别调节含砷模拟废水(浓度为250 mg· L-1) pH值至2、3、4、5、6、7、8、9、10、11, 按照1:25的固液比准确称取MAMC加入到100 mL锥形瓶中, 充分振荡后离心过滤, 检测滤出液结果, 探究pH值与材料的吸附量qe的关系, 结果如图 7所示.材料对As(Ⅲ)和As(Ⅴ)的吸附量与溶液的pH值关系较为密切, 对于含As(Ⅴ)的废水, 酸性条件更有利于材料的吸附, 但pH逐渐升高时, 单位材料的吸附量逐渐降低, 并在pH=9时急剧下降.这是因为吸附剂的表面电荷特性和溶质形态与溶液的pH值有重要的关系(Stumm et al., 1993), 当pH值保持在3.0~6.0时, As(Ⅴ)主要以H2AsO4-的形式存在, 当pH为8.0~10.5时, As(Ⅴ)以HAsO42-的形式存在, 而AsO43-出现在更高的pH值区间(Kim et al., 2014), 当溶液介质中的pH值大于MAMC的等电点pH值时(pHPZC=6.3±0.5), 会加大材料表面的负电荷量, 进而加大材料与阴离子的静电斥力, As(Ⅴ)的吸附量可能会明显减少(Kanel et al., 2006).对于含As(Ⅲ)的废水, 材料在高pH值和低pH时的吸附效果都不明显, 当溶液的pH值较低时, MAMC表面的部分铁氧化物会发生溶解(观察到有铁盐生成, 溶液体系颜色发生改变), 从而减少了砷酸根的吸附位点.随着溶液的pH值逐渐升高, 金属氧化物上的配体吸附逐渐增加, 非电离亚砷酸(H3AsO30)更有利于吸附到MAMC的非离子化位点上(Cumbal et al., 2005).当pH远大于PZC点时, 纳米铁氧化物发生水解, 产物Fe(OH)3发生电子转移而生成Fe(OH)4-, 加大了以阴离子形式存在的离子间的竞争吸附与库仑斥力, 从而抑制H2AsO3-、HAsO32-、AsO33-等砷酸根等阴离子形式的吸附(Zhang et al., 2013).考虑到实验的可行性, 将下一步实验的溶液介质的pH值定位到6.5.
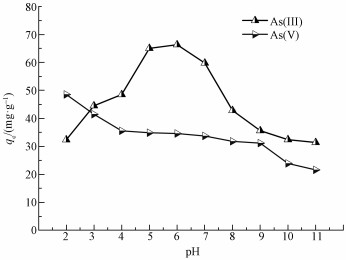 |
| 图 7 pH值对MAMC吸附两种价态As的影响 Fig. 7 Effect of pH value on As adsorption on MAMC |
在同温同压下, As(Ⅲ)和As(Ⅴ)空白溶液浓度为150 mg· L-1, 利用吸附动力学实验探究不同反应时间下材料对As(Ⅲ)、As(Ⅴ)的吸附量.实验采用定时取样法, 通过测定特定时间段平衡时的废液浓度计算出特定时刻的吸附量, 用Origin9软件对吸附过程进行线性准一级动力学(式(1))、准二级动力学(式(2))拟合(罗钰等, 2017), 所得结果如图 8所示.
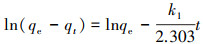
|
(1) |
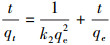
|
(2) |
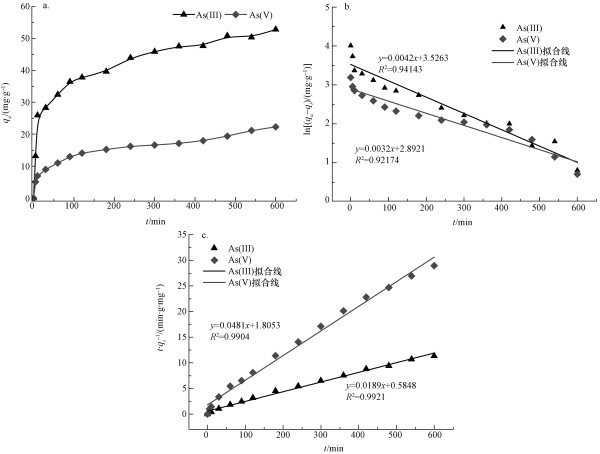 |
| 图 8 MAMC的吸附动力学实验结果(a)及其动力学拟合结果(b.准一级动力学, c.准二级动力学) Fig. 8 Adsorption kinetics experiment results(a) and kinetic fitting results of MAMC(b.pseudo-first-order kinetics, c. pseudo-second-order kinetics) |
式中, qe和qt分别是吸附平衡时和t时刻的吸附容量(mg· g-1), t为吸附时间(min), k1为准一级动力学吸附速率常数(min-1), k2为准二级动力学吸附常数(g· mg-1· min-1).
根据式(1)和式(2)拟合ln(qe-qt)-t和t/qt-t的线性关系如图 8b和8c所示, 方程的可决系数R2如表 1所示.通过对两种价态含砷废水的吸附动力学实验结果的分析发现, 材料对于As(Ⅲ)、As(Ⅴ)的吸附过程较满足于准二级动力学方程.在初始废液浓度为150 mg· L-1时, 准二级动力学方程计算出的理论最大吸附量(As(Ⅲ) 52.91 mg· g-1、As(Ⅴ) 20.79 mg· g-1)与当前浓度实验值较为接近, 且材料在500 min时基本达到吸附平衡.从图 8a中不难发现, MAMC达到吸附平衡时对于As(Ⅲ)的吸附量大于对As(Ⅴ)的吸附量, 这是因为As(Ⅲ)、As(Ⅴ)在铁氧化物纳米颗粒内、外扩散机制不同造成(Babaee et al., 2017).
| 表 1 动力学拟合结果 Table 1 Kinetic fitting results |
在温度和压力相同的情况下, 通过改变溶液中As(Ⅲ)和As(Ⅴ)的初始物浓度, 测定各浓度下材料的饱和吸附量和溶液吸附后的平衡浓度.实验得到材料对As(Ⅲ)和As(Ⅴ)的吸附等温曲线结果如图 9所示, 等温模型拟合结果如表 2所示.利用Langmuir方程(式(3))和Freundlich方程(式(4))对材料的吸附等温曲线进行非线性拟合, 试图通过吸附模型来探究MAMC的吸附机理.
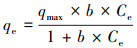
|
(3) |
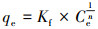
|
(4) |
 |
| 图 9 等温吸附模型拟合结果(a.As(Ⅲ), b.As(Ⅴ)) Fig. 9 Isothermal adsorption model fitting results(a.As(Ⅲ), b.As(Ⅴ)) |
| 表 2 等温吸附模型拟合结果 Table 2 Isothermal adsorption model fitting results |
式中, qmax为吸附剂的单层饱和最大吸附量(mg· g-1), b为Langmuir常数(L· mg-1), 表示吸附亲和力, Kf为吸附能力平衡常数, n为不均匀系数.Freundlich吸附等温方程是一个经验公式, 其n值越大, 说明吸附性能越好.一般认为1/n在0.1~0.5之间, 容易吸附;1/n大于2时吸附较难进行.
通过对两种等温吸附模型的R2可以判断, MAMC对As(Ⅲ)、As(Ⅴ)的吸附过程更符合Langmuir模型, 推测MAMC是具有有限吸附位点的吸附剂, 对重金属As进行单分子层吸附(Dada et al., 2012), 材料对As(Ⅲ)的理论最大吸附量(82.97174 mg· g-1)大于对As(Ⅴ)的理论最大吸附量(50.52885 mg· g-1), 说明材料对As(Ⅲ)的吸附能力优于As(Ⅴ)(Dixit et al., 2003; Yu et al., 2006).从Freundlich模型中发现, MAMC对As(Ⅲ)的不均匀系数均大于1且1/n介于0.1~0.5之间, 说明吸附过程为优惠吸附, 材料的吸附性能较好, 而MAMC对As(Ⅴ)的1/n大于0.5, 进一步强调了材料对As(Ⅲ)的吸附能力优于As(Ⅴ)这一结论.
3.4.5 脱附再生实验结果脱附再生实验结果如图 10所示, 实验中分别采用0.01、0.1、1 mol· L-1的NaOH对吸附As(Ⅲ)和As(Ⅴ)的材料进行脱附和再生实验.结果表明, 使用0.1 mol· L-1的NaOH作为材料的脱附和再生溶液较为理想(Babaee et al., 2017; Pitt et al., 2016), 材料在进行4次脱附后对As(Ⅲ)和As(Ⅴ)的去除效果仍然能够保持在85%和59%左右, 材料对As(Ⅲ)、As(Ⅴ)的去除效果随着脱附和再生次数的增加而减少.这可能是因为碱性环境会造成海藻酸钠前驱和部分纳米铁氧化物的溶解, 从而造成部分吸附位点减少, 造成材料吸附容量的降低.
 |
| 图 10 脱附和再生实验结果(a.As(Ⅲ), b.As(Ⅴ)) Fig. 10 Desorption and regeneration experiment results(a.As(Ⅲ), b.As(Ⅴ)) |
1) 本实验以海藻酸钠为前驱模板, 通过离子交联法成功合成了多孔海藻酸铁微球, 经过真空冷冻和高温碳化制备了磁性海藻酸铁介孔碳微球(MAMC), 通过对MAMC的表征分析证实了材料处理水体As(Ⅲ)、As(Ⅴ)的可行性.
2) 吸附实验中以人工模拟废水为对象探究了MAMC对两种价态含As废水的处理能力, 并探讨了pH值、材料的投加量、初始污染物浓度、接触时间等因素材料吸附性能的影响.实验发现, 在处理低浓度(10~50 mg· L-1)含砷废水时, 材料的最优投加量为1 g· L-1, 材料吸附过程受pH的影响较大, 在处理As(Ⅲ)废水时, 溶液较高pH值(pH>9)和较低pH值(pH < 6)均不利于吸附过程的进行, 在处理As(Ⅴ)废水时, 酸性条件更有利于吸附反应的进行.吸附动力学实验发现, 材料的吸附过程更满足于准二级吸附动力学方程, 材料对重金属As的吸附过程较稳定且在500 min时基本达到吸附平衡.等温吸附实验结果中R2值表明, Langmuir方程能够更好地满足材料对As(Ⅲ)和As(Ⅴ)的吸附过程, 材料对As的吸附过程满足优惠吸附条件, 材料对As(Ⅲ)的吸附能力优于As(Ⅴ), 材料对两种价态的As离子的吸附为物理吸附和化学吸附同时进行.
3) MAMC的再生实验证实了材料再生的可行性, 实验发现, 0.1 mol· L-1NaOH的再生性能和脱附性能较好, 高浓度的再生和脱附介质并不能提升再生材料吸附量, 材料对于As(Ⅲ)的脱附性能优于As(Ⅴ), 材料经过4次脱附和再生MAMC对于As(Ⅲ)和As(Ⅴ)仍然能够保持90%和60%以上的吸附能力, 这也说明了MAMC能够实现二次利用和循环再生, 能够达到绿色环境功能材料的要求.
Babaee Y, Mulligan C N, Rahaman M S. 2017. Removal of arsenic(Ⅲ) and arsenic(Ⅴ) from aqueous solutions through adsorption by Fe/Cu nanoparticles[J]. Journal of Chemical Technology & Biotechnology, 93(1): 63–71.
|
Badruddoza A Z M, Tay A S H, Tan P Y, et al. 2011. Carboxymethyl-β-cyclodextrin conjugated magnetic nanoparticles as nano-adsorbents for removal of copper ions: Synthesis and adsorption studies[J]. Journal of Hazardous Materials, 185(2/3): 1177.
|
陈敏, 张新新, 赵孔银, 等. 2016. 抗污染海藻酸钙水凝胶纳滤膜对水中重金属离子的去除性能[J]. 高分子材料科学与工程, 2016, 32(8): 99–103.
|
Clancy T M, Hayes K F, Raskin L. 2013. Arsenic waste management: a critical review of testing and disposal of arsenic-bearing solid wastes generated during arsenic removal from drinking water[J]. Environmental Science & Technology, 47(19): 10799.
|
Cumbal L, Sengupta A K. 2005. Arsenic removal using polymer-supported hydrated iron(Ⅲ) oxide nanoparticles: role of donnan membrane effect[J]. Environmental Science & Technology, 39(17): 6508.
|
Dada A O, Olalenkan A P, Olatunya A M, et al. 2012. Langmuir, Freundlich, Temkin and Dubinin Radushkevich isotherms studies of equilibrium sorption of Zn2+ unto phosphoric acid modified rice husk[J]. Journal of Applied Chemistry, 3: 38–45.
|
Dixit S, Hering J G. 2003. Comparison of arsenic(Ⅴ) and arsenic(Ⅲ) sorption onto iron oxide minerals: implications for arsenic mobility[J]. Environmental Science & Technology, 37(18): 4182.
|
Kanel S R, Grenèche J M, Choi H. 2006. Arsenic(Ⅴ) removal from ground-water using nano scale zero-valent iron as a colloidal reactive barrier material[J]. Environmental Science & Technology, 40(6): 2045–2050.
|
Kim S J, Kim H S, Ju S J. 2014. Mitochondrial genome of the hydrothermal vent crab Austinograea alayseae (Crustacea: Bythograeidae): genetic differences between individuals from Tofua Arc and Manus Basin[J]. Mitochondrial Dna, 25(4): 251.
DOI:10.3109/19401736.2013.800489
|
Li Z, Shen J, Ma H, et al. 2012. Preparation and characterization of sodium alginate/polyisop ropylacryl amide/clay semi-IPN magnetic hydrogels[J]. Polymer Bulletin, 68(4): 1153–1169.
DOI:10.1007/s00289-011-0671-0
|
Liu H Y, Wang K P, Teng H. 2005. A simplified preparation of mesoporous carbon and the examination of the carbon accessibility for electric double layer formation[J]. Carbon, 43(3): 559–566.
DOI:10.1016/j.carbon.2004.10.020
|
罗钰, 白波, 王洪伦, 等. 2017. Mn@海藻酸微球吸附去除盐酸四环素及其类Fenton再生[J]. 环境科学学报, 2017, 37(5): 1732–1741.
|
Mahdavinia G R, Mousanezhad S, Hosseinzadeh H, et al. 2016. Magnetic hydrogel beads based on PVA/sodium alginate/laponite RD and studying their BSA adsorption[J]. Carbohydrate Polymers, 147: 379.
DOI:10.1016/j.carbpol.2016.04.024
|
Mahdavinia G R, Rahmani Z, Karami S, et al. 2014. Magnetic/pH-sensitive carrageenan/sodium alginate hydrogel nanocomposite beads: preparation, swelling behavior, and drug delivery[J]. Journal of Biomaterials Science Polymer Edition, 25(17): 1891–1906.
DOI:10.1080/09205063.2014.956166
|
Mohan D, Sarswat A, Singh V K, et al. 2011. Development of magnetic activated carbon from almond shells for trinitrophenol removal from water[J]. Chemical Engineering Journal, 172(2): 1111–1125.
|
Park H G, Chae M Y. 2010. Novel type of alginate gel‐based adsorbents for heavy metal removal[J]. Journal of Chemical Technology & Biotechnology, 79(10): 1080–1083.
|
Pitt S J J. 2016. Pirates, merchants, settlers, and slaves: Colonial America and the Indo-Atlantic World by Kevin P.Mcdonald (review)[J]. Journal of World History, 27(1): 150–152.
DOI:10.1353/jwh.2016.0082
|
Qi M, Morch Y, Lacík I, et al. 2012. Survival of human islets in microbeads containing high guluronic acid alginate cross-linked with Ca2+ and Ba2+[J]. Xenotransplantation, 19(6): 355–364.
DOI:10.1111/xen.2012.19.issue-6
|
Sigdel A, Park J, Kwak H, et al. 2016. Arsenic removal from aqueous solutions by adsorption onto hydrous iron oxide-impregnated alginate beads[J]. Journal of Industrial & Engineering Chemistry, 35: 277–286.
|
Sohfong L, Zheng Y M, Zou S W, et al. 2009. Uptake of arsenate by an alginate-encapsulated magnetic sorbent: process performance and characterization of adsorption chemistry[J]. Journal of Colloid & Interface Science, 333(1): 33–39.
|
Stumm W. 1993. Chemistry of the solid-water interface: processes at the mineral-water and particle water interface in natural systems[J]. Geochimica Et Cosmochimica Acta, 57(3): 205.
|
Swain S K, Patnaik T, Patnaik P C, et al. 2013. Development of new alginate entrapped Fe(Ⅲ)-Zr(Ⅳ) binary mixed oxide for removal of fluoride from water bodies[J]. Chemical Engineering Journal, s 215-216(35): 763–771.
|
Yu X, Amrhein C, Zhang Y, et al. 2006. Factors influencing arsenite removal by zero-valent iron[J]. Journal of Environmental Engineering, 132(11): 1459–1469.
DOI:10.1061/(ASCE)0733-9372(2006)132:11(1459)
|
Zhang G, Ren Z, Zhang X, et al. 2013. Nanostructured iron(Ⅲ)-copper(Ⅱ) binary oxide: a novel adsorbent for enhanced arsenic removal from aqueous solutions[J]. Water Research, 47(12): 4022–4031.
DOI:10.1016/j.watres.2012.11.059
|
张静进, 刘云国, 张薇, 等. 2010. 海藻酸钠包埋活性炭与细菌的条件优化及其对Pb2+的吸附特征研究[J]. 环境科学, 2010, 31(11): 2684–2690.
|
Zhang T, Zhu C L, Shi Y, et al. 2017. Synthesis of Fe2O3 in situ on the surface of mesoporous carbon from alginate as a high-performance anode for lithium-ion batteries[J]. Materials Letters, 205: 10–14.
DOI:10.1016/j.matlet.2017.06.020
|
Zheng J C, Feng H M, Lam M H W, et al. 2009. Removal of Cu(Ⅱ) in aqueous media by biosorption using water hyacinth roots as a biosorbent material[J]. Journal of Hazardous Materials, 171: 780–785.
DOI:10.1016/j.jhazmat.2009.06.078
|
 2018, Vol. 38
2018, Vol. 38


