2. 福州大学能源与环境光催化国家重点实验室, 福州 350002
2. Research Institute of Photocatalysis, State Key Laboratory of Photocatalysis on Energy and Environment, Fuzhou University, Fuzhou 350002
偶氮染料是使用最多的染料,约占全部染料的70%左右(Singh et al., 2011;Çinar et al., 2008).偶氮染料分子结构中一般除了含有氮氮双键外,其化学键上还连有苯环、萘环等结构,苯环或萘环上又有—NH2、—CH3、—NO2、—SO3、—Cl和—OH等取代基团.目前国内外处理偶氮染料废水的方法仍以生化法为主.研究发现,单独生物处理耗时长、效率低,且厌氧处理产生的中间产物(如苯胺)的毒性甚至比原水更大、更抗生物降解(Harrelkas et al., 2008;Mutambanengwe et al., 2007).而将生物技术与高级氧化技术组合用于印染废水处理逐渐成为近年来人们关注的焦点(Oller et al., 2011;Chen et al., 2014; Deveci et al., 2016).为了更好地发挥光催化反应和生物降解的协同作用,一种紧密耦合光催化/生物降解体系(Intimate coupling of photocatalysis and biodegradation, ICPB)成为近年来的研究热点.ICPB体系利用大孔基材使得微生物可在基材内部生长,一定程度上避免了外部光催化效应产生的活性氧物质(· OH、O2 ·、H2O2等)对微生物的毒害作用(Marsolek et al., 2008;Dong et al., 2016;Li et al., 2011).若将ICPB体系用于偶氮染料废水处理,还存在一些难点需要解决,如高浓度染料可能导致的光能利用率下降或光催化剂中毒现象,以及难降解有机物或其中间产物对微生物细胞的抑制作用.鉴于此,本文提出利用光合细菌(Photosynthetic bacteria,PSB)代替普通的活性污泥或生物膜微生物群落来构建一种新型g-C3N4/TiO2/PSB复合材料.与普通活性污泥相比,PSB具有COD去除效率高、脱色效果明显、耐高负荷和高盐度及对有毒有机物有一定降解能力等特点(Wang et al., 2016;Hong et al., 2003;Kuroki et al., 2001).研究表明,g-C3N4和TiO2的复合可以显著改善可见光的吸收及载流子的分离,能够克服各自在光催化领域中的缺点,获得性能优异的光催化材料(Zhang et al., 2010;Song et al., 2015).
本文以光合细菌和自制的g-C3N4-P25复合光催化剂为基础,采用海藻酸钠将两者进行共固定,合成g-C3N4/TiO2/光合细菌复合材料.以模拟印染废水为研究对象,对比固定光催化剂、固定光合细菌及光催化-微生物复合材料降解染料和COD的规律.最后,利用紫外-可见全波长扫描光谱(UV-Vis)、傅里叶红外光谱(FT-IR)及气相色谱-质谱联用仪(GC-MS)等手段对反应残留物进行表征,分析光催化与微生物之间相互作用的关系,推测活性艳红X-3B的降解途径,以期为这一新型光催化/微生物复合材料在染料废水处理领域的应用提供理论依据.
2 材料和方法(Materials and methods) 2.1 实验材料 2.1.1 实验试剂实验使用的双聚氰胺(分析纯)与海藻酸钠(化学纯)购自索莱宝试剂有限公司,二氧化钛(P25)购自阿拉丁化学试剂有限公司,无水乙醇、氯化钙、无水乙酸钠、碳酸氢钠、氯化铵、磷酸氢二钾、氯化钠、氯化亚铁、酵母膏、硫酸镁、硼酸、硫酸锰、二水钴酸钠、三水硝酸铜(均为分析纯)皆购自天津市福晨化学试剂厂,活性艳红X-3B(100%强度)购自上海将来试剂有限公司,葡萄糖(分析纯)购自西陇科学股份有限公司,实验中用水为去离子水.
2.1.2 光合细菌实验光合细菌选用红螺菌属(Rhodospirillum)的商业菌株.基本培养基成分为:无水乙酸钠3 g、碳酸氢钠1 g、氯化铵1 g、磷酸氢二钾0.5 g、氯化钠1 g、氯化亚铁0.005 g、酵母膏0.05 g、硫酸镁0.2 g,蒸馏水定容到1000 mL.微量元素成分为:硼酸0.7 g、硫酸锰0.389 g、二水钴酸钠0.188 g、三水硝酸铜0.01 g,蒸馏水定容到1000 mL.取1 mL配制好的微量元素置于基础培养基溶液中,定容到1000 mL(刘鹏,2012).移取80 mL红螺菌菌液于1000 mL锥形瓶中,加入配制好的培养基,定容至刻度,置于100 W日光灯下培养(4±1) d,通过离心(5000 r · min-1,5 min)获得菌液,用去离子水洗涤用于复合材料制备(Saratal et al., 2011).
2.2 实验方法 2.2.1 固定化光催化剂的制备方法称取适量双聚氰胺于坩埚中,并放置在程序升温马弗炉中,设置条件为:初始温度44 ℃,按2.3 ℃ · min-1升至550 ℃,550 ℃下煅烧4 h;将煅烧合成的块状g-C3N4研磨成粉末,放置干燥处储存、备用(Yan et al., 2009);将g-C3N4和P25按一定质量比(g-C3N4 : P25=1.5)混合于无水乙醇中,放置于六联搅拌器中搅拌4 h,超声1 h;然后将混合液置于真空干燥箱中,70 ℃干燥24 h(Song et al., 2015),所合成的g-C3N4-P25光催化剂简称为PC.
配制50 mL 2%的海藻酸钠溶液,向海藻酸钠溶液中加入1 g g-C3N4-P25光催化剂,搅拌并置于超声清洗仪中(超声频率为100 Hz,时间设定为30 min),使其在海藻酸钠溶液中分散均匀.待超声完毕,用注射器将含有光催化剂的海藻酸钠溶液逐滴滴入2%的氯化钙溶液中,生成的包埋小球放置于4 ℃冰箱固化24 h以提高其硬度,最后用蒸馏水清洗小球备用(Kanakaraju et al., 2016),所合成的固定光催化剂简称为CA+PC.
2.2.2 固定化光合细菌的制备方法配制50 mL 2%的海藻酸钠溶液,向海藻酸钠溶液中加入3 g(湿重)光合细菌,搅拌均匀,其余步骤同2.2.1节,所合成的固定化菌简称为CA+B.
2.2.3 g-C3N4/TiO2/光合细菌复合材料的制备方法称取1 g海藻酸钠溶于25 mL蒸馏水中,向海藻酸钠溶液中加入适量g-C3N4-P25复合光催化剂,搅拌并置于超声清洗仪中(超声频率为100 Hz,时间设定为30 min),使其在海藻酸钠溶液中分散均匀.然后在含有3 g(湿重)光合细菌的离心管中加入25 mL蒸馏水,制成菌悬液.将菌悬液倒入含有光催化剂的海藻酸钠溶液中,搅拌均匀,其余步骤同2.2.1节,所合成的g-C3N4/TiO2/光合细菌复合材料简称为CA+B+PC.
2.3 模拟印染废水降解试验以模拟印染废水为处理对象,废水水质如下:染料活性艳红X-3B浓度为50 mg · L-1,COD(葡萄糖配)约1500 mg · L-1.选用300 W的卤素灯作为光源模拟太阳光,对比CA+PC、CA+B及CA+B+PC降解染料和COD的规律.反应结束,取样进行UV-Vis(UV765,中国)、FT-IR(Nicolet iS10,美国)及GC-MS(Agilent5975,美国)分析.
3 结果与讨论(Results and discussion) 3.1 样品的表观形貌和结构表征 3.1.1 材料的外观试验制备的CA+B、CA+B+PC、CA+PC材料的外观见图 1,合成的材料呈小球状,直径约为2~3 mm.
 |
| 图 1 CA+B (a)、CA+B+PC (b)、CA+PC (c)的外观形貌 Fig. 1 Images of immobilized photosynthetic bacteria(a), immobilized photosynthetic bacteria/photocatalyst(b) and immobilized photocatalyst(c) |
图 2为海藻酸钙载体(CA)、CA+PC、CA+B、CA+B+PC的电镜扫描图.由图可见,CA载体含有很多微小的孔道(图 2a),一方面有利于微生物的附着,另一方面可以为包埋在载体内部的微生物提供生命代谢活动所需营养物质的输送通道.相比CA载体的孔道,CA+PC的孔道变得更致密,可能是由于纳米级的光催化剂分散或附着在孔道中(图 2b).而CA+B表面相对比较光滑,其表面还可以看到部分光合细菌分散在载体上(图 2c).从图 2d中可明显地看到光合细菌包埋并分布于凝胶网络结构中,由于纳米级材料几乎观测不到,因此结合图 2e可知,该载体含有C、N、O、Ti等元素,说明g-C3N4-P25光催化剂已负载到载体中.理想状态下,大部分微生物包埋于CA载体内部,由于载体的保护,微生物可免受强氧化性自由基的氧化.光催化剂均匀分散在载体中,而只有小球外表面部分光催化剂可以接受光源的激发从而产生自由基破坏难以生物降解的物质.后续将利用该复合材料同时降解染料和COD的结果来验证以上猜测.
 |
| 图 2 CA (a)、CA+PC (b)、CA+B (c)和CA+B+PC (d)的电镜扫描图及CA+B+PC的能谱分析图(e) Fig. 2 SEM images of calcium alginate beads (a), CA+PC (b), CA+B (c), CA+B+PC (d) and the EDS spectrum of composites (e) |
图 3给出了g-C3N4-P25光催化剂、CA+PC及CA+B+PC的吸附脱附等温曲线,其比表面积、孔隙直径、孔容等特征见表 1.根据IUPAC分类,图中的吸附脱附等温曲线均属于Ⅲ型,说明该材料吸附作用力弱.在P/P0=0.8处出现明显滞后回环,滞后回环呈H3型,表明该材料的介孔是由孔型为狭缝形或为两平板之间的缝隙构成,这主要是由CA+B+PC中负载的g-C3N4-P25介孔引起的.表 1中各材料的比表面积由大至小依次为g-C3N4-P25、CA+PC、CA+B+PC、CA+B,可见各材料比表面积的贡献主要来自于g-C3N4-P25,CA+B+PC的比表面积小于CA+PC,这是由于光合细菌的加入覆盖了g-C3N4-P25的表面.
 |
| 图 3 PC、CA+PC、CA+B+PC的N2吸附-脱附等温线 Fig. 3 Nitrogen adsorption-desorption isotherm of PC、CA+PC and CA+B+PC |
| 表 1 材料的比表面积、孔容和平均孔隙直径 Table 1 The BET surface area, pore volume and average pore diameter of materials |
试验对比了CA+B、CA+PC、CA+B+PC材料去除染料及高COD的能力(图 4).从图 4a可以看出,在60 min内,3种材料对染料的去除效率都较高,这主要是由于材料的吸附作用.随着时间的延长,脱色速率减小,反应8 h后,CA载体、CA+B、CA+PC、CA+B+PC对染料的去除率分别为20%、68%、92%和94%.CA+B在前8 h染料去除率低可能是因为细菌刚进入一个新的环境,需要一定的适应期;CA+PC和CA+B+PC的染料去除率也几乎一致.相应各材料的COD去除能力随时间变化如图 4b所示.CA+B+PC中剩余COD仅为200 mg · L-1左右,远小于CA+PC反应中的剩余COD,而CA+B的剩余COD仅次于CA+B+PC.
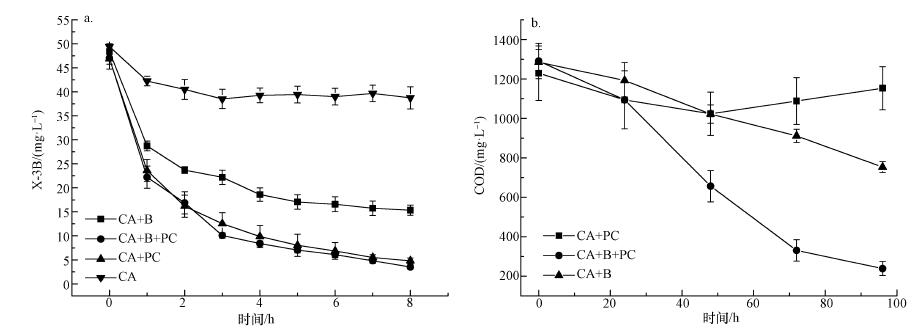 |
| 图 4 不同体系内活性艳红X-3B浓度(a)和COD (b)随时间变化曲线(n=5) Fig. 4 Profile of reactive brilliant red X-3B (a) and COD (b) concentration in different systems (n=5) |
继续进行高COD的模拟印染废水的降解试验,收集反应96 h后剩余COD的数据并计算相应COD的去除率(图 5).由图 5可见,CA+B、CA+PC和CA+B+PC的COD去除率分别为13.0%、42.9%、84.7%.CA+PC与CA+B+PC对COD去除率的不同在于光合细菌的作用.光催化剂产生的自由基由于受到模拟废水中加入的NaHCO3、NH4Cl等的影响及氧气的限制,并不能完全矿化反应体系中的有机物,累积中间产物使得COD去除率较低(Konstantinou et al., 2004;Guillard et al., 2003).相反地,在光催化结合微生物反应体系中,染料随光催化降解产生的中间产物和可生化降解的葡萄糖一起进入复合材料内部,迅速被光合细菌降解、矿化.
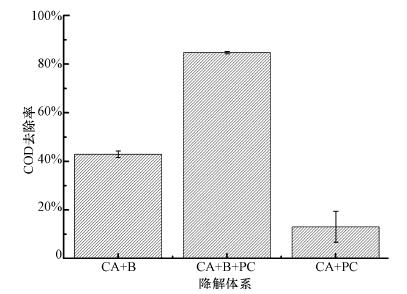 |
| 图 5 不同体系下96 h的COD去除率(n=5) Fig. 5 COD removal percentage after 96 h in the different systems (n=5) |
分别对CA+B、CA+PC、CA+B+PC降解84 h后的产物及配制的原始染料废水进行紫外-可见全波长扫描,结果见图 6.图中原始染料的全波长扫描图中活性艳红X-3B染料的几个典型特征峰都有出现,其中,染料所具有的共轭显色体系的特征吸收峰在可见光区域内的540 nm处,染料的脱色原理就是通过氧化途径破坏其发色基团(N=N结构).在紫外区域内,苯环、萘环等难降解芳香结构的特征吸收峰分别在245、283、324 nm处(黄春梅等,2012).反应结束后,540 nm处的吸收峰消失,说明染料分子中的偶氮结构被光催化体系和微生物共同破坏了.相比反应前活性艳红X-3B的波长扫描图,各材料降解反应后产物的萘环吸收峰也消失了,该结果表明萘环结构是不稳定的,相对比较容易被氧化降解;而苯环化学结构稳定,其吸收峰一直存在,反应结束后,245 nm和283 nm处的吸收峰有一定程度的减弱.在283 nm处的苯环吸收峰中,CA+B降解反应后产物的吸收峰明显高于CA+PC和CA+B+PC反应后产物的吸收峰,其中,复合材料的吸收峰是最小的.而在245 nm处的苯环吸收峰中,同样是CA+B+PC反应后产物的峰值最小.说明染料分子降解过程中,光合细菌对苯环的降解能力相对较弱,而CA+B+PC发挥了光催化剂的作用,从而使得苯环的吸收峰大大减小.
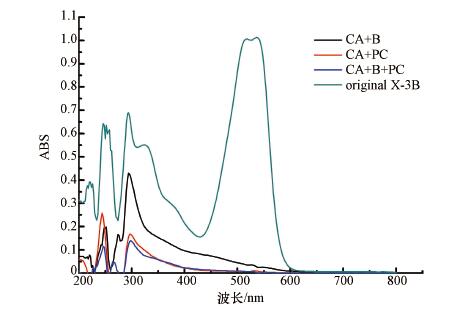 |
| 图 6 不同反应体系下的紫外-可见吸收光谱 Fig. 6 UV-Vis absorption specta of effluent in the different systems |
在活性艳红X-3B的FT-IR光谱中(图 7),3435 cm-1处的峰为N—H和O—H的伸缩振动吸收峰,1539、1490和1454 cm-1处的峰为苯环、萘环或三嗪环的骨架振动吸收峰,1220、1172、1140和1051 cm-1处的峰为染料分子结构中R-SO3-的吸收峰,1629 cm-1对应的峰为N=N的吸收峰(Kaewsuk et al., 2010).由图可见,3种材料的降解产物中都含有O—H和N—H的吸收峰,1634 cm-1处的强吸收峰为C=O的伸缩振动峰.结合表 2可知,3种材料降解反应结束后,pH值都有所下降,其中pHCA+PC>pHCA+B+PC>pHCA+B,说明反应体系中都有羧酸产生.羧酸的可能来源是葡萄糖的生物降解及光催化降解活性艳红X-3B所产生.在1450~1540 cm-1处仍存在吸收峰,这可能为苯环、萘环或三嗪环的骨架振动吸收峰,表明活性艳红X-3B染料分子没有被100%的降解即完全矿化,苯类物质很难进一步被分解.由图 7还可发现,CA+B反应产物中苯环的吸收峰(1450~1540 cm-1)比CA+PC与CA+B+PC反应产物的苯环吸收峰更强烈,说明光合细菌对苯环类物质降解能力较差,这与紫外-可见全波长扫描谱图分析的结论一致.CA+B+PC的FT-IR光谱中没有1220、1172、1140和1051 cm-1的吸收峰,说明R-SO3-的吸收峰消失,表明—SO3Na基团被破坏降解.
 |
| 图 7 活性艳红X-3B染料和不同体系反应残余物的红外谱图 Fig. 7 Typical IR spectra of X-3B before and after treatment in different systems |
| 表 2 不同体系反应前后pH值 Table 2 pH in the different systems before and after reaction |
通过GC-MS测定CA+B、CA+PC和CA+B+PC降解活性艳红X-3B染料的产物.图 8是气相色谱的出峰图,表 3是相应停留时间对应的物质.结合图 8和表 3可发现,反应体系结束后,CA+B降解染料的中间产物主要是具有苯环结构的芳香烃物质,以及少量的短链烷烃物质.而CA+PC体系中累积的中间产物主要为高分子量的长链烷烃物质,芳香烃类的有机物相对较少.此外,在CA+B+PC反应体系中,相比于CA+B,芳香烃类化合物含量减少,而对比于CA+PC,该反应溶液中的长链烷烃类物质类型和含量都有所降低.基于以上试验结果,可以推测CA+B+PC中光催化与微生物的相互作用关系如下:最初,由于反应溶液中含有大量的DO,在模拟太阳光的照射下(卤素灯,全波长),光催化活性强,活性艳红X-3B染料的发色基团在光催化与微生物的共同作用下被破坏,使其溶液脱色,此时光催化的脱色速率远远大于微生物脱色速率.然后,光催化剂产生的自由基继续攻击染料分子中的苯环结构,开环及一系列的加成聚合等反应生成长链烷烃化合物.随着时间延长,DO量减少,光催化活性也随之降低,长链烷烃类物质就很难继续被降解.此时由于光合细菌的存在,长链烷烃化合物易被微生物降解.总的来说,光催化剂的存在可以降低芳香烃物质的累积量从而减少该化合物对微生物的影响,而体系中光合细菌又可以弥补光催化的缺点.这就是复合材料降解模拟印染废水中芳香烃与烷烃化合物浓度相对较低,COD和染料去除率高的原因.
| 表 3 活性艳红X-3B降解中间产物的分析 Table 3 Degradation intermediates of reactive brilliant red X-3B identified by GC-MS |
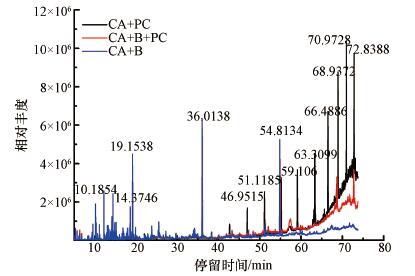 |
| 图 8 不同体系反应残余物的GC图谱 Fig. 8 GC graph of effluent in different systems |
为了更进一步了解CA+B+PC降解染料的途径,试验每隔12 h取样,测定其COD(表 4),并利用GC-MS对中间产物进行检测分析(图 9).反应12 h的气相出峰图中,停留时间为58.90、62.86、66.42、71.02、72.91 min时的物质都为长链烷烃类化合物,而随着反应时间的延长,长链烷烃物质逐渐减少,36和48 h时几乎不存在这些物质.图 9中停留时间约为19.15、35.89和54.72 min左右的物质分别为2, 4-二叔丁基苯酚、邻苯二甲酸二丁酯、2, 2′-亚甲基双-(4-甲基-6-叔丁基苯酚),这些具有芳香烃结构的化合物峰面积变化规律如表 5所示.根据试验结果可以推测,反应前12 h,光催化降解染料速率远远大于光合细菌的降解速率,光催化起主导作用,此时溶液在脱色的同时,一些自由基会破坏染料分子中的苯环结构,使其生成长链烷烃类化合物.12 h后,由于光合细菌已经开始适应体系中的新环境,光合细菌降解染料生成苯环结构化合物的同时,可以即时迅速地将光催化氧化生成的长链烷烃降解矿化.这也是CA+B+PC降解染料中后期一直没有长链烷烃化合物出现的原因.在12~24 h期间,可以发现芳香烃化合物迅速增加,24 h后减少,可能是因为此时光合细菌作用大于光催化作用,酚类、酯类化合物生成量大于其降解量,使其累积,而后缓缓降解.
| 表 4 不同时间的COD去除率 Table 4 Removal percentage of COD under different time |
 |
| 图 9 不同反应时间降解活性艳红X-3B中间产物的GC图谱 Fig. 9 GC graph of degradation intermediates of reactive brilliant red X-3B at different time |
| 表 5 主要物质的峰面积 Table 5 Peak area of essential substance |
基于以上中间产物的测定及结合相关文献报道(涂盛辉等,2015;Wu et al., 2000;Liu et al., 2015;Xu et al., 2009),推测出CA+B+PC降解染料(活性艳红X-3B)的途径(图 10)为:首先,由光催化产生的自由基和光合细菌共同破坏染料的偶氮结构,生成苯胺类化合物及多种具有苯环结构的化合物;然后,自由基继续破坏苯环结构产生长链烷烃,光合细菌及时利用光催化生成的长链烷烃,使其降解矿化.此外,光合细菌也可将部分含有苯环结构的中间产物缓慢降解为分子量较小的烃类、酚类、醇类、酯类,最后矿化成CO2和H2O.
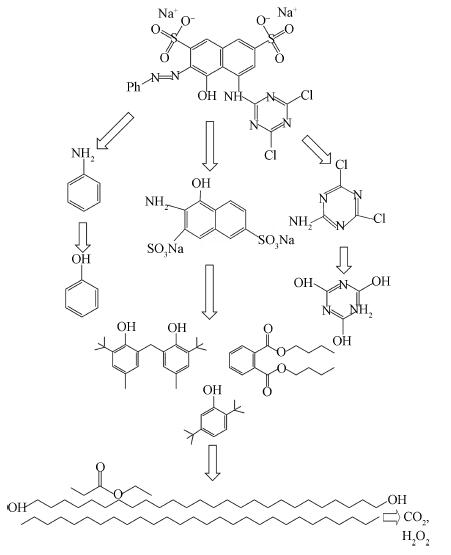 |
| 图 10 g-C3N4/TiO2/光合细菌复合材料降解活性艳红X-3B的路径 Fig. 10 Degradation pathway of X-3B by g-C3N4-P25/photosynthetic bacteria composite |
利用海藻酸钙共固定光合细菌与可见光响应的g-C3N4-P25光催化剂,成功合成了同时具有光催化氧化和生物降解作用的g-C3N4-P25/光合细菌复合材料.研究发现,该复合材料对染料X-3B的降解效率为94%,COD去除率为84.7%,远远优于固定化微生物及固定化光催化剂.结合SEM及采用UV-Vis、FT-IR和GC-MS等手段对反应后的产物进行检测分析,发现染料的可能降解途径为:由光催化产生的自由基和光合细菌共同破坏染料的偶氮结构,生成苯胺类化合物及多种具有苯环结构的化合物,自由基继续破坏苯环结构产生长链烷烃,光合细菌及时利用光催化生成的长链烷烃,使其降解矿化.此外,光合细菌也可将部分含有苯环结构的中间产物缓慢降解为分子量较小的烃类、酚类、醇类、酯类,最后矿化成CO2和H2O.
Chen C Y S H, Chung Y C. 2014. Combination of photoreactor and packed bedbioreactor for the removal of ethyl violet from wastewater[J]. Chemosphere, 117(1): 494–501.
|
Çinar Ö, Yasar S, Kertmen M, et al. 2008. Effect of cycle time on biodegradation of azo dye in sequencing batch reactor[J]. Process Safety and Environmental Protection, 86(6): 455–460.
DOI:10.1016/j.psep.2008.03.001
|
Deveci E V, Dizge N, Yatmaz H Z, et al. 2016. Integrated process of fungal membrane bioreactor and photocatalytic membrane reactor for the treatment of industrial textile wastewater[J]. Biochemical Engineering Journal, 105(part B): 420–427.
|
Dong S S, Dong S S, Tian X D, et al. 2016. Role of self-assembly coated Er3+:YAlO3/TiO2 in intimate coupling ofvisible-light-responsive photocatalysis and biodegradation reactions[J]. Journal of Hazardous Materials, 302: 386–394.
DOI:10.1016/j.jhazmat.2015.10.007
|
Guillard C, Lachheb H, Houas A, et al. 2003. Influence of chemical structure of dyes, of pH and of inorganic salts on their photocatalytic degradation by TiO2 comparison of the efficiency of powder and supported TiO2[J]. Journal of Photochemistry & Photobiology A Chemistry, 158(1): 27–36.
|
Harrelkas F, Paulo A, Alves M M, et al. 2008. Photocatalytic and combined anaerobic-photocatalytic treatment of textile dyes[J]. Chemosphere, 72(11): 1816–1822.
DOI:10.1016/j.chemosphere.2008.05.026
|
Hong J, Otaki M. 2003. Effects of Photocatalysis on biological decolorization reactor and biological activity of isolated photosynthetic bacteria[J]. Journal of Bioscience and Bioengineering, 96(3): 298–303.
DOI:10.1016/S1389-1723(03)80197-4
|
黄春梅, 黄瑞敏. 2012. 活性艳红X-3B的厌氧生物降解与机理[J]. 环境化学, 2012, 31(3): 354–359.
|
Kaewsuk J, Thorasampan W, Thanuttamavong M, et al. 2010. Kinetic development and evaluation of membrane sequencing batch reactor (MSBR) with mixed cultures photosynthetic bacteria for dairy wastewater treatment[J]. Journal of Environmental Management, 91(5): 1161–1168.
DOI:10.1016/j.jenvman.2010.01.012
|
Kanakaraju D, Ravichandar S, Lim Y C. 2016. Combined effects of adsorption and photocatalysis by hybrid TiO2/ZnO-calcium alginate beads for the removal of copper[J]. Journal of Environmental Sciences, 55: 214–223.
|
Konstantinou I K, Albanis T A. 2004. TiO2-assisted photocatalytic degradation of azo dyes in aqueous solution:kinetic and mechanistic investigations[J]. Applied Catalysis B:Environmental, 49(1): 1–14.
|
Kuroki S, Furukawa K, Nakakawa G. 2001. Biodegradation of acid azo dyes by newly isolated purple nonsulfur bacteria[J]. Japanese Journal of Water Treatment Biology, 37(2): 69–75.
DOI:10.2521/jswtb.37.69
|
Li G, Park S, Kang D W, et al. 2011. 2, 4, 5-Trichlorophenol degradation using a novel TiO2-coated biofilm carrier:roles of adsorption, photocatalysis, and biodegradation[J]. Environmental Science & Technology, 45(19): 8359–8367.
|
刘鹏. 2012. 包埋固定化复合菌处理抗生素废水的研究[D]. 重庆: 重庆大学. 28-29
|
Liu S, Song H, Wei S, et al. 2015. Effect of direct electrical stimulation on decolorization and degradation of azo dye reactive brilliant red X-3B in biofilm-electrode reactors[J]. Biochemical Engineering Journal, 93: 294–302.
DOI:10.1016/j.bej.2014.11.002
|
Marsolek M D, Torres C I, Hausner M, et al. 2008. Intimate coupling of photocatalysis and biodegradation in a photocatalytic circulating-bed biofilm reactor[J]. Biotechnology and Bioengineering, 101(1): 83–92.
DOI:10.1002/bit.v101:1
|
Mutambanengwe C C Z, Togo C A, Whiteley C G. 2007. Decolorization and degradation of textile dyes with biosulfidogenic hydrogenases[J]. Biotechnology Progress, 23(5): 1095–1100.
|
Oller I, Malato S, Sánchez-Pérez J A. 2011. Combination of Advanced Oxidation Processes and biological treatments for wastewater decontamination-a review[J]. Science of the Total Environment, 409(20): 4141–4166.
DOI:10.1016/j.scitotenv.2010.08.061
|
Saratale R G, Saratale G D, Chang J S. 2011. Bacterial decolorization and degradation of azo dyes:a review[J]. Journal of the Taiwan Institute of Chemical Engineers, 42: 138–157.
DOI:10.1016/j.jtice.2010.06.006
|
Singh K, Arora S. 2011. Removal of synthetic textile dyes from wastewaters:acritical review on present treatment technologies[J]. Critical Reviews in Environmental Science and Technology, 41(9): 807–878.
DOI:10.1080/10643380903218376
|
Song G X, Chu Z Y, Jin W Q, et al. 2015. Enhanced performance of g-C3N4/TiO2 photocatalysts for degradation of organic pollutants under visible light[J]. Chinese Journal of Chemical Engineering, 23(8): 1326–1334.
DOI:10.1016/j.cjche.2015.05.003
|
涂盛辉, 刘婷, 朱细平. 2015. 紫外助CWPO降解活性艳红X-3B工艺及降解路径[J]. 南昌大学学报, 2015, 39(2): 1006–0604.
|
Wang H Y, Zhang G M, Peng M, et al. 2016. Synthetic white spirit wastewater treatment and biomass recovery by photosynthetic bacteria:Feasibility and process influence factors[J]. International Biodeterioration & Biodegradation, 113: 134–138.
|
Wu F, Deng N S, Hua H L. 2000. Degradation mechanism of azo dye C.I.reactive red 2 by iron powder reduction and photooxidation in aqueous solutions[J]. Chemosphere, 41(8): 1233–1238.
DOI:10.1016/S0045-6535(99)00538-X
|
Xu G R, Zhang Y P, Li G B. 2009. Degradation of azo dye active brilliant red X-3B by composite ferrate solution[J]. Journal of Hazardous Materials, 161(2/3): 1299–1305.
|
Yan S C, Li Z S, Zou Z G. 2009. Photodegradation performance of g-C3N4 fabricated by directly heating melamine[J]. Langmuir, 25(17): 10397–10401.
DOI:10.1021/la900923z
|
Zhang Y, Mori T, Ye J, et al. 2010. Phosphorus-doped carbon nitride solid:enhanced electrical conductivity and photocurrent generation[J]. Journal of the American Chemical Society, 132(18): 6294–6295.
DOI:10.1021/ja101749y
|
 2018, Vol. 38
2018, Vol. 38